Сиволоб А.В. Молекулярна біологія. Підручник
Подождите немного. Документ загружается.


Розділ 5. Транскрипція: Прокаріоти
143
рюються замість двох зруйнованих. Аналогічно, пересування полі-
мерази назад буде супроводжуватись руйнуванням пари в гібриді
на 3'-кінці РНК (3'-кінцевий нуклеотид при цьому опиняється у вто-
ринному каналі) і пари ДНК позаду від міхура з одночасним утворен-
ням пари ДНК попереду та гібрида позаду.
Різниця між кінцевими результатами двох рухів – в енергії взаємо-
дій РНК-полімерази з нуклеїновими кислотами. У вихідному претранс-
локаційному стані (положення і + 1, рис. 5.10) реалізуються певні нук-
леопротеїнові взаємодії, що зумовлює знаходження системи в локаль-
ному мінімумі вільної енергії. Із двох інших локальних мінімумів, що
відповідають положенням і та і + 2, другий є більш глибоким, оскільки
для нього реалізуються найсприятливіші взаємодії між активним
центром та 3'-кінцем РНК. Максимуми енергії (бар'єри) між мінімума-
ми на рис. 5.10 відповідають проміжним станам при пересуванні по-
лімерази (часткове порушення взаємодій, конформаційні зміни полі-
мерази). Ці максимуми є досить невисокими, тобто легко долаються за
рахунок теплової енергії. Отже, полімераза спонтанно переміщується
вперед, і система опиняється в більш глибокому мінімумі вільної енергії
(рис. 5.10), звідки починається наступний елонгаційний цикл.
Якщо напрямок переміщення полімерази визначається положен-
ням мінімумів на шкалі вільної енергії, швидкість переміщення зале-
жить від висоти максимумів вільної енергії: чим нижчим є максимум,
тим легше він долається. Висота максимумів залежить від послідов-
ності пар основ у складі гібрида, а також може змінюватись під дією
додаткових факторів (фактори елонгації, шпильки в мРНК тощо).
Під час елонгації здійснюється також
редагування помилок.
Забезпечити стовідсоткову точність операцій з такими невеликими
молекулами, як нуклеотиди, практично неможливо. Зокрема, джере-
лом (одним із основних) помилкового приєднання нуклеотидів під час
транскрипції є таутомерія азотистих основ. Спонтанні перебудови
електронних систем гетероциклів приводять до того, що кожна основа
існує у вигляді двох таутомерних форм: аміно- чи іміноформи для A, C;
енольної чи кетоформи для G, U, T (рис. 5.11). Рівновага зсунута в
бік аміно- та кетоформ, які присутні у складі подвійних спіралей
(див. рис. 3.1) і для яких реалізуються правила комплементарності
A-T, G-C. Але спарювання основ підпорядковується іншим правилам
для мінорних таутомерних форм: наприклад, іміноформа А та аміно-
форма С утворюють між собою два водневі зв'язки, що може відбутися
під час упізнання матриці нуклеозидтрифосфатом. Тоді після хімічної
Сиволоб А.В. Молекулярна біологія
144
реакції, у результаті швидкого повернення до мажорної таутомерної
форми, у складі ДНК-РНК гібрида на 3'-кінці транскрипту залишить-
ся некомплементарна пара нуклеотидів.
Нестабільність гібрида на 3'-кінці у випадку, коли щойно приєдна-
ний нуклеотид є помилковим, приводить до зміни енергетичного ба-
лансу між різними позиціями РНК-полімерази відносно матриці
(рис. 5.10). Найсприятливішою (такою, що відповідає найнижчому
мінімуму енергії) тепер є позиція і, оскільки при цьому гібрид стає
стабільним по всій довжині. Відповідно, відбувається зворотний рух
полімерази з виходом 3'-кінця транскрипту у вторинний канал. При
цьому ніщо більше не фіксує 3'-кінець транскрипту, і всі позиції по-
заду від і (і, і–1, і–2, ...) є майже ізоенергетичними (варіації залежать
від стабільності гібрида, тобто від послідовності нуклеотидів). Отже,
зворотний рух відбувається на невизначену випадкову відстань.
A
C
G
U
N
N
N
N
NH
2
N
N
N
NH
NH
N
N
O
NH
2
N
NH
O
NH
N
N
N
NH
O
NH
2
N
N
N
N
OH
NH
2
N
NH
O
O
N
N
O
OH
Аміно-
форма
Іміно-
форма
Кето-
форма
Енольна
форма
Рис. 5.11. Таутомерні форми азотистих основ
Коли 3'-кінцевий фрагмент транскрипту опиняється у вторинному
каналі, з полімеразою в тому ж вторинному каналі взаємодіє особливий
фактор елонгації транскрипції, який можна назвати фактором реда-
гування, і який існує у двох варіантах: GreA та GreB (еукаріотичним
аналогом цих факторів є фактор TFIIS, див розділ 6). Gre-фактори,
через конформаційні зміни РНК-полімерази, індукують нуклеазну ак-
тивність її активного центру. У результаті відбувається відщеплення
3'-кінцевого фрагмента транскрипту і в активному центрі залишаєть-
ся новий 3'-кінець (зі стабільною нуклеотидною парою гібрида), який
використовується для відновлення елонгаційного процесу. Загальна
точність процесу транскрипції дорівнює приблизно 10
–6
(частота по-
милково включених нуклеотидів, що залишаються у складі РНК).
Розділ 5. Транскрипція: Прокаріоти
145
З викладеного видно, що РНК-полімераза є одним із прикладів мо-
лекулярної машини (див. розділ 2). Конформаційна рухливість полі-
мерази забезпечує їй можливість існувати в кількох структурних ста-
нах. Ці стани мають різну спорідненість до певних лігандів (NTP, пари
основ у складі РНК-ДНК гібрида, фактори елонгації). Взаємодії
з лігандами фіксують певні стани. Хімічні реакції, які каталізуються
машиною, приводять до заміни лігандів, а відповідно – і до переходу
в інший структурний стан. Рушійною силою для переміщення поліме-
рази є тепловий рух: структурні блоки полімеразного комплексу
рухаються відповідно до конструкції машини; зв'язування лігандів
та їхня заміна внаслідок реакцій каналізують ці рухи в певних на-
прямах. Результатом структурних перебудов є переміщення поліме-
рази вздовж матриці з одночасним синтезом транскрипту із серед-
ньою швидкістю 40 нуклеотидів/с.
Термінація транскрипції
Як уже йшлося, швидкість пересування РНК-полімерази під час елон-
гації визначається висотою максимумів вільної енергії (див. рис. 5.10).
Якщо ці максимуми (по обидва боки від мінімуму, що відповідає
позиції і + 1 на рис. 5.10) за певних причин виявляться досить ви-
сокими, полімераза опиниться в енергетичній пасці й зупиниться
на досить довгий час.
UAAUCCCACA
G-C
A-U
C-G
C-G
G-C
C-G
C-G
G-CAUUUUUUU
C
U C
U G
Д
НК Сигнал термінації
РНК
Рис. 5.12. Типовий сигнал термінації
Сиволоб А.В. Молекулярна біологія
146
Саме це й відбувається під час термінації транскрипції на певних
елементах послідовності. Прокаріотичний сигнал термінації являє
собою інвертований повтор (паліндром – послідовність ДНК, що чи-
тається однаково в обох ланцюгах у напрямках 5'-3'), безпосередньо
фланкований polyТ послідовністю (близько 7 нуклеотидів). Відповідно,
у матричному ланцюзі розташована polyА послідовність, а у складі
транскрипту – polyU. Інвертований повтор у складі транскрипту
утворює дволанцюгову шпильку (рис. 5.12), а ДНК-РНК гібрид за
шпилькою складається з порівняно менш стабільних А-U пар.
Загальний сценарій термінації виглядає наступним чином. Порівняно
нестабільний гібрид ускладнює елонгацію транскрипції, а шпилька –
зворотний рух полімерази. Під час зупинки полімерази (приблизно
на 60 с) здійснюються зумовлені взаємодіями зі шпилькою структурні
перебудови полімерази, руйнування гібрида, відновлення подвійної
спіралі ДНК і визволення транскрипту.
5'
ρ
-фактор
Рис. 5.13. ρ-Залежна термінація
У кількох бактеріальних оперонах термінація залежить від так зва-
ного фактора ρ. Цей фактор (моногексамер) зв'язується з РНК-транс-
криптом у певних С-збагачених ділянках. Після цього починається
АТР-залежне пересування ρ-фактора вздовж транскрипту в напрямку
5'-3' зі швидкістю, яка є нижчою за швидкість руху полімерази. Сиг-
нал термінації в цьому випадку, як правило, нічим не відрізняється від
описаних вище термінаторів і зумовлює зупинку полімерази. У результа-
ті ρ-фактор дожинає полімеразу і, продовжуючи рух уздовж РНК,
руйнує гібридну подвійну спіраль (працює як геліказа (helicase) – так
називаються ферменти, що АТР -залежно руйнують подвійні спіралі
нуклеїнових кислот). Результатом є колапс транскрипційного міхура
(відновлення подвійної спіралі ДНК) і визволення транскрипту.

Розділ 5. Транскрипція: Прокаріоти
147
Регуляція транскрипції
Зрозуміло, що гени та оперони (див. розділ 4) не транскрибуються
постійно, а вмикаються / вимикаються в певні моменти залежно від
зовнішніх умов, стадій клітинного циклу тощо. Головними елемента-
ми, взаємодія між якими приводить до активації чи репресії транс-
крипції, є так звані цис- і транс-елементи. Цис-елементи – це регуля-
торні елементи послідовності ДНК, які фізично зв'язані з даним геном
чи опероном; у прокаріотів часто називаються операторами
і розташовані в безпосередній близькості до промоторів. Транс-
елементи – білкові фактори транскрипції, що вільно дифундують
(транспортуються) у просторі клітини, шукаючи свій цис-елемент,
з яким вони мають специфічну спорідненість. Якщо зв'язування
транс-елемента з оператором приводить до активації транскрипції
(часто за рахунок прямих білок-білкових взаємодій транскрипційного
фактора з РНК-полімеразою, які підвищують її спорідненість до про-
мотора), кажуть, що фактор є активатором і здійснює позитивну ре-
гуляцію. Якщо фактор блокує зв'язування РНК -полімерази (часто за
рахунок зниження доступності промотора), його називають репресо-
ром і кажуть про негативну регуляцію.
Ці загальні принципи регуляції, які, ускладнюючись, зберігаються
також в еукаріотів (розділ 6), реалізуються на стадії ініціації. Крім того,
для регуляції використовуються інші моменти процесу транскрипції.
Найтиповіші механізми регуляції в прокаріотичних системах проілю-
стровано нижче на конкретних прикладах.
Лактозний оперон
Лактозний оперон (lac-оперон) E. coli став у свій час, завдяки дослі-
дженням Жакоба і Моно (François Jacob, Jacques Monod), першою де-
тально вивченою системою регуляції транскрипції. До складу оперона
(рис. 5.14) входять три структурні гени, що кодують ферменти, залу-
чені до утилізації (катаболізму) лактози. Транскрипція всіх трьох генів
здійснюється з одного промотора (синтезується єдина, так звана
поліцистронна, молекула мРНК, яка має три послідовні відкриті рам-
ки зчитування). Промотор оточують дві однакові операторні ділянки
(lac-оператори), що мають спорідненість до lac-репресора, і сайт зв'я-
зування CAP (Catabolite A
ctivator Protein).
Сиволоб А.В. Молекулярна біологія
148
Промотор lac-оперона є слабким – має досить низьку власну спорід-
неність до РНК-полімерази. Навіть якщо в середовищі є лактоза, але
присутня також глюкоза (кращий харчовий субстрат для бактерій),
транскрипція lac-оперона майже не здійснюється. Зниження рівня
глюкози приводить до підвищення внутрішньоклітинної концентрації
сАМР (циклічного аденозинмонофосфату), зв'язування якого з САР ін-
дукує конформаційну перебудову білка та появу його специфічної
спорідненості до відповідного сайта на ДНК (див. структуру комплек-
су на рис. 3.13, б). Взаємодія САР із РНК-полімеразою підсилює її спо-
рідненість до промотора – САР рекрутує полімеразу, яка далі розпо-
чинає синтез мРНК (рис. 5.14).
Оператор
Оператор
Структурні гени
Промотор
САР-сайт
сАМР
САР
Зниження
рівня
глюкози,
зростання
рівня сАМР
Рибосоми
RNAP
Рис. 5.14. Позитивна регуляція lac-оперона
катаболітним активаторним білком САР
Описаний сценарій позитивної регуляції реалізується лише за тієї
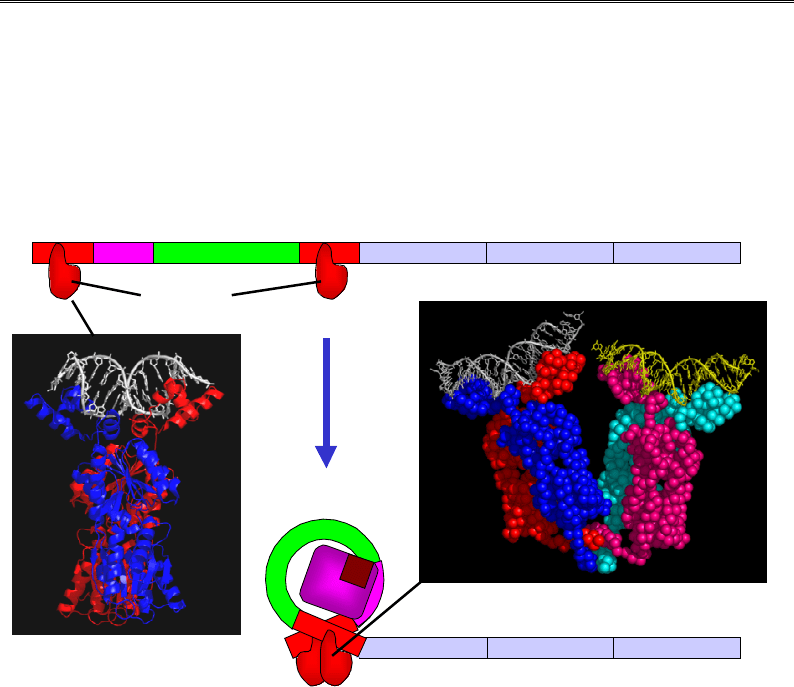
умови, що lac-оператори не взаємодіють з lac-репресором. У разі
відсутності лактози (коли відповідні ферменти її утилізації напевно
не потрібні) гомодимери репресора (незалежно від можливої присут-
ності САР) зв'язуються з обома операторами (рис. 5.15, див. також
рис. 3.22) і при цьому взаємодіють між собою: утворюється тетрамер-
ний комплекс, що утримує петлю ДНК (рис. 5.15). Усередині петлі
Розділ 5. Транскрипція: Прокаріоти
149
розташований промотор, і це абсолютно запобігає зв'язуванню з ним
РНК-полімерази. Коли з'являється лактоза, її невелика кількість пере-
творюється на алолактозу, яка спрацьовує як індуктор lac-оперона:
зв'язування алолактози з репресором індукує втрату його споріднено-
сті до оператора. Унаслідок руйнування петлі РНК-полімераза зв'язу-
ється з промотором і оперон починає працювати.
репресор
а
б
Рис. 5.15. Негативна регуляція lac-оперона lac-репресором.
На вставках: структура димеру репресора в комплексі з оператором (а, 1JWL)
і тетрамерний комплекс із двома операторами (б, 1LBG)
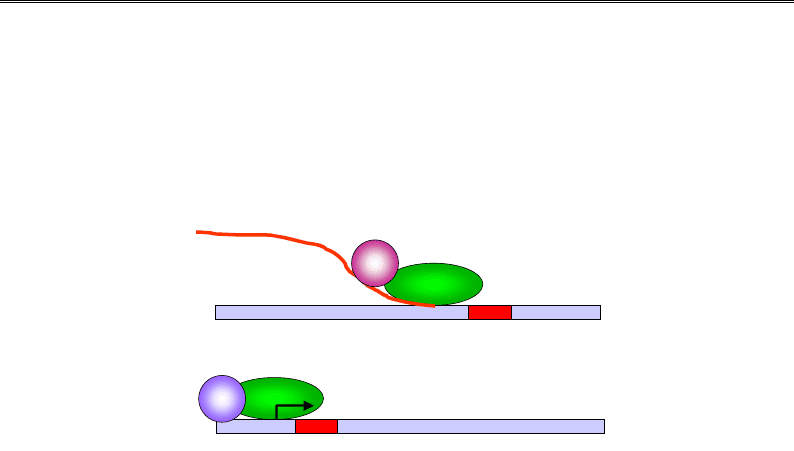
Антитермінація
У системах антитермінації (кілька генів бактеріофага λ, гени рибо-
сомної РНК E. coli) активатори транскрипції запобігають упізнанню
РНК-полімеразою сигналів термінації, що знаходяться всередині ко-
дуючої частини гена. У відсутності факторів ген є неактивним: наяв-
ність термінуючого сигналу приводить до термінації транскрипції та
визволення нефункціонального РНК-продукту. Для певних генів опи-
сано два механізми активації. У першому випадку білок-активатор
упізнає специфічний сайт перед сигналом термінації у складі мРНК.
Сиволоб А.В. Молекулярна біологія
150
Зв'язуючись із транскриптом, білок взаємодіє також із РНК-поліме-
разою і впливає на неї таким чином, що термінатор стає непомітним
для ферменту (рис. 5.16, а). У другому випадку транскрипційний фак-
тор упізнає регуляторну ділянку поряд із промотором, взаємодіє з по-
лімеразою і запобігає впізнанню термінатора, що міститься відразу за
стартом транскрипції (рис. 5.16, б).
Термінатор
Термінатор
RNAP
RNAP
а
б
Рис. 5.16. Два механізми антитермінації: фактор транскрипції
запобігає впізнанню термінатора РНК-полімеразою
Атенюація
Із використанням сигналів термінації пов'язана також система
атенюації (attenuation – послаблення), яка використовується, зокрема,
для регуляції активності триптофанового оперона (trp-оперона) E. coli.
Оперон містить 5 структурних генів, що відповідають за синтез аміно-
кислоти Trp, перед ними знаходяться промотор, оператор і лідерна по-
слідовність, з якої розпочинається транскрипція (рис. 5.17, а).
Атенюація використовує ту обставину, що прокаріотична транс-
крипція тісно пов'язана з трансляцією. Лідерна частина РНК містить
стартовий кодон, що впізнається рибосомою, і чотири елементи по-
слідовності: ділянка 1 містить два сусідні триптофанові кодони, ді-
лянки 2–3 і 3–4 є попарно комплементарними, за ділянкою 4 розта-
шована оліго-U послідовність (рис. 5.17, б). Отже, шпилька 3–4, флан-
кована оліго-U, є сигналом термінації транскрипції. Коли концент-
рація Trp є низькою (є потреба в Trp і оперон має бути активним),
рибосома зупиняється на триптофанових кодонах ділянки 1 (оскіль-
ки відсутня й триптофаніл-тРНК). У цьому випадку утворюється
шпилька 2–3 (ділянка 3 не залучається до утворення термінуючої
шпильки), і РНК полімераза продовжує синтез повноцінної мРНК.

Розділ 5. Транскрипція: Прокаріоти
151
Рибосоми зв'язуються зі стартовими кодонами, що відповідають
структурним генам, і синтезуються відповідні білки.
У разі високого рівня Trp рибосома швидко проходить через ділян-
ку 1 на ділянку 2 і зупиняється на стоп-кодоні. У результаті утворюється
шпилька 3–4 – формується сигнал термінації, РНК-полімераза зупиняє
транскрипцію після синтезу короткої нефункціональної лідерної РНК.
1234
2
3
3
4
U
8
U
8
промотор
оператор
л
ідер
Структурні гени
Стартовий кодон
Висока
концентрація Trp
Низька
концентрація Trp
Низька
концентрація Trp
РН
К
Висока
концентрація Trp
а б
Рис. 5.17. (а): Схема trp-оперона, на якому синтезуються два
РНК-продукти залежно від внутрішньоклітинної концентрації Trp. (б):
Лідерна РНК і два варіанти спарювання основ у її складі
залежно від розташування рибосоми
trp-Оперон перебуває також під контролем trp-репресора. Алосте-
ричним регулятором репресора є сам Trp: у комплексі з ним репресор
набуває конформаційної форми, що має високу спорідненість до опе-
ратора. При зниженні концентрації Trp репресор дисоціює й ефектив-
ність ініціації транскрипції підвищується в ~70 разів. Атенюація
є додатковим, менш ефективним механізмом регуляції: ефективність
транскрипції підвищується в ~10 разів у відсутності Trp за рахунок
атенюації (у присутності Trp ~10 % РНК-полімераз долають сигнал тер-
мінації й продовжують працювати, у разі відсутності Trp – практично
всі). Сумісна дія атенюації та негативного контролю за рахунок реп-
ресора дозволяє змінювати активність оперона в ~700 разів залежно
від внутрішньоклітинної концентрації Trp.
Сиволоб А.В. Молекулярна біологія
152
Регуляція транскрипції бактеріофага λ
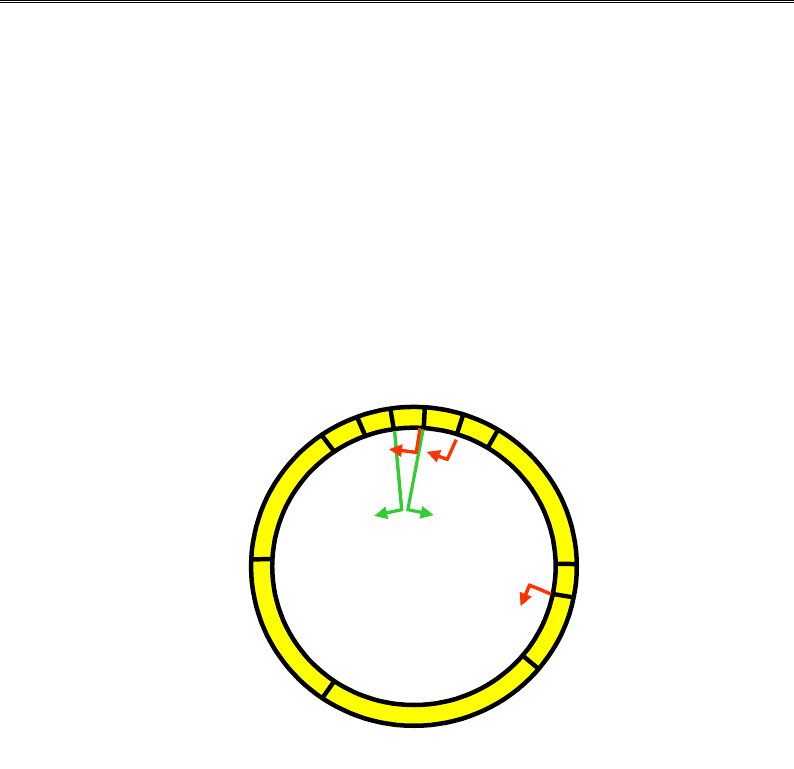
Після проникнення в бактеріальну клітину лінійна ДНК бактеріо-
фага
λ (довжиною приблизно 50 тис. пар основ) замикається в кіль-
це бактеріальною лігазою (ligase – АТР-залежний фермент, що ката-
лізує утворення фосфодіефірного зв'язку між 5'- та 3'-кінцевими ну-
клеотидами). Геном фага містить гени, що відповідають за синтез
білків головки та хвоста фагової частинки, реплікацію фагової ДНК,
лізис бактерії, рекомбінацію (вбудовування фагової ДНК у бактеріа-
льний геном), і кілька регуляторних генів, що кодують фактори
транскрипції (рис. 5.18).
Гени
рекомбінації
Гени
голівки
Гени хвоста
Гени
л
ізису
Q
cIII
N
cI
cII
cro
Гени
реплікації
P
RM
P
RE
P
R'
P
R
P
L
Рис. 5.18. Циркулярна ДНК бактеріофага λ.
Стрілочками позначено промотори та напрямок транскрипції:
зелені – сильні промотори, червоні – такі, що потребують активації
Існують два шляхи розвитку фага : лізогенія – лінеаризація фагової
ДНК, вбудовування її в бактеріальний геном і блокування більшості
генів фага; лізис (після інфекції або шляхом вирізання фагової ДНК із
бактеріального геному та її циркуляризації після лізогенії) – активація
реплікації фагової ДНК і синтезу білків оболонки, збирання фагових
частинок та руйнування клітини.
