Семиохин И.А., Страхов Б.В., Осипов А.И. Кинетика химических реакций
Подождите немного. Документ загружается.


начает, что
кривая
зависимости y(t) имеет перегиб. Используя
необходимое
условие перегиба и уравнение
(3.25),
запишем
т.
е. d
2
z/dt
2
обращается в
нуль
при том же значении t, что и
производная
dy/dt.
Следовательно,
'пер — Гмакс 7 7 Г"^ 77' ^ '
Рассмотрим
предел *макс=*пер при
|-*<х>.
Чтобы разрешить не-
определенность
оо/оо,
воспользуемся правилом Лопиталя:
lim
/
MaKC
=lim—!5£—
= lim
-^-=0.
(3.32)
l-oo
S-*oo^(g—
1) ^oo k
x
Таким образом, максимум концентрации промежуточного
вещества В с возрастанием
k
2
/ki
не только уменьшается, как
было показано
выше,
но и смещается к началу координат.
Очевидно, что по мере увеличения отношения констант
кривая
y(t)
приближается к оси абсцисс и производная
dy/dt
все боль-
ше приближается к нулю.
При
k^>k
x
уравнение
(3.27)
можно заменить следующим
выражением:
Запишем отношение
[В]/[А],
учитывая
(3.26):
Ж
=
Х
==
А
=
Т1
/
2
<
2
)
>
(3.33)
[А]
X k
2
Т
1/2(1)
'
где
т./,(1)
и
т./,(2)
— периоды полупревращения веществ А и В,
Выражение
(3.33)
получило название векового равновесия.
При
k
2
>k
x
уравнение
(3.27)
приобретает вид
В
этом случае отношение
[В]/[А]
становится
равным:
i5L
=
JL=:_^_
(3.33а)
[А]
х
кг-к
х
Это
уравнение отвечает постоянству отношения концентраций
промежуточного вещества В и исходного вещества А в стацио-
нарном состоянии. В отличие от предыдущего векового равно-
весия последнее состояние
(3.33а)
называют переходным рав-
новесием,.
31

§
5. Механизм сложных реакций. Принцип стационарных
концентраций
Одной
из
типичных
задач феноменологической кинетики яв-
ляется
установление кинетического уравнения сложной реак-
ции на основе ее механизма. При решении этой задачи исполь-
зуют
основной постулат химической кинетики,
принцип
неза-
висимости и
принцип
стационарных концентраций.
Пусть
реакция типа
идет
по сложному механизму с образованием двух промежу-
точных веществ
М.
{
и М
2
:
1)
A-^
2)
M
1+
B-b-C
+Mt
.
(3.34)
3)
M
1
+A-*-*C+M
lf
4)
Mi-fMx-^A.
Пользуясь
основным постулатом химической кинетики
(1.11а)
и
уравнением
(1.10),
запишем уравнения для скоростей эле-
ментарных стадий:
*
2
*
(3
35)
_
4
2
dt dt
Используя
эти соотношения, запишем теперь уравнения для
суммарных скоростей изменения концентраций исходных ве-
ществ,
промежуточных веществ и продуктов реакции:
dt
dt
-к
г
[MJ
[В]
+k
3
[M
2
]
[А]-2Л
4
[Щ\
(3.36)
32

Получили систему пяти нелинейных дифференциальных
уравнений с постоянными.коэффициентами. В качестве началь-
ных условий взяты уравнения материального баланса:
(3-37)
Эта система не интегрируется в квадратурах. Ее решение мож-
но
проводить с помощью численных методов (в том числе с
использованием ЭВМ) или применять какие-либо приближен-
ные
методы (чаще всего это принцип стационарных концент-
раций).
Допустим, что концентрации промежуточных веществ малы
по
сравнению с концентрациями исходных веществ и продук-
тов реакции. В этом случае вместо условий (3.37) запишем
Дифференцируя эти уравнения по времени
<*[А] • 1 d[C] _
Q и
d[B] I d[C) _
Q
dt 2 dt dt 2 dt
и
подставляя соответствующие значения скоростей из (3.36),
получим
ИЛИ
Аналогично,
-М
Мх]
[В]
+ у
*,[
MJ
[Bj + ± k
a
[м
2
]
[А]=о,
или,
что то же самое,
Из
этого следует, что при условии
[MJ, [М
2
]<[А], [В], [С] (3.38)
концентрации
промежуточных веществ стационарны, т. е.
AML^o,
d
IM«]
=0 (
3.з9)
dt dt
v ;
Соотношения
(3.39) и являются выражением
принципа
ста-
ционарных
концентраций,
а неравенство (3.38) — достаточным
2 Зак 303 33

условием
корректного его применения. Принцип стационарных
концентраций следует применять в случае, когда промежуточ-
ные вещества обладают высокой реакционной активностью и в
силу
этого не накапливаются в
ходе
реакции.
Производные
по времени от концентраций реагирующих ве-
ществ
равны
нулю и тогда, когда значения концентраций экс-
тремальны, но в этом случае — только в точке экстремума
или с учетом ошибок кинетических измерений — в некоторой
ее
окрестности. В литературе иногда принимаются за стацио-
нарные концентрации промежуточных веществ, далекие от ну-
левых. Однако в
этих
случаях желательно экспериментальное
подтверждение
справедливости сделанного предположения.
Вернемся
к системе уравнений
(3.36).
Складывая два пред-
последних
уравнения
этой
системы и учитывая соотношения
(3.39),
найдем концентрации промежуточных веществ М, и М
2
:
Подставив
эти значения в уравнение для скорости
образо-
вания продукта реакции
(3.36):
и
обозначая концентрацию С через 2х, получим
[А]
=
[А]„-х,
[В]
=
[В]
0
-х
И
^Н
1/2
^-х).
(3.40)
Таким образом, в результате применения принципа стационар-
ных концентраций для скорости реакции получено дифферен-
циальное уравнение с разделяющимися переменными, которое
нетрудно
проинтегрировать. Следует отметить, что в уравнении
(3.40)
отсутствует константа
k$,
т. е. скорость реакции не за-
висит от ее величины.
В
качестве второго примера рассмотрим механизм
образо-
вания бромистого водорода:
Н
2
+
Вг
2
->-2НВг.
В
интервале температур от 230 до
300
°С эта реакция, по Бо-
денштейну, происходит по
схеме:
2)
Вг+Н
2
->НВг
+
Н,
ДН
2
=
69,9
кДж/моль;
3)
Н
+
Вг
2
->НВг
+
Вг,
ДН
3
=
—172,0
кДж/моль;
(3.41)
4)
Н
+
НВг-*Н
2
+Вг,
ДН
4
=—69,9
кДж/моль;
5)
34

Из-за
сильной эндотермичности
в
этой
схеме
не
учитывается
стадия Вг+НВг-*Н + Вг
2
.
Скорость образования бромистого водорода можно записать
в виде
W
=
T
(3.42)
Согласно принципу стационарных концентраций Боденштей-
на
для
промежуточных веществ (атомов
Н и Вг):
^
[Вг
а
]
+
k
t
[H]
[HBr]—2k
b
[Br]
2
[M]
=
0.
(3.43)
Складывая
оба
уравнения, получим
1/2
. (3.44)
Подставим теперь значение
[Вг] в
первое
уравнение системы
(3.43):
г
HI
= MHtHMBr,]/*,,)"
2
,
3 45
ч
1
J
ftj,[Brt)+ft«[HBr]
'
V
" '
При
совместном решении уравнений
(3.42)
и
(3.43)
получим
соотношение
для
скорости образования бромистого водорода:
, (3.46)
w
Подставим
в это
соотношение значение
[HI из
(3.45):
w
^
I d
[HBr]
^
frfr
[Hl
]
[Вг
а
]
2
dt ЫВг
2
]+*
4
[НВг]
Разделив числитель
и
знаменатель
на
ЫВг
2
], получим выраже-
ние
для
скорости образования бромистого врдорода
в
соответ-
ствии
с
рассмотренным выше механизмом реакции:
=
MW^N^
(3
47)
1
+ Л1НВг]/Л[Вг] '
Это выражение совпадает
с
приведенным
в § 5
главы
1 ки-
нетическим уравнением, полученным
из
опытных данных.
Применение
принципа стационарных концентраций, приво-
дящее
к
замене части дифференциальных уравнений алгебраи-
ческими, позволяет получать кинетические уравнения сложных
реакций
в
аналитическом виде. Однако
при
таком
подходе
уравнения становятся приближенными, происходит неизбежная
потеря информации.
2*
35

Чтобы
получить представление о характере приближений,
обратимся
к простейшему примеру — последовательным реак-
циям первого порядка, рассмотренным в § 4 настоящей
главы:
Интегрируя систему кинетических уравнений
(3.26—3.28),
мы получили
=
a(1
Js
где
х, у, z — текущие концентрации веществ А, В и С соответ-
ственно.
Применяя
принцип стационарных концентраций к концент-
рации вещества В, предположим, что
dy/dt=O,
тогда
Сравнивая приближенное решение с точным, обратим вни-
мание на то, что концентрация продукта реакции z не зависит
от
константы скорости k
2
и целиком определяется только кон-
стантой
скорости первой реакции k
x
. С другой стороны, при
k
{
=k
2
концентрации А и В в любой момент времени равны.
Если
же
k
x
>k
2
,
то концентрация В при /-*0 стремится к вели-
чине, превышающей начальную концентрацию А. Таким обра-
зом,
принцип стационарных концентраций нельзя применять
при значениях констант скорости
k
x
>>k
2
.
Для выяснения роли
отношения
констант k
2
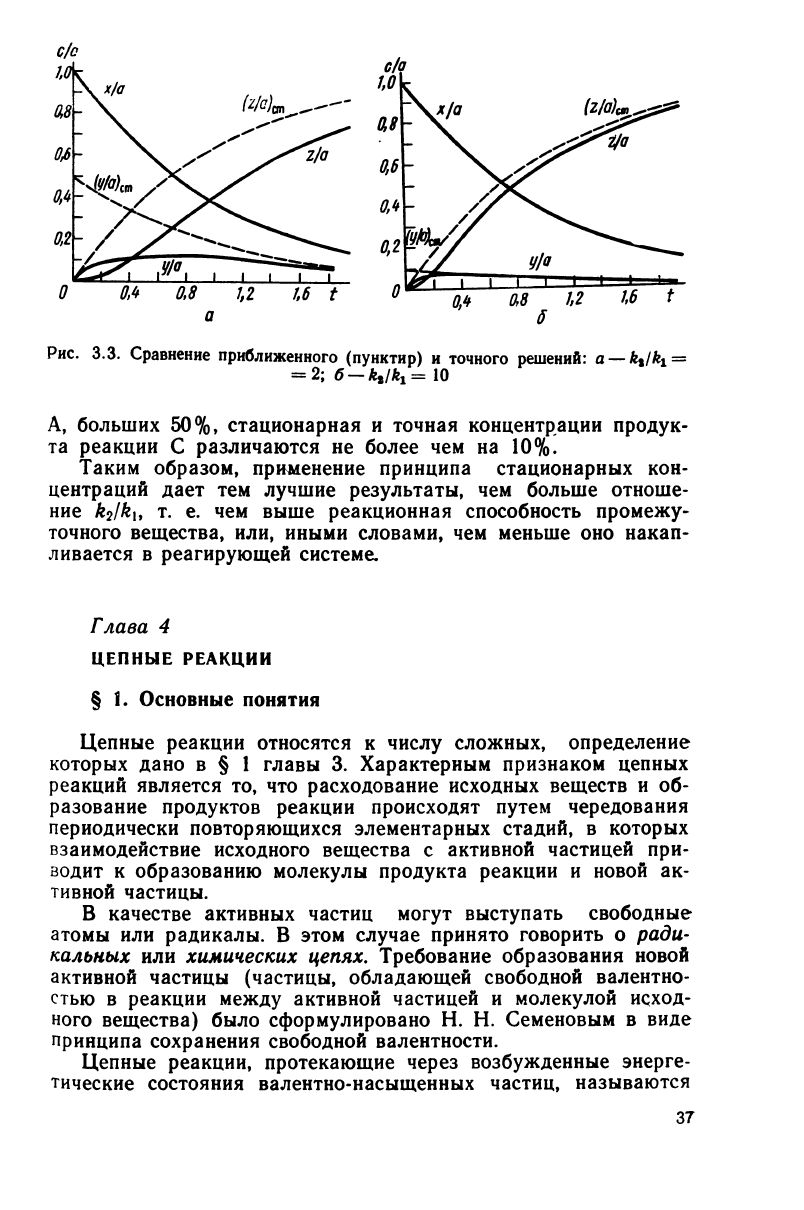
\k\ рассмотрим два примера (рис.
3.3,
а, б).
В
первом случае
(k
2
/k
{
=2)
концентрация промежуточного
вещества
В, рассчитанная с применением принципа стационар-
ных концентраций, становится близкой к соответствующей кон-
центрации, полученной из точного решения
лишь
тогда, когда
степень
превращения исходного вещества достигла 70%- К это-
му же времени стационарная концентрация продукта реакции
С
отличается от точно вычисленной на 50% ее> величины.
Во
втором случае
(k
2
/k
{
=l0)
стационарная концентрация
промежуточного вещества В практически совпадает с вычис-
ленной из точного решения, начиная со степени превращения
исходного
вещества, равной 20%. При степенях превращения
36
0,4
0,8 1,2 1,6 t
Ofi
0,8 1,2
5
Рис.
3.3. Сравнение приближенного (пунктир) и точного решений:
=
2;
6
—
1
1,6
t
А, больших 50%, стационарная и точная концентрации продук-
та
реакции С различаются не
более
чем на 10%.
Таким образом, применение
принципа
стационарных кон-
центраций
дает
тем
лучшие
результаты, чем больше отноше-
ние
k
2
/k
u
т. е. чем
выше
реакционная способность промежу-
точного вещества, или,
иными
словами, чем меньше оно накап-
ливается в реагирующей системе.
Глава
4
ЦЕПНЫЕ РЕАКЦИИ
§
1.
Основные понятия
Цепные
реакции относятся к числу сложных, определение
которых дано в § 1
главы
3. Характерным признаком цепных
реакций является то, что расходование исходных веществ и об-
разование продуктов реакции происходят путем чередования
периодически повторяющихся элементарных стадий, в которых
взаимодействие исходного вещества с активной частицей при-
водит к образованию молекулы продукта реакции и новой ак-
тивной частицы.
В
качестве активных частиц могут выступать свободные
атомы или радикалы. В этом случае принято говорить о ради-
кальных
или химических цепях. Требование образования новой
активной частицы (частицы, обладающей свободной валентно-
стью в реакции между активной частицей и молекулой
исход-
ного вещества) было сформулировано Н. Н. Семеновым в виде
принципа
сохранения свободной валентности.
Цепные
реакции, протекающие через возбужденные энерге-
тические состояния валентно-насыщенных частиц, называются
37

реакциями с энергетическими цепями. Широко распростране-
ны смешанные цепи, в которых участвуют активные частицы
того
и другого сорта.
Образование
продуктов реакции при взаимодействии актив-
ных частиц с молекулами исходного вещества не является до-
статочным признаком цепной реакции. В качестве примера
можно
привести реакцию термического разложения оксида
азота
N26:
,
2 2
3. N
2 2
2.
N
2
CT->N
a
+O,
4.
N
2
O+O-*N
2
+O
2
.
Здесь
атомы кислорода образуются в результате термически
активированной реакции распада молекулы N
2
O и в последую-
щих стадиях не приводят к образованию новых активных ча-
стиц.
§
2. Классификация элементарных стадий
В
зависимости от роли в развитии цепной реакции элемен-
тарные стадии классифицируют следующим образом: 1) зарож-
дение
цепей; 2) продолжение цепей; 3) разветвление цепей;
4)
обрыв цепей.
Реакциями
зарождения цепей называют реакции превраще-
ния исходных молекул, приводящие к образованию активных
частиц, например:
В
реакциях продолжения цепей активные частицы взаимо-
действуют с молекулами исходных веществ с образованием но-
вых активных частиц,
причем
общее число активных частиц со-
храняется:
СН
4
+
ОН->СН
3
+Н
2
О.
К
реакциям продолжения относятся также процессы, в кото-
рых одна активная частица заменяется другой, но не расходу-
ется
молекула исходного вещества или (и) не образуется
MO
J
лскула продукта:
R + O
2
->RO
2
,
QH
6
-*•
C
2
H
4
+н,
СН
3
СЮ->СН
2
ООН.
38

Реакциями
разветвления
цепей
называют реакции, в резуль-
тате
которых увеличивается число активных частиц:
Н
+ О
2
-+ОН4 О,
NC1
3
+ NC1
2
-+ N
2
+
Cl
2
+
ЗС1.
К
реакциям
обрыва
цепей
относятся
реакции, приводящие к
исчезновению активных частиц. В зависимости от порядка ре-
акции
по активным частицам различают линейный- и квад-
ратичный обрывы цепей:
С1
стенка
-^1/2С1
2
) . . *
\
линейный обрыв,
Н
+
Н
+
М
* Н
2
+ М—квадратичный обрыв.
§
3.
Неразветвленные
цепные
реакции
В качестве примера неразветвленной цепной реакции рас-
смотрим реакцию водорода с хлором. Важнейшими стадиями
механизма этой реакции являются следующие:
0) C
или
2
—НС1
+ Н,
2)
3)
4)
В механизме не учитывается первичная диссоциация водо-
рода, поскольку ее энергия
(448,9
кДж/моль) почти в два ра-
за превышает энергию диссоциации хлора
(238,9
кДж/моль).
Не
учитываются также процессы рекомбинации:
Н
н+а+м-^на+м.
Эти процессы вследствие малой концентрации атомов водоро-
да, обусловленной их высокой активностью, не
могут
конкури-
ровать с процессами (3) и (4).
В то же время тормозящее влияние различных посторонних
примесей (О
2
, СЮ
2
, NC1
3
, NH
3
и др.) приводит к необходимо-
сти
учета
процессов обрыва цепей, связанных с гибелью актив-
ных частиц (Н, С1) при взаимодействии их с молекулами при-
месей:
н+о
2
+м->но
2
+м,
2
+
М->СЮ
2
+М,
39

за которыми
следуют
процессы
Н,
С1
+
НО
2
-*Н
2
,
НС1
+ О
2
и
Н,
С1
+
СЮ
2
-*НС1,
С1
2
+ О
2
.
Одно из ярких проявлений тормозящего действия примесей
выражается в существовании так называемого
периода
индук-
ции цепных реакций.
1.
Кинетика
неразветвленных
цепных
реакций.
Кинетику
неразветвленных цепных реакций
удобно
описывать исходя из
понятия
средней
длины
цепи,
под которой понимают среднее
число актов продолжения цепи, начиная с появления актив-
ной
частицы в акте зарождения и кончая обрывом цепи.
Обозначим через а вероятность продолжения цепи,
тогда
вероятность того, что цепь
будет
состоять из s звеньев, равна
/>
8
=
a
s
(l-cc)
=
(l-P)
s
P,
(4.1)
где р=1—a — вероятность обрыва цепи.
Среднюю длину цепи v можно найти как математическое
ожидание случайной величины s с вероятностью Р:
Если вероятность обрыва цепей мала, то средняя длина цепи
равИа обратной вероятности обрыва цепей: v=l/f$.
Каждая цепь, начинающаяся с момента зарождения актив-
ной
частицы, приводит к образованию s молекул продукта ре-
акции,
а w
0
активных частиц, зарождающихся в.единицу вре-
мени,
— к образованию w$v молекул продукта. Таким образом,
скорость неразветвленной цепной реакции равна
w = w
o
v =
ш
о
/Р
(4.3)
и
определяется целиком факторами, влияющими на скорость
зарождения и обрыва цепей.
Скорость неразветвленной цепной реакции можно описать
также исходя из предположения, что в
ходе
реакции наблюда-
ется только линейный обрыв цепей. В этом
случае
для ско-
40
