Панов В.К. Физические основы теплотехники. Ч. I: Термодинамика
Подождите немного. Документ загружается.


69
Удельная теплоемкость вещества равна теплу, необ-
ходимому единице количества вещества для изменения
температуры на градус:
.
tm
Q
c
Δ
=
(3.11)
Здесь же стóит добавить: теплоемкость – это физическое
свойство, определяющее характер изменения температуры
вещества в процессах теплообмена. Слова «характер измене-
ния» в данном случае очень соответствуют сути: увеличение
или уменьшение, большое или маленькое.
Из определения сразу следует размерность удельной те-
плоемкости. В выражении (3.11) количество вещества обозна-
чено буквой, обычно используемой для обозначения массы. В §
5 обсуждалось, что количество может быть задано по-разному,
с использованием разных единиц. Поэтому для удельной тепло-
емкости возможны три размерности и три названия:
с
m
,
Ккг
Дж
⋅
–
удельная массовая;
с
μ
,
Ккмоль
Дж
⋅
–
удельная мольная или молярная;
с΄,
Км
Дж
3
⋅
–
удельная объемная.
Про удельную теплоемкость можно сказать, что это теп-
лоемкость единицы количества вещества. Про объемную надо
уточнить – это теплоемкость кубометра вещества при нор-
мальных физических условиях, что особенно важно для газов.
Наиболее надежные значения удельной теплоемкости,
как и большинства физических свойств, определяются экспе-
риментально и их можно найти в справочниках.
Теперь обсудим некоторые особенности этого свойства.
1. Разным размерностям соответствуют разные чис-
ленные значения. Это и понятно, ведь на один гра-
дус изменяется температура различного количества
вещества. Так, в киломоле (см. определение в § 5)
вещества всегда больше, чем в килограмме. Поэтому
между молярной и массовой теплоемкостями про-

70
стое соотношение:
с
μ
= μ с
m
. (3.12)
Для каждого вещества в справочниках обычно приво-
дятся все три величины. Для расчетов нужно выбирать ту, ко-
торая соответствует размерности заданного количества веще-
ства: если задана масса – брать с
т
, если количество молей — c
μ
.
2. Большинство свойств и теплоемкость зависят от пара-
метров состояния вещества, в первую очередь от температуры:
с = f (Т). (3.13)
Это означает, что при нагревании на один градус, на-
пример от 10-го до 11-го, потребуется одно тепло, а от 500-го
до 501-го — другое.
В связи с этим появляются два понятия: истинная и
средняя теплоемкость. Несколько упрощенно можно сказать
так: истинная теплоемкость – это теплоемкость вещества
при любой определенной температуре. Имея в виду ее экспе-
риментальное определение, надо уточнить, что это предельное
значение, к которому стремится величина, вычисляемая по
выражению (3.11), при уменьшении интервала Δt до нуля:
mdt
Q
с
t
δ
0
ист
lim
→Δ
=
= f (T). (3.14)
Организовав такой бесконечно малый процесс (считает-
ся достаточным Δt = 1 °С) вокруг различных значений темпе-
ратуры, можно получить зависимость (3.13).
Про среднюю теплоемкость можно сказать, что это ве-
личина, соответствующая определенному конечному (т. е.
крупному) интервалу температур. Определение (3.11) отно-
сится именно к средней теплоемкости. С другой стороны,
если известна зависимость (3.14), то при ее интегрировании
в нужном диапазоне температуры получается среднее для
интервала значение теплоемкости:
)()(
1
2
ист
tfdТТс
t
с
t
. (3.15)
1
t
Δ=
Δ
=
∫
Значение
с
будет различным в зависимости от ширины
интервала и его положения на температурной шкале.
Характер зависимости (3.13) у разных веществ различ-
ный. Но общие черты таковы:
−
теплоемкость газов растет с температурой. В идеаль-

71
но-газовой области состояний с = f (Т) практически линейна;
−
у многих технически важных газов зависимость до-
вольно слабая, и ею можно пренебречь. Например, у двух-
атомных газов, таких как водород, кислород, азот, окись угле-
рода и пр., в интервале от 0 до 1000 °С изменение теплоемко-
сти составляет 10–15%.
Практический вывод из этого такой. При технических
расчетах приходится использовать значения физических
свойств, определяемых экспериментально, а поэтому с по-
грешностью. Обычно это несколько процентов. Кроме того,
используются модели (наподобие идеального газа с описы-
вающим его уравнением Клапейрона – Менделеева), которые
также приблизительны. Поэтому результаты технических рас-
четов содержат погрешность, как правило, в несколько про-
центов. В связи с этим во множестве случаев теплоемкость
можно считать постоянной, равной значению при какой-либо
известной температуре (начальной, конечной, средней или
другой, осмысленно выбранной).
Зависимость теплоемкости от давления еще более сла-
бая, чем от температуры. Заметным влияние давления стано-
вится только при значениях в сотни бар.
3. Самая важная особенность. В определении теплоем-
кости говорится, что «это тепло…». Тепло, как мы выяснили в
предыдущем параграфе, зависит от процесса при фиксирован-
ных начальном и конечном состояниях. Процессов в одном и
том же интервале температур можно организовать множество.
Поэтому удельная теплоемкость вещества, определяемая по
формуле (3.11), тоже становится функцией процесса:
с = f (процесса). (3.16)
Этот формальный пока вывод означает следующее. Один
и тот же, к примеру, килограмм одного и того же вещества для
изменения температуры на один и тот же градус в разных про-
цессах «потребует» разное количество тепла! Чтобы показать,
насколько разное, приведу пару наглядных примеров.
Пример 1. Думаю, каждому в детстве приходилось хоть
раз накачивать колесо своего велосипеда ручным насосом.
Порции воздуха в этом цилиндрике сжимаются и отправляют-
ся в камеру. Термометр, роль которого выполняет рука, дер-
72
жащая насос, говорит о том, что температура воздуха повыша-
ется. Спрашивается: почему? Разве вы греете его, подводя те-
пло? Нет. Многие здесь вспоминают про трение. Действитель-
но, трение кое-что добавляет, но его вклад можно существен-
но уменьшить (например, хорошей смазкой) – принципиально
это дела не изменит. Температура повышается не из-за тепло-
обмена, а по другим причинам. В таком процессе, в котором
тепло не подводится и не отводится (теплообменом можно
пренебречь), согласно §13 надо считать
Q = 0 ⇒ (из (3.11)) с = 0.
Пример 2. Вспомним снова процесс кипячения чайника.
Тепло подводится, не вызывая изменения температуры. В зна-
менателе дроби в (3.11) появляется ноль, а вся дробь стано-
вится бесконечной:
Q > 0, Δt = 0 ⇒ (из (3.11)) с =
∞
.
По существу, теплоемкость может быть любой. И это
физическое свойство!
Такой вывод в первый момент обескураживает как сам
по себе, так и в практическом смысле. Действительно, что
проку от простого хорошего выражения (3.10), если одна ве-
личина в нем может принимать любые значения?
Но все не так плохо. В самом деле, главное, для чего
нужна теплоемкость — вычисление тепла. Тепло — в очеред-
ной раз повторю — характеристика процесса. Это означает,
что, берясь вычислять тепло, мы заранее должны знать, о ка-
ком процессе идет речь, иначе это бессмысленно. Тогда не-
определенность с теплоемкостью исчезает — в выражение
(3.10) необходимо подставлять теплоемкость, соответствую-
щую процессу:
Q = с
проц
m Δt . (3.17)
Конечно, теплоемкость с
проц
должна быть заранее опре-
делена. Это, к счастью, не означает необходимости прово-
дить бессчетное количество экспериментов, соответствую-
щих всем мыслимым процессам. В следующей главе будет
показано, что достаточно в эксперименте определить тепло-
емкость в каком-то одном, наиболее просто и надежно реали-
зуемом процессе, а на любой другой ее можно будет пере-

73
считать, зная, разумеется, какой это процесс.
Подведем итоги. Вычисление тепла – одна из наиболее
важных задач технической термодинамики. Необходимо
уметь грамотно подсчитать тепло хотя бы потому, что оно
стóит немалых денег. Для этого есть простое выражение
(3.17). Вся сложность его использования сводится к правиль-
ному выбору удельной теплоемкости. Для облегчения можно
выделить три последовательных шага, соответствующих
трем обсужденным особенностям теплоемкости:
1)
определить, о каком процессе идет речь. Это, как прави-
ло, самый сложный момент, если дело касается реальной
ситуации, а не задачи из задачника. Приходится прояв-
лять инженерную смекалку для того, чтобы увидеть, а
при необходимости – доказать, к какому из известных
процессов ближе всего данный конкретный. Порой для
этого приходится организовать дополнительные измере-
ния;
2)
обратить внимание на размерность количества вещества и
исходя из этого сразу брать из справочника массовую,
мольную или объемную, чтобы потом не пересчитывать
одну в другую;
3)
определить, есть ли возможность и необходимость учесть
зависимость теплоемкости от температуры. Для этого
должны быть известны: интервал температуры, в котором
происходит процесс, конкретный вид зависимостей (3.14)
или (3.15) в аналитическом (в виде формулы) или таблич-
ном виде. Если этого нет, то результат по (3.17) все равно
может быть получен, только к нему надо относиться как к
первому приближению, требующему уточнения.
При таком подходе к делу полученный результат
можно будет отстаивать хоть перед преподавателем, хоть
перед государственной комиссией по разбору чрезвычайно-
го происшествия.
Справедливости ради нужно сказать, что вопрос об
удельной теплоемкости имеет гораздо большее значение, чем
только подсчет денег, потраченных на тепло. Исследования
теплоемкости, ее связи с другими свойствами проливают свет
на внутреннее строение вещества. И наоборот, особенности в

74
поведении теплоемкости в определенных диапазонах парамет-
ров находят убедительное объяснение с позиций молекуляр-
ной физики.
Вопросы для самопроверки
1.
Сформулируйте первое начало термодинамики.
2.
Приведите уравнение первого начала термодинамики.
3.
Каково правило знаков для работы?
4.
Что такое работа в термодинамике?
5.
Как вычисляется работа в произвольном процессе?
6.
Каким свойством обладает р-V диаграмма?
7.
Каким свойством обладает работа?
8.
Какой смысл вкладывается в понятие внутренней энергии?
9.
От чего зависит внутренняя энергия вещества? идеального
газа?
10.
Каким свойством обладает внутренняя энергия?
11.
Что такое тепло?
12.
В каких единицах исчисляется тепло? Что такое калория?
13.
Что означает запись Q = f(процесса)?
14.
Что общего и отличного у тепла и работы?
15.
Какое правило знаков установлено для тепла?
16.
Дайте определение удельной теплоемкости.
17.
Что такое и для чего нужна удельная теплоемкость?
18.
Какова размерность удельной теплоемкости?
19.
Какова связь между массовой и мольной теплоемкостями?
20.
Что такое истинная теплоемкость?
21.
Что такое средняя теплоемкость?
22.
От чего зависит удельная теплоемкость?
23.
В каких пределах может изменяться теплоемкость одного
и того же вещества?

75
ГЛАВА 4
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ
В ИДЕАЛЬНОМ ГАЗЕ
Предыдущая глава подводит нас к необходимости рас-
смотрения закономерностей различных термодинамических
процессов хотя бы потому, что работа и тепло зависят от про-
цесса. Теплоемкость оказалась свойством вещества, тоже за-
висящим от процесса.
Поэтому переходим к процессам. Процессы можно раз-
личить по условиям их реализации, по характерному поведе-
нию параметров. Обсуждение проведем по единому плану, от-
ражающему технический взгляд на предмет:
1.
Условия (практической) реализации процесса.
2.
Уравнение процесса и его вид в диаграммах. Связь
между параметрами, выраженная уравнением Клапейро-
на –Менделеева, в различных процессах проявляет свои
различные стороны. Это и выражают уравнения процес-
сов.
3.
Выражения для работы и тепла.
4.
Закономерности, вытекающие из применения к про-
цессу первого начала термодинамики.
Такой взгляд на процессы связан с возможностью или
целесообразностью их использования в тепловых машинах,
хотя про каждый из них можно узнать еще много интересного.
Дальнейшее рассмотрение относится к процессам, про-
исходящим с постоянным количеством одного и того же газа –
в закрытых системах. Напомню, что только такие, причем
равновесные процессы и могут быть изображены в термоди-
намических диаграммах без оговорок. В уравнениях процессов
и получаемых на их основе выражениях используются абсо-
лютные давление и температура.

§ 15. Изотермический процесс
76
§ 15. Изотермический процесс
1. Т = const. Изотермический — это процесс при постоян-
ной температуре. Раз один из трех параметров — температура
— постоянен, то меняются два других — давление и объем.
Значит, это должны быть процессы расширения-сжатия. Для
того чтобы температура не менялась, нужно проводить их либо
очень медленно (чтобы температура газа успевала выравни-
ваться с температурой окружающей среды), либо обеспечить
очень интенсивный теплообмен газа с окружающей средой.
2. Первое детальное исследование изотермического про-
цесса, как упоминалось во введении, предпринял Роберт Бойль.
Примерно в одно время с Бойлем подобные эксперименты проводили
и другие. Бойль считается автором закона благодаря тому, что его экспери-
менты сопровождались весьма точными измерениями. Кроме этого, Бойль
первым опубликовал свои результаты сначала на английском, а затем на
международном тогда языке науки – латинском.
Установка Бойля представляла собой U-образную трубку высотой в
несколько метров с одним закрытым концом. Через второй открытый конец
понемногу добавлялась ртуть, игравшая роль одновременно гидрозатвора,
отделяющего сжимаемый газ от атмосферы, поршня, сжимающего газ, и
элемента манометра, определяющего давление в газе.
Эксперименты состояли в сжатии и расширении воздуха
при давлениях как существенно выше, так и ниже атмосфер-
ного. Результатом стал всем известный закон
рV = const. (4.1)
В переводе на русский эта фраза может звучать так: для
заданного количества выбранного газа произведение его
давления и объема будет одинаковым во всех состояниях с
выбранной температурой. Значение константы может быть
различным, поскольку в ней скрываются количество газа, его
молярная масса и та постоянная температура, при которой
происходит процесс. Но это выяснилось позже.
Из уравнения (4.1) следует, что между объемом и давле-
нием обратно пропорциональная зависимость, расширение со-
провождается понижением давления, сжатие – наоборот:
V
p
const
=
. (4.2)
Значение константы можно расшифровать еще и так.
Поскольку произведение давления и объема в любом состоя-
§ 15. Изотермический процесс
77
н
ам
г
, 800 К и 1500
нии одного и того же процесса одинаково, достаточно знать
обе величины в каком-то одном состоянии, например началь-
ном. Тогда уравнение процесса (4.1) можно представить в виде
р
1
V
1
= р
2
V
2
= р
3
V
3
= … (4.3)
и, ограничившись одним равенством из этой цепочки, исполь-
зовать для нахождения любого из четырех параметров, если
известны остальные три.
Теперь изобразим процесс в диаграммах для одного ки-
лограмма газа при различных постоянных температурах. Как
следует из выражения (4.2), это будет семейство гипербол, ка-
ждая из которых соответствует определенной температуре.
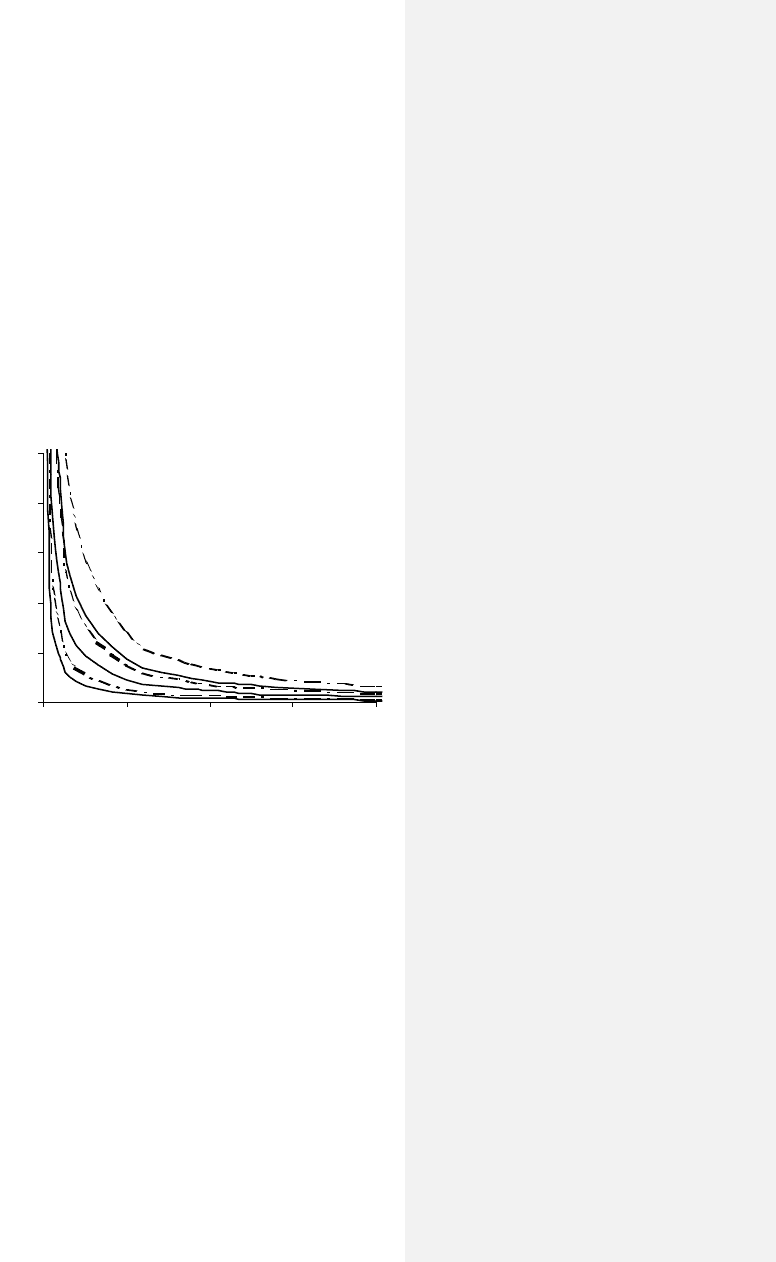
На рис. 4.1
представлены а од-
ной диагр ме изо-
термы азота, на три
четверти составляю-
ще о воздух, и водя-
ного пара в практиче-
ски наиболее интерес-
ном диапазоне пара-
метров. Для каждого
из газов изображены
процессы, соответст-
вующие температурам
300 К К.
Гипербола, соответствующая большей температуре, располага-
ется дальше от начала координат.
Из этой диаграммы можно заключить, например, что при
одинаковой температуре и плотности (ρ = 1/
v) давление водяно-
го пара будет выше, чем азота. Этот любопытный момент мо-
жет быть легко объяснен с позиций молекулярного строения
вещества. Одинаковая плотность означает, что в одинаковом
объеме сосредоточена одинаковая масса газов. Но молекулы
водяного пара меньше и легче, чем молекулы азота (μ
пара
= 18
кг/кмоль, μ
азот
= 28 кг/кмоль), поэтому их больше поместится в
том же объеме для того, чтобы набралась та же масса. Давление
газа по молекулярно-кинетической теории пропорционально
количеству молекул в единице объема, т. е. концентрации.
40
50
р, бар
0
10
20
30
00,511,52
v, м
3
/кг
Рис. 4.1 Изотермы воздуха (сплошные)
и водяного пара (пунктирные)

§ 15
78
∫
=
−
2
. Изотермический процесс
На диаграммах р-Т и v-Т изотермы будут, конечно, пря-
мыми, перпендикулярными оси температуры (рис. 4.2).
Полезно посмот-
реть на диаграммы и с
другой стороны — фор-
мально математической.
Изотермы к координатах
р-Т и
v-Т представляют
собой элемент привыч-
ной прямоугольной ко-
ординатной сетки, используемой для построения точки.
В р-
v диаграмме те же линии Т = const можно считать
элементом криволинейной координатной сетки и так же ис-
пользовать для построения точки, когда задана температура и
один из параметров – давление или объем.
3. Выражение для работы получим из ее определения
(3.3), если подставить туда зависимость р от V (4.2), расшиф-
ровав ее как в (4.3):
1
21
pdVL
=
⎥
⎦
⎤
⎢
⎣
⎡
=
V
Vp
p
11
=
∫
2
1
11
V
dV
Vp
=
∫
2
1
11
V
dV
Vp
=
=
2
111
lnVVp
=
1
2
11
ln
V
V
Vp
;
1
2
11изотерм
ln
V
V
VpL =
. (4.4)
Это выражение работы справедливо только в изотерми-
ческом процессе. Проанализируем его.
Произведение рV – левая часть уравнения состояния. Его
можно заменить на (m/μ)R
0
T. Поэтому при прочих равных условиях:
1)
работа газа тем больше, чем больше количество газа;
2)
килограмм более легкого газа (с меньшей молярной мас-
сой) совершит бóльшую работу;
3)
работа одной и той же порции газа больше при более
высокой температуре;
4)
зависимость работы от степени расширения (V
2
/V
1
) – лога-
рифмическая. С ее увеличением прирост работы становится
все меньше. Поэтому изотермический процесс с большим
расширением для получения работы малоэффективен.
р
Т
v
Т
Рис. 4.2. Изотермы в диаграммах р-Т и v-Т
