Панов В.К. Физические основы теплотехники. Ч. I: Термодинамика
Подождите немного. Документ загружается.

§ 28. Равновесность и обратимость процессов
119
нужно вернуть 100 Дж, т. е. непосредственно над газом долж-
на быть совершена такая работа. Но кроме этого внешней сре-
де придется потратить еще 10 Дж против силы трения. Поэто-
му при сжатии газа ΔU
внеш.ср
= –110 Дж, а получено было при
его расширении всего 90 Дж.
В результате мы провели адиабатный процесс в прямом
и обратном направлениях, вернули газ в исходное состояние,
но это привело к изменению состояния внешней среды. По-
этому такой процесс придется считать необратимым.
Какова причина необратимости? В данном примере это
сила трения. Степень изменения состояния внешней среды, а
значит, и степень необратимости процесса, очевидно, опреде-
ляется относительным вкладом силы трения в энергетический
баланс процесса. В этом примере он составил 10%.
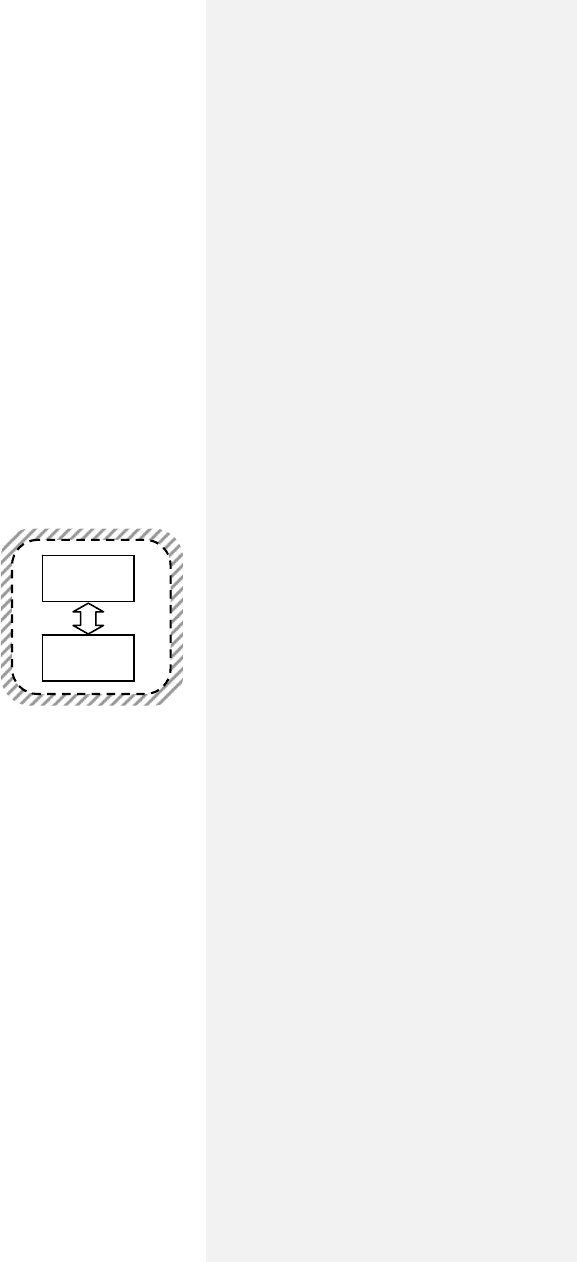
Другой пример — теплообмен.
Пусть два тела с температурами Т
1
и Т
2
об-
разуют изолированную систему (рис. 5.13).
Тело 1 передало телу 2 100 Дж тепла. Ес-
ли температуры тел одинаковы, эти 100 Дж
с тем же успехом могут быть переданы
обратно и «никто этого не заметит» — на
состоянии внешней среды и самих тел та-
кой обратимый процесс не отразится. Но,
опять же, так не бывает.
тело 1
Заметный теплообмен происходит между телами с раз-
личной температурой (рис. 5.14). Если Т
2
< Т
1
, то вернуть телу 1
его 100 Дж можно, но для этого между телами нужно помес-
тить рабочее тело и организовать в нем обратный цикл. Это
значит, что потребуются затраты внешней работы (L
ц
< 0) – на-
пример 20 Дж.
Как следует из первого начала для кругового процесса
Q
ц
= Q
1
– Q
2
= L
ц
⇒ Q
1
= L
ц
+ Q
2
,
горячему источнику – телу 1 будет передано больше тепла,
чем отнято у холодного – тела 2, на величину затраченной ра-
боты цикла. Поэтому, вернув телу 1 отданные им 100 Дж теп-
ла, тело 2 в исходное состояние мы не вернем, поскольку у не-
го будет отнято всего 80 Дж тепла. Точно так же, если захотим
вернуть в исходное состояние тело 2, отнимем у него полу-
тело 2
Q
T
1
T
2
Рис. 5.15. Обратимый
теплообмен

§ 28. Равновесность и обратимость процессов
120
ченные 100 Дж тепла, но телу 1 придется получить 120 Дж те-
пла. В любом случае один из участников теплообмена в ис-
ходное состояние не возвращается. Кроме того, затраты внеш-
ней работы вызывают изменения в состоянии внешней среды.
Поэтому неравновесный теплообмен – процесс необратимый.
Степень необратимости в данном случае определяется
отношением затрачиваемой работы цикла к передаваемому
теплу, а она, в свою очередь, тем меньше, чем ближе темпера-
туры тел. Это легко показать, используя в рассматриваемом
примере цикл Карно.
Итак, мы приходим к ответу на первый вопрос. Равно-
весный процесс является обратимым, неравновесный – необ-
ратимым. Степень необратимости определяется степенью
неравновесности процесса.
Второго вопроса мы уже частично коснулись в § 25, рас-
сматривая возможности реализации цикла Карно: необрати-
мость теплообмена рабочего тела с источниками приводит к
уменьшению КПД. Теперь к этому надо добавить необрати-
мость процессов расширения-сжатия, приводящую к потерям
работы на трение, и получим вывод: любая необратимость
процессов в тепловой машине приводит к уменьшению ее
КПД. Этой мысли для эффектности порой придают несколько
парадоксальную окраску. Наибольшую работу можно полу-
чить от неравновесной системы, проведя в ней равновесный
(обратимый) круговой процесс.
Практическая сторона дела сводится к следующему.
Прикрывая глаза на некоторые подробности, можно сказать так:
чем медленнее протекает процесс, тем он равновеснее (обрати-
Тело 1
Тело 2
Q
T
1
T
2
П
р
ямой п
р
оцесс
Тело 1
T
1
Q
1
Q
2
Тело 2
T
2
Рабочее
тело
L
ц
Об
р
атный п
р
оцесс
Рис. 5.14. Необратимость
реального теплообмена

§ 28. Равновесность и обратимость процессов
121
мее). Но медленные процессы в двигателе означают его малую

§ 29. Второе начало термодинамики
123
мощность. Поэтому конструктору приходится всегда искать
компромисс между мощностью и экономичностью тепловой
машины.
§ 29. Второе начало термодинамики
Формальным, численным показателем неравновесности
процесса служит изменение энтропии. В только что рассмот-
ренном примере теплообмена энтропия тела 1 уменьшилась на
ΔS
1
= Q/Т
1
(ΔS
1
< 0, так как от тела 1 тепло отводится). У тела 2
энтропия выросла на ΔS
2
= Q/Т
2
(ΔS
2
> 0, тепло подводится). Но
поскольку Т
2
< Т
1
, то |ΔS
1
| < ΔS
2
. В результате неравновесного
процесса энтропия изолированной системы из двух тел выросла:
0
21сист
>+−=Δ+Δ=Δ
T
Q
T
Q
SSS
. (5.22)
21
При равновесном процессе в той же системе (Т
1
= Т
2
)
изменения энтропии тел одинаковы, а энтропия всей системы
постоянна. Из этого делается общий вывод: энтропия изоли-
рованной системы не убывает при любых процессах в ней:
Δ
S
сист
≥ 0. (5.23)
Если система изолирована, НЕ взаимодействует с внеш-
ней средой, то процессы, возможные в ней, следует считать
самопроизвольными. Протекание неравновесных процессов в та-
кой системе приводит к выравниванию параметров, т. е. к со-
стоянию равновесия, и сопровождается ростом энтропии. Об-
ратное направление неравновесного процесса, как мы видели,
требует вмешательства извне, компенсирующего процесса во
внешней среде. Это и есть суть второго начала термодинамики.
Формулировки разные:
1.
Невозможен самопроизвольный переход тепла от
холодного тела к более нагретому (Клаузиус).
2.
Невозможно построить периодически действующую
машину, которая не производит ничего другого,
кроме поднятия груза и охлаждения некоторого ре-
зервуара тепла (Планк).
3.
Теплота наиболее холодного из данной системы тел
не может служить источником работы (Хвольсон).
4.
Другие.

§ 29. Второе начало термодинамики
118
Математическое выражение второго начала – неравен-
ство (5.23) называют еще принципом возрастания энтропии, а
процессы, противоречащие ему, считают невозможными.
Вопросы для самопроверки
1.
Что происходит в тепловом двигателе?
2.
Для чего нужен круговой процесс?
3.
Что такое работа цикла?
4.
Что такое тепловая машина?
5.
Какова роль холодного источника?
6.
Приведите выражение и сформулируйте первое начало
термодинамики для кругового процесса.
7.
Что такое вечный двигатель первого рода?
8.
Что такое КПД теплового двигателя?
9.
Каким будет КПД идеального теплового двигателя?
10.
В чем отличие прямого и обратного циклов?
11.
Что такое холодильный коэффициент?
12.
В каких устройствах осуществляется обратный цикл?
13.
Что такое тепловой насос?
14.
Что такое отопительный коэффициент?
15.
Какое устройство наиболее эффективно для отопления?
16.
Какой термодинамический цикл осуществляется в ком-
прессорах?
17.
Что представляет собой цикл Карно?
18.
Почему процесс 2–3 к цикле Карно адиабатный?
19.
Чем определяется эффективность цикла Карно?
20.
Первая теорема Карно.
21.
Вторая теорема Карно.
22.
С чем связаны трудности осуществления цикла Карно?
23.
Что такое энтропия?
24.
Что означает запись s = f (T, v) = f (состояния)?
25.
Какова размерность энтропии?
26.
Что такое изоэнтропийный процесс?
27.
Как ведет себя энтропия при наличии теплообмена?
28.
Что означает аддитивность для энтропии?
29.
Каким свойством обладает Т-s диаграмма?
30.
Изобразите цикл Карно в р-v и Т-s диаграммах.

§ 30. Смесь идеальных газов 119
31. Что такое обратный процесс и обратимый процесс?
32.
Какие причины приводят к необратимости процессов?
33.
Как необратимость процессов влияет на КПД тепловых
машин?
34.
В чем суть второго начала термодинамики?
35.
Что такое самопроизвольный процесс?

§ 30. Смесь идеальных газов 120
ГЛАВА 6
ГАЗОВЫЕ СМЕСИ
§ 30. Смесь идеальных газов
Модель строения вещества по имени идеальный газ дает
возможность вести расчеты с приемлемой инженерной точно-
стью во множестве практических задач. Любой реальный газ
можно считать идеальным в тех состояниях, когда он не соби-
рается конденсироваться в жидкость.
Между тем практически всегда приходится иметь дело
не с одним газом, а с их смесью, и очень привлекательно было
бы применить модель идеального газа к газовой смеси. Но
прежде всего нужно оговорить условия, при которых смесь из
газов, взятых по отдельности в идеально-газовом состоянии,
тоже будет идеальным газом.
Первое условие. При смешивании газы не должны хи-
мически реагировать друг с другом — иначе образуется не
смесь, а новое вещество. Если смешаны газы, между которыми
возможна химическая реакция, то она будет идти обязательно.
Но скорость реакций экспоненциально зависит от температу-
ры, а в газовой фазе еще и степенным образом от давления.
Поэтому в области состояний, где скорость реакции между
смешанными компонентами пренебрежимо мала, они образу-
ют смесь. Если же со смесью происходят процессы сжатия,
подогрева, то скорость реакции будет нарастать и рано или
поздно пренебречь ею будет уже нельзя.
Второе условие. Идеальный газ — это разреженный газ
(§ 9). Значит, в смеси каждый компонент в присутствии дру-
гих по-прежнему не должен стремиться сконденсироваться в
жидкость. Смесь должна оставаться разреженным газом. Кри-
терием проверки смеси на идеальность может служить закон
Дальтона, о котором речь пойдет в следующем параграфе.

§ 30. Смесь идеальных газов 121
Состав смеси. Состав предполагает прежде всего указа-
ние, какие компоненты входят в смесь. Но этого недостаточно.
Возьмем для образования смеси два сильно различающихся
компонента, например водород с μ = 2 кг/кмоль и сернистый
газ с μ = 64 кг/кмоль. Если в смеси будет чуть-чуть водорода, а
остальное сернистый газ, то по свойствам такая смесь, оче-
видно, будет походить на сернистый газ. Наоборот: в смеси
чуть-чуть сернистого газа, а остальное — водород. Свойства
такой смеси, конечно, будут определяться водородом. Таким
образом, из этих двух компонентов можно получить бесчис-
ленное количество смесей с разными свойствами. Иными сло-
вами, состав означает: какие компоненты и в каком количест-
ве входят в смесь.
Количество вещества может быть задано массой, числом
киломолей и объемом. Так же и состав смеси может быть за-
дан массовыми, мольными и объемными долями.
1.
Массовая доля компонента:
см
m
m
с
i
i
=
∑
=1
i
c
– отношение массы компонента к массе
всей смеси; величина безразмерная;
0 ≤ с
i
≤ 1, поэтому часто выражается в процентах;
– сумма всех долей всегда равна целому.
2.
Мольная доля:
см
N
N
c
i
i
=
′
,
где N
i
– число киломолей i-го компонента; N
см
– число кило-
молей всех компонентов смеси: N
см
= Σ
N
i
. Мольная доля обла-
дает теми же свойствами, что и массовая.
3.
Объемная доля:
см
V
V
r
i
i
= ,
где V
i
– парциальный объем компонента (он будет рассмотрен
в следующем параграфе); V
см
— полный объем смеси.
Состав смеси может быть задан любым из трех способов
из соображений удобства, но все они связаны и при необходи-
мости могут быть пересчитаны друг в друга.
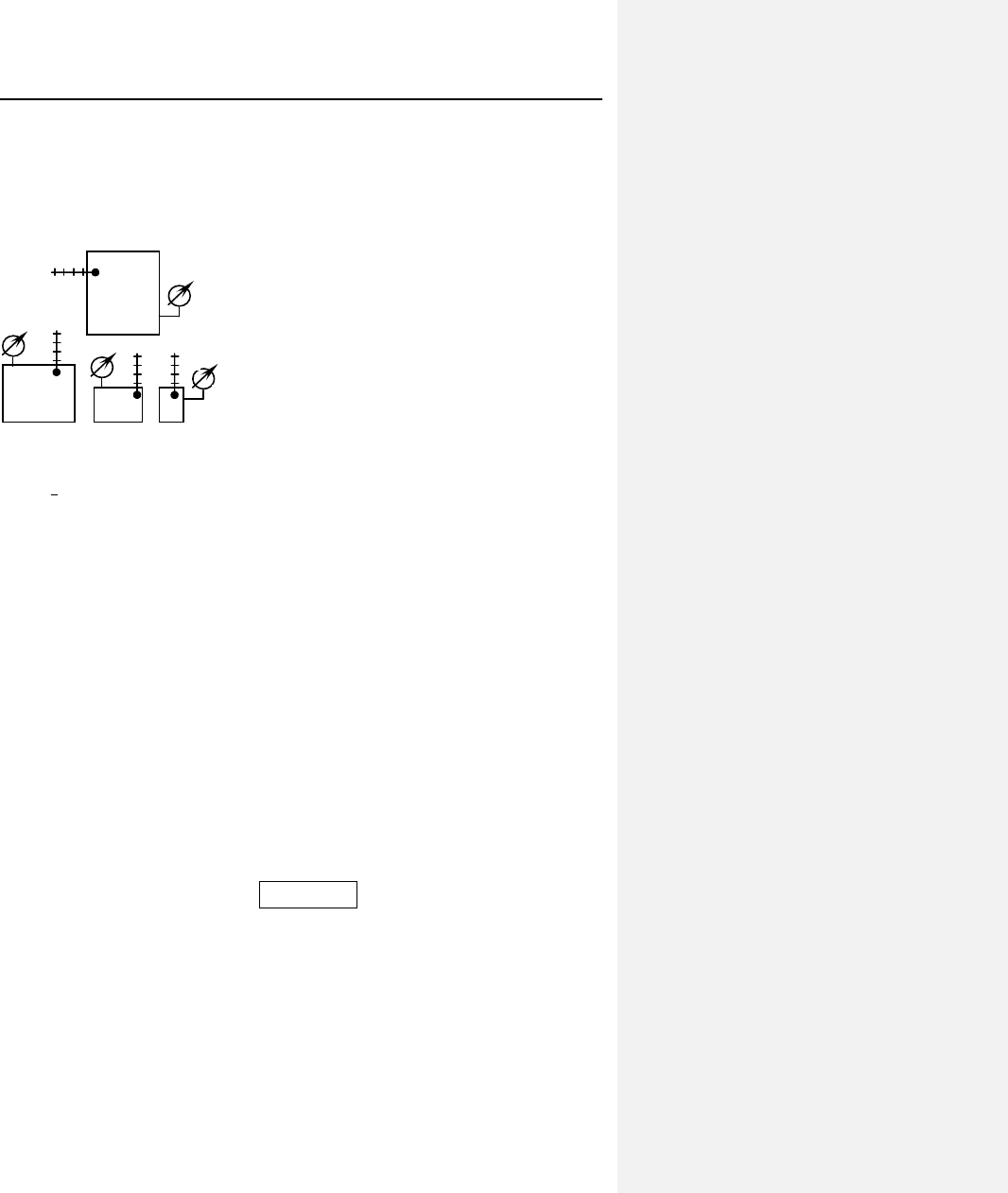
§ 31 еси . Параметры состояния см122
§ 31. Параметры состояния смеси
1. Давление. Проведем мысленный эксперимент. Есть
пустой сосуд, в котором будет составлена смесь, и три сосуда с
компонентами (рис. 6.1). В смеси-
тельном сосуде измеряется давление,
температура, известен объем. Помес-
тим в него сначала компонент 1 и
измерим давление р
1
. Затем вернем
первый газ обратно, наполним сосуд
вторым и при той же температуре за-
регистрируем давление р
2
. Повторим
процедуру с третьим газом, опреде-
лив р
3
. Это будут парциальные давления компонентов.
Парциальное давление компонента — это давление в со-
суде, предоставленном для смеси, когда он наполнен ОТ-
ДЕЛЬНЫМ компонентом в том же количестве и при той же
температуре, что и в смеси.
Теперь составим смесь. Поместив в сосуд первый компо-
нент, увидим уже известное давление р
1
. Добавим к нему вто-
рой. Манометр, видимо, покажет большее давление, поскольку
в том же объеме теперь больше газа. Затем добавим третий
компонент, вновь ожидая увеличения показаний манометра.
Такого рода эксперименты, сопровождаемые тщатель-
ными измерениями, провел в 1801 г. замечательный англий-
ский ученый Джон Дальтон. В результате он сформулировал
утверждение, называемое ныне законом Дальтона:
давление смеси идеальных газов складывается из их
парциальных давлений:
р
см
= Σ
р
i
.
(6.1)
Это значит, что каждый компонент в смеси имеет такое
же давление, какое имел бы в отсутствии всех остальных, т. е.
«не замечает» их присутствия.
Этот опытный факт получил простое объяснение гораз-
до позже, с позиций молекулярно-кинетической теории. Как
уже говорилось в главе 2, давление есть суммарный импульс,
переданный молекулами газа квадратному метру стенки за се-
р
Т
3
р
Т
2
р
Т
1
Р
1, 2, 3
Т
V
см
Рис. 6.1. Составление смеси
