Лабораторные работы по курсу общей физики (3-я Редакция 2012 г.)
Подождите немного. Документ загружается.

- 5 -
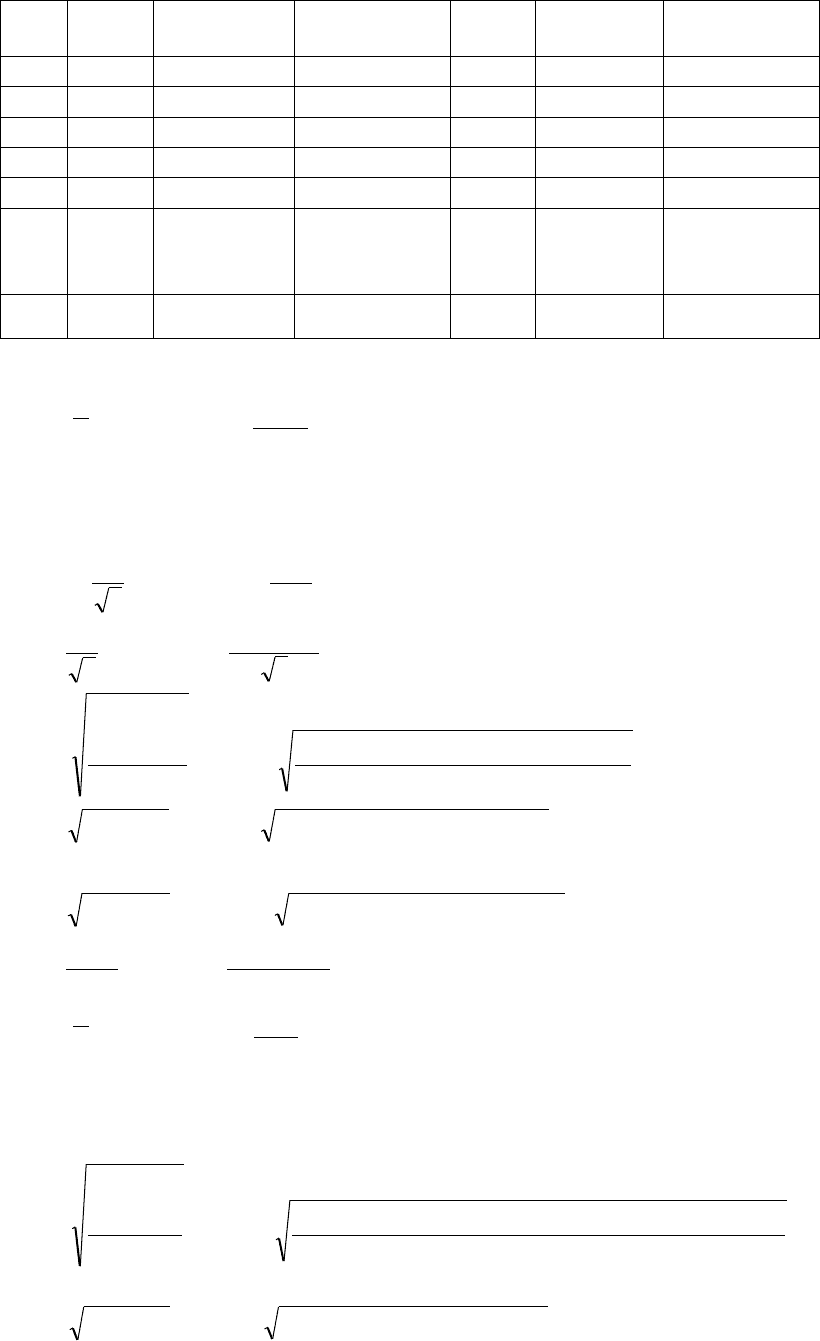
Оценка погрешности при прямых вычислениях величин h и d, произведенные
микрометром.
№
п/п
H
i
,
Мм
(h
i
- <h>),
мм
(h
i
- <h>)
2
,
мм
2
D
i
,
Мм
(d
i
- <d>),
мм
(d
i
- <d>)
2
,
мм
2
1
20,5
0,28
78,410
-3
18,5
-0,02
410
-4
2
20,14
-0,08
6,410
-3
18,45
-0,02
410
-4
3
20,16
-0,06
3,610
-3
18,57
0,03
910
-4
4
20,17
-0,05
2,510
-3
18,55
-0,02
410
-4
5
20,13
-0,09
8,110
-3
18,4?
0,03
910
-4
<h>,
мм
(h
i
- <h>),
мм
(h
i
- <h>)
2
,
мм
2
<d>,
мм
(d
i
-
<d>),
мм
(d
i
- <d>)
2
,
мм
2
20,22
810
-3
19,810
-3
9,52
0
610
-4
Найдём действительное значение измеряемой величины <h>.
<h>
n
i 1
i
h
n
1
; < h >
40,17
5
04,87
(мм)
h
i
= h
i
- <h>; h
1
= 9,50 – 9,52= -0,02 (мм) h
4
= 9,50 – 9,52 = -0,02 (мм)
h
2
= 9,50 – 9,52 = -0,02 (мм) h
5
= 9,55 – 9,52 = 0,03 (мм)
h
3
= 9,55 – 9,52 = 0,03 (мм)
с
= k
3
c
;
с
= 1,1
2
01,0
= 5,7
3
10
(мм)
3
c
с
;
3
3
103,3
3
107,5
с
(мм)
сл
1)-n(n
)h(
2
1
i
n
i
;
сл
20
)01,0()01,0()01,0()01,0(
2222
= 4,47
10
-3
(мм)
22
слсh
;
52323
103)1047,4()103,3(
h
(мм)
сл
= t
с
сл
;
сл
= 2,78
3
1047,4
=12,43
3
10
(мм)
h =
22
слс
; h =
22323
1037,1)1043,12()107,5(
(мм)
h
h
;
4
2
1087,7
40,17
1037,1
(мм)
<d>
n
i 1
i
d
n
1
; < d >
52,9
5
6,47
(мм)
d
i
= d
i
- <d>; d
1
= 9,50 – 9,52 = -0,02 (мм) d
4
= 9,50 – 9,52 = -0,02 (мм)
d
2
= 9,50 – 9,52 = -0,02 (мм) d
5
= 9,55 – 9,52 = 0,03 (мм)
d
3
= 9,55 – 9,52 = 0,03 (мм)
сл
1)-n(n
)d(
2
1
i
n
i
;
сл
20
)03,0()02,0()03,0()02,0()02,0(
22222
=
= 1,2210
-2
(мм)
22
слсd
;
22223
1026,1)1022,1()103,3(
d
(мм)
- 6 -
сл
= t
с
сл
;
сл
= 2,781,2210
-2
= 3,410
-2
(мм)
d =
22
слс
; d =
22223
1045,3)104,3()107,5(
(мм)
d
d
;
3
2
1062,3
52,9
1045,3
(мм)
Расчётаем погрешность при косвенных вычислениях величины V, на основе величин h
и d, измеренных микрометром.
<V>=f(<h>, <d>); <V>
4
d h
2
; <V>
92,1237
4
52,940,1714,3
2
(мм
3
)
2
h
22
d
2
V
)
h
V
()
d
V
(
; при
4
dh2
d
V
,
4
d
h
V
2
и
d
= 1,2610
-2
,
h
= 310
-5
;
28,3)103()
4
52,914,3
()1026,1()
4
52,940,1728,6
(
252
2
222
V
(мм
3
)
V
сV
t
;
V
43,696,128,3
(мм
3
)
V
V
V
;
3
V
102,5
92,1237
61,0
%
V=<V>
V
; V=1237,92
43,6
(мм
3
)
3
V
102,5
%
P = 0,95
Цель работы: Изучение движения тел по наклонной плоскости. В первой
части исследуется поступательное движение (скольжение) цилиндра. При
этом необходимо экспериментально определить зависимость ускорения от
угла наклона плоскости и найти коэффициент трения скольжения. Во
второй части изучается движение методом чистого качения и качения со
скольжением; по экспериментальной зависимости ускорения шарика от
угла наклона плоскости определяется угол, при котором качение
переходит в качение со скольжением.
Приборы и материалы: макет экспериментальной установки с набором тел.
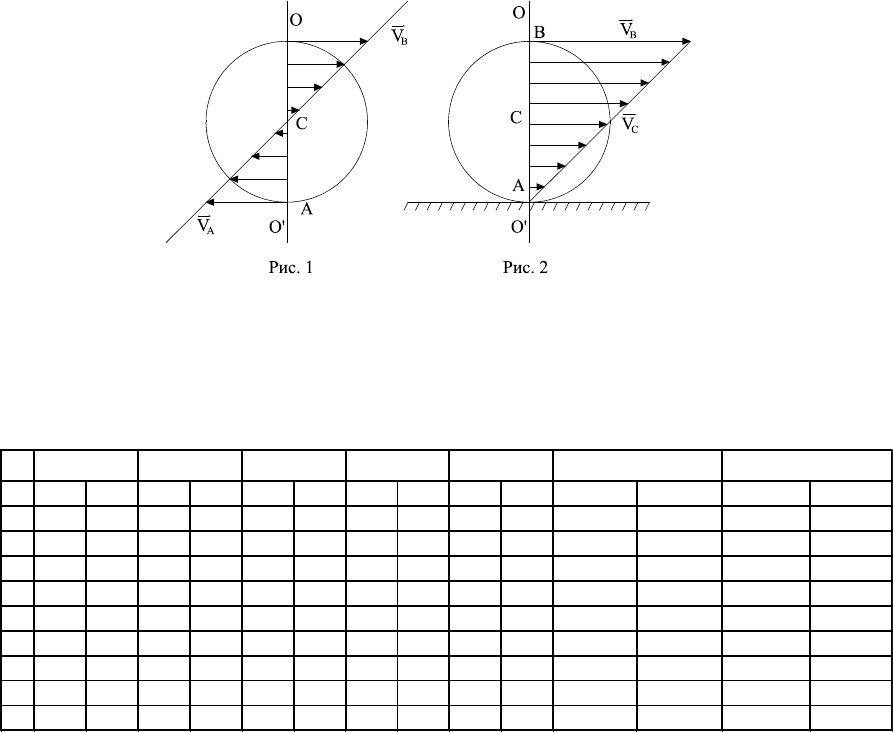
При вращении тела вокруг неподвижной оси мгновенная линейная
скорость любой точки этого тела равна V
i
=[,r], где - угловая
скорость, r – радиус вектор, проведенный из оси вращения в данную
точку. На рис.1 показано, как распределены линейные скорости точек
тела, лежащих на прямой (ОО'), и проходящих через ось вращения.
Вектор расположен перпендикулярно плоскости чертежа и проходит
через чертеж.
Сложное плоское движение, например движение катящегося тела,
следует рассматривать как сумму двух движений – вращательного вокруг
оси, проходящей через центр масс С, и поступательного движения со
скоростью V
С
центра масс. В этом случае, в соответствии с принципом
сложения скоростей, линейные скорости точек тела будут равны
векторной сумме скоростей, которые они имели при вращательном
движении V
i
, и одинаковой для всех точек тела скорости
поступательного движения V
С
.
V=V
i
+V
C
. (1)
На рис.2 показано распределение скоростей вдоль прямой (ОО') в
случае, когда скорость V
i
в точке A равна скорости V
C
движения центра
масс:
V
i
=-V
C
. (2)
Тогда, в соответствии с (1), результирующая скорость точки А
соприкосновения тела с плоскостью будет равна нулю. Следовательно,
V
С
=[,R].
Равенство нулю линейной скорости точки соприкосновения при качении
по плоскости означает отсутствие скольжения. В свою очередь, это
возможно лишь при определенных значениях силы трения.
Таблица экспериментальных данных:
Ц. Ш. Ц. Ш. Ц. Ш. Ц. Ш. Ц. Ш. Ц. Ш. Ц. Ш.
10 1.1 1 1 1 0.9 1.000 1.000
20 0.65 0.66 0.67 0.66 0.66 0.660 2.296
30 0.65 0.52 0.67 0.53 0.66 0.53 0.66 0.52 0.66 0.52 0.660 0.524 2.250 3.642
40 0.49 0.44 0.49 0.44 0.49 0.44 0.48 0.45 0.5 0.45 0.490 0.444 4.082 5.073
50 0.41 0.39 0.42 0.4 0.41 0.4 0.42 0.39 0.41 0.39 0.414 0.394 5.718 6.442
60 0.37 0.37 0.37 0.36 0.38 0.36 0.37 0.36 0.36 0.35 0.370 0.360 7.159 7.716
70 0.35 0.35 0.34 0.34 0.34 0.34 0.34 0.33 0.35 0.34 0.344 0.340 8.282 8.651
80 0.33 0.33 0.34 0.32 0.33 0.32 0.33 0.33 0.32 0.33 0.330 0.326 8.999 9.409
90 0.32 0.32 0.32 0.32 0.32 0.32 0.32 0.32 0.32 0.32 0.320 0.320 9.570 9.766
t
5
, c
t
сред.
, c
a, m/c
2
t
1
, c
t
2
, c
t
3
, c
t
4
, c
Цель работы: Изучение законов сохранения момента импульса, закона
сохранения энергии при неупругом соударении и определение скорости
полета пули.
Элементы теории:
Абсолютным твердым телом называется такое тело, которое в условиях
данной задачи не деформируется, т.е. расстояние между любыми его
точками не изменяется.
Рассмотрим движение некоторой материальной точки A, обладающей
импульсом p, положение которой относительно некоторой точки O
выбранной системы отсчета задается радиус-вектором r. Тогда вектор L,
равный векторному произведению векторов p и r , называется моментом
импульса частицы A относительно точки O:
L=[r,p]. (1)
Модуль вектора L равен:
L=rpsin=lp,
Где - угол между векторами r и p;
L=rsin - плечо вектора p относительно точки O.
По свойству векторного произведения вектор L перпендикулярен
плоскости векторов r и p. Направление вектора L определяется по
правилу правого винта.
Теперь продифференцируем уравнение (1) по времени:
dL
dt
M
где l - плечо силы F относительно точки O.
Таким образом уравнение (5) принимает вид:
7
M r F sin
l F
Модуль этой силы
6
M r F( )
Величина стоящая в правой части этого уравнения, называется моментом силы
F относительно точки O:
5
dL
dt
r F( )
Следовательно, формула (2) с учетом (3) и (4) будет имель вид:
где F - равнодействующая всех внешних сил, приложенных к
мвтериальной точке
4
dp
dt
F
По второму закону Ньютона
3
dr
dt
p
p
Поскольку точка O неподвижна, то вектор равен скорости
материальной точки ,т.е.,
2
dL
dt
dr
dt
p
r
dp
dt

№ r, м
, град t, с
1 115 40 39.6
2 114 38 40.2
3 112 35 41.7
4 111 37 41.4
5 110 36 41.1
6 116 40 39.9
7 112 34 41.8
8 114 36 40.1
9 113 39 40.6
10 111 38 41.4
<r>=112.8
<>=37.3 <t>=40.7
r 0.1128 m
37.3
180
t 40.7 s
I 0.00 094 kg m
2
m 0.002 kg
n 10
T
t
n
2 I
m r T
Скорость пули равна:
4.188
m
s

- 1 -
Министерство образования РФ
Рязанская государственная радиотехническая академия
Кафедра ОиЭФ
Лабораторная работа № 1-9
«ОПРЕДЕЛЕНИЕ ЭФФЕКТИВНОГО ДИАМЕТРА МОЛЕКУЛ ГАЗА»
Выполнил ст. гр. 255
Ампилогов Н. В.
Проверил
Малютин А. Е.
Рязань 2002
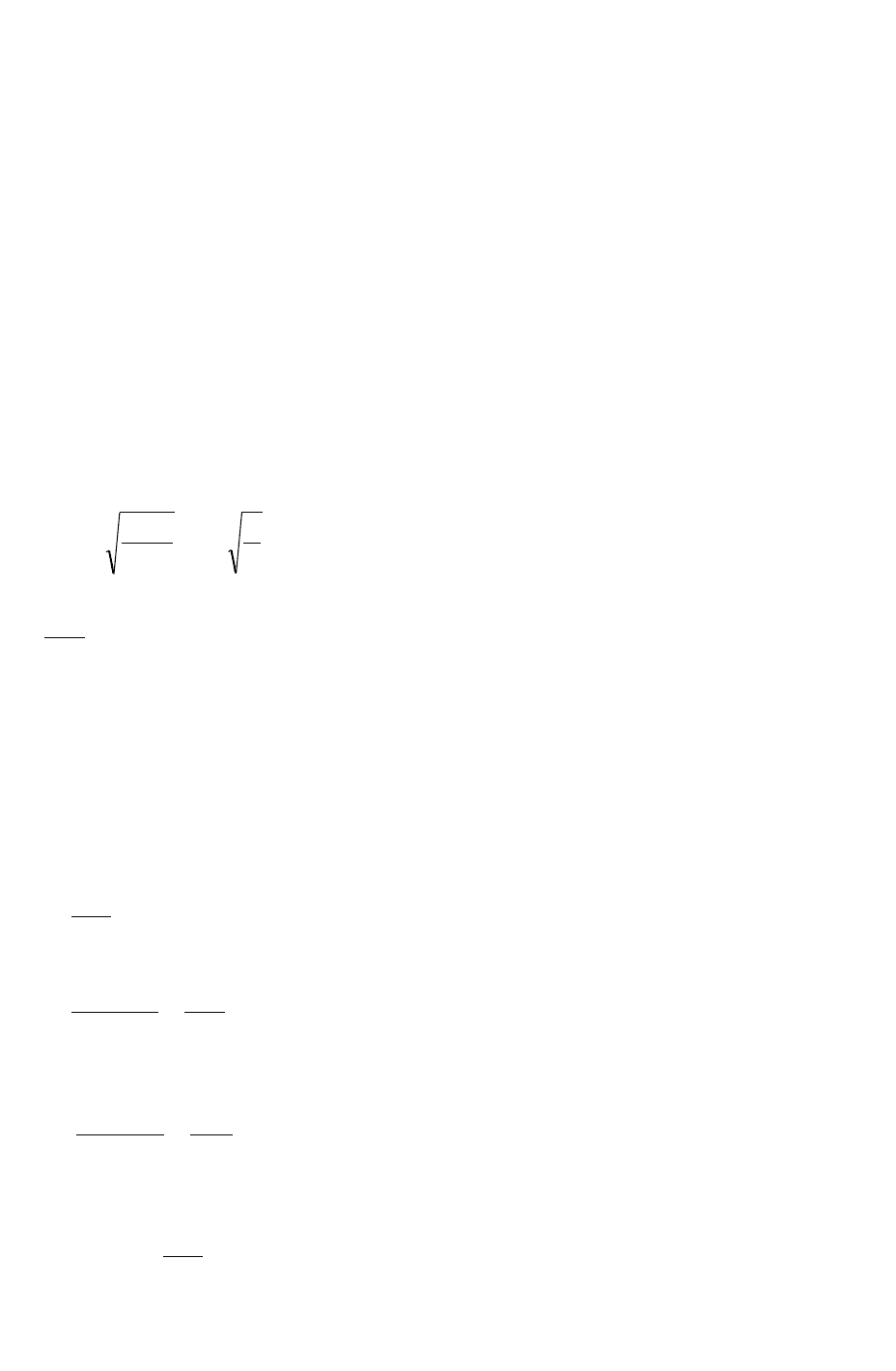
- 2 -
Цель работы: изучение законов колебания маятника; ознакомление с косвенными
методами измерения ускорения свободного падения при помощи математического и
оборотного маятников.
Приборы и принадлежности: маятник универсальный ФПМ-04 (далее - маятник).
Элементы теории
Наиболее точные измерения ускорения свободного падения g выполняются с помощью
косвенных методов. Многие из них основаны на использовании формулы для периода
колебаний физического маятника. Массу маятника и период его колебаний можно
измерить с очень высокой точностью, но точно измерить момент инерции не удается.
Указанного недостатка лишен метод оборотного маятника, который позволяет
исключить момент инерции из расчетной формулы для g.
Рассмотрим тело массы m, способное колебаться относительно точки О и отклоненное от
положения равновесия на угол а (рис. 1). Это тело представляет собой физический
маятник с моментом инерции I (относительно оси О, перпендикулярной плоскости
рисунка).
Приведенная длина физического маятника l - это длина такого математического
маятника, период колебаний которого равен периоду колебаний данного физического
маятника:
(1)
g
l
mgS
I
T
22
1
;
Отсюда
1
mS
I
l
, где I - момент инерции маятника относительно оси качаний, т - его масса, S
1
-
расстояние от центра масс до точки подвеса.
Измерить приведенную длину можно перераспределением масс маятника или
изменением положения точки его подвеса.
Точка К, лежащая на перпендикуляре к оси качаний, проходящем через центр тяжести
физического маятника на расстоянии l от этой оси, называется центром качаний
(математический маятник длины l, подвешенный к оси качаний физического маятника,
будет колебаться синхронно с центром качаний).
Приведенная длина маятника
2)
1
1
mS
I
l
.
По теореме Штейнера
3)
1
1
0
1
2
10
1
S
mS
I
mS
mSI
l
.
Если заставить маятник колебаться около горизонтальной оси, проходящей через К, его
приведенная длина
4)
2
2
0
2
2
20
2
S
mS
I
mS
mSI
l
, где S
2
=KC - расстояние от новой оси вращения до центра
масс маятника; I
0
-момент инерции относительно оси, перпендикулярной плоскости
рисунка и проходящей через центр масс маятника. Из рис. 1 следует, что
5)
1
0
112
mS
I
SlS
.
Подставим это выражение в формулу (4) и найдем приведенную длину l
2
:

- 3 -
6)
1
1
0
1
1
0
0
10
2
l
mS
I
S
mS
I
mI
mSI
l
.
Таким образом, центр качаний обладает следующим свойством: если ось пройдет через
центр качаний, то новый центр качаний будет расположен на месте старой оси.
Из равенства приведенных длин следует равенство периодов колебаний.
Оборотным маятником называется физический маятник, центр качаний которого
расположен в пределах колеблющегося тела. Такой маятник можно подвешивать в
любой из двух точек О и К (рис. 2) без изменения периода колебаний: T
1
=T
2
=T.
Взаимозаменяемые точки О и К расположены по обе стороны от центра масс С на
расстояниях S
1
и S (рис. 2). Моменты инерции относительно осей, проходящих через эти
точки, различны:
7) I
l
=I
0
+mS
1
и I
2
=I
0
+mS
2
.
Периоды колебаний оборотного маятника могут быть выражены:
8)
1
2
10
1
2
mgS
mSI
T
и
2
2
1
2
20
2
mgS
mSI
T
.
Учитывая равенство периодов, и решая эту систему уравнений, легко получить
выражение для ускорения свободного падения:
9)
2
2
2
21
2
4
)(4
T
l
T
SS
g
, где l = S
1
+ S
2
- приведенная длина маятника.
В данной лабораторной работе используется маятник универсальный ФПМ-04, общий
вид которого изображен на рис. 3.
Расчетная часть

- 1 -
Министерство образования РФ
Рязанская государственная радиотехническая академия
Кафедра ОиЭФ
Лабораторная работа № 1-10
«ИЗМЕРЕНИЕ ОТНОШЕНИЯ УДЕЛЬНЫХ ТЕПЛОЁМКОСТЕЙ»
Выполнил ст. гр. 255
Ампилогов Н. В.
Проверил
Малютин А. Е.
Рязань 2002

- 2 -
Цель работы: изучение теоретических основ и экспериментального метода измерения
отношения удельных теплоёмкостей воздуха.
Приборы и принадлежности: звуковой генератор, электронный осциллограф, микрофон,
телефон, частотомер, труба с воздухом.
Элементы теории
Термодинамикой называется раздел физики, в котором изучаются физические процессы с
точки зрения происходящих в них превращений энергии с учетом двух форм ее передачи:
работы и теплообмена. Термодинамика не рассматривает самого механизма явлений и
ограничивается лишь энергетическими соображениями, основанными на двух законах,
получивших название «начал».
Первый закон (первое начало) термодинамики – изменение внутренней энергии U
1-2
замкнутой системы, которое происходит в процессе 12 перехода системы из состояния 1 в
состояние 2, равно сумме работы А’
1-2
, совершаемой над системой внешними силами, и
количества теплоты Q
1-2
сообщаемого системе:
1) U
1-2
= А’
1-2
+ Q
1-2,
А’
1-2
= - А
1-2
, А
1-2
- работа, совершаемая системой над внешними телами в
процессе 12, поэтому:
2) Q
1-2
= U
1-2
+
А
1-2
.
Количество теплоты, сообщаемое системе, расходуется на изменение внутренней энергии
системы и на совершение системой работы против внешних сил.
Для элементарного количества теплоты Q, элементарной работы А и бесконечно малого
изменения dU внутренней энергии первый закон термодинамики имеет вид:
2) Q = dU + А.
Если Q > 0 , то к системе подводится теплота. Если Q < 0 , то от системы отводится теплота.
В конечном процессе 12 элементарные количества теплоты могут быть обоих знаков, и
общее количество теплоты Q
1-2
процессе 12 равно алгебраической сумме количества
теплоты на всех участках этого процесса:
4)
2
1
21
QQ
.
Если система производит работу над внешними телами, то считается, что А > 0, а если над
системой совершается работа внешними силами, то А < 0 . Работа А
1-2
, совершаемая
системой в конечном процессе 12, равна алгебраической сумме работ А, совершаемых
системой на всех участках этого процесса:
5)
2
1
21
AA
.
Адиабатический процесс происходит при условии Q = 0. Существенно, что для определения
этого процесса условие Q = 0 не годится, ибо оно не означает требования отсутствия
теплообмена с внешней средой, а лишь равенство нулю алгебраической суммы количества
теплоты, подводимой и отводимой от газа на различных участках процесса. При
адиабатическом процессе работа совершается идеальным газом за счет убыли его внутренней
энергии:
6)
dTC
M
dUA
, где С
- молярная теплоемкость газа при постоянном объеме;
M
- число молей газа, содержащихся в массе М газа; dT - элементарное изменение температуры
газа.
Если газ адиабатически расширяется, то А = pdV > 0 и происходит его охлаждение ( dT < 0 ).
При адиабатическом сжатии газа он нагревается:
А = pdV < 0 и dT >0.
