Кац Н.Г., Стариков В.П., Парфенова С.Н. Химическое сопротивление материалов и защита оборудования нефтегазопереработки от коррозии
Подождите немного. Документ загружается.

79
iii
а
. (2.6)
Если U
2
больше U
1
, то
i
больше
i
, т.е. преобладает катодный
процесс – разряд ионов металла из раствора, суммарная скорость ко-
торого
iii
k
. (2.7)
Когда энергетический уровень ионов на поверхности металла и в
растворе становится одинаковым, т.е. U
1
= U
2
, устанавливается дина-
мическое равновесие, при котором скорости анодного и катодного
процессов равны. В этом случае изменения массы металла не проис-
ходит, т.е. коррозии нет.
Таким образом, металл является донором электронов, и на его
поверхности протекает анодная реакция [1]:
n
Me
ne
Me
. (2.8)
Катодная реакция, называемая катодной деполяризующей реак-
цией, протекает с участием компонентов электропроводящей среды, в
качестве которой чаще всего выступают водные растворы кислот,
щелочей или солей.
Акцепторами электронов могут быть либо ионы водорода или
молекулы воды (водородная деполяризация)
OHHeOH
223
2/1
в кислых растворах,
OHHeOH 222
22
в щелочных растворах,
либо кислород О
2
(кислородная деполяризация):
OHeOHO 44
22
в нейтральных и щелочных растворах,
OHeHO
22
244
в кислых растворах.
80
Уравнение Нернста для водородной деполяризации с учетом то-
го, что стандартный потенциал водородного электрода принят рав-
ным нулю, а десятичный логарифм активности водородных ионов ра-
вен величине
pH
, взятой с обратным знаком, имеет вид [24]:
pHE
HH
059,0
)/(
2
,
т.е. при изменении
pH
на единицу потенциал водородного электрода
уменьшается на 0,059 В.
Потенциал кислородного электрода положительнее водородного
на 1,23 В, тогда
pHE
OHO
059,023,1
)/(
2
.
В кислой среде при
0
pH
0
)/(
2
HH
E , а 23,1
)/(
2
OHO
E В. В
нейтральной при
7
pH
415,0
)/(
2
HH
E В, а 815,0
)/(
2
OHO
E В.
2.2 Закономерности кинетики электродных реакций
Если электрод находится при равновесном потенциале Е
р
, то ток
равен нулю. Если потенциал электрода смещается относительно рав-
новесного значения, например, становится равным Е
р
+
Е, то начина-
ется направленный переход электронов или ионов через границу фаз,
и ток в цепи становится отличным от нуля. Возможен и другой вари-
ант, например, если пропускать через электрод ток, то потенциал
электрода отклонится от равновесного значения на величину сдвига
потенциала
Е (
Е=Е–Е
р
). Это смещение при прохождении тока че-
рез электрод называется поляризацией электрода [1, 24].
Изучение кинетики электродного процесса состоит в установле-
нии связи между поляризацией электрода
Е и плотностью тока
i
.

81
Графическую зависимость плотности тока от потенциала назы-
вают поляризационной кривой, которую широко используют при
изучении коррозионных процессов.
Важным признаком электрохимических реакций является связь
скорости коррозионного процесса с плотностью тока i, что следует из
закона Фарадея. Сущность этого закона состоит в том, что, например,
для реакции растворения металла величина потери массы металла в
течение определенного времени позволяет рассчитать скорость его
растворения, а из нее – плотность анодного тока [1]:
м
a
SA
meF
i
, (2.9)
где
м
A – атомная масса металла;
m – убыль массы металла за время ;
S – площадь электрода;
e – число электронов;
F – число Фарадея.
В форме, наиболее удобной для практического использования, в
уравнении для скорости электрохимической реакции принято выра-
жать эту скорость через плотность тока i.
Между токовым показателем коррозии и отрицательным показа-
телем изменения массы
m
K существует зависимость [24]:
F
n
Ki
m
3
1068,2 , А/см
2
.
Объемные показатели скорости коррозии также могут быть пере-
считаны в токовый показатель и отрицательный показатель измене-
ния массы [24]:
2
3
103896,2
VH
Ki
, А/см
2
;
2
3
107870,4
VO
Ki
, А/см
2
;

82
n
A
KK
VHm
2
8917,0
, г/м
2
∙ч;
n
A
KK
VOm
2
7862,1
, г/м
2
∙ч.
Если одновременно протекают кислородная и водородная депо-
ляризации, то [1, 4, 24]:
22
7862,18907,0
VOVHm
KK
n
A
K
, г/м
2
∙ч;
3
107870,43896,2
22
VOVH
KKi , А/см
2
.
Переход к глубинному показателю коррозии
П
K в случае равно-
мерного процесса коррозии может быть выполнен по формуле [1, 24]:
Me
П
n
iA
K
7,3268 , мм/год;
Me
VH
П
n
AK
K
2
8113,7 , мм/год;
Me
VO
П
n
AK
K
2
6471,15 , мм/год.
Любой электродный процесс состоит из ряда стадий, к ним отно-
сятся [1]:
– подвод реагирующих веществ к поверхности электрода из объ-
ема раствора;
– перенос заряженных частиц (электронов или ионов) через гра-
ницу раздела фаз;
– отвод продуктов реакции в объем раствора.
83
Скорость электродного процесса определяется скоростью самой
медленной стадии, которая называется лимитирующей.
Если скорость электрохимической реакции определяется стадия-
ми массопереноса, то возникает концентрационная поляризация. Ки-
нетика процесса в этом случае лимитируется диффузией.
Если самой медленной стадией электрохимического процесса яв-
ляется переход заряженных частиц через границу раздела фаз, то
имеет место замедленная стадия разряда – ионизация.
Теория, описывающая кинетические закономерности переноса
заряда через границу раздела фаз, называется теорией замедленного
разряда. Впервые в качественной форме она была сформулирована
М. Фольмером и А.Н. Фрумкиным [1, 4].
Основная причина влияния скачка потенциала на скорость элек-
трохимических реакций заключается в том, что скорость таких реак-
ций лимитируется стадией переноса заряда, энергия активации кото-
рого является функцией потенциала на границе «металл-раствор». В
подобных случаях количественная связь между скоростью электро-
химического процесса и электродным потенциалом описывается
уравнением, носящим название уравнение Фольмера-Фрумкина.
Скорость электрохимической реакции зависит от потенциала, из-
меняясь по экспоненциальному закону. Это – особенность любого
электрохимического процесса, в том числе и процесса растворения
металла.
Рассмотрим основные процессы, которые могут возникать при
контакте двух металлов, имеющих разные электродные потенциалы.
Предположим, что такими металлами являются железо и никель,
опущенные в раствор серной кислоты. Так как потенциал железа от-
рицательнее потенциала никеля, железо становится анодом образо-
вавшейся гальванической пары и будет посылать ионы в раствор, а
освободившиеся при этом электроны будут перетекать по соприка-
сающимся металлам к поверхности никеля, где соединятся с имею-
щимися в растворе ионами водорода. В дальнейшем образовавшиеся
атомы водорода будут соединяться в молекулы и образовывать пу-

84
зырьки газообразного водорода, отрывающиеся от поверхности ме-
талла и удаляющиеся из раствора. Такой процесс может продолжать-
ся до полного растворения железа (рис. 2.5) [1].
Рис. 2.5. Растворение железа в серной кислоте
при контакте его с никелем
Причинами возникновения коррозионных гальванических эле-
ментов могут быть:
а) включения или участки сплава, обогащенные компонентом с
более положительным электродным потенциалом;
б) границы блоков и зерен, которые могут быть как катодами, так
и анодами;
в) поры в структуре металла;
г) участки металла под продуктами коррозии;
д) более деформированные или напряженные участки металла,
являющиеся анодами;
е) участки металла, соприкасающиеся с более концентрирован-
ными растворами солей активным анодом, а с растворами пассиви-
рующих солей – катодом;

85
ж) раствором с большей концентрацией кислорода или другого
окислителя, являющимся катодом;
з) более нагретые или облучаемые участки металла;
и) участки металла, являющиеся анодами, где положительные за-
ряды (катионы) выходят в электролит.
Процессы, протекающие на поверхности корродирующего в
электролите металла, можно представить следующим образом.
На анодных участках, потенциал которых более электроотрица-
телен, происходит растворение металла [1, 5, 24]:
ne
n
neMe +
OmH
2
OmHMe
n
2
. (2.10)
в ме-
талле
анода
ион-атом
на поверх-
ности
анода
гидратированный
ион в растворе
Освободившиеся электроны перетекают от анода к катоду:
KA
nene
.
На поверхности катода электроны ассимилируются каким-либо
восстановителем. Если этого не происходит, то потенциал катода из-
меняется, смещаясь в отрицательном направлении и приближаясь к
потенциалу анода. Этот процесс получил название поляризации. Ас-
симиляция электронов на катоде может уменьшать поляризацию, то-
гда такой процесс называется деполяризацией, а восстановители, свя-
зывающие электроны на катоде, являются деполяризаторами.
2.3. Общая характеристика электрохимического
коррозионного процесса и явление поляризации
В простейшем случае коррозии металлов с образованием их рас-
творимых продуктов (т.е. ионов
n
Ме
) коррозионные процессы при-
нято называть процессами растворения металлов. Образование ионов
металла из его атомов, например, в кислом растворе электролита,
можно представить совокупностью реакций [1]
86
ne
Me
Me
n
; (2.11)
OHHeOH
223
)2/1(
, (2.12)
в которых электроны, освободившиеся в реакции (2.11), присоединя-
ются к ионам водорода. В результате на металле одновременно про-
текают две реакции: анодная (2.11) и катодная (2.12).
Перенос электронов осуществляется на поверхности металла, а пе-
ремещение ионов – в электролите. Явления, которые описываются за-
висимостями (2.11) и (2.12), графически изображены на рис. 2.6 [14].
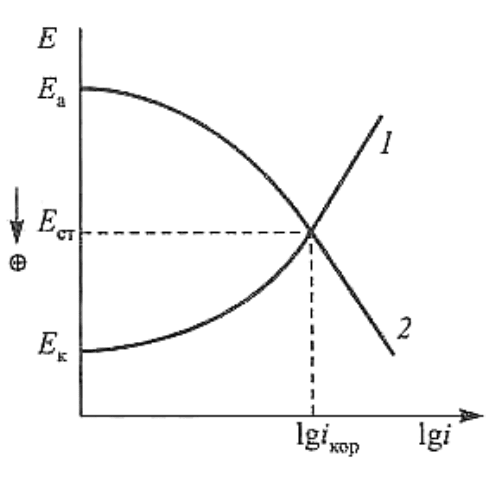
Рис. 2.6. Зависимость скоростей реакций разряда деполяризатора (1)
и ионизации металла (2)
При протекании электрохимического процесса анодный и катод-
ный потенциалы Е
а
и Е
к
выравниваются и принимают значение по-
тенциала Е
ст
. Этот потенциал называют стационарным, или смешан-
ным (компромиссным) потенциалом.
При Е
ст
соблюдается равенство катодного и анодного токов, т.е.
коркa
iii
, (2.13)
где
кор
i – скорость коррозии или саморастворения металла.

87
Если бы при этом электродные процессы не протекали, то потен-
циалы электродов сравнялись бы, и наступила полная поляризация.
В действительности анодный и катодный процессы продолжают-
ся. Присутствие в растворе деполяризаторов обеспечивает протека-
ние реакций, в результате которых образуется
2
H или
OH
. Таким
образом, если из двух реакций противоположного направления, одно-
временно протекающих на металле в отсутствие внешнего тока, одна
является реакцией растворения, а другая – реакцией восстановления
какого-либо окислительного компонента раствора, например, ионов
водорода, то это и есть коррозионный процесс [1, 5].
В большинстве случаев электрохимической коррозии металлов
основным тормозящим явлением, устанавливающим скорость про-
цесса, является поляризация.
Если элементы обратимого гальванического элемента с потен-
циалами в разомкнутом состоянии
обрa
E )( и
обрk
E )( и сопротивлением
электролита между ними в цепи R замкнуть и измерить установив-
шееся значение силы генерируемого тока I', то оказывается, что эта
сила тока значительно меньше рассчитанной по закону Ома, т.е:
R
EE
I
обраобрk
)()(
'
. (2.14)
Так как R величина постоянная, то неравенство определяется чис-
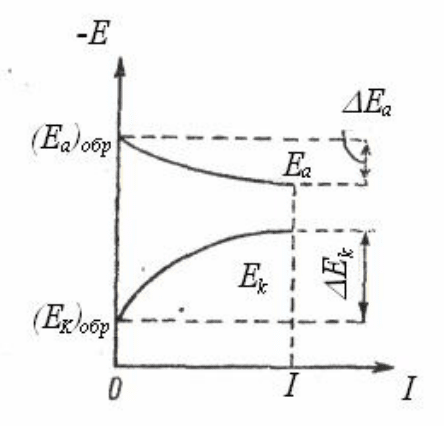
лителем дроби. Измерения показывают (рис. 2.7) [1], что потенциалы
электродов, через которые проходит при их работе (замыкании) элек-
трический ток, отличаются от потенциалов электродов, не нагружен-
ных током, т.е. потенциал анода при прохождении через него тока ста-
новится положительнее, а потенциал катода отрицательнее:
E
a
= (E
a
)
обр
+
E
a
;
(2.15)
E
к
= (E
к
)
обр
+
E
к
,
88
где
a
E и
k
E – устанавливающиеся при данном значении тока элек-
тродные потенциалы, называемые эффективными;
a
E
и
k
E
– смещение потенциала анода и катода.
Это изменение (сближение) потенциалов, а следовательно, и
уменьшение их разности, приводящее к уменьшению силы тока, на-
зывают поляризацией.
Рис. 2.7. Изменения потенциалов анода и катода гальванического
элемента с увеличением силы протекающего между ними тока
Поляризация является следствием отставания электродных про-
цессов от перетока электронов в гальваническом элементе. Анодный
процесс выхода ионов металла в электролит (2.16) отстает от перето-
ка электронов от анода к катоду, что приводит к уменьшению отри-
цательного заряда на поверхности электрода и делает потенциал ано-
да положительнее [1, 24]:
OmHMeMe
nn
2
. (2.16)
Катодный процесс ассимиляции электронов
DneneD
( от-
стает от поступления на катод электронов, что приводит к увеличе-
нию отрицательного заряда на поверхности электрода и делает по-
тенциал катода отрицательнее. Эти явления дополнительно тормозят
протекание коррозионного процесса.
