Кац Н.Г., Стариков В.П., Парфенова С.Н. Химическое сопротивление материалов и защита оборудования нефтегазопереработки от коррозии
Подождите немного. Документ загружается.

99
тролирующего фактора наибольшее распространение получил графи-
ческий метод.
Коррозионные диаграммы позволяют выявить тормозящий (кон-
тролирующий) фактор процесса коррозии. Это очень важно при вы-
боре метода защиты от коррозии, поскольку, как правило, наиболее
эффективным является воздействие на лимитирующую стадию про-
цесса [1].
О значительной поляризации процесса свидетельствует большая
величина наклона соответствующей поляризационной кривой. Поло-
гая кривая указывает на малую затрудненность реакции.
Н.Д. Томашов определил, что в практических условиях встреча-
ются шесть основных случаев контроля процесса коррозии, которые
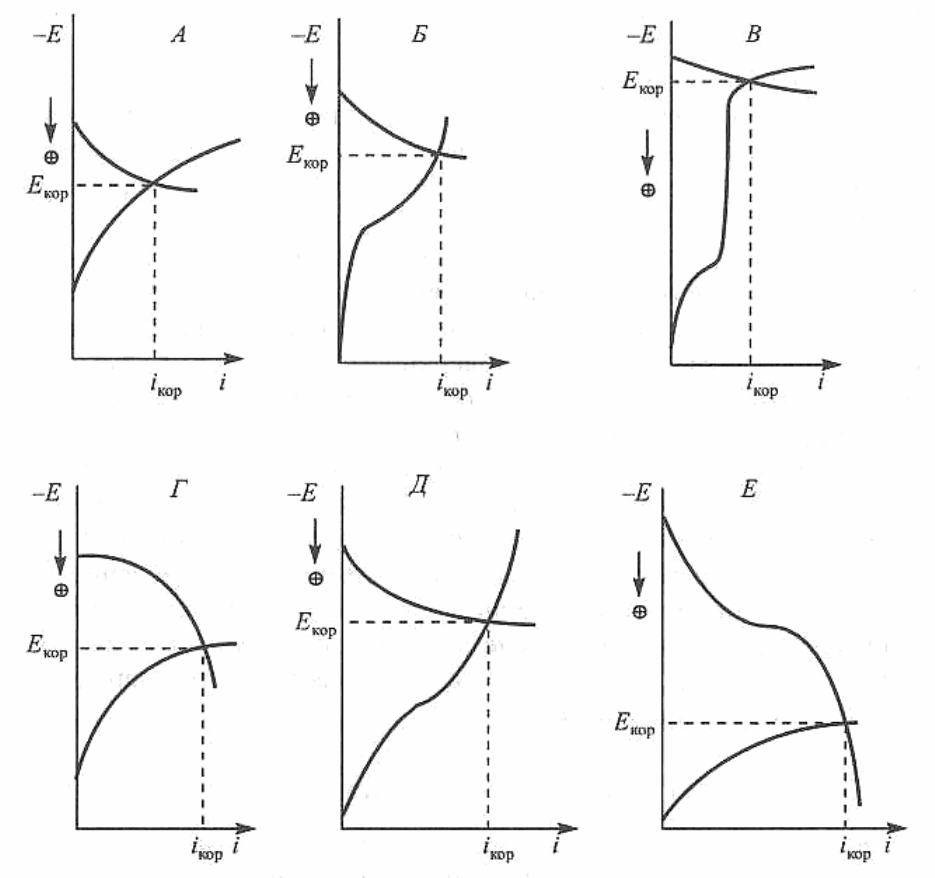
представлены на рис. 2.12 [1].
1. Катодный контроль при основной роли перенапряжения иони-
зации кислорода (рис. 2.12, А). В этом случае
0
R
,
ak
EE
. Та-
кой вид контроля может наблюдаться при коррозии металлов в силь-
но перемешиваемых нейтральных электролитах при подводе кисло-
рода к поверхности корродирующего металла.
2. Катодный контроль при основной роли диффузии кислорода
(рис. 2.12, Б). В этом случае
0
R
,
ak
EE
. Наблюдается при
коррозии железа, цинка и других металлов, в неперемешиваемых
нейтральных электролитах.
3. Катодный контроль при основной роли перенапряжения водо-
рода (рис. 2.12, В). В этом случае
0
R
,
ak
EE
и
22
OH
II
. На-
блюдается при коррозии железа, цинка и других металлов в растворах
кислот с низким содержанием
pH
, а также при коррозии магния и
его сплавов в нейтральных растворах.
100
Рис. 2.12. Виды контроля коррозионного процесса
4. Смешанный анодно-катодный контроль (рис. 2.12, Г). В этом
случае
0
R
,
ka
EE
. Наблюдается при коррозии железа, нержа-
веющих сталей, алюминия и других металлов в пассивном состоянии.
5. Смешанный анодно-омический контроль (рис. 2.12, Д). В этом
случае
0
R
,
aRk
EEE
. Наблюдается при коррозии макропар
на больших расстояниях друг от друга в электролитах с низкой элек-
тропроводностью (см. рис. 2.10).
6. Смешанный (рис. 2.12, Е) катодно-анодно-омический кон-
троль. В этом случае
aRk
EEE
. Наблюдается при легком дос-
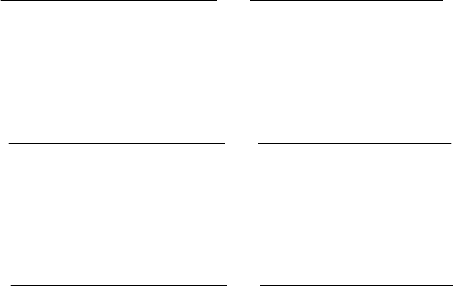
101
тупе кислорода к поверхности корродирующего металла, склонного к
пассивации при большом омическом сопротивлении электролита.
Таким образом, коррозионная диаграмма показывает, что вели-
чина тока коррозии зависит не только от значений равновесных по-
тенциалов катода и анода, но и от омического сопротивления в цепи.
Вклад катодной, анодной и омической составляющих в коррозион-
ный процесс может быть неодинаковым.
Степень контроля процесса можно оценить из уравнения этих ве-
личин, отнесенных к разности потенциалов коррозионного элемента
[1, 4]:
обрaобрk
a
Rka
a
a
EE
E
EEE
E
C
)()(
; (2.28)
обрaобрk
k
Rka
k
k
EE
E
EEE
E
C
)()(
; (2.29)
обрaобрk
R
Rka
R
R
EE
E
EEE
E
C
)()(
, (2.30)
где
обрaобрk
EE )()(
– начальная разность потенциалов электродных
процессов (движущая сила процесса коррозии).
Если ни одно из решений не имеет явного преимущества, то кон-
троль определяется как смешанный.
2.7. Пассивность металлов
Пассивность – это состояние высокой коррозионной стойкости
металлов и сплавов, находящихся в агрессивной среде в определен-
ной области потенциалов.
Скорость процесса растворения металла в области пассивации
может сохраняться достаточно долго. Типичным примером пассивно-
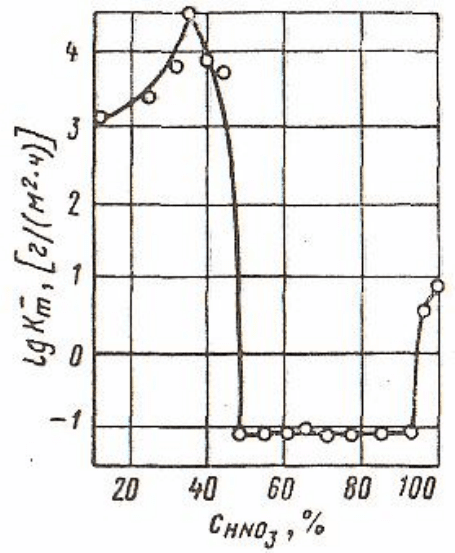
102
сти металлов является резкое уменьшение скорости растворения же-
леза в растворе азотной кислоты, наступающее при высокой ее кон-
центрации (рис. 2.13) [1, 24].
Рис. 2.13. Зависимость логарифма скорости коррозии железа
от концентрации
3
HNO при 20 °С
Наступление пассивного состояния металлов характеризуется
следующими явлениями:
а) резким уменьшением скорости коррозии металла, которая в
пассивном состоянии постоянна во времени;
б) значительным смещением потенциала металла в положитель-
ную сторону (т.е. затормаживается протекание анодного процесса
электрохимической коррозии).
В качестве количественных характеристик степени пассивности
можно использовать [1, 4, 24]:
1) степень анодного контроля коррозионного процесса (2.28), вы-
сокие значения которого соответствуют пассивности металла;
103
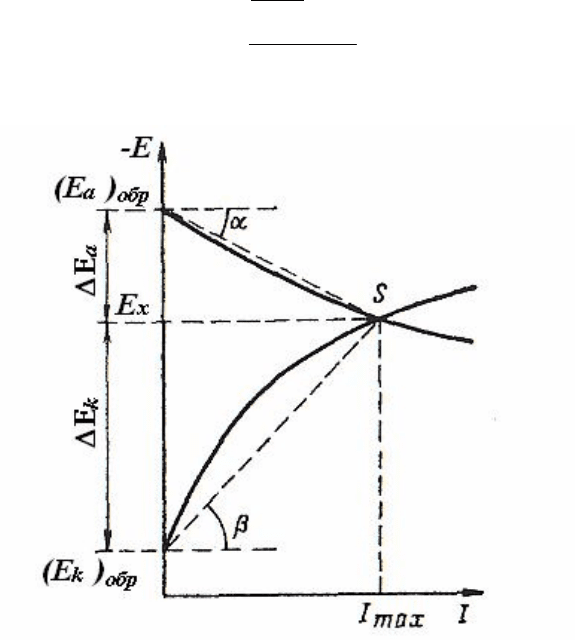
2) коэффициент пассивности
, представляющий собой отноше-
ние анодной поляризации к катодной (рис. 2.14):
tg
tg
E
E
k
a
. (2.31)
Рис. 2.14. Поляризационная диаграмма коррозии для определения
средней анодной и катодной поляризуемости
Пассивность наблюдается в определенных условиях у титана,
алюминия, хрома, молибдена, магния, никеля, кобальта, железа и
других металлов.
По степени уменьшения способности пассивироваться в ней-
тральных средах металлы могут быть расположены в следующий ряд:
Ti Al Cr Mo Ni Co Fe Mn Zn Cd Sn Pb Cu
Этот ряд характеризует не общую коррозионную устойчивость, а
только степень повышения коррозионной стойкости, определяемой
возникновением пассивного состояния [60].
104
С точки зрения термодинамики смещение потенциала электрода
в положительную сторону должно приводить к увеличению термоди-
намической вероятности протекания электрохимической реакции
растворения металла. В действительности этого не происходит.
Явление пассивации наглядно показывает, как на практике быва-
ет трудно реализовать термодинамическую возможность.
Пассивация была открыта более 150 лет назад. Ее открытие свя-
зывают с именем английского физика М. Фарадея, хотя первое описа-
ние этого явления встречается в трудах М.В. Ломоносова (1738 г.) [1].
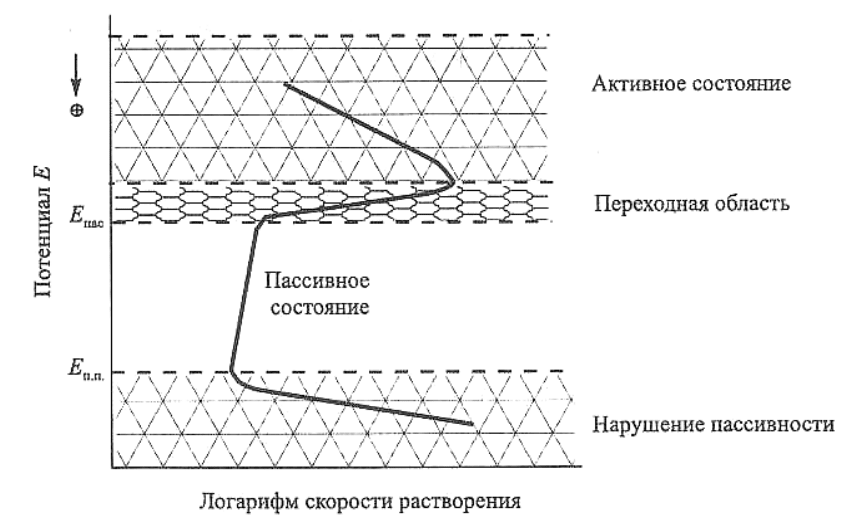
В условиях активного растворения скорость процесса при сдвиге
потенциала Е в положительном направлении закономерно возрастает.
При достижении некоторого определенного потенциала скорость рас-
творения резко снижается, потенциал, при котором это происходит,
называют потенциалом пассивации Е
пас
(рис. 2.15) [24]. В этой облас-
ти вопреки уравнению электрохимической кинетики скорость рас-
творения металла снижается при сдвиге потенциала в положительную
сторону, что может быть вызвано образованием оксидных или гидро-
оксидных пленок.
При смещении потенциала Е от потенциала пассивации Е
пас
в по-
ложительном направлении (см. рис. 2.15) скорость растворения ме-
талла, как правило, практически не изменяется. Металл в этом интер-
вале потенциалов пассивен. Следует отметить, что хотя величина то-
ка полной пассивации может быть ничтожно мала, она не достигает
нулевого значения.
По достижении определенного потенциала
..пп
E (см. рис. 2.15)
снова имеет место рост скорости растворения металла при сдвиге по-
тенциала в положительную сторону. В этом случае происходит на-
рушение пассивного состояния металла, которое принято называть
его активацией, или перепассивацией (депассивацией). Скорость рас-
творения вновь растет с увеличением положительного значения по-
тенциала. При этом отличие от области активного состояния состоит
в том, что металл растворяется с образованием ионов высшей степени
105
окисления. Так, железо в активной области переходит в раствор в ви-
де двухзарядных ионов, а в области перепассивации – в виде трехза-
рядных ионов.
Рис. 2.15. Зависимость скорости растворения металлов от потенциала
Вещества или процессы, нарушающие пассивное состояние ме-
таллов или затрудняющие наступление пассивности, называют акти-
ваторами, или депассиваторами, которыми являются [1, 4]:
1) восстановители, например водород,
32
SONa и др.;
2) катодная деполяризация;
3) некоторые ионы, например
H
,
Cl
,
2
4
SO и другие, которые
называют активными ионами;
4) повышение температуры;
5) механические нарушения пассивной поверхности металла.
Так, например, царапина на поверхности металла становится
анодом, а неповрежденная поверхность – катодом. В результате рабо-
ты такой гальванической пары катодный восстановительный процесс
на пассивных участках оказывает активирующее действие.
106
Переход металла в пассивное состояние связывается с образова-
нием на поверхности металла защитных гидратированных оксидных
пленок (пленочная теория пассивности металлов). Вероятность их ус-
тойчивости определяется величиной рН раствора. Было установлено,
что потенциалы пассивации металлов с ростом кислотности агрес-
сивной среды сдвигаются в положительном направлении.
Существуют и другие теории пассивности металлов, например,
адсорбционная теория, кинетическая теория, теория электронных
конфигураций и другие.
2.8. Факторы электрохимической коррозии металлов и сплавов
Скорость и характер процесса электрохимической коррозии зави-
сят от многих факторов, к числу которых относятся:
внутренние факторы – связанные с природой металла: состав,
структура, состояние поверхности, напряжения в металле и др.;
внешние факторы – связанные с составом коррозионной среды
и условиями процесса коррозии: температура, давление, скорость
движения среды, внешняя поляризация и др.
2.8.1. Внутренние факторы
Коррозионную характеристику металла можно проследить по по-
ложению его в периодической системе элементов Д.И. Менделеева
(табл. 2.3) [1].
Наиболее коррозионно-неустойчивые металлы находятся в под-
группах IА и II групп периодической системы элементов, это щелоч-
ные и щелочноземельные металлы. Металлы подгрупп А главных
подгрупп, начиная со второй, склонны пассивироваться. Их пассив-
ность растет снизу вверх, т.е. с уменьшением их порядкового номера.
Коррозионная стойкость металлов подгрупп В побочных под-
групп определяется их термодинамической неустойчивостью и обра-
зующейся оксидной пленкой.

107
Таблица 2.3
Периодическая система элементов Д.И. Менделеева
Наиболее коррозионно-стойкие металлы находятся внизу группы
VIII и IВ.
Обработка поверхности (шлифовка, полировка) повышает корро-
зионную стойкость металлов на начальной стадии коррозии за счет
образования защитных пленок.
Структурная неоднородность и величина зерна металла сильно
влияют на его коррозионную стойкость. Можно отметить следующие
основные случаи [1].
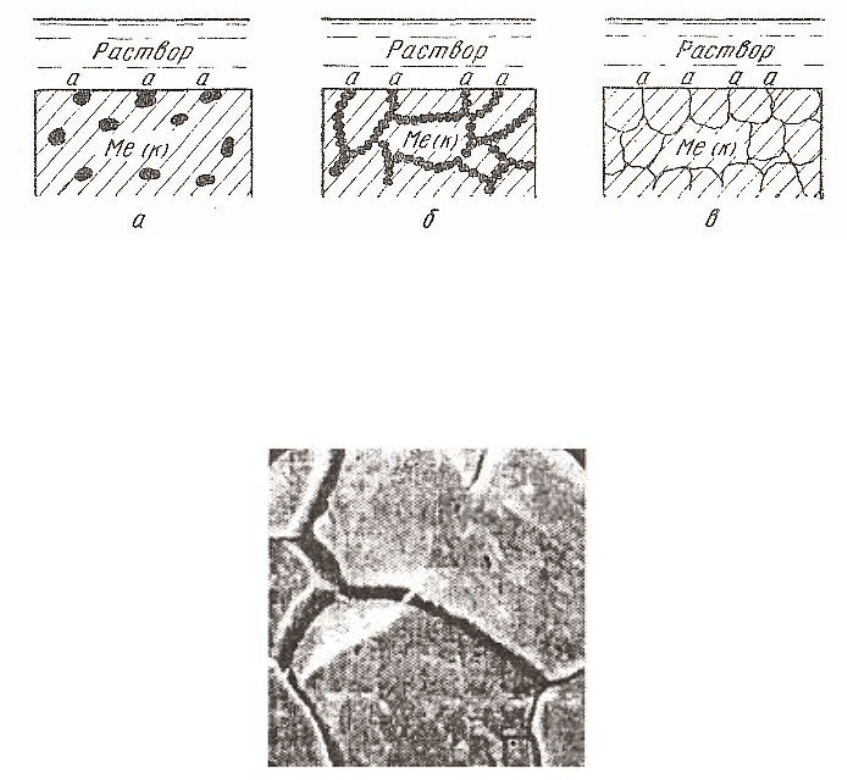
1. Влияние анодной структурной составляющей сплава. Если
анодная фаза присутствует в незначительном количестве в виде рав-
номерно распределенных включений (рис. 2.16, а), то при взаимодей-
ствии с раствором электролита эти включения будут быстро вытрав-
лены с поверхности, и она станет более или менее однородной. В
этом случае неоднородность сплава не будет сильно влиять на его
коррозионную стойкость.
108
Если анодная фаза распределена так, что она непрерывно прони-
зывает весь сплав (рис. 2.16, б), то это проводит к усилению коррозии
(случай избирательной коррозии).
Если анодом является узкая зона границы зерен (рис. 2.16, в), то
это приведет к интенсивной коррозии границ зерен, т.е. к межкри-
сталлитной коррозии (рис. 2.17) [1].
Рис. 2.16. Три случая распределения анодной структурной
составляющей сплава
Рис. 2.17. Характер коррозионного разрушения стали
09Х18Н14 с 0,75%
Si
после отпуска при 650 °С
2. Влияние катодной структуры составляющей сплава. Зависит от
характера контроля коррозионного процесса. Так, если коррозионный
процесс контролируется перенапряжением катодной реакции, то ка-
тодные включения облегчают протекание катодного процесса, сни-
жая его перенапряжение и увеличивая скорость коррозии сплава.
