Горбунова В.Н., Савельева-Васильева Е.А., Красильников В.В. Молекулярная неврология. Заболевания нервно-мышечной системы
Подождите немного. Документ загружается.

лых пациентов с относительно поздним началом заболева-
ния (Taroni et al., 1993). Вторая мутация, найденная при дет-
ской форме заболевания, заключается в замене аргинина
на цистеин в 631 положении белка (Taroni et al., 1992). Инте-
ресно отметить, что эта мутация часто обнаруживается в со-
четании с двумя другими мутациями в СРТ1 гене — G1203A
и V368I, которые сами по себе не приводят к заболеванию, а
являются относительно редкими формами полиморфизмов.
Однако эти же полиморфные мутации с повышенной часто-
той встречаются и при взрослых формах заболевания. По-
видимому, сами эти замены не инактивируют фермент, но
способны усиливать эффект мутаций, повреждающих актив-
ность фермента.
в) Миопатия напряжения (MIM: 102770)
Наследственная недостаточность АМФ-дезаминазы
является причиной одной из форм миопатии напряжения,
характеризующейся икроножными болями и слабостью верх-
них конечностей после упражнений. Миоаденилат дезамина-
за, или аденозинмонофосфат (АМФ) дезаминаза, играет важ-
ную роль в пуриновом нуклеотидном цикле. Ее дефицит, по-
видимому, является наиболее общей причиной метаболиче-
ских миопатии у человека и особенно состояний, провоциру-
емых физической нагрузкой. Уровень фермента на порядок
выше в скелетных мышцах, чем в других тканях. Обобщен-
ный опыт показывает, что в 1—2% исследуемых мышечных
биоптатов наблюдается дефицит АМФ-дезаминазы. В норме
активность АМФ-дезаминазы на 95% ингибируется ГТФ. Ге-
нетически детерминированное снижение чувствительности
фермента к этому ингибированию, по-видимому, является
основой развития наследственной первичной подагры.
Тканеспецифические изоформы АМФ-дезаминазы об-
разуются за счет дифференциальной экспрессии двух генов
в сочетании с альтернативным сплайсингом первичного
транскрипта одного из этих генов. С использованием мето-
дов соматической гибридизации и гибридизации in situ ген
AMPD1 (adenosine monophosphate deaminase 1) локализован
в области 1p21-p13 (Sabinaetal., 1990). Ген состоит из 16 эк-
зонов, расположенных в участке геномной ДНК размером
20 тысяч пар оснований. В 0.6—2% мРНК гена AMPD1, экс-
прессирующегося в скелетных мышцах взрослых, в резуль-
тате альтернативного сплайсинга отсутствует экзон 2. Одна-
ко образующаяся при этом делетированная форма фермен-
та функционально активна.
У большинства пациентов с миопатией напряжения,
обусловленной недостаточностью АМФ-дезаминазы, одновре-
менно присутствуют две мутации в гене AMPD1 в cis-поло-
жении (Morisaki et al. 1992). Одна из них — нонсенс-мутация
в 12-м кодоне второго экзона, приводящая к преждевремен-
ной терминации синтеза фермента, что согласуется с отсут-
ствием иммунореактивных форм белка у обследованных па-
циентов. Вторая — миссенс-мутация в 48-м кодоне третьего
экзона. Этот полиморфный мутантный аллель встречается с
частотой 12% среди представителей белой расы, с частотой
19% среди американцев африканского происхождения и пол-
ностью отсутствует среди японцев. Популяционная частота
этого аллеля может обьяснить 2% зарегистрированных слу-
чаев дефицита АМФ-дезаминазы в биоптатах мышц. Присут-
ствие в гомозиготном состоянии полиморфной миссенс-му-
тации у неродственных пациентов с недостаточностью АМФ-
дезаминазы, одновременно гомозиготных по нонсенс-мута-
ции, по-видимому, является результатом «эффекта основате-
ля», приведшего к распространению в Западной Европе этой
комбинации аллелей в гене AMPD1. Клиническая гетерогенность
недостаточности АМФ-дезаминазы частично может быть свя-
зана с изменчивостью в характере сплайсинга первичного РНК
транскрипта в скелетных мышцах (Morisaki et al., 1993).
г) Миопатия, обусловленная недостаточностью
фосфоглицератмутазы (MIM: 261670)
К основным клиническим признакам данной формы
миопатии можно отнести следующие: мышечная слабость,
162
миалгия (часто по типу крампи), провоцируемая физически-
ми нагрузками, миоглобинурия, повышенная активность сы-
вороточной креатинкиназы, почечная недостаточность.
Фосфоглицератмутаза — димер, две изоформы кото-
рого — медленно мигрирующая мышечная (М) и быстро миг-
рирующая мозговая (В) содержатся в различных тканях в
разных пропорциях. Эти изоформы кодируются разными ге-
нами. Семейство включает также бифосфоглицератмутазу.
Полноразмерная кДНК мышечной субъединицы фер-
мента клонирована (Shanske et al., 1987). Блот гибридизация
по Саузерну геномной ДНК с кДНКовыми зондами выявила
существование мультигенного семейства PGAM в геноме
человека, причем в разных тканях происходит специфичес-
кая транскрипция различных PGAM генов. В-субьединица
преимущественно экспрессируется в красных клетках кро-
ви, в печени и в мозге, тогда как М-субъединица — в мышцах
и обе субъединицы экспрессируются в сердце. Ген мышеч-
ной фосфоглицератмутазы — PGAMM (gihosphoglycerate
rnutase М) картирован в области 7р13-р12 (Mattei et al., 1989).
Ген содержит 3 экзона, распределенных на площади 2.83 кб
геномной ДНК. Бифосфоглицератмутазный (BPGM) ген кар-
тирован в области 7q22-q34 и имеет высокий процент гомо-
логии с PGAMM-геном и одинаковое количество и располо-
жение интронов. При сравнении генов, кодирующих мышеч-
ные ферменты, обнаружена консервативная последователь-
ность из 9 пар оснований в 5'-нетранслируемой области
(GGGGCTGGG). По-видимому, эта последовательность свя-
зана с экспрессией мышечных ферментов.
Идентифицировано три точечных мутации в PGAMM-
гене у больных с миопатией, обусловленной недостаточнос-
тью фосфоглицератмутазы (Tsujino et al. 1993). При этом одна
из них — нонсенс-мутация в 78-м кодоне, преимущественно
встречается среди пациентов афро-американского происхож-
дения. Первый зарегистрированный пациент европейского
происхождения оказался гомозиготен по миссенс-мутации в
90-м кодоне гена PGAMM.
163

ГЛАВА 2
БОЛЕЗНИ МЫШЦ. МИОТОНИЧЕСКИЕ
СИНДРОМЫ И ПЕРИОДИЧЕСКИЕ
ПАРАЛИЧИ
2.1. Общая характеристика
В данной группе болезней мышц будут рассмотрены
миотоническая дистрофия, миотония Томсена и периодичес-
кие параличи. Для всех заболеваний, включенных в группу
миотоний, специфичен феномен миотонии, состоящий в не-
произвольном тоническом спазме мышц, возникающем вслед
за резким произвольным сокращением. Расслабление насту-
пает лишь через несколько секунд (до 30 сек.). Описанный
феномен типичен для начального («стартового») движения.
Повторные сокращения этих мышечных групп совершаются
с меньшим затруднением, а затем вообще нормализуются.
Медленные, слабые движения, как правило, не сопровожда-
ются миотоническим спазмом.
Периодические параличи характеризуются своеобраз-
ными клиническими проявлениями в виде внезапной, при-
ступообразной утраты способности производить активные
движения. При этом мышцы утрачивают способность к со-
кращению. Страдает вся скелетная мускулатура. В зависи-
мости от содержания калия в сыворотке крови различают
гипер-, гипои нормокалиемические формы заболевания.
Следует подчеркнуть, что уровень калия в сыворотке крови
меняется только во время пароксизма. При всех формах
периодического паралича наблюдаются специфические из-
менения морфологии мышечной ткани в виде дегенерации
центральной части миофибрилл с последующим образовани-
ем вакуолей.
В табл. 10 представлена общая характеристика генов,
ответственных за миотонические синдромы и периодические
параличи.
165

Таблица 10
Молекулярно-генетическая характеристика
миотонических синдромов и периодических параличей
Нозологическая
Ген,
Белок, функции
форма, MIM
локализация
Миотоническая
DM, DMPK
миотонин-протеинкиназа -
дистрофия,
цАМФ-зависимая серии/
160900
треонинкиназа
+
DMAHP
гомеодоменны
19q13.2-q13.3
транскрипционный фактор
Миотония врожденная CLC1
хлорный канал
Томсена,
скелетных
160800;
мышц
Беккера болезнь,
255700
5q12.2-q13
Паралич
HYPP,
натриевый
периодический
SCN4A
канал тип 4,
гипер-
альфа
калиемический II,
170500;
парамиотония
Эйленбурга, 168300;
атипичные
не индуцируемые
холодом миотонии,
168350; 170600
17q23.1-q25.3
Паралич
HOKPP,
кальциевый
периодический
CACNL1A
канал 1_типа,
гипокалиемический I,
1q31-q32
альфа 1
170400
альфа 1
С генетической точки зрения миотоническая дистро-
фия относится к группе болезней экспансии. Подобные за-
болевания обусловлены динамическими мутациями — уве-
личением (или экспансией) выше допустимого критичес-
кого уровня числа копий повторяющихся элементов в мес-
166
тах локализации микрои минисателлитных последователь-
ностей. Если подобные последовательности расположены
в значимых областях генов, их экспансия может сопровож-
даться нарушением регуляции работы гена или образова-
нием аномального продукта, обладающего определенной
агрессивной функцией по отношению к тем клеткам, в ко-
торых этот ген экспрессируется. И то и другое может явить-
ся причиной развития патологических процессов и реали-
зоваться в виде наследственных заболеваний. Подробная
характеристика болезней экспансии будет представлена во
второй части монографии.
Миотонии, не сопровождающиеся мышечной дистро-
фией, и периодические параличи обусловлены мутациями
в генах ионных каналов: в хлорном канале скелетных мышц
при миотонии Томсена, в вольтаж-зависимых натриевом и
кальциевом каналах L-типа при гипери гипокалиемичес-
ких периодических параличах соответственно. Вольтаж-за-
висимые ионные каналы являются частью семейства мак-
ромолекул, функции которых включают контроль и поддер-
жание внутриклеточного электропотенциала, секрецию и
сигнальную трансдукцию (Bulman, 1997). На рис. 19 изоб-
ражена структура трансмембранных вольтаж-зависимых
калиевых и натриевых ионных каналов. Фундаментальной
особенностью эволюционно родственного суперсемейст-
ва вольтаж-зависимых К+, Na+ и Са2+ каналов является
присутствие ряда из шести трансмембранных сегментов
(S1-S6), формирующих отдельный домен. Один такой до-
мен представлен в калиевых каналах и четыре подобных
домена образуют альфа1 субъединицы натриевых и каль-
циевых каналов. Предполагается, что сегмент 4 обладает
вольтаж-сенсорной функцией и в каждом третьем или чет-
вертом положении этого сегмента присутствует основная
аминокислота. Отдельные каналы высококонсервативны.
Кроме того, в различных ионных каналах также присутст-
вуют консервативные районы, что является признаком их
эволюционно родственного происхождения.
167
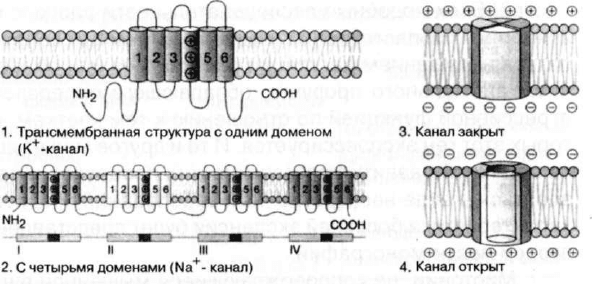
Рис. 19. Структура трансмембранных вольтаж-зависимых
ионных каналов
Характерным для генов ионных каналов является то,
что мутации, затрагивающие разные участки этих белков,
могут приводить к такому различному течению заболева-
ний, что клинически они могут быть отнесены к разным
нозологическим формам. Так, разные мутации в одном и
том же гене, кодирующем альфа-субъединицу мышечного
натриевого канала, могут быть причиной развития семи
клинически самостоятельных форм гипери гипокалиеми-
ческой пароксизмальной миоплегии, парамиотонии и мио-
тонии.
Это в полной мере относится и к генам кальциевых
каналов. Мутации в гене альфа-субъединицы кальциевого
канала скелетных мышц являются причиной развития
гипокалиемического периодического паралича. В то же
время разные мутации в гене альфа1 А-субъединицы
нейронального Са2+-канала P/Q-типа могут реализоваться
в виде таких разных заболеваний, как спиноцеребеллярная
атаксия типа 6, наследственная эпизодическая атаксия и
семейная гемиплегическая мигрень.
168

2.2. Миотонические синдромы
а) Миотоническая дистрофия (MIM: 160900)
1. Клиническая характеристика заболевания
Клиническая картина миотонической дистрофии пред-
ставляет собой сочетание миотонии, миопатии, сердечно-
сосудистых нарушений и эндокринно-вегетативных расст-
ройств. Начало заболевания относится к детскому возрасту,
хотя более типичен дебют на втором-третьем десятилетии
жизни. Первая клиническая симптоматика определяется при-
знаками миотонического спазма и затруднения разгибания
пальцев рук при резких, быстрых движениях. Симптом мио-
тонического «ровика», обусловленный повышенной механи-
ческой возбудимостью, легче получить на дельтовидной, ик-
роножной и мышцах языка. Течение болезни неуклонно про-
грессирующее. На фоне усиливающегося миотонического
синдрома развивается мышечная слабость и атрофические
проявления, сходные с миопатиями. Однако, в отличие от
последних, формула распределения мышечной слабости иная.
Слабеют мышцы лица, в частности круговая мышца глаза,
мышца, поднимающая веко, жевательные мышцы, а также
сгибатели шеи, плечелучевая и перонеальная на конечнос-
тях. Атрофии мышц ладоней приводят к своеобразной «обе-
зьяньей лапе». Мышечная слабость и атрофии возникают од-
новременно. Постепенно из-за снижения мышечной силы
миотонический синдром становится менее ярким. Глубокие
рефлексы постепенно снижаются и в дальнейшем угасают.
Достаточно типично наличие катаракты, та или иная степень
интеллектуальной недостаточности. Нередко миотонической
дистрофии сопутствуют различные эндокринные и вегетатив-
ные нарушения.
В разных популяциях заболевание встречается с час-
тотой 1 на 8—40 тысяч, наследуется по аутосомно-доминант-
ному типу и характеризуется высокой пенетрантностью му-
тантных аллелей и феноменом антиципации — более ран-
169

ним началом и нарастанием тяжести симптомов заболева-
ния в семье в последующих поколениях. Мужчины болеют в
три раза чаще женщин.
2. Картирование и идентификация гена DM
Ген миотонческой дистрофии DM (dystrophia
myotonica) — один из первых аутосомных генов человека,
для которого методами генетического анализа была иденти-
фицирована группа сцепления (Eiberg et al., 1983; O'Brien et
al., 1983). Он расположен в области 19q13.2-q13.3 и его бли-
жайшими проксимальными маркерами являются гены апо-
липопротеина С2 (АРОС2) и мышечной креатинкиназы
(СКММ) (Harley et al., 1991). Микросателлитный маркер
D19S63 наиболее информативен для проведения пренаталь-
ной и досимптоматической диагностики миотонической дис-
трофии (Cobo et al., 1992). Ген миотонческой дистрофии со-
стоит из 15 экзонов, распределенных на площади в 13 кб ге-
номной ДНК. Эта область ДНК полностью просеквенирована
(Shaw et al., 1993; Mahadevan et al., 1993). Ген DM активно
экспрессируется во всех типах мышечных клеток, а также в
других тканях, дефектных при миотонической дистрофии, в
частности в мозге и в сердце. Обнаружено несколько раз-
личных изоформ мРНК гена DM в мышцах плода и новорож-
денных, что доказывает возможность альтернативного сплай-
синга первичного РНК-транскрипта.
3. Молекулярная природа мутаций в гене DM
Как мы уже отмечали, миотоническая дистрофия отно-
сится к группе так называемых болезней экспансии, так как
в подавляющем большинстве случаев молекулярной основой
заболевания служат значительные экспансии числа копий
тринуклеотидного CTG-повтора, расположенного в З'-нетран-
слируемой части гена DM. Впервые предположение о моле-
кулярных основах заболевания было высказано после обна-
ружения у больных с миотонической дистрофией необычно-
го рестрикционного EcoRI-фрагмента, гибридизующегося с
170
