Герасименко В.Г., Герасименко М.О., Цвіліховський М.І. та ін. Біотехнологія
Подождите немного. Документ загружается.


діють на клітинну мембрану дріжджів, помітно стимулюють
вміст ергостерину в біомасі.
При одержанні ергостерину у виробничих умовах можна
виділити такі етапи: розмноження вихідної культури і накопи
чення інокулята; ферментація; сепарування клітин; опромінен
ня клітин ультрафіолетовими променями; висушування і упа
кування цільового продукту.
Так, стосовно дріжджів інокулят одержують на середови
щах, які забезпечують повноцінний розвиток клітин. Після цьо
го основне середовище з ацетатом (активатором біосинтезу сте
ринів), яке містить знижену кількість азоту, але збагачене
джерелом вуглецю (високе значення С:N), засівають порівняно
великим об’ємом інокулята. Культивування дріжджів (фермен
тацію) проводять при температурі, наближеній до максималь
ної для конкретного штаму, і належній аерації (2 % О
2
в газовій
фазі). Через 3–4 доби, залежно від ростових характеристик і
біосинтетичної активності культури, клітини сепарують і підда
ють вакуумвисушуванню. Потім сухі дріжджі опромінюють
ультрафіолетовими променями – УФП (довжина хвилі
280–300 нм) протягом оптимального часу за необхідної темпе
ратури і з урахуванням домішок.
Опромінення дріжджів можна проводити до сепарації клі
тин у тонкому шарі 5 % суспензії, враховуючи невелику прони
кну здатність УФП.
Опромінені сухі дріжджі використовують у тваринництві.
У промисловості їх випускають під назвою «кормові гідролізні
дріжджі, збагачені вітаміном D
2
». У такому препараті міститься
не менше 46 % сирого білка, незамінні амінокислоти (лізин, ме
тіонін, триптофан) і 5000 МО вітаміну D
2
/г.
У випадку одержання кристалічного вітаміну D
2
клітини
продуцента гідролізують соляною кислотою при температурі
110
о
С. Потім температуру знижують до 75–78
о
С і додають ета
нол. Суміш фільтрують при 10–15
о
С і масу, яка залишилася пі
сля фільтрації, промивають водою, висушують, подрібнюють,
нагрівають до 78
о
С і двічі обробляють потрійним об’ємом ета
нолу. Спиртові екстракти об’єднують і упарюють до 70 %го
вмісту сухих речовин. Одержаний «ліпідний концентрат» обро
бляють розчином їдкого натрію. Ергостерин кристалізується з
ЧастинаII.Спеціальнібіотехнолоії
380

неомиленої фракції концентрату при 0
о
С. Його можна очисти
ти повторними перекристалізаціями. Кристали висушують,
розчиняють у сірчаному ефірі, опромінюють УФП, ефір відга
няють, а розчин вітаміну D
2
концентрують і кристалізують.
«Кислотний фільтрат» зазвичай упарюють до 50 %го вмі
сту сухих речовин і використовують як концентрат Dвітамінів.
Виробляють також масляний концентрат вітаміну D
2
.
Рибофлавін або ВІТАМІН В
2
. Міститься в клітинах різ
них мікроорганізмів, будучи коферментом у складі флавопроте
їнів (перш за все відповідних ферментів класу оксидоредуктаз –
ФМН, ФАД). Продуцентами рибофлавіну (флавопротеїнів)
можуть бути бактерії, дріжджі і нитчасті гриби. Однак найбільш
перспективними є штами, які утворюють на рідких середови
щах 0,5 г і більше рибофлавіну в 1 л середовища. До таких орга
нізмів належать Ashbyii gossypii, Eremothecium ashbyii i Candida
guilliermondii. Враховуючи мінливість активних продуцентів
названих видів за здатністю синтезувати вітамін В
2
, необхідний
систематичний підтримувальний відбір культур у процесі їх ек
сплуатації на виробництві. Зазвичай активні продуценти пер
ших двох видів формують яскравооранжеві колонії на агаризо
ваних середовищах.
Методами генетичної інженерії вдалось одержати штам сін
ної палички, яка утворює приблизно 6 г рибофлавіну в 1 л куль
турального середовища, що містить патоку, білкововітамінний
концентрат і його гідролізат.
Високий вихід рибофлавіну у E. ashbyii корелює з азотом
пуринів та іншими азотистими джерелами, вміст яких у середо
вищі має бути достатнім. Як джерело вуглецю використовують
глюкозу або цукрозу, дріжджовий або кукурудзяний екстракт,
соєву муку, масла (жири).
Рідкі поживні середовища для одержання інокуляту і для
основної ферментації можуть дещо відрізнятися між собою. На
приклад, для одержання посівного матеріалу відоме середови
ще, яке містить цукрозу, пептон, кукурудзяний екстракт, калію
дигідрофосфат, магнію сульфат, рослинну олію. Час вирощу
вання продуцента на цьому середовищі — 2 доби при температу
рі 27–30
о
С (залежно від штаму). Ферментаційне середовище
Розділ17.Біотехнолоіяодержаннявітамінів
381

зазвичай включає кукурудзяну і соєву муку, цукрозу, кукуруд
зяний екстракт, калію дегідрофосфат, кальцію карбонат, натрію
хлорид і ненасичений жир.
Зазвичай тривалість ферментації становить 5 діб при
рН 5,5–7,7. Після використання цукрози (приблизно через 30
годин) починає помітно накопичуватися вітамін В
2
, спочатку —
в міцелії, а потім — у культуральній рідині.
Для використання в годівлі тварин всю біомасу висушують
і в одержаному сухому продукті вологістю 8 % міститься
1,5–2,5 % рибофлавіну, 20 % білка, тіамін, нікотинова кислота,
піридоксин, ціанкобаламін, мікроелементи та інші речовини.
У випадку високих вихідних показників за рибофлавіном
вітамін можна виділяти індивідуально і разом із синтетичним
рибофлавіном використовувати в медицині.
Для Сandidia guilliermondii дуже важливо регулювати вміст
заліза в поживному середовищі, оптимальна концентрація яко
го коливається в середньому від 0,005 до 0,05 мкг/мл. При цьо
му певні штами дріжджів можуть утворювати за 5–7 днів понад
0,5 г/л вітаміну. Однак для промислового виробництва рибо
флавіну перевагу надають більш продуктивним видам і штамам
грибів – E.ashbyii i Ashbyiі gossypii.
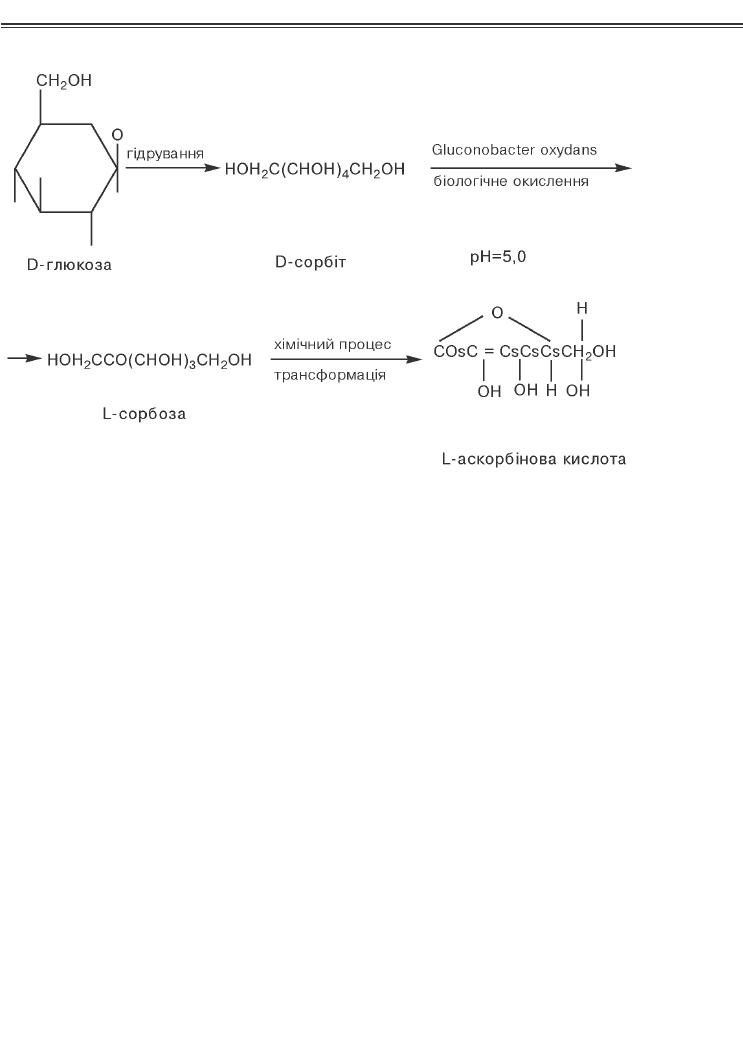
Аскорбінова кислота, або ВІТАМІН С. Це протицин
готний вітамін, який міститься у всіх вищих рослинах і твари
нах. Тільки людина і мікроби не синтезують її, але людям вона
вкрай необхідна, а мікроби не потребують цього вітаміну. Однак
певні види оцтовокислих бактерій синтезують напівпродукт ас
корбінової кислоти — Lсорбозу. Таким чином, весь процес
одержання аскорбінової кислоти є змішаним, тобто хімікофер
ментативним.
Біологічна стадія процесу каталізується мембранозв’яза
ною поліолдегідрогеназою, а остання (хімічна) включає послі
довно такі етапи: конденсація сорбози з діацетоном і одержання
діацетонLсорбози; окислення останньої до діацетон2кетоL
гулонової кислоти, яку в подальшому піддають гідролізу з одер
жанням 2кетоLгулонової кислоти; останню піддають еноліза
ції з наступною трансформацією в Lаскорбінову кислоту
(рис. 17.1).
ЧастинаII.Спеціальнібіотехнолоії
382
Ферментацію G.oxydans проводять на середовищах, які мі
стять сорбіт (20 %), кукурудзяний або дріжджовий екстракт,
при інтенсивній аерації (8–10 г О
2
/л/год). Вихід Lсорбози мо
же сягнути 98 % за одну–дві доби. При досягненні культурою
logфази можна додатково вводити в середовище сорбіт, дово
дячи його концентрацію до 25 %. Також установлено, що
G.oxydans може окислювати і вищі концентрації поліспирту
(30–50 %), який утворюється на останніх стадіях процесу. Фер
ментацію бактерій проводять в періодичному або безперервно
му режимі. Доведена можливість одержання Lсорбози із сорбі
ту за допомогою іммобілізованих у поліакриламідному гелі
бактеріальних клітин.
Аскорбінову кислоту використовують як антиоксидант у
медицині, а також у харчовій промисловості.
Ціанкобаламін, або ВІТАМІН В
12
. Одержують тільки
мікробіологічним синтезом. Його продуцентами є прокаріоти і
перш за все пропіоновокислі бактерії, які в природних умовах
утворюють цей вітамін. Мутанти Propionibacterium shermanii
Розділ17.Біотехнолоіяодержаннявітамінів
383
Рис. 17.1. Схема хіміко<ферментативного методу одержання
аскорбінової кислоти
(за Єліновим Н.П., 1995)

M82 і Pseudomonas denitrificans M2436 продукують на рідко
му середовищі до 58–59 мг/л ціанкобаламіну.
Враховуючи важливу функцію вітаміну в організмі людини
(він є протианемічним фактором), його світове виробництво до
сягло 10 т на рік, з яких 6,5 т витрачають на медичні потреби, а
3,5 т — у тваринництві (Єлінов Н.П., 1995).
Вітчизняне виробництво ціанкобаламіну базується на вико
ристанні Р. freudenreichii Var. shermanii, яка культивується у пе
ріодичному режимі без доступу кисню. Ферментативне середо
вище зазвичай містить глюкозу, кукурудзяний екстракт, солі
амонію і кобальту. pН близько 7,0 підтримують додаванням
NH
4
ОН. Тривалість ферментації 6 діб. Через 3 доби у середови
ще додають 5,6–диметилбензімідазол — попередник вітаміну
В
12
і продовжують ферментацію ще 3 доби.
Ціанкобаламін накопичується в клітинах бактерій, тому
операції з виділення вітаміну полягають у наступному: сепару
вання клітин, ектрагування водою при рН 4,5–5,0 і температурі
85–90
о
С за присутності стабілізатора (0,25 %й розчин натрію
нітриту). Екстракція відбувається протягом години, після чого
водний розчин охолоджують, нейтралізують розчином NaOH,
додають коагулянти білка (хлорид заліза тривалентного і алю
мінію сульфату) з подальшою фільтрацією. Фільтрат упарюють
і додатково очищують, використовуючи методи іонного обміну
і хроматографії, потім проводять кристалізацію вітаміну при
температурі 3–4
о
С з водноацетонового розчину.
Кристалічний ціанкобаламін можна одержати за допомо
гою резорцину або фенолу, що утворюють з ним аддукти, які по
рівняно легко розкладаються на складові компоненти.
При реалізації даного біотехнологічного процесу потрібно
зважати на високу чутливість до світла вітаміну В
12
. Через це усі
операції необхідно проводити в умовах затемнення (або при
червоному світлі).
На ацетонобутиловій або спиртових бардах з додаванням
солей кобальту і метанолу одержують кормовий препарат
КМБ
12
– концентрат, який містить вітамін В
12
та інші ростові
біологічно активні речовини. Біооб’єктом є змішана культура
метаногенних бактерій.
ЧастинаII.Спеціальнібіотехнолоії
384

Контрольні питання
1. Якими методами одержують вітаміни?
2. У якому випадку мікробіологічний синтез вітамінів перева
жає над хімічним?
3. Які існують напрями вирішення проблеми одержання вітамі
нів мікробіологічним синтезом?
4. Які продуценти та поживні середовища використовуються
для одержання каротиноїдів?
5. Як отримують вітамін D?
6. Які етапи біотехнології отримання ергостерину у виробни
чих умовах?
7. Яким методом отримують рибофлавін (вітамін В
2
)?
8. Які особливості методу отримання аскорбінової кислоти?
9. Яким синтезом отримують вітамін В
12
?
10.Які мікроорганізми є продуцентами вітаміну В
12
та склад по
живного середовища для їх культивування?
Розділ17.Біотехнолоіяодержаннявітамінів
385

Розділ 18.
БІОТЕХНОЛОГІЇ ОДЕРЖАННЯ
БІОЛОГІЧНО АКТИВНИХ ПРОДУКТІВ
НА ОСНОВІ МЕТАЛОКОМПЛЕКСНИХ
СПОЛУК
Розробка наукових основ створення і використання біоло
гічно активних металокомплексних сполук передбачає одер
жання фундаментальних знань щодо механізмів регулювання
біохімічних окисновідновних процесів із застосуванням ком
плексів перехідних металів з біолігандами. При конструюванні
біохелатів використовуються принципи одержання ефективно
діючих біонеорганічних комплексів, які функціонують у кліти
нах іn vivo. Є можливості моделювати властивості складних
біокомплексів, шляхом створення спрощених аналогів, які ха
рактеризують найбільш суттєві ознаки вихідних сполук. Для
цього необхідне проведення порівняння створюваного біоком
плексу і моделі з використанням структурного і (або) функціо
нального підходу при конструюванні, тобто модель за структу
рою має бути аналогічною біокомплексу, що моделюється, чи
його головного активного компонента; або модель, яка не має
структурної ідентичності з вихідним біокомплексом, здатна ви
конувати аналогічні біологічні функції.
При створенні аналогів можливе одержання структур, які за
своїми характеристиками перевищують вихідні біокомплекси,
оскільки останні синтезуються в клітинах при невисоких кон
центраціях реагуючих речовин, температурах, тиску, у вузькому
інтервалі рН. При конструюванні модельних систем є можли
вість для широкого варіювання цих параметрів.
Сконструйовані моделі біокомплексів спроможні виконува
ти різноманітні біологічні функції і мати значні переваги сто
совно структур, утворених in vivo. В процесі конструювання
біомоделей перш за все необхідно використовувати сучасні дані
про шляхи утворення і транспорту біосистем, які моделюються,

Розділ18.Біотехнолоіїодержаннябіолоічноативнихпродтівнаоснові...
387
проформи, у яких вони елімінуються з оточуючого середовища,
транспортуються крізь мембрани клітин і досягають кінцевого
пункту, де утворюють відповідні біокомплекси. Біокомплекси
металів – це їх координаційні сполуки, які виконують певні
функції в організмі.
Металопротеїни – комплекси металів з білками, які відігра
ють важливу роль у накопиченні, транспорті й активації моле
кулярного кисню з використанням його в різних окислюваль
них процесах. Під час метаболізму енергетичні потреби клітин
задовольняються за рахунок енергії, яка вивільнюється при
окисленні біосполук за участю кисню.
Одним з перспективних напрямів досліджень є моделюван
ня ферментних систем, які беруть участь в окисновідновних
процесах, для вивчення механізмів біоактивації молекулярного
кисню. Окисновідновні процеси в організмі каталізуються
ферментамиоксидоредуктазами.
Для вищих форм життя велике значення має молекулярний
кисень, реакція відновлення якого щодо води – основа біоенер
гетики клітин. Молекулярний кисень в основному стані є біра
дикалом, у якого два неспарених електрони з паралельними спі
нами знаходяться на різних розпушуючих π
gx
і π
gy
молекулярних
орбіталях. Саме тому молекулярний кисень є відносно інерт
ною молекулою, бо за законом зберігання спіну в результаті
взаємодії О
2
з речовинами, якими заповнені орбіталі, повинен
з’явитися бірадикал, але для такої реакції потрібна висока енер
гія активації (заборона за спіном). Таким чином, органічні мо
лекули існують у кисневому оточенні завдяки забороні за спі
ном. Спінову заборону для реакцій триплетного кисню
можливо подолати послідовним додаванням електронів:
О
2
+ е → О
•
2
; О
•
2
+H
+
→ HO
•
2
; HO
•
2
+ H
+
+ е → H
2
O
2
.
Крім цього, О
2
активно взаємодіє з органічними радикала
ми, у яких є неспарені електрони. Ці реакції мають важливе зна
чення для клітин у ланцюгових радикальних процесах перекис
ного окислення ліпідів (ПОЛ). Кисень не вступає в прямі
неферментативні реакції з органічними речовинами, але в клі
тинах є сформовані високоспеціалізовані ферментні системи,
які беруть участь у відновленні кисню шляхом перенесення на

нього одного, двох або чотирьох електронів. Ферменти, які відно
влюють О
2
, є металопротеїдами, що мають активний центр з од
ним або декількома атомами перехідних металів (заліза, цинку,
міді, марганцю, кобальту, молібдену). Ферментний контроль ре
акцій окислення за участю кисню зумовлюється слабкими вну
трішніми магнітними збурюваннями та перемішуванням спіно
вих станів діючих речовин у процесі окислення під впливом
обмінних взаємодій з парамагнітними іонами металів. Метали
активного центру виконують роль донорів електронів для кисню.
Процеси енергетичного забезпечення життєдіяльності клі
тин еукаріот підтримуються завдяки окисновідновним реакціям
за участю багатьох ферментних систем під контролем спінових
ефектів. Проте навіть за умов високої специфічності процесів
окислювального фосфорилювання в мітохондріях, або мікросо
мального окислення за участю монооксигеназ у всіх таких реак
ціях, де беруть участь металопротеїди і кисень, відбувається утво
рення активних метаболітів кисню — супероксиданіонрадикалу,
гідроксилрадикалу, пероксиду водню, синглетного кисню та про
дуктів радикальних окислювальних реакцій: перекисних сполук,
дієнових кон’югатів, малонового диальдегіду та інших.
У клітинах для захисту від токсичних метаболітів кисню і
продуктів їх діяльності сформовані високоспеціалізовані систе
ми ферментних антиоксидантів. Розрізняють чотири лінії фер
ментного захисту клітин від активних метаболітів кисню: 1) су
пероксиддисмутаза (СОД); 2) глутатіонпероксидаза (ГПО) і
каталаза (КТ); 3) ГПО і глутатіонтрансфераза; 4) глутатіон
трансфераза, формальдегіддегідрогеназа, гліоксилаза, хінонре
дуктаза, епоксигідратаза.
Для окремих ферментів антиоксидантного захисту харак
терні специфічність дії клітинної і органної локалізації і вико
ристання як каталізаторів елементів Zn, Сu, Fe, Mn, Se. З метою
зменшення токсичного впливу активних метаболітів кисню в
експериментальній терапії використовують антиоксидантні
ферменти СОД і каталазу. При введенні препарату СОД спо
стерігається накопичення пероксиду водню, що призводить до
інактивації ферменту. При спільному введенні каталази, яка
ферментативно перетворює токсичний Н
2
О
2
на нешкідливі Н
2
О
і О
2
, СОД не втрачає активності навіть після дисмутації більше
ЧастинаII.Спеціальнібіотехнолоії
388
10
3
радикалів О
2
–
на моль ферменту. Оскільки супероксидради
кал частково інгібує КТ, стає зрозумілим, що спільне викори
стання комплексу антиоксидантних ферментів значно збільшує
їх ефект і попереджує утворення найбільш токсичного гідрок
сильного радикалу.
Одним з перспективних напрямів є використання в клініч
ній практиці препаратів СОД і КТ, що є ефективним при різних
патологіях, пов’язаних з надлишковою індукцією високотоксич
них активних форм кисню. Для попередження швидкої інакти
вації ферменту при потраплянні в біорідини є спроби викори
стання іммобілізованих форм ферменту, що значно збільшує
тривалість дії біокаталізатора. Другим практичним напрямом є
моделювання низькомолекулярних комплексів антиоксидант
них металоферментів, які є високоефективними каталізаторами
і, на відміну від аналогів, можуть мати набагато вищу активність.
Комплекси металів з біолігандами – одна із форм найбільш
наближених до оригіналу моделей металоферментів. Крім того,
для низькомолекулярних моделей не існує проблеми щодо пе
реносників і транспорту. Одним з таких прикладів є моделю
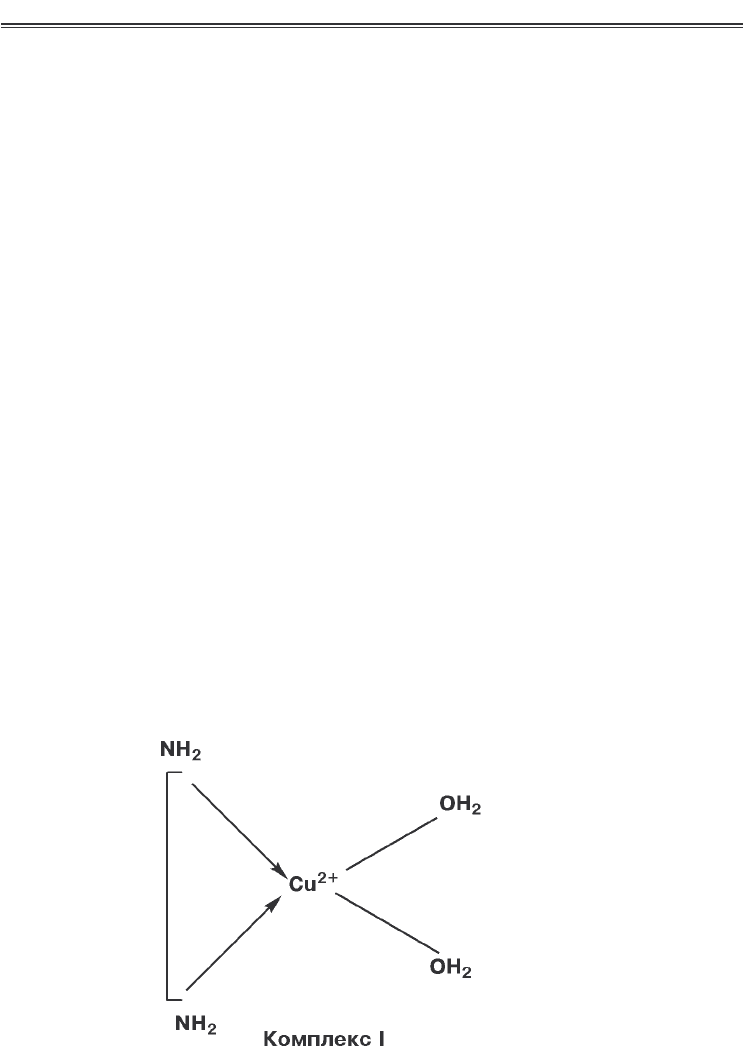
вання каталазної активності хелатами міді (ІІ) з поліамінами.
Так, для прояву каталітичної активності комплексу в ньому ма
ють бути два вільних координаційних місця, натомість як мета
лохелати, у яких усі координаційні місця зайняті, не проявля
ють специфічної активності.
Розділ18.Біотехнолоіїодержаннябіолоічноативнихпродтівнаоснові...
389
