Чугаев Л.В. Металлургия благородных металлов
Подождите немного. Документ загружается.

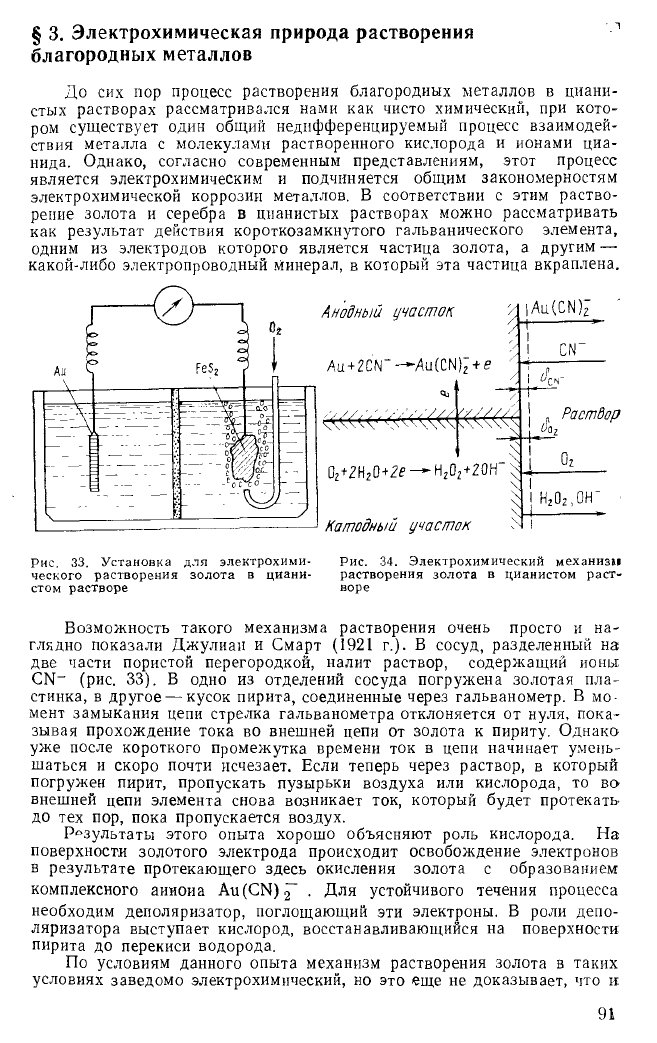
§ 3. Электрохимическая природа растворения
п
благородных металлов
До сих пор процесс растворения благородных металлов в циани-
стых растворах рассматривался нами как чисто химический, при кото-
ром существует один общий неднфференцируемый процесс взаимодей-
ствия металла с молекулами растворенного кислорода и ионами циа-
нида. Однако, согласно современным представлениям, этот процесс
является электрохимическим и подчиняется общим закономерностям
электрохимической коррозии металлов. В соответствии с этим раство-
рение золота и серебра в цианистых растворах можно рассматривать
как результат действия короткозамкнутого гальванического элемента,
одним из электродов которого является частица золота, а другим —
какой-либо электропроводный Минерал, в который эта частица вкраплена.
Анодный участок
Au
+
2CN~—Au(CN)
2
+e
Au(CN)z
0
2
+2Н
2
0+2е —Н
2
0
2
+20Н
Катодный участок
Раствор
Рис. 33. Установка для электрохиыи- Рис. 34. Электрохимический механизм
ческого растворения золота в циани- растворения золота в цианистом раст-
стом растворе воре
Возможность такого механизма растворения очень просто и на-
глядно показали Джулиан и Смарт (1921 г.). В сосуд, разделенный на
две части пористой перегородкой, налит раствор, содержащий ионы
CN
-
(рис. 33). В одно из отделений сосуда погружена золотая пла-
стинка, в другое — кусок пирита, соединенные через гальванометр. В мо-
мент замыкания цепи стрелка гальванометра отклоняется от нуля, пока-
зывая прохождение тока во внешней цепи от золота к пириту. Однако
уже после короткого промежутка времени ток в цепи начинает умень-
шаться и скоро почти исчезает. Если теперь через раствор, в который
погружен пирит, пропускать пузырьки воздуха или кислорода, то во
внешней цепи элемента снова возникает ток, который будет протекать
до тех пор, пока пропускается воздух.
Результаты этого опыта хорошо объясняют роль кислорода. На
поверхности золотого электрода происходит освобождение электронов
в результате протекающего здесь окисления золота с образованием
комплексного аииоиа Au(CN)J" . Для устойчивого течения процесса
необходим деполяризатор, поглощающий эти электроны. В роли депо-
ляризатора выступает кислород, восстанавливающийся на поверхности
пирита до перекиси водорода.
По условиям данного опыта механизм растворения золота в таких
условиях заведомо электрохимический, но это еще не доказывает, что и
91

в реальных условиях цианирования процесс растворения является так-
же электрохимическим.
Основное отличие электрохимического механизма от чисто хими-
ческого состоит в том, что общая реакция взаимодействия металла с
реагентами при электрохимической коррозии разделяется на два в
значительной мере самостоятельных процесса (рис. 34):
1) анодный процесс — переход металла в виде ионов в раствор с
освобождением эквивалентного количества электронов;
2) катодный процесс — ассимиляция появившихся избыточных элек-
тронов каким-либо деполяризатором (в нашем случае — кислородом).
Возможность такого разделения общей реакции коррозии обуслов-
лена электронной проводимостью у металла и ионной проводимостью у
раствора. Это обстотельноство позволяет, кроме того, анодным и катод-
ным процессам протекать также и территориально раздельно — на раз-
личных участках поверхности раздела металл — раствор. Пространст-
венное разделение анодного и катодного процессов не обязательно, и в
некоторых случаях оба они осуществляются на одной поверхности,
чередуясь во времени. Однако в большинстве случаев территориальное
разделение анодного н катодного процессов более выгодно в энергети-
ческом отношеннии, так как каждый из них может локализоваться на
тех участках, где их протекание по каким-либо причинам облегчено.
Поэтому дифференциация поверхности металла на анодные и катодные
участки — второе важное отличие электрохимического механизма кор-
розии от чисто химического. Разделение поверхности металла на анод-
ные и катодные участки вызвано неоднородностью этой поверхности в
электрохимическом отношении. Причины такой неоднородности могут
быть самыми различными (электропроводные макро- или микровключе-
ния, неоднородные деформации и внутренние напряжения в металле и
т.д.). Считается, что поверхность даже очень чистого металла все же
неоднородна, так как в кристаллической решетке этого металла всегда
есть дефекты.
Известно, что скорость электрохимического процесса зависит от
потенциала поверхности, на которой этот процесс протекает. Смещение
потенциала в положительную сторону ускоряет анодный процесс и тор-
мозит катодный. Смещение потенциала в отрицательную сторону, наобо-
рот, ускоряет катодный и тормозит анодный процесс. Поэтому сущест-
вование определенной связи между скоростью процесса растворения и
потенциалом металла является дополнительным признаком электрохи-
мического механизма. Следует заметить, что даже при электрохимиче-
ском механизме процесса такая связь все же необязательна. Дело в
том, что для протекания собственно электрохимической реакции (так
же, как и химической) необходимым условием является диффузия реа-
гентов к поверхности металла и диффузия продуктов реакциии в объем
раствора. Если скорость диффузии намного меньше скорости собственно
электродного процесса, то общая скорость процесса будет подчиняться
закономерностям диффузии, рассмотренным нами ранее. Если же ско-
рость диффузии велика по сравнению со скоростью электродной реак-
ции, то общая скорость процесса будет подчиняться законам элек-
трохямической кинетики и, следовательно, зависеть от потенциала ме-
талла.
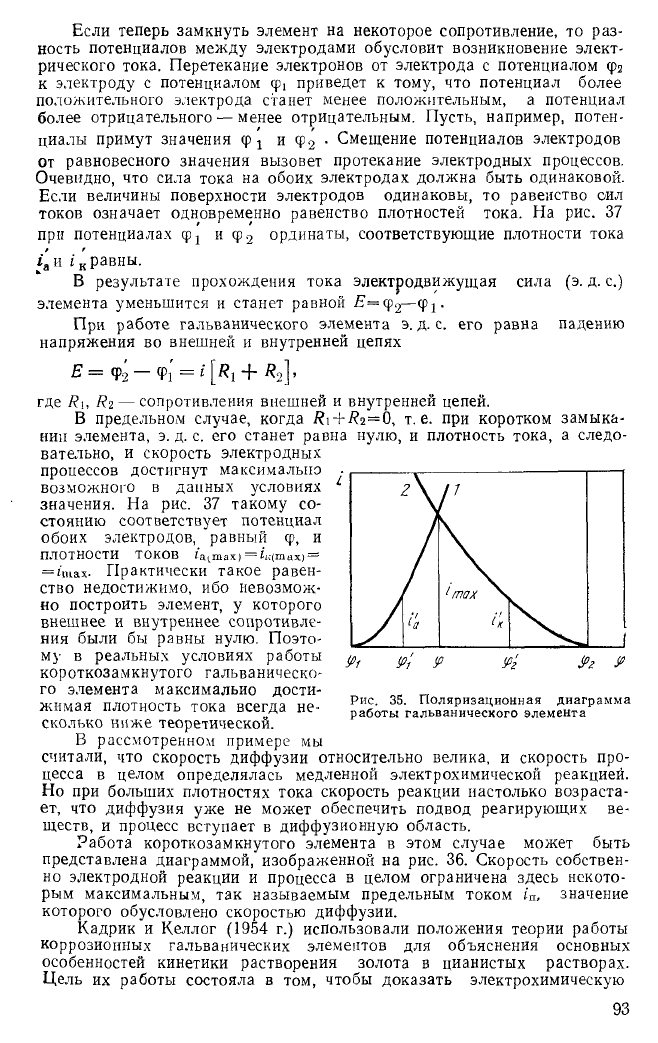
Рассмотрим работу коррозионного гальванического элемента, поль-
зуясь методом поляризационных кривых. Пусть кривые 1 и 2 (рис. 35)
показывают зависимость скоростей i анодного и катодного процессов
от потенциалов электрода ф. Когда внешняя цепь элемента разомкну-
та, потенциалы электродов равны <pi и ф
2
, а э. д. с. элемента максималь-
на:
Етах —
ф2—фь
92
Если теперь замкнуть элемент на некоторое сопротивление, то раз-
ность потенциалов между электродами обусловит возникновение элект-
рического тока. Перетекание электронов от электрода с потенциалом ф
2
к электроду с потенциалом ф! приведет к тому, что потенциал более
положительного электрода станет менее положительным, а потенциал
более отрицательного — менее отрицательным. Пусть, например, потен-
циалы примут значения и ф
2
• Смещение потенциалов электродов
от равновесного значения вызовет протекание электродных процессов.
Очевидно, что сила тока на обоих электродах должна быть одинаковой.
Если величины поверхности электродов одинаковы, то равенство сил
токов означает одновременно равенство плотностей тока. На рис. 37
при потенциалах ф
1
и ф
2
ординаты, соответствующие плотности тока
х
а
и i
к
равны.
В результате прохождения тока электродвижущая сила (э. д. с.)
элемента уменьшится и станет равной Е= ф
2
—ф^
При работе гальванического элемента э. д. с. его равна падению
напряжения во внешней и внутренней цепях
Е =
q>2
— ф{ = i + Д
2
].
где Rь /?2 — сопротивления внешней и внутренней цепей.
В предельном случае, когда + т.е. при коротком замыка-
нии элемента, э. д. с. его станет равна нулю, и плотность тока, а следо-
вательно, и скорость электродных
процессов достигнут максимально
возможного в данных условиях
значения. На рис. 37 такому со-
стоянию соответствует потенциал
обоих электродов, равный ф, и
ПЛОТНОСТИ ТОКОВ I'aimax) =L(max) =
=
i'iuax.
Практически такое равен-
ство недостижимо, ибо невозмож-
но построить элемент, у которого
внешнее и внутреннее сопротивле-
ния были бы равны нулю. Поэто-
му в реальных условиях работы
короткозамкнутого гальваническо-
го элемента максимально дости-
жимая плотность тока всегда не-
сколько ниже теоретической.
В рассмотренном примере мы
считали, что скорость диффузии относительно велика, и скорость про-
цесса в целом определялась медленной электрохимической реакцией.
Но при больших плотностях тока скорость реакции настолько возраста-
ет, что диффузия уже не может обеспечить подвод реагирующих ве-
ществ, и процесс вступает в диффузионную область.
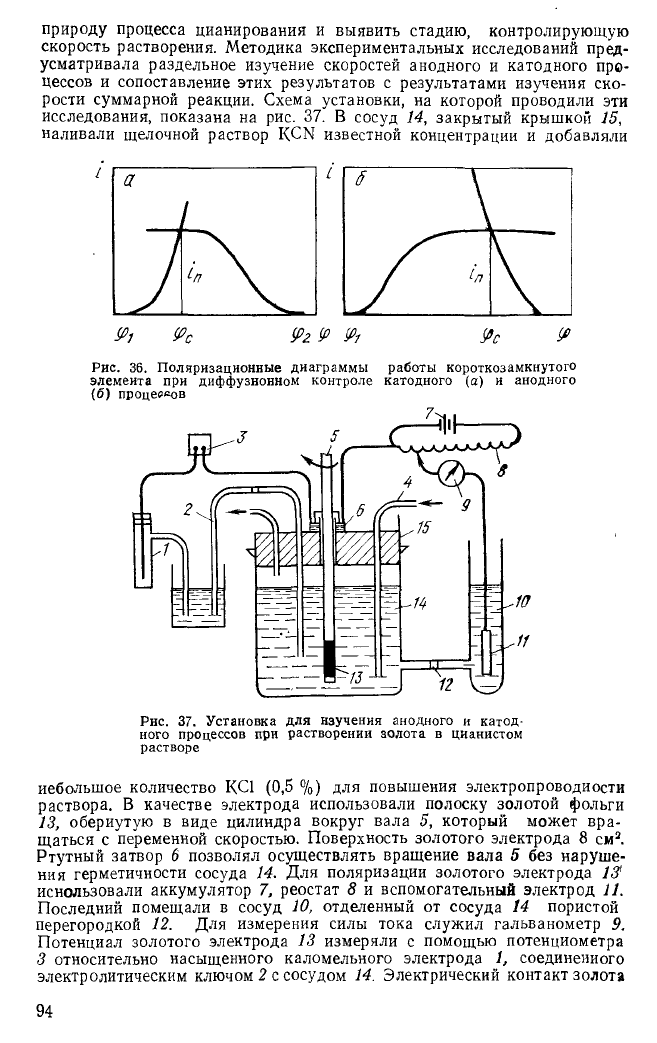
Работа короткозамкнутого элемента в этом случае может быть
представлена диаграммой, изображенной на рис. 36. Скорость собствен-
но электродной реакции и процесса в целом ограничена здесь некото-
рым максимальным, так называемым предельным током <
п
, значение
которого обусловлено скоростью диффузии.
Кадрик и Келлог (1954 г.) использовали положения теории работы
коррозионных гальванических элементов для объяснения основных
особенностей кинетики растворения золота в цианистых растворах.
Цель их работы состояла в том, чтобы доказать электрохимическую
Рис. 35. Поляризационная диаграмма
работы гальванического элемента
93
природу процесса цианирования и выявить стадию, контролирующую
скорость растворения. Методика экспериментальных исследований пред-
усматривала раздельное изучение скоростей анодного и катодного про-
цессов и сопоставление этих результатов с результатами изучения ско-
рости суммарной реакции. Схема установки, на которой проводили эти
исследования, показана на рис. 37. В сосуд 14, закрытый крышкой 15,
наливали щелочной раствор KCN известной концентрации и добавляли
Рис. 36. Поляризационные диаграммы работы короткозамкнутого
элемента при диффузионном контроле катодного (а) и анодного
(б) процессов
растворе
небольшое количество КС1 (0,5 %) для повышения электропроводности
раствора. В качестве электрода использовали полоску золотой фольги
13, обернутую в виде цилиндра вокруг вала 5, который может вра-
щаться с переменной скоростью. Поверхность золотого электрода 8 см
2
.
Ртутный затвор 6 позволял осуществлять вращение вала 5 без наруше-
ния герметичности сосуда 14. Для поляризации золотого электрода 13'
иснользовали аккумулятор 7, реостат 8 и вспомогательный электрод 11.
Последний помещали в сосуд 10, отделенный от сосуда 14 пористой
перегородкой 12. Для измерения силы тока служил гальванометр 9.
Потенциал золотого электрода 13 измеряли с помощью потенциометра
3 относительно насыщенного каломельного электрода 1, соединенного
электролитическим ключом 2 с сосудом 14. Электрический контакт золота
94
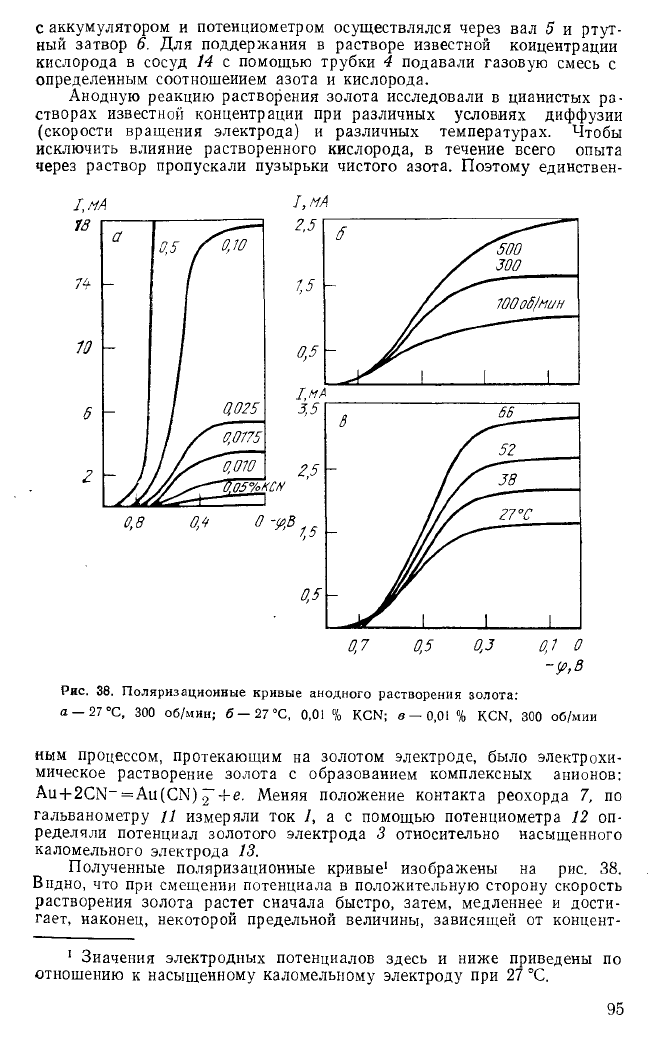
с аккумулятором и потенциометром осуществлялся через вал 5 и ртут-
ный затвор 6. Для поддержания в растворе известной концентрации
кислорода в сосуд 14 с помощью трубки 4 подавали газовую смесь с
определенным соотношением азота и кислорода.
Анодную реакцию растворения золота исследовали в цианистых ра-
створах известной концентрации при различных условиях диффузии
(скорости вращения электрода) и различных температурах. Чтобы
исключить влияние растворенного кислорода, в течение всего опыта
через раствор пропускали пузырьки чистого азота. Поэтому единствен-
-<р,В
Рис. 38. Поляризационные кривые анодного растворения золота:
а- 27 °С, 300 об/мин; б - 27 "С, 0,01 % KCN; в -0,01% KCN, 300 об/мии
ным процессом, протекающим на золотом электроде, было электрохи-
мическое растворение золота с образованием комплексных анионов:
Au+2CN~ = Au(CN) + Меняя положение контакта реохорда 7, по
гальванометру 11 измеряли ток /, а с помощью потенциометра 12 оп-
ределяли потенциал золотого электрода 3 относительно насыщенного
каломельного электрода 13.
Полученные поляризационные кривые
1
изображены на рис. 38.
Видно, что при смещении потенциала в положительную сторону скорость
растворения золота растет сначала быстро, затем, медленнее и дости-
гает, наконец, некоторой предельной величины, зависящей от концент-
1
Значения электродных потенциалов здесь и ниже приведены по
отношению к насыщенному каломельному электроду при 27 °С.
95

рации цианида, интенсивности перемешивания и температуры. Появле-
ние горизонтальных участков на этих кривых обусловлено, тем, что при
высоких плотностях тока скорость собственно электрохимической реак-
ции становится гораздо больше скорости диффузионного подвода ионов
CN
-
к поверхности золотого электрода. Доказательством этого могут
служить следующие признаки, характерные для диффузионного режи-
ма:
1) при постоянных температуре и скорости вращения электрода
значение предельного тока прямо пропорционально концентрации циани-
да (рис. 38, а);
2) при постоянных концентрации цианида и температуре значение
предельного тока возрастает с увеличением частоты вращения электрода
(рис. 38,6);
3) при постоянных концентрации цианида и интенсивности переме-
шивания значение предельного тока очень мало изменяется с темпера-
турой (рис. 38, s), возрастая примерно иа 2,5 % при повышении темпе-
ратуры на один градус; такой температурный коэффициент соответст-
вует энергии активации ~ 15—17 кДж/моль.
Эти результаты показывают, что в зависимости от условий экспери-
мента процесс анодного растворения золота может протекать либо по
электрохимической, либо по диффузионной кинетике. В последнем слу-
чае процесс лимитируется стадией диффузии ионов CN~ к поверхности
золота.
Для снятия катодных поляризационных кривых использовали раст-
вор 0,5 %-иого КС1, не содержащий цианида, но насыщенный кислоро-
дом при заданном парциальном давлении. Поэтому единственным про-
цессом, протекающим на золотом электроде, было электрохимическое
восстановлоние кислорода: V20
2
+ H
2
0= V2H2O2+OH-—е. Соответст-
вующие поляризационные кривые показаны на рис. 39. Видно, что при
значительном смещении потенциала золотого электрода в отрицатель-
ную сторону процесс восстановления кислорода смещается из области
электрохимической кинетики в область диффузионной кинетики, где ско-
рость катодной реакции контролируется скоростью диффузии молекул
растворенного кислорода к поверхности электрода. Признаками диф-
фузионного контроля являются следующие:
1) при постоянных температурах и частоте вращения электрода
значение предельного тока прямо пропорционально парциальному дав-
лению кислорода над раствором и, следовательно, концентрации' кисло-
рода в растворе (см. рис. 39, а);
2) при постоянных температуре и парциальном давлении кислорода
иад раствором предельный ток возрастает с увеличением частоты вра-
щения электрода (см. рис. 39, б);
3) при постоянных давлении кислорода и частоте вращения элект-
рода величина предельного тока увеличивается (см. рис. 39, в) при-
мерно на 2,5 % при повышении температуры на один градус (при усло-
вии, что учитывается снижение растворимости кислорода с повыше-
нием температуры).
Следует заметить, что изменения температуры значительно меньше
влияют на катодный предельный ток, чем на анодный. Это связано с
понижением концентрации кислорода в растворе при повышении тем-
пературы.
Используя полученные кривые анодной и катодной поляризации,
можно определить ожидаемые скорость и потенциал растворения золота
при обычных условиях цианирования в присутствии кислорода (без по-
ляризации от внешнего источника э. д. е.). Для этого необходимо сов-
местить анодные и катодные кривые поляризации. Тогда ордината
96
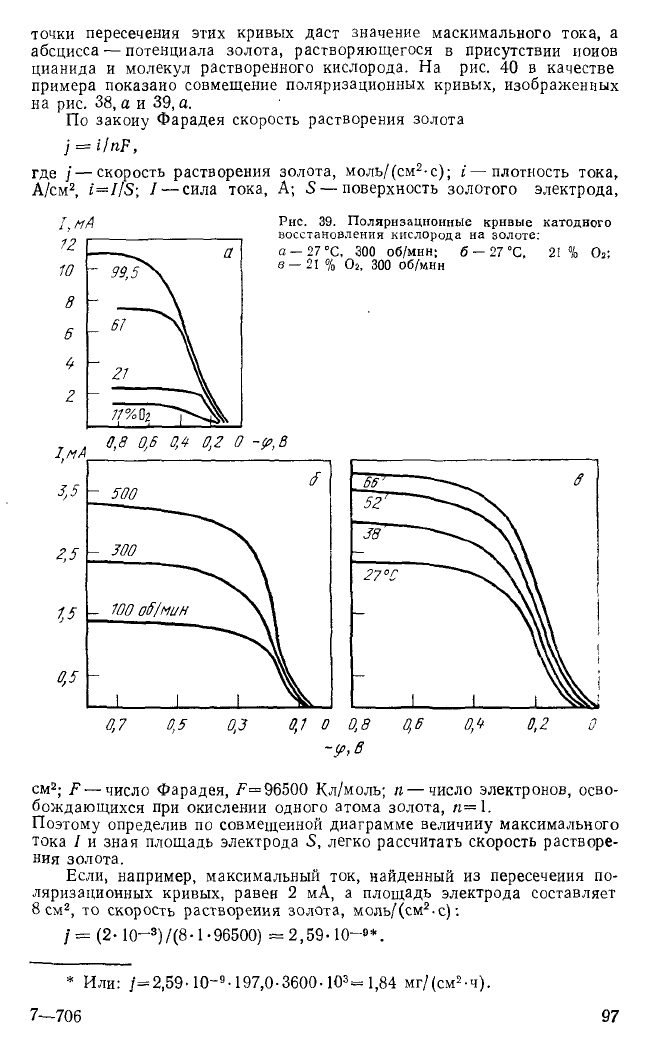
точки пересечения этих кривых даст значение маскимального тока, а
абсцисса — потенциала золота, растворяющегося в присутствии иоиов
цианида и молекул растворенного кислорода. На рис. 40 в качестве
примера показано совмещение поляризационных кривых, изображенных
на рис. 38, а и 39, а.
По закону Фарадея скорость растворения золота
j = UnF,
где / — скорость растворения золота, моль/(см
2
-с); i—плотность тока,
А/см
2
, i=//S; / — сила тока, A; S — поверхность золотого электрода,
1,мА
72
10
1,мА.
3,5
2,5
1,5
0,5
\
а
а — 27
0
в
—214
- * \
0,8 0,5 0,4 0,2 О -<р,В
- 500
S
- 300
-
700 off!'мин
1 1 1
Рнс. 39. Поляризационные кривые катодного
ия кислорода на золоте:
0 об/мнн; 6 — 27 "С, 21 % 0
2
;
0,7 0,5
0.3
см
2
; F — число Фарадея, ^=96500 Кл/моль; п — число электронов, осво-
бождающихся при окислении одного атома золота, п=1.
Поэтому определив по совмещенной диаграмме величину максимального
тока I и зная площадь электрода S, легко рассчитать скорость растворе-
ния золота.
Если, например, максимальный ток, найденный из пересечения по-
ляризационных кривых, равен 2 мА, а площадь электрода составляет
8 см
2
, то скорость растворения золота, моль/(см
2
, с):
/ = (2-10—
3
)/(8 -1-96500) =2,59-10-9*.
* Или: /=2,59-10~
9
-197,0-3600-10
3
= 1,84 мг/(см
2
-ч).
7—706 97
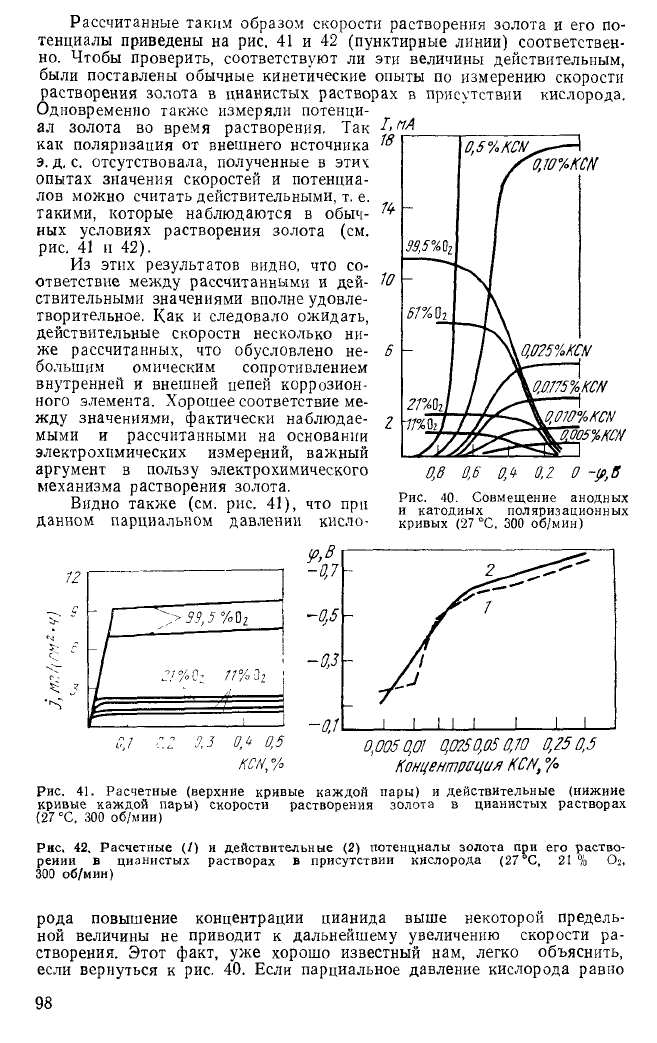
Рассчитанные таким образом скорости растворения золота и его по-
тенциалы приведены на рис. 41 и 42 (пунктирные линии) соответствен-
но. Чтобы проверить, соответствуют ли эти величины действительным,
были поставлены обычные кинетические опыты по измерению скорости
растворения золота в цианистых растворах в присутствии кислорода.
Одновременно также измеряли потенци-
ал золота во время растворения. Так hnA
как поляризация от внешнего источника
э. д. с. отсутствовала, полученные в этих
опытах значения скоростей и потенциа-
лов можно считать действительными, т. е.
такими, которые наблюдаются в обыч-
ных условиях растворения золота (см.
рис. 41 и 42).
Из этих результатов видно, что со-
ответствие между рассчитанными и дей- Ю
ствительными значениями вполне удовле-
творительное. Как и следовало ожидать,
действительные скорости несколько ни-
же рассчитанных, что обусловлено не-
большим омическим сопротивлением
внутренней и внешней цепей коррозион-
ного элемента. Хорошее соответствие ме-
жду значениями, фактически наблюдае-
мыми и рассчитанными на основании
электрохимических измерений, важный
аргумент в пользу электрохимического
механизма растворения золота.
Видно также (см. рис. 41), что при
данном парциальном давлении кисло-
OJO'AKCH
0,025%KCN
0,0775%KCN
p,OW%KCN
-у, Б
Рис. 40. Совмещение анодных
и катодных поляризационных
кривых (27 °С, 300 об/мин)
ОЬ 0,5
KCN
%
0,0050,01 0,0250,050,10 0,250,5
Концентрация KCN,
Рис. 41. Расчетные (верхние кривые каждой пары) и действительные (нижние
кривые каждой пары) скорости растворения золота в цианистых растворах
(27 "С, 300 об/мии)
Рис. 42. Расчетные (/) и действительные (2) потенциалы золота при его раство-
рении в цианистых растворах в присутствии кислорода (27
°С,
21% Ог,
300 об/мин)
рода повышение концентрации цианида выше некоторой предель-
ной величины не приводит к дальнейшему увеличению скорости ра-
створения. Этот факт, уже хорошо известный нам, легко объяснить,
если вернуться к рис. 40. Если парциальное давление кислорода равно
98

0,021 МПа, то при концентрации цианида выше 0,0175 % анодная и
катодная кривые пересекаются в области предельного тока процесса
восстановления кислорода. Следовательно, в этих условиях скорость
процесса в целом контролируется скоростью катодной реакции, кото-
рая в свою очередь определяемся скоростью диффузии кислорода к по-
верхности золота. При концентрации цианида ниже 0,0175 % и том
же парциальном давлении кислорода поляризационные кривые пересе-
каются в области предельного тока процесса ионизации золота. Поэтому
контролирующим фактором в этих условиях будет диффузия ионов
цианида. С повышением парциального давления кислорода величина
предельной концентрации цианида смещается в сторону больших зна-
чений и пропорционально увеличивается максимально достижимая ско-
рость растворения.
Эти выводы вполне аналогичны полученным ранее. Однако рас-
смотрение процесса растворения с позиций работы коррозионного галь-
ванического элемента имеет не только теоретический интерес, но позво-
ляет также сделать некоторые дополнительные важные выводы, которые
не могут быть получены, если рассматривать этот процесс как чисто
химический. В частности, таким образом можно объяснить наблюдаемое
иногда ускорение процесса растворения золота, когда оно находятся
в контакте с другими электропроводными минералами. В этом случае
присутствие постороннего минерала увеличивает катодную поверхность,
на которой происходит восстановление кислорода. При контроле про-
цесса диффузией кислорода это приводит к росту скорости растворения.
§ 4. Факторы, определяющие скорость цианирования
в заводских условиях
Экспериментальные исследования по изучению кинетики
цианирования проводили в условиях, несравненно более
простых, чем реальные. В частности, вместо руды, содержа-
щей золотины разной степени дисперсности и различного
лигатурного состава, в этих опытах использовали образцы
из химически чистых золота и серебра, к тому же правиль-
ной геометрической формы. Цианистые растворы, которые
применяли в этих исследованиях, были абсолютно чистыми,
тогда как в реальных условиях цианирования производст-
венные цианистые растворы, как правило, содержат значи-
тельное количество примесей, существенно влияющих на
ход процесса. Совершенно не учитывалось также присутст-
вие в рудах посторонних минералов, способных взаимодей-
ствовать с цианистыми растворами, вызывая при этом мно-
гообразные побочные явления.
Эти и многие другие отличия не оставляют сомнений в
том, что пользуясь результатами лабораторных кинетичес-
ких исследований, невозможно объяснить все особенности
процесса цианирования золотосодержащих руд в заводских
условиях. Тем не менее отдельные, наиболее важные и
принципиальные моменты цианистого процесса находят
вполне удовлетворительное объяснение на основании этих
исследований.
99

Результаты изложенных выше кинетических исследова-
ний показывают, что при той умеренной интенсивности пе-
ремешивания, которая наблюдалась в этих опытах, процесс
растворения золота и серебра в цианистых растворах носит
диффузионный характер. При высоких концентрациях циа-
нида, когда скорость диффузии ионов CN- относительно ве-
лика, самой медленной стадией растворения является диф-
фузия молекул растворенного кислорода. При низких кон-
центрациях ионов CN
-
диффузия их протекает со скоростью,
меньшей, чем диффузия кислорода, и скорость процесса
ограничена подводом этих ионов к поверхности металла.
Многочисленные исследования, проведенные по циани-
рованию золотосодержащих руд, а также анализ работы
ЗИФ показывают, что и в реальных условиях цианирова-
ния процесс растворения благородных металлов в боль-
шинстве случаев носит диффузионный характер. В связи с
этим все факторы, ускоряющие диффузию, следует рассмат-
ривать как возможные пути интенсификации процесса циа-
нирования.
Скорость диффузии возрастает с повышением скорости
перемешивания. Поэтому, используя интенсивное переме-
шивание, можно достичь значительного увеличения скоро-
сти растворения независимо от того, лимитируется процесс
диффузией ионов CN
-
или диффузией молекул растворен-
ного кислорода. Этот важный вывод широко используют в
практике выщелачивания золотых руд, применяя различно-
го рода аппараты с высокой интенсивностью перемешива-
ния.
При выборе оптимальной концентрации цианида следу-
ет учитывать, что ее величина связана с концентрацией
кислорода в растворе. Так, при 15 °С и парциальном давле-
нии кислорода 0,021 МПа растворимость кислорода состав-
ляет 0,314-10—
6
моль/см
3
, поэтому оптимальная концентра-
ция свободного (не связанного в комплексные соединения)
цианида в соответствии с выражениями (76) и (75) соста-
вит — 0,01% NaCN при растворении золота и —0,02 %
NaCN при растворении серебра. На практике в большин-
стве случаев применяют несколько более крепкие цианис-
тые растворы (0,02—0,05 % NaCN). Это объясняется тем,
что в рабочих цианистых растворах обычно присутствует
значительное количество примесей, снижающих активность
(растворяющую способность) таких растворов. Во многих
случаях в состав золотосодержащих руд входят различные
сопутствующие минералы, способные окисляться с замет-
ной скоростью, в результате чего некоторая доля растворен-
100
