Буценко Л.М., Красінько В.О. Технології мікробного синтезу лікарських засобів: Лабор. практикум
Подождите немного. Документ загружается.

З ацетатним буфером рН 4,7 величина АС у грибних препаратів у
середньому у 1,5 разу вища, ніж при визначенні з фосфатним (рН 4,9), тому
рекомендується брати ацетатний буфер.
Прилади, посуд, реактиви
Пробірки великі; скляні палички; циліндр; ультратермостат; секундомір;
біла фарфорова пластинка;
ацетатний буфер. Для його приготування 1 н. розчин оцтової кислоти
(57,25 мл або 60,12 г льодяної оцтової кислоти у 1 л дистильованої води) і 1 н.
розчин оцтовокислого натрію (136,0 на 1л води) змішати у співвідношенні 1:1
для одержання буфера рН 4,7.
Для одержання буферного розчину рН 6,0 на одну частину розчину
оцтової кислоти необхідно взяти 16 частин 1 н. розчину оцтовокислого натрію;
1 %-й розчин розчинного крохмалю. Для його одержання наважку
крохмалю, яка містить 1 г сухих речовин, потрібно помістити у мірну колбу на
100 мл, додати 25 мл буфера (для грибних препаратів рН 4,7, для аналізу
бактеріальних препаратів рН 6,0) і довести до мітки дистильованою водою;
розчин йоду. Для приготування основного розчину у тарованому
стаканчику з притертою кришкою зважують 4,4 г йодистого калію і 1,4 г
металевого йоду і додають 2 мл дистильованої води. Після розчинення йоду
вміст переносять кількісно у мірну колбу місткістю 100 мл і доводять до мітки
дистильованою водою. Розчин зберігають у темному місці. Основним розчином
йоду можна користуватися протягом 30 діб;
Для приготування робочого розчину йоду до 20 мл основного розчину
йоду у мірній колбі на 100 мл додають 4,4 г йодистого калію і доводять об’єм
до мітки дистильованою водою. Робочий розчин можна використовувати
протягом 6 діб.
Техніка визначення
Необхідно 25 мл субстрату вмістити у широку пробірку, в яку вставлена
скляна паличка. 30 мл води і 30 мл витяжки налити в окремі пробірки,
поставити їх в ультратермостат і витримати на протязі 10 хв при температурі 30
ºС.
Потім у пробірку з крохмалем додати 1 – 25 мл ферментного розчину у
відповідну кількість води так, щоб загальний об’єм реакційної суміші становив
50 мл.
Вміст пробірки перемішати паличкою і відмітити за секундоміром час,
коли була додана витяжка до розчину крохмалю у пробірці, вміщеній в
ультратермостат. Через кожні 60 с паличкою відбирати пробу у вигляді краплі.
Краплю помістити на білу фарфорову пластинку, з’єднати її з краплею
робочого розчину йоду і спостерігати за забарвленням. Реакція розщеплення
крохмалю вважається закінченою, коли йод перестає змінювати забарвлення
при з’єднанні з краплиною забарвленого розчину протягом перших 10 с. Час, за
який відбувається розщеплення крохмалю до продуктів, не забарвлених йодом,
– 10 – 12 хв. В іншому разі аналіз необхідно повторити з більшою чи меншою
кількістю розчину ферменту .
Амілолітична активність ферментних матеріалів
31

АС=
nB
6025,0
од/г або од/мл,
де 0,25 – кількість крохмалю, яка міститься в 25 мл його 1%-го розчину,
г;
60 – перерахунок на одиницю часу, 1 год;
n – кількість ферменту, що бере участь у реакціях, г або мл. Ця величина
визначається з урахуванням концентрації вихідної витяжки і наступного
розведення; B – час, за який пройшло розщеплення крохмалю до не
забарвлених йодом продуктів.
Приклад. Вихідний розчин ферменту приготовано із розрахунку 5 г
культури гриба на 100 мл забуференої води. Культура дуже активна, тому
потрібно додаткове розведення: 20 мл вихідного розчину доведено в мірній
колбі до 50 мл дистильованою водою і звідти на аналіз взято 2 мл, тобто
отримано ланцюг розведень: 5 г – 100 мл – 20 мл – 50 мл – 2 мл.
Для проведення гідролізу 0,25 г крохмалю 2 мл ферментного розчину
останнього розведення потрібно 12 хв. Тоді:
АС=
25,31
520212
1100506025,0
од. АС/г
У даному разі з урахуванням усіх розведень
110050
5202
n
при перерахунку на 1 г вихідної повітряно-сухої культури.
4.2. Ферменти протеолітичного комплексу
Протеолітичні ферменти належать до класу гідролаз, до четвертого
підкласу пептидгідролаз. Це найбільш поширена група ферментів, що
гідролізує пептидні зв’язки в білках і пептидах, а також діє на деякі інші зв’язки
– ефірні, амідні.
Всі пептидгідролази за систематичною класифікацією поділяються на
чотири підпідкласи (умовно – групи):
3.4.1 – -амінопептидаміноацидогідролази (амінопептидази);
3.4.2 – - карбоксіпептидаміноацидогідролази (карбооксіпептидази);
3.4.3 – діпептидгідролази (діпептидази);
3.4.4 – пептидпептидогідролази.
У першу групу (3.4.1) входять ферменти, які гідролізують N-кінцеві
зв’язки в білках і пептидах; у другу (3.4.2) – ферменти, які гідролізують С-
кінцеві зв’язки в білках і пептидах, тобто вказані групи пептидгідролаз є
ферментами екзодії.
Третій підпідклас (3.4.3) розщеплює переважно внутрішні пептидні
зв’язки білка і може бути віднесений до ендопептидгідролаз. Найчастіше
пептидгідролази розглядають як комплекс протеолітичних ферментів або
протеїназ без чіткого розподілу на зазначені систематичні групи.
Протеолітичні ферменти міцеліальних грибів і бактерій є комплексом
протеїназ і пептидаз, специфічність якого залежить від продуцента і умов
культивування.
32

Нині встановлено, що багато мікроорганізмів синтезують різні
протеїнази, які діють у широкому інтервалі рН – від 1,8 до 10,5 й вище.
За характерним рН-оптимумом активності розрізняють три типи
протеїназ: кислі (з оптимумом рН 2,5 – 3,0), нейтральні (оптимум рН 6,0 – 7,5) і
лужні (оптимум рН 8,0 – 11).
Визначення протеолітичної активності (ПС) (модифікований метод
Ансона)
Основою визначення протеолітичної активності є вимірювання кількості
тирозину, який утворився в результаті ферментативного гідролізу білка, з
реактивом Фоліна.
Після дії дослідного ферментного препарату на розчин казеїну білок, що
не розклався, осаджують 5%-ю трихлороцтовою кислотою (ТХО) і у фільтраті
за допомогою колориметричної реакції з реактивом Фоліна визначають
кількість гідролізованого білка, який не осаджується ТХО. Беруть кількість
розщепленого білка, пропорційну кількості тирозину, що міститься у фільтраті.
Одержані значення оптичної густини переводять у мікромолі тирозину за
стандартною кривою, побудованою за чистим тирозином. За одиницю ПС взято
таку кількість ферменту, яка каталізує перехід у неосаджуваний ТХО стан
кількість білка, яка містить 1 мікромоль тирозину, за 1 хв при температурі 30
о
С.
Протеолітичну активність препаратів виражають числом одиниць в 1 г
препарату, а розчинів ферментів числом одиниць в 1 мл розчину.
Техніка визначення
Для визначення протеолітичної активності у дві пробірки наливають по 2
мл розчину казеїну і вміщують в ультратермостат з температурою 30
о
С.
Приблизно через 10 хв, після нагрівання розчину, у кожну з них додають по 2
мл розчину ферменту, струшують і поміщують в ультратермостат для гідролізу
на 10 хв. Через 10 хв у обидві пробірки додають по 4 мл 5% ТХО, щоб
перервати ферментативну реакцію і осадити білки та високомолекулярні
продукти гідролізу. Суміш швидко перемішують і для забезпечення повного
осадження витримують при температурі 30
о
С ще 20 хв. Потім фільтрують
через паперовий фільтр на маленьких воронках у сухі пробірки. Із прозорих
фільтратів відбирають у пробірки по 1 мл, додають по 5 мл 0,5 М розчину
Na
2
CO
3
, перемішують і при безперервному перемішуванні швидко додають по 1
мл робочого розчину реактиву Фоліна. Дають реакційній суміші постояти 20
хв. Розчини набувають блакитного забарвлення, інтенсивність якого
визначають на фотоелектроколориметрі.
Контроль готують, додаючи реагенти у зворотному порядку: до 2 мл
ферментного розчину того самого розведення, що і в досліді, додають 4 мл
ТХО, витримують в ультратермостаті 10хв, а потім вносять 2 мл субстрату.
Через 20 хв витримування в термостаті розчин фільтрують, відбирають у
суху пробірку 1 мл фільтрату, а потім при перемішуванні вносять 5 мл 0,5 М
Na
2
CO
3
та 1 мл робочого розчину реактиву Фоліна. Контрольна проба повинна
мати слабке блакитне забарвлення.
33
Колориметрування здійснюють на ФЕК з червоним світлофільтром
(довжина хвилі 670 нм) в кюветах завтовшки 10 мм. Спочатку визначають
поглинання контролю проти води D
k
, а потім поглинання дослідного розчину
проти води D
0
. Дійсне поглинання розчину становить D
0
– D
k
. Для забезпечення
достоменності аналізу поглинання розчину має бути в межах 0,3...0,6. У
розрахунках використовують середнє значення, одержане із двох паралельних
визначень.
Побудова калібрувальної кривої.
Для розрахунку активності необхідно побудувати калібрувальну криву по
тирозину і обчислити за нею тирозиновий еквівалент, тобто ту оптичну
густину, яку дав би 1 мкМ тирозину в 1 мл. Тирозиновий еквівалент
використовується для обчислення протеолітичної активності.
Для побудови калібрувальної кривої готують розчин тирозину з
концентрацією 10
-3
М. Для цього наважку 182,19 мг чистого тирозину
розчиняють в 1 л 0,2 н. HCl. Із цього вихідного розчину готують подальші
розведення, при цьому беруть 1, 2, 3, 4, 5 мл вихідного розчину у мірну
колбочку місткістю 50 мл і доводять до мітки 0,2 н. HCl. Тоді виготовлені
розчини будуть мати відповідно 0,02; 0,04; 0,06; 0,08; 0,1 мкМ тирозину в 1 мл.
Потім у пробірку вносять по 1 мл стандартних розчинів, додають при
перемішуванні по 5 мл 0,5 М Na
2
CO
3
і 1 мл робочого розчину Фоліна. Глухий
дослід готують так само, але замість розчину тирозину беруть 1 мл
дистильованої води. Через 20 хв після додавання реактивів інтенсивність
утвореного забарвлення вимірюють на фотоелектроколориметрі. Вимірювання
проводять проти глухого досліду з червоним світлофільтром у кюветах з
завтовшки 10 мм. Для більшої точності рекомендується приготувати три
наважки тирозину і провести описаним вище методом три паралельних досліди.
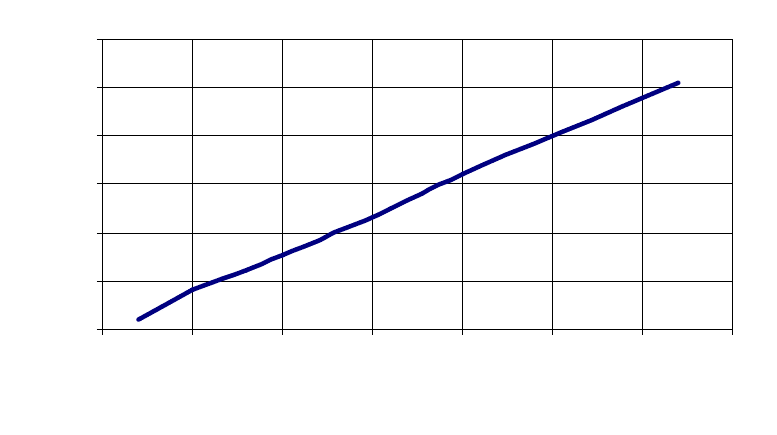
За одержаними даними будують калібрувальний графік, відкладаючи на осі
абсцис кількість тирозину, а на осі ординат – відповідні значення оптичної
густини (рисунок).
0
0,1
0,2
0,3
0,4
0,5
0,6
0 0,05 0,1 0,15 0,2 0,25 0,3 0,35
Вміст тирозину, мкмоль/мл
D
Рис.4.1 . Залежність оптичної густини від концентрації тирозину
34

На основі калібрувального графіка виводять тирозиновий еквівалент
(ТЕ). ТЕ – оптична густина розчину тирозину, який містить 1 мкМ тирозину в 1
мл. На наведеній кривій 0,1 мкМ тирозину дає оптичну густину 0,151, тоді 1
мкМ повинен дати 1,51. Значить ТЕ дорівнює 1,51.
Розрахунок активності. Протеолітичну активність од./г, визначають за
формулою
ПС=
1000
n10ТE
4D
, од/г
де D = D
0
– D
K
– оптична густина; 4 – об’єм реакційної суміші, мл; 10 -
час гідролізу, хв ; n – кількість ферментного препарату, яку взято на протеоліз,
мг у 1 мл ферментного розчину; 1000 – переведення одержаних одиниць на 1 г
ферментного препарату.
Для визначення протеолітичної активності розчину (наприклад,
культуральної рідини), од / мл, користуються формулою,
ПС =
,P
10ТЕn
4D
де n - кількість розчину, взятого на аналіз, мл; Р – розведення
досліджуваного розчину.
Реактиви. Розчин субстрату – 2%-й розчин казеїну. Для його
приготування 2,0 г повітряно-сухого казеїну (вологість 8 – 10 %) заливають 100
мл 1/15 М фосфатного буферу рН 8,0 і нагрівають до повного розчинення осаду
на водяній бані, перемішуючи скляною паличкою. Після охолодження розчину
перевіряють рН потенціометрично і у разі необхідності доводять до значення
8,0 додаванням 1 н. NaOH або 1 н. HCl. Розчин можна зберігати у
холодильнику не більше трьох діб .
2%-й розчин гемоглобіну (субстрат). Для його приготування
наважку 2 г повітряно-сухого гемоглобіну розтирають у ступці з невеликою
кількістю дистильованої води, переносять кількісно у мірну колбу на 100 мл,
підкислюють 0,3 н. HCl до рН 3,0 і об’єм доводять до мітки дистильованою
водою. Розчин необхідно готовити щодня, бо він нестійкий.
0,3 М розчин трихлороцтової кислоти. Для його приготування
беруть наважку 50 г ТХО беруть на технічних терезах, переносять у колбу на 1
л і доводять до мітки дистильованою водою, після чого фільтрують .
Визначення активності лужної протеази ( метод ФОЛП)
Метод розроблено на основі методу Ансона спеціально для визначення
активності лужних протеаз.
За одиницю протеолітичної активності взято таку кількість ферменту, яка
каталізує гідроліз 1 г білка (казеїну) в строго визначених умовах – рН 10,5 і
при температурі 40
о
С, тривалість гідролізу 1 год.
Метод базується на визначенні тирозину, що утворюється в результаті
гідролізу білка, з реактивом Фоліна, як і метод Ансона.
35

Техніка визначення
У дві пробірки заввишки 20 см і діаметром 2 см наливають по 5 мл
субстрату і витримують при температурі 40 ºС в ультратермостаті протягом 10
хв для досягнення розчином зазначеної температури.
Потім у першу пробірку додають 2,5 мл дистильованої води (контроль), а
в другу – 2,5 мл досліджуваного ферментного розчину (дослід). Пробірки
ставлять у термостат з температурою 40 ºС на 1 год.
Після закінчення гідролізу в кожну пробірку додають по 5 мл 0,3 М
розчину ТХО, щоб припинити ферментативну реакцію та осадити
непрогідролізований казеїн. Суміш швидко перемішують і для більш повного
осадження витримують 15 хв при температурі 40 ºС в термостаті. Потім
розчини фільтрують через паперові фільтри і у фільтраті визначають кількість
прогідролізованого білка за тирозином.
Для цього по 2 мл фільтрату наливають у широкі пробірки, повільно
приливають у кожну по 5 мл 0,5М розчину вуглекислого натрію та по 1 мл
робочого розчину реактиву Фоліна, безперервно перемішуючи, витримують в
ультратермостаті при температурі 40
ºС для розвитку забарвлення 30 хв, а потім
фотометрують на ФЕК з довжиною хвилі 656 – 677 нм при використанні кювет
5 мм. Оптичну густину розчинів вимірюють по відношенню до контрольної
проби.
Розрахунок проводять за формулою, виведеною для визначення
протеолітичної активності бактеріальних ферментних препаратів:
1000
n
1,0D7,4
ПС
, од/г або од/мл,
де 4,7 і 0,1 – постійні коефіцієнти, отримані експериментально; D –
оптична густина досліджуваного розчину; n – кількість ферментного препарату
в 2 мл реакційної суміші, мг; 1000 – перерахунок на 1 г препарату.
Приклад розрахунку. На аналіз взято 0,1 г ферментного препарату,
розчинено в 100 мл дистильованої води. Із цього розчину зроблено розведення
– 5 мл до 100 мл, на протеоліз відібрано 2,5 мл. Після додавання ТХО об’єм
реакційної суміші дорівнює 12,5 мл. На визначення тирозину взято 2 мл і
отримано оптичну густину 0,193.
Кількість ферментного препарату в 2 мл фільтрату буде дорівнювати:
г/од505001000
02,0
1,0193,07,4
ПС
мг02,0
5,12100100
25,25100
n
Реактиви
1. Розчин казеїну 1%-й. Для його приготування 2 г (порошку) і вносять у
конічну колбу на 300 мл і приливають 140 мл карбонатно-гідрокарбонатного
буфера рН 10,7. Колбу ставлять на магнітну мішалку і розчин перемішують
протягом 30 хв. Потім, продовжуючи перемішування, колбу з субстратом
вміщують у водяну баню з температурою 70 ºС до повного розчинення,
охолоджують до 40 ºС і при цій температурі доводять рН до 10,5, додаючи 1 М
розчин їдкого натрію.
36
Розчин казеїну кількісно переносять у мірну колбу на 200 мл і додають
карбонатно-гідрокарбонатний буфер до об’єму 180 мл. Потім розчин казеїну
охолоджують проточною водою до температури 20 ºС і об’єм субстрату
доводять до 200 мл тим самим буфером. Розчин зберігають у холодильнику не
більше 3 діб.
2. 0,2 М карбонатно-гідрокарбонатний буфер. Готують його змішуванням
у мірній колбі на 200 мл розчин А – 45 мл, розчину Б – 5 мл, об’єм доводять до
мітки дистильованою водою.
Розчин А – 0,2 М розчин карбонату натрію. Для його приготування
розчиняють 21,2 г карбонату натрію в дистильованій воді, об’єм доводять до 1
л.
Розчин Б – 0,2 М розчин гідрокарбонату натрію. Для його приготування
розчиняють 16,8 г гідрокарбонату натрію в дистильованій воді, об’єм доводять
до 1 л.
3. 1 н. розчин їдкого натрію. Для його приготування 40 г їдкого натрію
розчиняють у дистильованій воді, об’єм доводять до 1 л.
4, 5, 6 – 0,3 М розчин трихлороцтової кислоти (ТХО); 0,5 М розчин
вуглекислого натрію та реактив Фоліна.
7. Робочий реактив Фоліна. Готують розведенням основного розчину
безпосередньо перед аналізом у співвідношенні 1:3.
4.3. -галактозидаза
Лактоза – дисахарид, який складається з глюкози і галактози. Міститься в
молоці і молокопродуктах (близько 4%).
Однією з важливих медичних проблем є корекція дефіциту лактази (-
галактозидази) в організмі людини. Лактаза виробляється у верхньому відділі
тонкого кишечнику і розщеплює лактазу на глюкозу і галактозу, які після цього
легко всмоктуються у кров. Відсутність чи недостатність цього ферменту
призводить до того, що хворі практично позбавлені можливості
використовувати у своєму раціоні молоко і молочні продукти. Використання
екзогенного ферменту лактази може вирішити цю проблему.
Визначення активності -галактозидази (лактази)
Метод ґрунтується на здатності ферменту -галактозидази каталізувати
гідроліз лактози до глюкози і галактози. Глюкоза, що утворюється в процесі
гідролізу, визначається специфічним глюкозооксидним методом.
За одиницю активності -галактозидази взято таку кількість ферменту,
яка каталізує розщеплення 1 мікромоля лактози за 1 хв при температурі 30 ºС і
оптимальному рН (оптимум рН для дріжджової -галактозидази дорівнює 6,9, а
для грибної – 4,2).
Техніка визначення.
Ферментативна реакція гідролізу лактози відбувається у строго
стандартних умовах при температурі 30 ºС і рН 6,9 для дріжджової -
галактозидази або рН 4,2 для грибного ферменту, тривалість реакції 15 хв (за
секундоміром).
37
У пробірку наливають 5 мл субстрату (лактози) і ставлять в
ультратермостат з температурою 30 ºС на 10 – 15 хв для досягнення необхідної
температури. Загальний об’єм реакційної суміші повинен становити 10 мл.
Тому максимальна кількість доданого розчину ферменту становить 5 мл. Якщо
розчину ферменту взято менше, то решту об’єму доливають водою до 5 мл.
Після додавання до субстрату розчину ферменту суміш швидко
перемішують і одразу з реакційної суміші відбирають 1 мл (нульова проба) в
пробірку, яку вміщують у киплячу водяну баню на 3 хв. Основну реакційну
суміш вміщують в ультратермостат при температурі 30 ºС на 15 хв, після чого
відбирають 1 мл реакційної суміші (кінцева проба) і також вміщують у киплячу
баню на 3 хв для припинення дії ферменту.
Після кип’ятіння пробірки швидко охолоджують і додають по 3 мл
робочого реактиву, інтенсивно струшують і залишають при кімнатній
температурі на 30 хв для досягнення інтенсивного забарвлення.
У першій пробірці (нульова проба) розчин безбарвний, у другій (кінцева
проба) – жовтого кольору. Інтенсивність забарвлення кінцевої проби залежить
від кількості глюкози, що утворилася в результаті гідролізу лактози ферментом.
Через 30 хв оптичну густину розчину вимірюють на ФЕК у кюветах
товщиною 10 мм, використовуючи світлофільтр з довжиною хвилі 410 нм
(синій світлофільтр).
Колориметрування проводять, порівнюючи з контрольним розчином, що
складається з 1 мл води та 3 мл робочого реактиву. Отримують два значення
оптичних густин: D
о
– оптична густина нульової проби; D
к
– оптична густина
кінцевої проби.
Кількість глюкози у міліграмах, що відповідає цим оптичним густинам,
знаходять за калібрувальною кривою і вносять у формулу розрахунку.
Побудова калібрувальної кривої
Калібрувальну криву будують за стандартними розчинами глюкози, що
містять від 20 до 300 мкг глюкози в пробі. При цьому до 1 мл розчину глюкози
додають 3 мл робочого реактиву, витримують 30 хв при кімнатній температурі і
потім вимірюють оптичну густину розчинів на ФЕК в умовах, як зазначено
вище. Стандартні розчини глюкози зручно готувати на насиченому розчині
бензойної кислоти (2,7 г/л). Такі розчини можуть зберігатися протягом року.
Ферментативна реакція відбувається пропорційно в інтервалах
концентрацій глюкози від 20 до 150 мкг. Тому надалі для побудови кривої
достатньо двох точок. Калібрувальний графік потрібно будувати окремо для
кожної серії дослідів, бо в такому разі нівелюється відхилення у
температурному режимі, концентрації реактивів і т. ін.
Розрахунок активності. Припустимо, що при проведенні реакції в 1 мл
ферментного розчину міститься одна одиниця ферменту, який розщеплює за 1
хв 1 мікромоль лактози і звільняє 1 мікромоль глюкози, тобто 0,00018 г
глюкози.
Розрахунок активності -галактозидази проводять за формулою
38

)мл/од(г/од
а15018,0
КК
Е
ок
де К
к
та К
о
– кількість глюкози в кінцевій і нульовій пробах, мг; 0,018 –
кількість глюкози, що утворилася під час дії 1 од. ферменту, мг; 15 – тривалість
гідролізу, хв; а – кількість ферменту, взятого на реакцію, г чи мл.
Приклад розрахунку. Для аналізу взято 0,03 г технічного препарату
дріжджової -галактозидази і розчинено в 10 мл буфера. Для реакції взято 1 мл
розчину ферменту.
За калібрувальною кривою одержано значення:
D
о
= 0,04 або 0,02 мг глюкози;
D
к
= 0,927 або 0,135 мг глюкози;
г003,0
10
103,0
а
;
г/од142
003,015018,0
02,0135,0
Е
Реактиви. Розчин субстрату (1%-й розчин лактози): 1 г лактози
розчиняють у буфері і доводять до 100 мл буферним розчином (для грибної -
галактозидази у фосфатно-цитратному буфері рН 4,2, а для дріжджової – у 0,2
н. фосфатному буфері рН 6,9). Розчин може зберігатися у холодильнику
протягом декількох днів;
Фосфатно-цитратний буфер рН 4,2: а) 0,1 М розчин лимонної кислоти
(21, 008 г лимонної кислоти розчиняють у воді і доводять у мірній колбі до 1 л);
б) 0,2 М розчин Na
2
HPO
4
2H
2
O (36,65 г Na
2
HPO
4
2H
2
O розчиняють у воді і
доводять об’єм до 1 л. Для одержання буфера рН 4,2 змішують 11,72 мл
розчину А і 8,28 мл розчину Б (рН перевіряють потенціометрично);
Розбавлений фосфатно-цитратний буфер рН 4,2: Для розчинення
ферментного препарату грибної -галактозидази використовують розбавлений
фосфатно-цитратний буфер рН 4,2, одержаний розведенням вихідного буфера
(2) в 50 разів.
0,2 н. фосфатний буфер рН 6,9: а) 0,2 н. розчин Na
2
HPO
4
12H
2
O (35,81 г
солі розчиняють у воді і об’єм доводять водою до 1 л); б) 0,2 н. розчин
Na
2
HPO
4
2H
2
O (31,2 г солі розчиняють у воді і об’єм доводять водою до 1 л).
Для отримання буфера необхідно змішати 7,5 ч. розчину А і 2,5 ч.
розчину Б (величину рН перевіряють потенціометрично);
розбавлений 0,001 н. фосфатний буфер рН 6,9 з 0,5 % MgCl
2
: 0,2 н. буфер
рН 6,9 (4) розбавляють у 200 разів водою і розчиняють у ньому 5 г на 1 л MgCl
2
.
Використовують для розчинення препарату дріжджової -галактозидази;
0,1 % розчин ферроціаніду калію (жовта кров’яна сіль): Розчин готують у
день визначення або напередодні і зберігають у темній склянці;
0,5 М фосфатний буфер рН 7,5: а) 1 М розчин KH
2
PO
4
: 136,092 г KH
2
PO
4
в 1 л; б) 1 М розчин КОН: 36,11 г КОН в 1 л.
1 М буферний розчин рН 7,5 готують змішуванням рівних об’ємів
розчинів А і Б; 0,5 М буфер отримують розведенням 1 М у два рази водою;
39
Глюкозооксидаза кристалічна; пероксидаза;
Робочий реактив. Для приготування 100 мл робочого реактиву 10 мг
глюкозооксидази і 6 мг пероксидази розчиняють у 66,4 мл 0,5 М калій-
фосфатного буфера рН 7,5 і добавляють до позначки 0,1 % розчином
ферроціаніду калію. Розчин можна зберігати у холодильнику протягом
декількох діб у темній склянці.
4.4. Глюкозооксидаза
Глюкозооксидаза (КФ 1.1.3.4) є аеробною дегідрогеназою, що каталізує
дегідратацію субстрату, тобто відщеплення водню і перенесення його на кисень
повітря з утворенням пероксиду водню. При цьому глюкоза перетворюється в
глюконо-5-лактон, який, приєднуючи воду, перетворюється на глюконову
кислоту. При цьому в реакції утворюється в еквівалентних кількостях пероксид
водню, який розкладається пероксидазою, а виділений при цьому атомарний
кисень окисляє доданий в реакційну суміш барвник, що окислюється (о-
діанізідин, про-толуідин та ін.) На вимірюванні ступеня забарвлення барвника
засноване кількісне визначення глюкози.
Висока специфічність глюкозооксидази робить її дуже цінним реагентом у
дослідженнях з виявлення і кількісного визначення вмісту глюкози в різних
біологічних матеріалах.
Цю властивість використовують для визначення активності
глюкозооксидази манометричним методом за споживанням кисню. Широко
застосовується колориметричний метод визначення активності глюкозоксидази,
заснований на окисленні пероксидазою (допоміжний фермент) допоміжного
субстрату, наприклад о-діанізидину. Це відбувається за участю водню, що
утворюється при дії глюкозооксидази. Інтенсивність забарвлення отриманого
продукту вимірюють на фотоелектроколориметрі.
Визначення активності глюкозооксидази фотоколориметричним
методом
Метод заснований на визначенні швидкості ферментативної реакції за
кількістю глюкози, окисленої до глюконової кислоти під дією глюкозооксидази
в присутності пероксидази. Виділений під дією пероксидази пероксид водню
окисляє хромоген (о-діанізидин) з утворенням забарвленї сполуки,
інтенсивність забарвлення пропорційна кількості окисленої глюкози.
За одиницю глюкозооксидазної активності в даному методі беруть таку
кількість ферменту, що каталізує окислення 1 мкг глюкози за 1 хв в прийнятих
умовах.
Реактиви. 1. Субстратний 0,1% - ний розчин глюкози: 0,1 г глюкози
розчиняють у 50 мл дистильованої води, обсяг отриманого розчину доводять
нею до 100 мл.2. 1 М розчин фосфатного буферу з рН 7,5. 3. 2%-ний розчин о-
діанізидину: 0,5 г о-діанізидину розчиняють в невеликій кількості
дистильованої води, об'єм доводять нею до 25 мл. 4. Робочий розчин: 2 мг
пероксидази розчиняють в 50 мл
дистильованої води, доливають 10 мл
1 М
40
