Братковский Е.В., Заводяный А.В. Высокие технологии в металлургии. Производство цветных металлов
Подождите немного. Документ загружается.

Раздел 3. Металлургия алюминия
3.1 Свойства алюминия и области его применения
Алюминий – серебристо-белый легкий металл.
По производству и потреблению он занимает второе место среди всех металлов
(после железа) и первое место среди цветных металлов.
В периодической системе элементов Д. И. Менделеева он находится в III группе 3-го
периода. Его порядковый номер 13, атомная масса 26,98.
Температура плавления алюминия 660,24
0
С, температура кипения – около 2500
0
С.
Плотность металла 2,7 г/см
3
. Очень пластичен, легко прокатывается в фольгу
толщиной около 0,005 мм.
Хороший тепло- и электропроводник.
Многие физические свойства алюминия существенно изменяются в зависимости от
степени его чистоты. Так, чем чище алюминий, тем выше его температура плавления и
электропроводность и ниже плотность. Однако ряд свойств алюминия можно существенно
улучшить легирующими добавками магния, кремния, меди, цинка, марганца, которые
повышают механические и литейные свойства алюминия и его коррозионную стойкость.
В большинстве химических соединений алюминий трехвалентен, но в определенных
условиях, теряя всего один электрон, он проявляет одновалентное состояние, образуя
соединения низшей валентности (субсоединения). Образование одновалентного алюминия
представляет не только теоретический, но и технологический интерес. С участием
субсоединений могут быть осуществлены процессы выделения алюминия из
электротермических сплавов и его рафинирования.
Поверхность алюминия всегда покрыта плотным слоем Al
2
O
3
, который является
прозрачным и отражает около 90% падающих световых лучей.
Без окисной пленки алюминий обладает большой химической активностью по
отношению к кислороду, галоидам, сере и углероду.
В ряду напряжений алюминий занимает место среди наиболее электроотрицательных
элементов (нормальный электродный потенциал алюминия равен -1,36 В), что делает
невозможным его электрохимическое выделение из водных растворов его солей.
Вследствие высокого сродства к кислороду алюминий восстанавливает оксиды
многих металлов до металлического состояния. При нагреве алюминий легко растворяется в
разбавленных азотной и серной кислотах; холодная азотная кислота его пассивирует.
Алюминий хорошо растворяется в щелочах с образованием алюминатов. В органических
кислотах и в воде он устойчив.
Алюминий в настоящее время находит очень широкое применение в виде чистого
металла, многочисленных сплавов и в виде солей и оксида.
В виде чистого металла алюминий используют для изготовления электрических
проводов и химической аппаратуры, получения фольги, применяемой для упаковки пищевых
продуктов, изготовления электроконденсаторов, отражательных зеркал в телескопах, посуды
для приготовления пищи, разнообразных украшений и декоративных изделий, корпусов
часов и т. д.
Алюминий высокой чистоты широко используют в новейших областях техники -
атомной энергетике, радиотехнике, радиолокации и в качестве плакирующего материала для
защиты металлических поверхностей от воздействия различных химических веществ и
атмосферной коррозии.
Большую роль алюминий играет в производстве стали, где его применяют не только в
качестве раскислителя, но и как легирующую добавку в жароупорные стали, а также при
термитной сварке и в процессах получения ряда цветных металлов методом алюмотермии. В
виде тонкодисперсного порошка - пудры - алюминий используют для жаропрочной окраски
нагревательных печей и декоративной антикоррозионной окраски различных изделий.
41

Значительное количество алюминия применяется в в виде сплавов с кремнием, медью,
магнием, цинком, титаном и другими металлами. Наиболее известные сплавы на
алюминиевой основе: дюралюминий (Al + 3-4%Cu + 0,5Mn + 0,5 Mg) и силумины (Al + Si).
Из дюралюминовых сплавов в основном изготавливают листы, профили, прутки,
проволоку, трубы и заклепки. Листы часто выпускают плакированными чистым алюминием,
что повышает их стойкость к атмосферной коррозии и способствует широкому
использованию в современной авиации в качестве обшивки самолетов.
Из силуминовых сплавов получают фасонные отливки любой конфигурации.
Известны также подшипниковые алюминиевые сплавы на основе систем Аl-Fе, А1-Ni,
А1-Сu.
Важнейшими потребителями алюминия и его сплавов являются авиационная и
автомобильная промышленность, железнодорожный и водный транспорт,
электротехническая и химическая промышленность, машиностроение, строительство.
3.2 Сырье для получения алюминия
Алюминий по распространенности в природе уступает только кислороду и кремнию.
Кларк алюминия равен 8,05, что в пересчете на А1
2
0
3
составляет около 15%. Из-за высокой
химической активности он встречается в природе только в виде химических, соединений.
Известно около 250 минералов, содержащих алюминий. Наиболее распространены в
природе соединения алюминия с кислородом.
Ниже приведен состав алюминиевых минералов, имеющих промышленное значение
или перспективных в будущем (табл. 3).
Важнейшими алюминиевыми рудами в настоящее время являются бокситы, а также
нефелины и алуниты. В перспективе возможно использование бесщелочных
алюмосиликатов (кианитов, каолинов) и некоторых промышленных отходов:
высокоглиноземистых зол, шлаков, хвостов обогащения углей.
Таблица 3 – Алюминиевые минералы, имеющие промышленное значение
минерал химическая
формула
содержание алюминия (в
пересчете на А1
2
0
3
),
%
корунд А1
2
0
3
100,0
диаспор А1
2
0
3
·Н
2
О 85,0
гидраргиллит А1
2
0
3
·3Н
2
О 71,0
кианит А1
2
0
3
·SiO
2
63,0
каолинит А1
2
0
3
·2SiO
2
·2Н
2
О 39,5
алунит K
2
SO
4
·Al
2
(SO
4
)
3
·4Al(OH)
3
37,0
нефелин (Na,K)
2
O·А1
2
0
3
·2SiO
2
32,3-35,9
Из алюминиевых руд, как правило, сначала выделяют глинозем - технический оксид
алюминия, из которого затем получают металлический алюминий. Для производства
глинозема годятся далеко не все горные породы. Возможность использования алюминий
содержащих горных пород в качестве рудного сырья для получения алюминия определяется
технико-экономическими соображениями с учетом применимости известных способов
переработки.
Бокситы являются рудой, наиболее широко используемой алюминиевой
промышленностью. За рубежом практически весь алюминий получают из бокситовых руд. В
нашей стране для производства алюминия используют также нефелины и алуниты.
Химический состав бокситов изменяется в очень широких пределах, как в разных
месторождениях, так и в пределах одного месторождения. Содержание А1
2
0
3
в бокситах
колеблется от 35 до 60 %. По внешнему виду бокситы похожи на глину. Они могут иметь
различные цвета и оттенки - от белого до темно-красного.
42

Важнейшими характеристиками, определяющими качество бокситов, являются
содержание оксида алюминия и кремневый модуль, который выражается отношением
содержания А1
2
0
3
к содержанию SiO
2
. Чем выше кремневый модуль, т. е. чем больше
содержание А1
2
0
3
и меньше SiO
2
, тем выше качество боксита.
3.3 Схема производства алюминия
В свободном состоянии алюминий был выделен химическим путем в 1825. В конце
80-х годов 19 века химические методы получения алюминия были вытеснены
электролитическим способом.
В 1888 г. началось промышленное производство алюминия методом электролиза
глинозема, растворенного в криолитовом расплаве. Этот метод применяется повсеместно до
настоящего времени.
В настоящее время алюминий занимает второе место по производству после железа.
В Советском Союзе промышленное производство алюминия началось только в 30-х
годах 20 века после создания первых в стране электростанций.
Рисунок 18 – Принципиальная технологическая схема получения алюминия
Современная алюминиевая промышленность строится на основе четкого разделения
глиноземных заводов и заводов по производству металлического алюминия. Это связано с
тем, что электролитическое получение алюминия относится к одному из наиболее
энергоемких производств, и размещение таких заводов привязывается к источникам дешевой
электроэнергии гидроэлектростанций. Поэтому большинство алюминиевых заводов
располагается в Сибири.
Производство же глинозема базируется в местах добычи алюминиевой руды.
Технология получения алюминия включает четыре самостоятельных производства
(рис. 18):
43
1) производство глинозема;
2) производство криолита и фтористых солей;
3) производство угольных изделий;
4) производство электролитического алюминия.
Часть электролитического алюминия при необходимости подвергается
дополнительному рафинированию.
Это типовая технологическая схема, применяемая во всем мире. Несмотря на
различия внутри производств, сущность самой схемы остается неизменной.
Каждое из производств, входящих в схему, требует самостоятельного рассмотрения.
В данном пособии не будет рассмотрено производство угольных изделий.
3.4 Производство глинозема
Глинозем – чистый оксид алюминия А1
2
0
3
– является основным исходным
материалом при производстве алюминия электролизом.
Существуют три группы процессов получения глинозема: щелочные, кислотные и
кислотно-щелочные. В настоящее время практически весь глинозем получают щелочными
методами, которые в свою очередь подразделяются на способ Байера, способ спекания и
комбинированный способ.
За рубежом в основном используют способ Байера, в России - и способ Байера, и
способ спекания.
Способ Байера целесообразнее применять при небольшом содержании SiO
2
в сырье
(Al
2
O
3
: SiO
2
> 5-7). При кремневом модуле < 5-7 экономичнее способ спекания.
Способ Байера
Способ Байера относится к щелочным гидрохимическим процессам. В его основе
лежит обратимая реакция
Al(OH)
3
+ NaOH ↔ NaAlO
2
+ 2H
2
O.
Метод основан на выщелачивании, цель которого растворить содержащийся в боксите
глинозем, не растворяя остальные составляющие боксита. В условиях выщелачивания
равновесие реакции идет вправо, т.е. алюминий переходит в раствор в виде алюмината
натрия. В условиях декомпозиции (разложения) растворов равновесие сдвигается влево,
приводя к гидролизу алюминатного раствора с образованием кристаллического осадка
гидроксида алюминия. Таким образом, технологический цикл по щелочи замкнут.
Способ Байера применяют для переработки высококачественных бокситов с
относительно низким содержанием кремнезема. Упрощенная схема производства глинозема
по способу Байера приведена на рисунке 19. Согласно технологии исходный боксит дробят и
затем измельчают. Выщелачивание бокситов проводят в вертикальных автоклавах (рис. 20).
Автоклавы представляют собой стальные сосуды, работающие под давлением до 3 МПа и
температуре до 250
0
С. Такие условия позволяют выщелачивать даже трудные бокситы. В
отечественном производстве применяют автоклавы емкостью 25-72 м
3
, обогреваемые острым
паром (вдуваемым непосредственно в пульпу).
Диаметр автоклава 1,6-2,5 м, высота 13,5-17,5 м.
Выщелачивание проводится и в непрерывном и в периодическом режимах.
44
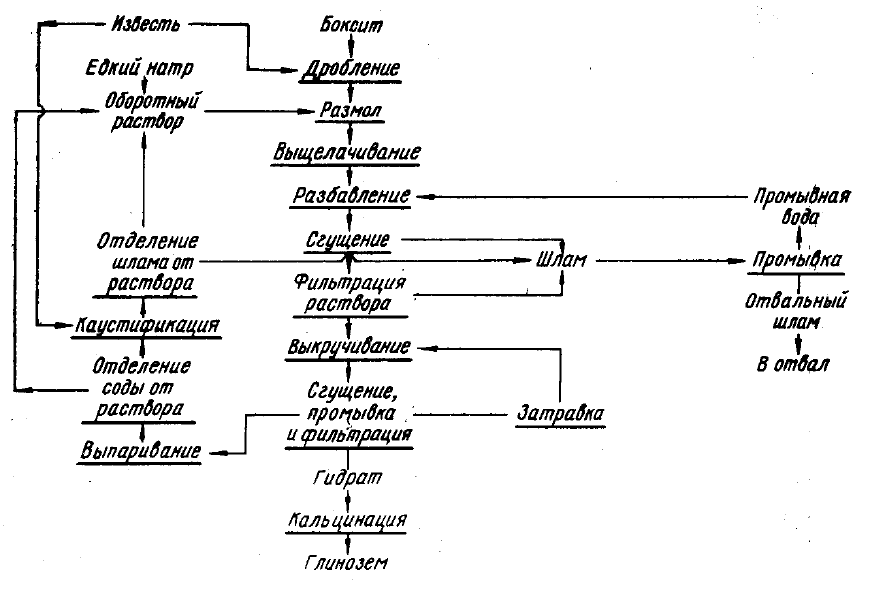
Рисунок 19 – Схема производства глинозема по способу Байера
При периодическом выщелачивании пульпу с начала до конца обрабатывают в одном
автоклаве. Длительность процесса составляет около 3 ч. Более современным является
непрерывное автоматизированное выщелачивание, которое проводится в автоклавных
батареях. В зависимости от технологических требований батарея может объединять 6-10
автоклавов. Общее время пребывания пульпы в автоклавах составляет около 2 ч.
Пульпа, состоящая из алюминатного раствора и красного шлама, затем поступает на
разбавление и далее в отделение сгущения и промывки красного шлама.
Алюминатный раствор после сгущения обрабатывают на фильтрах и отправляют на
разложение (декомпозицию). Цель декомпозиции – кристаллизовать из раствора Al (OH)
3
.
Для осуществления процесса разложения алюминатного раствора его охлаждают и
вводят «затравку» (ранее получение мелкие кристаллы Al (OH)
3
). Для наращивания крупных
кристаллов пульпу перемешивают в течение 50-90 часов.
Процесс проводится в аппаратах, называемых декомпозерами, с механическим или
воздушным перемешиванием. Режим работы аппаратов может быть периодическим или
непрерывным.
Декомпозер с механическим перемешиванием представляет собой стальной бак
высотой и диаметром по 8 м, внутри которого вращается цепная мешалка.
Наиболее совершенными и крупными аппаратами являются декомпозеры с
воздушным перемешиванием (рис. 21).
45

1-зонт; 2-отверстиве для сдува пара; 3-лапы для крепления автоклава; 4-горловина
нижнего днища; 5-теплоизоляция; 6-разгрузочная труба; 7-верхнее днище; 8-отверстие для
манометра; 90-загрузочное отверстие
Рисунок 20 – Вертикальный автоклав
Вместимость декомпозеров с воздушным перемешиванием до 3000 м3. Для
перемешивания пульпы служит циркуляционный аэролифт. Он состоит из двух
концентрически установленных вертикальных труб. По внутренней трубе сверху подают
сжатый воздух. Образуется воздушно-пульповая взвесь, которая сливается через верхний
конец наружной трубы. Декомпозеры с воздушным перемешиванием устанавливаются в
серии по 16-28 аппаратов.
Гидратная пульпа из декомпозеров направляется на сгущение и классификацию.
Годной продукцией считается фракция с размером частиц 40-100 мкм, которую далее
отправляют на кальцинацию. Мелкая фракция используется в качестве «затравки».
Цель кальцинации – термическое обезвоживание гидроксида алюминия по реакции
2Al(OH)
3
→ Al
2
O
3
+ 3H
2
O.
46

1-корпус; 2-аэролифт для перемешивания; 3-транспортный аэролифт; 4-боковая
барботажная трубка; 5-водяные рубашки; 6-люк; 7-разгрузочный клапан; 8-вытяжная труба
Рисунок 21 – Схема декомпозера с воздушным перемешиванием
На практике кальцинацию проводят в трубчатых вращающихся печах длиной 35-110
м, диаметром 2,5-4,5 м. Печи кальцинации имеют наклон 2,5-3% к длине. Скорость вращения
трубы 1-2 об/мин.
На некоторых зарубежных заводах кальцинацию глинозема проводят в печах
кипящего слоя.
При способе Байера извлечение глинозема из бокситов составляет около 87%.
Способ спекания
Способ спекания относится к термическим методам производства глинозема.
Применяется в основном для высокосремнистых руд (SiO
2
> 6-8%) с кремнистым
модулем <5-7, но вообще пригоден для переработки любого алюминиевого сырья.
Сущность способа спекания – образование алюмината натрия при высокой
температуре в результате взаимодействия алюминиевой руды, соды и известняка. В процессе
получают спек, который выщелачивают водой. Затем алюминатный раствор разлагают
47

углекислотой с выделением гидроксида алюминия. При прокаливании гидроксида получают
глинозем.
Схема способа спекания представлена на рисунке 22.
Рисунок 22 – Схема производства глинозема из бокситов по способу спекания
Цель спекания – перевести алюминий руды в форму водорастворимого алюмината
NaAlO
2
и связать кремнезем в малорастворимые кальциевые силикаты. Спекание проводится
в трубчатых вращающихся печах длиной до 185 м и диаметром до 5 м. Печи оборудованы
холодильниками.
Полученный спек на выходе из холодильника дробится до крупности 6-8 мм и
отправляется на выщелачивание. Выщелачивание проводят водой в диффузорах (рис. 23),
перколяторах или трубчатых выщелачивателях.
Диффузоры высотой 5 м и диаметром 1,5 м группируют в батареи по 12-15 шт.
Диффузорная батарея работает по принципу противотока.
Перколяторы и трубчатые выщелачиватели имеют более высокую
производительность, но пока предпочтение отдают диффузорам.
Продуктами выщелачивания являются алюминатный раствор и красный шлам.
Полученный алюминатный раствор загрязнен примесями, особенно кремнеземом. Поэтому
перед осаждением гидроокиси алюминия необходимо провести очистку раствора от
примесей методом обескремнивания.
48

1-крышка загрузочного люка; 2-стальной корпус; 3-гидравлическое устройство для
прижима нижней крышки; 4-ввод растворителя; 5-решетка откидной крышки; 6-крышка
загрузочного люка
Рисунок 23 – Диффузор
На практике обескремнивание растворов осуществляют длительным нагревом без
добавок или в присутствии извести в автоклавах.
Чистые алюминатные растворы подвергают карбонизации, т.е. осаждению гидроксида
алюминия в специальных аппаратах – карбонизаторах (рис. 24). Для этого через
алюминатный раствор пропускают топочные газы печей спекания, содержащие углекислоту
(10-14% СО
2
). Процесс карбонизации протекает быстрее декомпозиции в способе Байера и
завершается в течение 10-12 час.
Карбонизаторы применяют двух типов: цилиндрической и цилиндроконической
формы. Чаще используется аппарат второго типа. Он имеет диаметр цилиндра 11 м, общую
высоту 16 м и емкость 600 м
3
. Газ поступает в коническую часть аппарата через 8
барботеров, расположенных по окружности. Перемешивание пульпы с газом происходит
посредством циркуляционного аэролифта.
После карбонизации пульпу отстаивают, фильтруют. Гидроксид алюминия тщательно
промывают и прокаливают в трубчатых печах для обезвоживания.
49

1-корпус; 2-барботер; 3-центральный аэролифт; 4-транспортный аэролифт; 5-
регулирующая заслонка; 6-вытяжная труба; 7-нижний люк; 8-клапан
Рисунок 24 – Карбонизатор с коническим днищем
Как уже отмечалось выше, способ спекания является более универсальным способом
производства глинозема. Тем не менее, когда качество бокситов позволяет, предпочитают
способ Байера, как более простой и дешевый.
3.5 Производство криолита и фтористых солей
Фтористые соли необходимы для приготовления расплавленного электролита – среды
для растворения и электролиза глинозема. Основным компонентом электролита для
получения алюминия является криолит – двойная соль фтористого натрия и фтористого
алюминия Na
3
AlF
6
(3NaF·AlF
3
). Состав криолита характеризуется криолитовым отношением,
т.е. молярным отношением числа молей фторидов натрия и алюминия. В чистом криолите
криолитовый модуль равен 3, в промышленности электролиты обогащают фторидом
алюминия, поэтому для них величина криолитового модуля колеблется от 2,5 до 2,9.
Криолит встречается в природе, но промышленные месторождения встречаются
только в Гренландии. Поэтому для нужд алюминиевой промышленности криолит и его
составные компоненты получают искусственным путем из плавикового шпата CaF
2
.
Из природного плавикового шпата получают концентрат (до 96% CaF
2
), обычно с
избытком фтористого алюминия.
Криолит и фтористые соли в нашей стране производят кислотным способом. Процесс
осуществляется в две стадии: получение плавиковой кислоты и получение непосредственно
криолита.
Получение HF
Концентрат плавикового шпата смешивают с крепкой серной кислотой и нагревают
до 200
0
С в трубчатых вращающихся печах с целью разложения CaF
2
:
CaF
2
+ H
2
SO
4
= CaSO
4
+ 2HF↑.
50
