Брагина В.И., Брагин В.И. Флотационные методы обогащения
Подождите немного. Документ загружается.


e − заряд иона;
r − радиус иона;
D − диэлектрическая постоянная воды =81.
Если энергия гидратации больше энергии кристаллической решетки, то
происходит растворение минерала.
Образование такой гидратной оболочки означает, что энергия связи
между этим ионом и диполями больше чем между диполями. Гидратация за-
висит от размера и валентности иона и характеризуется энергией или тепло-
той гидратации.
Газовая фаза
В качестве газа в пенной флотации применяют воздух, который состоит
из азота, кислорода и углекислоты. Воздух влияет на свойства поверхности
минерала, а в виде пузырька является подъемной силой.
Внутри пузырька создается избыточное давление − капиллярное давле-
ние, зависящее от поверхностного натяжения воды и размера пузырька, в
частности для шара:
)
11
(
21
RR
P
жг
+=
σ
Чем меньше значение R, тем больше давление:
R
P
жг
σ
2
=
при R = 1,53 × 10
-7
см., T = 10° и σ
жг
= 74 дин/см., Р=1001ат.
Вероятность коалесценции пузырьков зависит от разности давлений в
пузырьках, т. е. от величины:
)
11
(2
21
RR
P
жг
−=∆
σ
,
где R
1
и R
2
– радиусы кривизны двух пузырьков
Твердая фаза
Состав и структура минералов
Структура кристалла − пространственное расположение атомов,
ионов или молекул в кристаллах (анимация рисунок 1.).
Изоморфизм − замещение ионов в кристаллической решетке.
11
Изоморфные вещества − это такие атомы или ионы, которые могут вза-
имно замещается в кристаллической решетке, которая остается формально
без существенных изменений (анимация рисунок 2.).
В кристаллах минералов можно различить − ионные, ковалентные и
Ван-дер-ваальсовые силы связи.
Ионная связь − наиболее простая, встречающаяся в ионных кристаллах.
По своим флотационным свойствам минералы могут быть разделены на
6 групп:
1. Аполярные неметаллические минералы, характеризующиеся несма-
чиваемостью водой (природно-гидрофобные). Флотация аполярными собира-
телями.
2. Самородные металлы и сульфиды тяжелых металлов: медь, свинец,
цинк, никель, железо, золото, серебро. Они смачиваются водой, если их по-
верхность сильно окислена или совсем не окислена и флотируются сульфгид-
рильными собирателями.
3. Окисленные минералы (труднорастворимые) цветных металлов:
медь, свинец, цинк (цирусит, англезит, смитсонит, азурит). Для них необходи-
ма предварительная сульфидизация.
4. Солеобразные минералы труднорастворимых (многовалентных ме-
таллов) кальция, магния, бария, железа. У них преобладает ионный характер
связи. Флотируются они оксигидрильными собирателями.
5. Окислы и силикаты, характерной особенностью этого класса является
ярко выраженная зависимость флотационных свойств от места их залегания.
Это рутил, гематит, хромит, циркон, сподумен, слюды. Они хорошо флотиру-
ются катионными собирателями и некоторые жирнокислотными собирателя-
ми.
6. Растворимые соли щелочноземельных металлов (галит, сильвин).
Они флотируются только в насыщенном растворе. Обычно применяемые реа-
генты не действуют, поэтому используют рартоновые кислоты и катионные
собиратели.
1.1.2. Характер ненасыщенных связей на поверхности минерала и его
взаимодействие с водой
Взаимодействие поверхности минерала с водой во многом зависит от
характера свободных (ненасыщенных) связей, которые имеются на поверхно-
сти минерала.
Атомы, молекулы, ионы или группы ионов, образующие кристалличе-
скую решетку минерала, связаны друг с другом различными видами связей.
Для полярной поверхности минералов характерны ионная и ковалентная
(атомная) связи.
Ионная связь характеризуется электростатическим взаимодействием
между узлами кристаллической решетки, занятыми ионами (например, натрия
12
и хлора в решетке поваренной соли) противоположного знака, образованны-
ми в результате практически полного перехода электронов от атома одного
элемента к атому другого (например, от атома натрия к атому хлора). При
переходе электронов в совместное владение атомами одного и того же эле-
мента образуется ковалентная (атомная) связь, осуществляемая в простейшем
случае парой электронов, причем эти электроны как бы располагаются по от-
ношению к указанным атомам точно посередине. Описанный случай характе-
ризует ковалентную связь в чистом виде.
В противоположность полярной поверхности аполярная поверхность
минерала характеризуется молекулярными силами связи (силы Ван-дер-Ва-
альса: силы притяжения между молекулами относительно малы по сравнению
с химическими), которые слабее ионных и ковалентных в десятки раз.
При разрушении кристалла образуется поверхность раскола с ненасы-
щенными связями, которые характерны для решетки данного минерала.
В случае ионных и атомных связей, существующих вокруг ионов или
атомов минерала и обнажающихся при его разрушении, образуется сильное
электрическое поле, в то время как в случае молекулярных связей поверх-
ностные атомы (молекулы) образуют сравнительно слабые силовые поля.
Оценивая активность взаимодействия с водой поверхности минералов с
преобладанием ионных и атомных связей (сильное поле) или молекулярных
связей (слабое поле), необходимо учитывать, что вода является полярной
жидкостью, молекулы которой имеют значительный дипольный момент и
атомы водорода, способные к образованию водородной связи. Как известно,
водородная связь обязана своим возникновением той особенности атома во-
дорода, что, отдавая свой единственный электрон на образование химической
связи, он остается в виде положительно заряженного ядра (протона), которое,
притягиваясь к электронным оболочкам атомов других элементов, и образует
водородную связь. Водородная связь может быть довольно прочной и являет-
ся как бы второй (побочной) валентностью водородного атома.
Г и др о ф и л ьн а я поверхность минерала характеризуется преобладани-
ем на ней ненасыщенных ионных, атомных или полярных связей, благодаря
которым она активно взаимодействует с молекулами воды (или их комплекса-
ми), присоединяя их. Напротив, г и др о ф о бна я поверхность минерала отли-
чатся преобладанием на ней ненасыщенных молекулярных связей, слабо вза-
имодействующих с водой.
В графите (рис. 1.2.) атомы углерода расположены слоями, образующи-
ми гексагональную сетку. В плоскости этих слоев (заштрихованных) между
атомами углерода имеются сильные атомные связи, однако связь между слоя-
ми осуществляется слабыми молекулярными силами. Этим объясняется лег-
кая раскалываемость графита по плоскости спайности, проходящей между
слоями, и гидрофобность его поверхности, совпадающей с плоскостью
спайности.
13
В противоположность этому плоскость, перпендикулярная плоскости
спайности (торец чешуйки графита), имеющая ненасыщенные атомные силы
связи, активно взаимодействует с водой и является о т н оси т е л ьно г и дро -
ф ил ь н о й . В связи с этим на поверхности торца чешуйки графита пузырек
воздуха будет закрепляться с трудом, тогда как на поверхности, являющейся
плоскостью спайности, пузырек будет закрепляться легко и прочно.
Рис. 1.2. Кристаллическая решетка
графита (заштрихованы плоскости
слоев, образованные атомами углеро-
да)
Аналогичная картина будет наблюдаться и для кристаллов серы: ее гид-
рофобность может быть объяснена тем, что при разрушении кристалла серы в
первую очередь обнажаются слабые межмолекулярные силы, которые связы-
вают между собой кольца из атомов серы, в то время как сильные атомные
связи, действующие внутри колец, при этом не нарушаются (рис. 1.3.)
14

Рис. 1.3. Кольца из атомов серы
(показаны в двух проекциях)
Поверхность минералов способна взаимодействовать не только с водой,
но и с газами, особенно с кислородом, наиболее активным из них. Так, напри-
мер, при разрушении кристаллов сульфидных минералов (например, галени-
та) обнажаются сильные полярные связи, что хорошо объясняет нам относи-
тельную гидрофильность поверхности галенита в момент ее обнажения в
течение короткого времени после этого. Однако спустя некоторое время на
поверхности галенита начинает сорбироваться кислород, всегда присутствую-
щий в воде в растворенном виде. Первичное воздействие кислорода на по-
верхность сульфида вызывает его некоторую гидрофобизацию. Дальнейшее
воздействие кислорода (в случае сульфидов) приводит к их окислению и со-
провождается гидрофилизацией.
Таким образом, естественная гидрофобность минералов, облегчающая
их флотацию, или естественная гидрофильность, препятствующая последней,
являются мерой активности поверхности минерала к взаимодействию с водой
и газами, в особенности с кислородом. Результатом этого взаимодействия в
большинстве случаев является образование на поверхности минерала гидрат-
ной оболочки, толщина которой соответствует по размеру многим тысячам
молекул воды и достигает 0,1 мкм. Гидратные оболочки (о которых подроб-
нее говорится дальше) образуются в тех случаях, когда энергия связи между
диполями воды и поверхностью минерала больше, чем между диполями
воды.
Лекция 3
План лекции:
15
1. Образование двойного электрического слоя на границе раздела
твердое – жидкое [1 с. 26-27]
2. Структурные и генетические особенности минералов [3 с.35-47]
1.1.3. Образование двойного электрического слоя на границе раздела
твердое–жидкое
До сих пор мы рассматривали явление на границе твердое − жидкое, не
принимая во внимание электрические явления.
Однако электрическая характеристика поверхностей раздела флотаци-
онных фаз является очень важным фактором, определяющим протекание про-
цесса флотации.
В результате взаимодействия диполей воды и присутствующих в ней
«неизбежных» ионов последние могут изменять электрическое состояние по-
верхности.
Существенной особенностью этого взаимодействия является появление
на границе раздела вода − минерал двойного электрического слоя, который
характеризуется электрокинетическим потенциалом и емкостью. Мы рассмот-
рим только лишь первые две характеристики.
Энергия взаимодействия молекул воды с различными ионами, находя-
щимися на поверхности минерала, неодинакова. Поэтому одни ионы перехо-
дят в раствор в большем количестве, чем другие. Этот преимущественный
переход в раствор ионов одного знака вызывает нарушение электрического
равновесия на поверхности минералов. Поверхность приобретает заряд, про-
тивоположный по знаку заряду, перешедших в раствор ионов.
По мере того как заряд поверхности будет возрастать, ионам противо-
положного заряда будет все труднее и труднее вырываться из кристалличе-
ской решетки. Часть перешедших в раствор ионов концентрируется в непо-
средственной близости к поверхности и будет уравновешивать ее.
Устанавливается состояние равновесия между раствором и поверхно-
стью минерала, которая будет окружена двойным электрическим (рис. 1.4.)
слоем, структуру которого можно представить следующим образом:
16
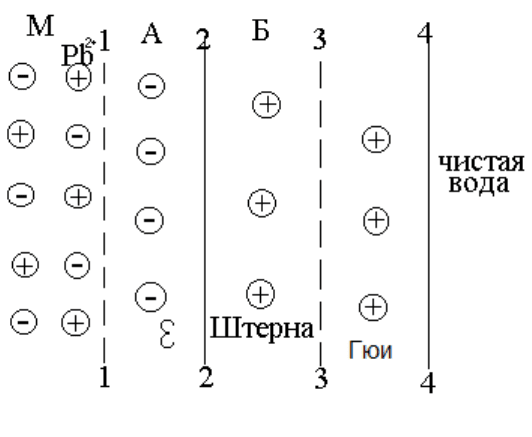
Рис.1.4 Двойной электрический слой
Предположим, что в раствор с внешнего слоя (1–1, 2–2) кристалличе-
ской решетки минерала переходят катионы.
М-минерал. Линия 1-1 является границей неизменной решетки PbS.
Следующий ряд А является как бы продолжением решетки PbS, но из него
удалена часть ионов свинца, поэтому здесь находятся в избытке ионы серы;
которые и создают отрицательный заряд поверхности. Линия 2–2 – является
физической границей минерала. Ряд ионов Б представляет собой упорядочен-
ный слой внешней обкладки, находящейся в жидкости. Линия 3-3 граница
жидкости, тесно связанной с поверхностью минерала. Зона от 3–3 до 4–4 это
диффузный слой ионов. Линия 4–4 граница между раствором и внешней об-
кладкой двойного слоя.
А − внутренняя обкладка двойного слоя. Б − внешняя обкладка или
слой противоионов.
Число катионов во внешней обкладке представляет только часть катио-
нов, перешедших в раствор. Остальные катионы образуют диффузный слой с
постоянно убывающей концентрацией ионов. Ионы, расположенные между
2–2 и 4–4 имеют знак противоположный ионам внутренней обкладки и назы-
ваются противоионами. Слой Б противоионов расположен упорядоченно на
расстоянии радиуса этих ионов, диффузная часть (3 − 3, 4 − 4) − слой Гуи.
Плотная часть двойного электрического слоя, т.е. совокупность вну-
тренней его обкладки и плотной части внешней обкладки – слой Гельмгольца.
При движении частиц минерала в жидкости или наоборот, противоионы
слоя Б плотно связанные с поверхностью будут перемещаться вместе с ней, а
ионы диффузного слоя будут отставать от них. В этом случае между поверх-
ностью минерала с увлеченной пленкой воды и жидкостью в объеме появ-
ляется разность потенциала.
17
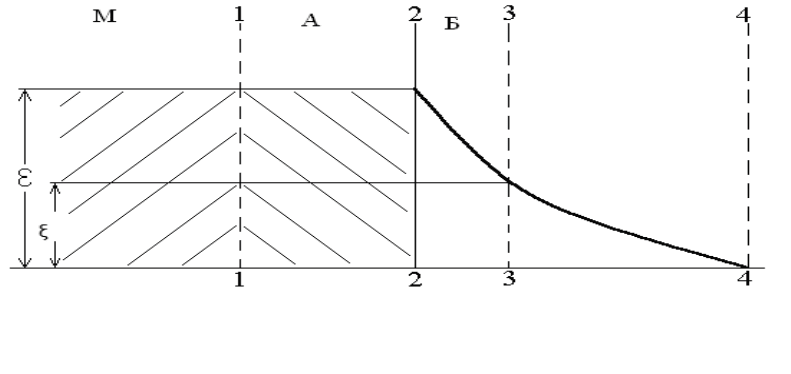
Дзета-потенциал (ξ) называется электрокинетическим или дзета-потен-
циалом. Знак дзета-потенциала зависит от знака заряда внутренней обкладки
двойного слоя. Если в поверхности преобладают катионы, то дзета-потенциал
будет положительным. Если в поверхностном слое наблюдается избыток ани-
онов, то дзета-потенциал имеет отрицательный заряд.
В дистиллированной воде некоторые минералы имеют следующие дзе-
та-потенциалы (в милливольтах):
Пирит −14
Сфалерит – 17
Галенит – 20
Флюорит + 46
Знак заряда поверхности одного и того же минерала в дистиллирован-
ной воде может быть различным. Он зависит от условий образования место-
рождения, от вида преобладающих ионов в растворах.
Рис.1.5. Изменение электрического потенциала в двойном электрическом слое:
М – неизменный слой кристаллической решетки;
А – измененный слой (внутренняя обкладка двойного слоя);
Б – внешняя обкладка двойного электрического слоя
Кроме ξ потенциала существует еще и термодинамический (полный,
электрохимический) потенциал ε, который можно характеризовать как раз-
ность потенциала между внешней обкладкой и внутренней обкладкой по фи-
зической границе минерала. Электрокинетический потенциал всегда меньше
электрохимического и составляет его часть.
Представление о строении двойного электрического слоя дает возмож-
ность понять процесс взаимодействия поверхности минеральных частиц с во-
дой и флотационными реагентами.
Знание механизма действия реагентов необходимо для направления
флотационного процесса и предсказания подачи того или иного реагента.
1.2. СТРУКТУРНЫЕ И ГЕНЕТИЧЕСКИЕ ОСОБЕННОСТИ МИНЕРА-
ЛОВ
18
Неоднородность поверхности минералов
Характерной особенностью минералов, связанной с их генезисом
(происхождением), структурой и во многом определяющих результаты взаи-
модействия минералов с водой и флотационными реагентами, является неод-
нородность их поверхности.
Основой неоднородности поверхности минералов являются уже указан-
ные ранее различия в уровнях свободной поверхностной энергии у различных
граней одного и того же кристалла, которые по этой причине могут обладать
и различной способностью адсорбировать различные соединения из раствора.
Адсорбционная активность поверхностных атомов (ионов) минерала также
различна и зависит от их положения на поверхности. Атомы (ионы), входя-
щие в состав минерала и расположенные в различных участках поверхности,
обладают разной способностью взаимодействовать с реагентами. В соответ-
ствии с этими представлениями установлено, что при взаимодействии кри-
сталлических тел с растворами реакция начиналась на наиболее активных
участках поверхности, а затем уже распространялась на другие менее актив-
ные участки.
Минералообразование является комплексом многочисленных и мало-
изученных сложных физических и физико-химических процессов, последова-
тельность, природа и длительность которых в конечном счете определяют все
наиболее существенные как объемные, так и поверхностные свойства минера-
ла. Распределение структурных элементов в кристаллических решетках дале-
ко не отвечает той классической картине, которая характеризуется строго по-
следовательным расположением в решетке кристалла атомов или ионов.
Важен тот факт, что практически в кристаллической решетке всегда
имеются нарушения стехиометрического состава элементов, характеризуемо-
го формулой минерала. На отдельных участках поверхности кристалла могут
наблюдаться стехиометрические избытки как металла, так и металлоида.
Реальные кристаллы отличаются от идеальных рядом отклонений, кото-
рые принято называть дефектами кристаллической решетки. В решетке реаль-
ного кристалла можно обнаружить незанятые места атомов, атомы, располо-
женные между узлами кристаллической решетки, и другие дефекты.
Примеси и дефекты кристаллической решетки минерала в значительной сте-
пени определяют его электрические и адсорбционные свойства.
Междуузельные ионы металла и пустые металлоидные узлы являются
электроположительными дефектами и местами наиболее благоприятными для
химического закрепления анионов реагента, в то время как междуузельные
металлоидные ионы и пустые металлические узлы представляют электро-
отрицательные дефекты, обладающие противоположными свойствами.
Стехиометрический избыток металлоидов означает преобладание элек-
троотрицательных дефектов, препятствующих химическому закреплению
анионов реагента, а при избытке металла имеет место преобладание электро-
положительных дефектов, благоприятное для закрепления минералом анио-
19
нов реагента. Электроположительные дефекты являются центрами притяже-
ния электронов, электроотрицательные – центрами отталкивания электронов.
Наряду с рассмотренными видами неоднородности поверхности минералов
следует иметь в виду еще и неоднородность, связанную с микрорельефом
(выступы, впадины и тому подобное) минеральной поверхности.
В процессе взаимодействия минералов с реагентами и другими компо-
нентами жидкой фазы пульпы большую роль играют примеси, присутствую-
щие в минерале и изменяющие в той или иной степени электронное состоя-
ние его кристаллической решетки.
Кроме того в процессе минералообразования весьма распространено яв-
ление изоморфизма. Изоморфными веществами называются такие, атомы или
ионы которых могут взаимозамещаться в кристаллических решетках, образуя
твердые растворы.
Изоморфные замещения в кристаллической решетке минералов
Обязательным условием для осуществления изоморфного замещения
является близость размеров замещаемых ионов или атомов, характеризуемых
величиной ионных или атомных радиусов. Однако могут замещаться и груп-
пы разных ионов группами других ионов при условии равенства зарядов.
Замещение ионов происходит особенно легко, если радиусы ионов мало
отличаются друг от друга, причем в ряде случаев различие в величинах ради-
усов могут доходить до 15% и даже несколько больше. Исключения из этого
правила редки. Чаще всего замещаются ионы одинаковой валентности.
При изоморфном замещении ионов кристаллическая решетка формаль-
но остается без существенных изменений. Однако вхождение в решетку вме-
сто ионов меньшей валентности ионов более высокой валентности приводит
к изменению тех свойств минералов, которые непосредственно связаны с
энергией кристаллической решетки, поскольку последняя при этом возраста-
ет: увеличивается твердость и снижается растворимость по сравнению с пер-
воначальным ее значением. При сравнительно редко наблюдаемом замеще-
нии иона более высокой валентности ионом меньшей валентности первона-
чальные свойства минерала изменяются в противоположном направлении.
Влияние совместного нахождения минералов в руде на результаты воз-
действия на них воды и кислорода
Изменения состава и структуры таких минералов, как сульфиды, могут
произойти благодаря воздействию на них кислорода и воды.
Скорость окисления и растворения сульфидов в значительной степени
изменяется, если они присутствуют совместно.
Это объясняется не только воздействием продуктов окисления и раство-
рения одних сульфидов на другие, но и другими причинами.
Схема изменения сульфидных минералов в общем виде следующая.
Наиболее активно в первой стадии сульфиды подвергаются воздействию кис-
20
