Березов Т.Т., Коровкин Б.Ф. Биологическая химия
Подождите немного. Документ загружается.

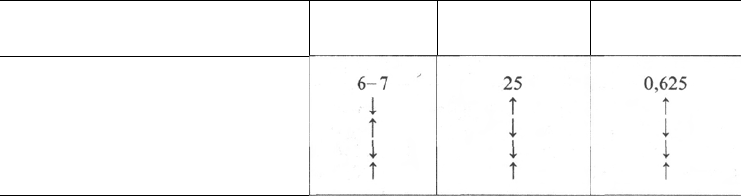
Таблица 17.3. Наиболее простые показатели оценки кислотно-основного равновесия
Сдвиги (изменения) кислотно-
основного равновесия
Норма
Дыхательный ацидоз
Дыхательный алкалоз
Метаболический ацидоз
Метаболический алкалоз
Моча, рН
Плазма,
НСО
3
–
, ммоль/л
Плазма,
Н
2
СО
3
, ммоль/л
В клинической практике изолированные формы дыхательных или мета-
болических нарушений встречаются крайне редко. Уточнить характер этих
нарушений и степень компенсации помогает определение комплекса показа-
телей КОР. В последние десятилетия для изучения показателей КОР широко
используются чувствительные электроды для прямого измерения рН и Р
CO2
крови. В клинических условиях удобно пользоваться приборами типа
«Аструп» или отечественными аппаратами АЗИВ, АКОР. При помощи этих
приборов и соответствующих номограмм можно определить следующие
основные показатели КОР:
1) актуальный рН крови – отрицательный десятичный логарифм кон-
центрации водородных ионов крови в физиологических условиях;
2) актуальное Р
CO2
цельной крови – парциальное давление углекислого
газа (Н
2
СО
3
+ СО
2
) в крови в физиологических условиях;
3) актуальный бикарбонат (АВ) – концентрация бикарбоната в плазме
крови в физиологических условиях;
4) стандартный бикарбонат плазмы крови (SB) – концентрация бикарбо-
ната в плазме крови, уравновешенной альвеолярным воздухом и при
полном насыщении кислородом;
5) буферные основания цельной крови или плазмы (ВВ) – показатель
мощности всей буферной системы крови или плазмы;
6) нормальные буферные основания цельной крови (NBB) – буферные
основания цельной крови при физиологических значениях рН и Р
CO2
альвео-
лярного воздуха;
7) излишек оснований (BE) – показатель избытка или недостатка буфер-
ных мощностей (BB–NBB).
ДЫХАТЕЛЬНАЯ ФУНКЦИЯ КРОВИ
Сущность дыхательной функции крови состоит в доставке кислорода от
легких к тканям и углекислого газа от тканей к легким (табл. 17.4).
Перенос кислорода кровью
Кровь осуществляет дыхательную функцию прежде всего благодаря нали-
чию в ней гемоглобина. Физиологическая функция гемоглобина как пере-
носчика кислорода основана на способности обратимо связывать кислород.
Поэтому в легочных капиллярах происходит насыщение крови кислородом,
а в тканевых капиллярах, где парциальное давление кислорода резко
снижено, осуществляется отдача кислорода тканям.
591
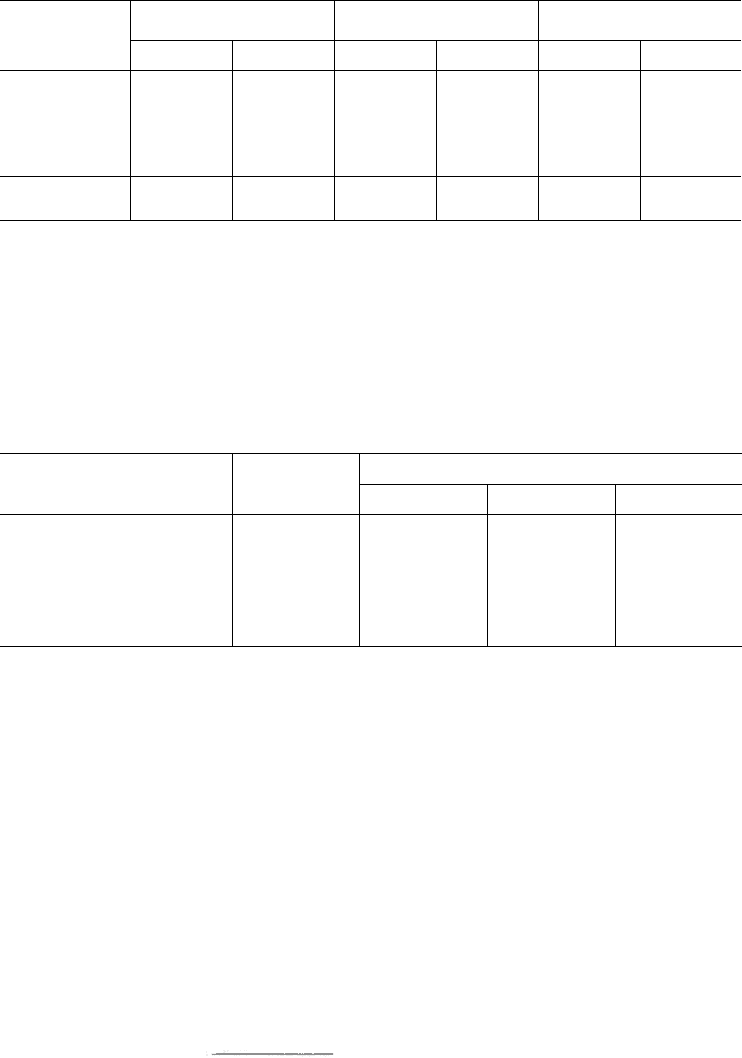
Таблица 17.4. Состав вдыхаемого, альвеолярного и выдыхаемого воздуха (по Уайту
и
др., 1981)
Газ
O
2
СО
2
N
2
Н
2
О
Всего...
Вдыхаемый воздух
Р
(гПа)
210,9
0,4
795,3
6,7
1013,3
об. %
20,95
0,04
79,0
–
99,99
Альвеолярный воздух
Р
(гПа)
134,9
53,3
762,4
62,7
1013,3
об. %
14,0
5,6
80,0
–
99,6
Выдыхаемый воздух
Р
(гПа)
154,9
38,0
757,7
62,7
1013,3
об. %
16,1
4,5
79,2
–
99,8
В состоянии покоя ткани и органы человека потребляют около 200 мл
кислорода в минуту. При тяжелой физической работе количество потреб-
ляемого тканями кислорода возрастает в 10 раз и более (до 2–3 л/мин).
Доставка от легких к тканям такого количества кислорода в виде газа,
физически растворенного в плазме, невозможна вследствие малой раство-
римости кислорода в воде и плазме крови (табл. 17.5).
Таблица 17.5. Коэффициенты абсорбции (растворимости) вдыхаемых газов (в мил-
лилитрах на 1 мл среды при давлении 1013,3 г Па - 760 мм рт. ст.)
Среда
Вода
Плазма
t°C
0
20
40
38
Газ
O
2
0,049
0,031
0,023
0,024
СО
2
1,71
0,87
0,53
0,51
N
2
0,024
0,016
0,012
0,012
Исходя из приведенных в табл. 17.5 данных, а также зная Р
O2
в арте-
риальной крови – 107–120 гПа (80–90 мм рт. ст.), нетрудно видеть, что
количество физически растворенного кислорода в плазме крови не может
превышать 0,3 об. %. При расчете кислородной емкости крови этой
величиной можно пренебречь.
Итак, функцию переносчика кислорода в организме выполняет гемогло-
бин. Напомним, что молекула гемоглобина построена из 4 субъединиц
(полипептидных цепей), каждая из которых связана с гемом (см. главу 2).
Следовательно, молекула гемоглобина имеет 4 гема, к которым может
присоединяться кислород, при этом гемоглобин переходит в оксигемо-
глобин.
Гемоглобин человека содержит 0,335% железа. Каждый грамм-атом
железа (55,84 г) в составе гемоглобина при полном насыщении кислородом
связывает 1 грамм-молекулу кислорода (22400 мл). Таким образом, 100 г
гемоглобина могут связывать
592
0,335•22400
55,84
= 134 мл кислорода,
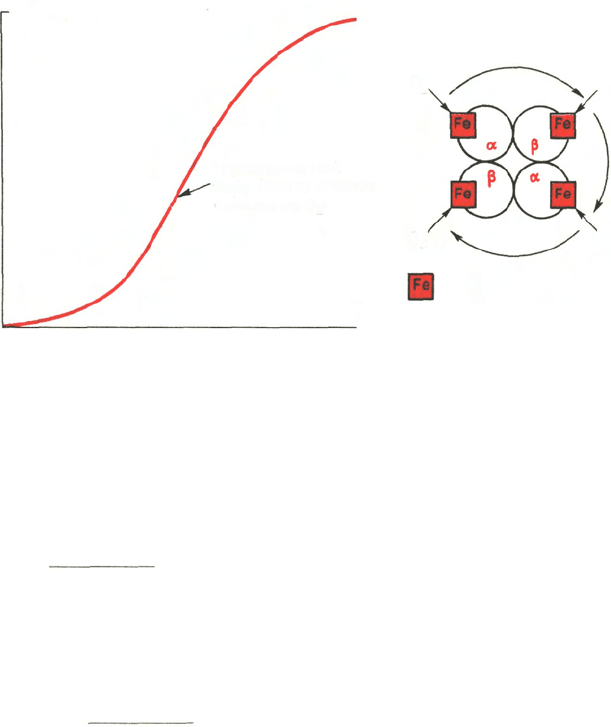
Рис. 17.6. Кривая насыщения гемоглобина кислородом. Объяснение в тексте.
а каждый грамм гемоглобина – 1,34 мл кислорода. Содержание гемогло-
бина в крови здорового человека составляет 13–16%, т.е. в 100 мл крови
13–16 г гемоглобина. При Р
О2
в артериальной крови 107–120 гПа гемогло-
бин насыщен кислородом на 96%. Следовательно, в этих условиях 100 мл
крови содержит 19–20 об. % кислорода:
В венозной крови в состоянии покоя Р
О2
= 53,3 гПа, и в этих условиях
гемоглобин насыщен кислородом лишь на 70–72%, т.е. содержание кисло-
рода в 100 мл венозной крови не превышает
Артериовенозная разница по кислороду * будет около 6 об. %. Таким
образом, за 1 мин ткани в состоянии покоя получают 200–240 мл кислоро-
да (при условии, что минутный объем сердца в покое составляет 4 л).
Возрастание интенсивности окислительных процессов в тканях, напри-
мер при усиленной мышечной работе всегда связано с более полным
извлечением кислорода из крови. Кроме того, при физической работе резко
увеличивается скорость кровотока. Зависимость между степенью насыще-
ния гемоглобина кислородом и Р
О2
, можно выразить в виде кривой насыще-
ния гемоглобина кислородом, или кривой диссоциации оксигемоглобина,
которая имеет S-образную форму и характеризует сродство гемоглобина
к кислороду (рис. 17.6).
Характерная для гемоглобина S-образная кривая насыщения кислоро-
дом свидетельствует, что связывание первой молекулы кислорода одним из
* Артериовенозная разница по кислороду в разных органах далеко не одинакова и зависит
от уровня метаболизма органа. В миокарде она составляет 12, в мозге - 6, в пищеварительном
тракте - 3, в почках - 1,5 об. %.
593
100
Насыщение кислородом,
%
0
Содержание кислорода
Нормальный НbА
α
2
β
2
(кооперативное
связывание О
2
)
Первая
молекула
повышает
повышает
повышает
Гем в гемоглобине
= 19,3 мл кислорода (в среднем 19–20 об. %).
15•1,34•96
100
15•1,34•70
100
= 14,1 мл кислорода (около 14 об. %).
О
2
О
2
О
2
О
2
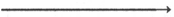
гемов гемоглобина облегчает связывание последующих молекул кислорода
тремя другими оставшимися гемами. Долгое время механизм, лежащий
в основе этого эффекта, оставался загадкой, так как, по данным рентгено-
структурного анализа, 4 гема в молекуле гемоглобина довольно далеко
отстоят друг от друга и вряд ли могут оказывать взаимное влияние.
В последнее время принято следующее объяснение происхождения S-образ-
ной кривой. Считают, что тетрамерная молекула гемоглобина способна
обратимо распадаться на две половинки, каждая из которых содержит одну
α-цепь и одну β-цепь:
При взаимодействии молекулы кислорода с одним из четырех гемов
гемоглобина кислород присоединяется к одной из половинок молекулы
гемоглобина (допустим, к α-цепи этой половинки). Как только такое
присоединение произойдет, α-полипептидная цепь претерпевает конформа-
ционные изменения, которые передаются на тесно связанную с ней β-цепь;
последняя также подвергается конформационным сдвигам. β-Цепь присо-
единяет кислород, имея уже большее сродство к нему. Таким путем
связывание одной молекулы кислорода благоприятствует связыванию вто-
рой молекулы (так называемое кооперативное взаимодействие).
После насыщения кислородом одной половины молекулы гемоглобина
возникает новое, внутреннее, напряженное состояние молекулы гемоглоби-
на, которое вынуждает и вторую половину гемоглобина изменить конфор-
мацию. Теперь еще две молекулы кислорода, по-видимому, по очереди
связываются со второй половинкой * молекулы гемоглобина, образуя
оксигемоглобин.
S-образная форма кривой насыщения гемоглобина кислородом имеет
большое физиологическое значение. При такой форме кривой обеспечивает-
ся возможность насыщения крови кислородом при изменении Р
О2
в доволь-
но широких пределах. Например, дыхательная функция крови существенно
не нарушается при снижении Р
О2
в альвеолярном воздухе со 133,3 до
80–93,3 гПа. Поэтому подъем на высоту до 3,0–3,5 км над уровнем моря не
сопровождается развитием выраженной гипоксемии.
Численно сродство гемоглобина к кислороду принято выражать величи-
ной Р
50
– парциальное напряжение кислорода, при котором 50% гемогло-
бина связано с кислородом (рН 7,4 температура 37°С). Нормальная
величина Р
50
около 34,67 гПа (см. рис. 17.6). Смещение кривой насыщения
гемоглобина кислородом вправо означает уменьшение способности гемо-
глобина связывать кислород и, следовательно, сопровождается повышени-
ем Р
50
. Напротив, смещение кривой влево свидетельствует о повышенном
сродстве гемоглобина к кислороду, величина Р
50
снижена.
Ход кривой насыщения гемоглобина кислородом или диссоциации
оксигемоглобина зависит от ряда факторов. Сродство гемоглобина к кисло-
роду в первую очередь связано с рН. Чем ниже рН, тем меньше способность
гемоглобина связывать кислород и тем выше Р
50
. В тканевых капиллярах
рН ниже (поступает большое количество СО
2
), в связи с чем гемоглобин
* Термин «субъединица» не вполне однозначен в применении к молекуле гемоглобина, так
как она содержит четыре структурных элемента (две α-цепи и две β-цепи), но имеет при этом
только две функциональные субъединицы, а именно две αβ-половинки.
594
ααββ
αβ + αβ
Молекула
гемоглобина
Две половинки молекулы
гемоглобина
легко отдает кислород. В легких СО
2
выделяется, рН повышается и гемо-
глобин активно присоединяет кислород.
Способность гемоглобина связывать кислород зависит также от темпе-
ратуры. Чем выше температура (в тканях температура выше, чем в легких),
тем меньше сродство гемоглобина к кислороду. Напротив, снижение
температуры вызывает обратные явления.
Количество гемоглобина в крови, а также в какой-то мере его способ-
ность связывать кислород (характер кривой диссоциации оксигемоглобина)
несколько меняются с возрастом. Например, у новорожденных содержание
гемоглобина доходит до 20–21% (вместо обычных для взрослого 13–16%).
У человека имеется несколько гемоглобинов, которые образуются в различ-
ном количестве в разные стадии онтогенеза и различаются по своему
сродству к кислороду.
Рассмотрим нарушения дыхательной функции крови при некоторых
патологических состояниях.
Различные формы гипоксии
Гипоксия (кислородное голодание) – состояние, возникающее при недоста-
точном снабжении тканей организма кислородом или нарушении его
утилизации в процессе биологического окисления. Согласно классификации,
предложенной И.Р. Петровым, гипоксии делятся на 2 группы:
1. Гипоксия вследствие понижения Р
О2
во вдыхаемом воздухе (экзоген-
ная гипоксия).
2. Гипоксия при патологических процессах, нарушающих снабжение
тканей кислородом при нормальном содержании его в окружающей среде.
Сюда относятся следующие типы: а) дыхательный (легочный); б) сердечно-
сосудистый (циркуляторный); в) кровяной (гемический); г) тканевый (гис-
тотоксический); д) смешанный.
Гипоксия вследствие понижения парциального давления кислорода во
вдыхаемом воздухе. Этот вид гипоксии возникает главным образом при
подъеме на высоту. Может наблюдаться и в тех случаях, когда общее
барометрическое давление нормальное, но Р
О2
понижено: например, при
аварии в шахтах, неполадках в системе кислородообеспечения кабины
летательного аппарата, в подводных лодках и т.п., а также во время
операций при неисправности наркозной аппаратуры. При экзогенной гипок-
сии развивается гипоксемия, т.е. уменьшается Р
О2
в артериальной крови
и снижается насыщение гемоглобина кислородом.
Гипоксия при патологических процессах, нарушающих снабжение или
утилизацию кислорода тканями. Дыхательный (легочный) тип ги-
поксии возникает в связи с альвеолярной гипервентиляцией, что может
быть обусловлено нарушением проходимости дыхательных путей (воспали-
тельный процесс, инородные тела, спазм), уменьшением дыхательной по-
верхности легких (отек легкого, пневмония и т.д.). В подобных случаях
снижаются Р
О2
в альвеолярном воздухе и напряжение кислорода в крови,
в результате чего уменьшается насыщение гемоглобина кислородом. Обыч-
но нарушается также выведение из организма углекислого газа, и к гипок-
сии присоединяется гиперкапния.
Сердечно-сосудистый (циркуляторный) тип гипоксии наблю-
дается при нарушениях кровообращения, приводящих к недостаточному
кровообращению органов и тканей. Для газового состава крови в типичных
случаях циркуляторной гипоксии характерны нормальные напряжение и со-
595
держание кислорода в артериальной крови, снижение этих показателей
в венозной крови и высокая артериовенозная разница по кислороду.
Кровяной (гемический) тип гипоксии возникает в результате
уменьшения кислородной емкости крови при анемиях, обусловленных
значительным уменьшением эритроцитной массы или резким понижением
содержания гемоглобина в эритроцитах. В этих случаях Р
О2
в венозной
крови резко снижено.
Гемическая гипоксия наблюдается также при отравлении оксидом угле-
рода (образование карбоксигемоглобина) и метгемоглобинообразователя-
ми (метгемоглобинемия), а также при некоторых генетически обусловлен-
ных аномалиях гемоглобина. При образовании карбоксигемоглобина и
метгемоглобина напряжение кислорода в венозной крови и тканях оказыва-
ется значительно пониженным, одновременно уменьшается артериовеноз-
ная разница содержания кислорода.
Тканевый (гистотоксический) тип гипоксии обычно обусловлен
нарушением способности тканей поглощать кислород из крови. Утилизация
кислорода тканями может затрудняться в результате угнетения биологи-
ческого окисления различными ингибиторами, нарушения синтеза фермен-
тов или повреждения мембранных структур клетки. Типичным примером
тканевой гипоксии может служить отравление цианидами. Попадая в орга-
низм, ионы CN
–
активно взаимодействуют с трехвалентным железом, тем
самым блокируя конечный фермент дыхательной цепи – цитохромоксидазу,
в результате чего подавляется потребление кислорода клетками. Иными
словами, при гистотоксической гипоксии ткани не в состоянии извлекать
кислород из тканевых капилляров даже при высоком Р
О2
.
Перенос углекислого газа кровью от тканей к легким
В организме человека, не выполняющего физической работы (состояние
покоя), от тканей к легким каждую минуту переносится примерно 180 мл
углекислого газа. Эту величину легко рассчитать. Если дыхательный коэф-
фициент равен 0,85, то при поглощении тканями в покое 200 мл кислорода
в минуту должно образовываться около 170 мл углекислого газа (200•0,85).
На самом деле величина несколько больше, поскольку количество погло-
щаемого в покое кислорода колеблется от 200 до 240 мл в минуту.
В целом за сутки с вдыхаемым воздухом в организм человека поступает
примерно 600 л кислорода и выделяется в окружающую среду 480 л
углекислого газа (примерно 942,8 г), что соответствует 21,4 моль углекисло-
го газа.
Организм располагает несколькими механизмами переноса СО
2
от
тканей к легким. Часть его переносится в физически растворенном виде.
Растворимость СО
2
в плазме крови в 40 раз превышает растворимость
в ней кислорода, тем не менее при небольшой артериовенозной разнице
Р
СО2
(напряжение СО
2
в венозной крови, притекающей к легким по легочной
артерии, равно 60 гПа, а в артериальной крови – 53,3 гПа) в физически
растворенном виде может быть перенесено в покое 12–15 мл СО
2
, что
составляет 6–7% от всего количества переносимого углекислого газа.
Некоторое количество СО
2
может переноситься в виде карбаминовой
формы. Оказалось, что СО
2
может присоединяться к гемоглобину посред-
ством карбаминовой связи, образуя карбгемоглобин, или карбаминогемо-
глобин (впервые мысль о наличии углекислого газа, непосредственно
связанного с гемоглобином, была высказана И.М. Сеченовым):
596

или
Карбгемоглобин – соединение очень нестойкое и чрезвычайно быстро
диссоциирует в легочных капиллярах с отщеплением СО
2
.
Количество карбаминовой формы невелико: в артериальной крови оно
составляет 3 об. %, в венозной – 3,8 об. % *. В виде карбаминовой формы
из ткани к легким переносится от 3 до 10% всего углекислого газа,
поступающего из тканей в кровь. Основная масса СО
2
транспортируется
с кровью к легким в форме бикарбоната, при этом важнейшую роль играет
гемоглобин эритроцитов.
Как отмечалось, кислотный характер оксигемоглобина выражен значи-
тельно сильнее, чем гемоглобина (константа диссоциации ННbО
2
примерно
в 20 раз больше константы диссоциации ННb). Важно также запомнить, что
поступающий в ткани с кровью оксигемоглобин является более сильной
кислотой, чем Н
2
СО
3
, и связан с катионом калия. Эту калийную соль
оксигемоглобина можно обозначить как КНbО
2
(рис. 17.7). В перифериче-
ских капиллярах большого круга кровообращения гемоглобин эритроцитов
отдает кислород тканям (КНbО
2
—> О
2
+ KHb), его способность связывать
ионы водорода увеличивается. Одновременно в эритроцит поступает про-
дукт обмена – углекислый газ. Под влиянием фермента карбоангидразы **
углекислый газ взаимодействует с водой, при этом образуется угольная
кислота. Возникающий за счет угольной кислоты избыток водородных
ионов связывается с гемоглобином, отдавшим кислород, а накапливающие-
ся анионы НСО
3
выходят из эритроцита в плазму ***:
КНb + Н
2
СO
3
—> К
+
+ НСО
3
–
+ ННb.
В обмен на эти ионы в эритроцит поступают анионы хлора, для которых
мембрана эритроцитов проницаема, в то время как натрий – другой состав-
ной элемент хлорида натрия, содержащегося в крови, остается в плазме.
В итоге в плазме крови повышается содержание бикарбоната натрия
NaHCO
3
.
Этот процесс способствует восстановлению щелочного резерва крови,
т.е. бикарбонатная буферная система находится в довольно тесных функ-
циональных связях с буферной системой эритроцитов.
* Содержание карбаминовой формы СО
2
в венозной крови составляет 1,5-2,0 ммоль/л,
в артериальной - 1,0 ммоль/л.
** Карбоангидраза существует в нескольких молекулярных формах (изоферменты А,
В и С), которые можно разделить при помощи электрофореза.
*** В артериальной крови содержится НСО
3
–
: в плазме - 25,5 ммоль/л, в эритроцитах -
12,7 ммоль/л, в венозной крови - соответственно 26,4 и 13,9 ммоль/л.
597
Гемоглобин
Угольная
кислота
Карбгемоглобин
R—NН
2
+ СO
2
R—NHCOO
–
+ Н
+

Рис. 17.7. Роль системы плазма-эритроцит в дыхательной функции крови (по
Г.Е. Владимирову, Н.С. Пантелеевой).
а - химические процессы в капиллярах легких; б - химические процессы в капиллярах ткани.
В легочных капиллярах, в эритроцитах, происходит процесс вытеснения
угольной кислоты из бикарбоната калия оксигемоглобином:
ННbO
2
+ К
+
+ НCO
3
–
—> КНbO
2
+ Н
2
СO
3
.
Образующаяся угольная кислота быстро расщепляется при участии
карбоангидразы на углекислый газ и воду. Низкое Р
CO2
в просвете альвеол
способствует диффузии углекислого газа из эритроцитов в легкие.
598
Альвеолярное пространство
Плазма
Эритроцит
Карбоан
гидраза
Тканевая
клетка
Тканевая
клетка
Эритроцит
Na-протеинат
Н-протеинат
Карбо-
ангидраза
Карбаминовая
форма
Плазма
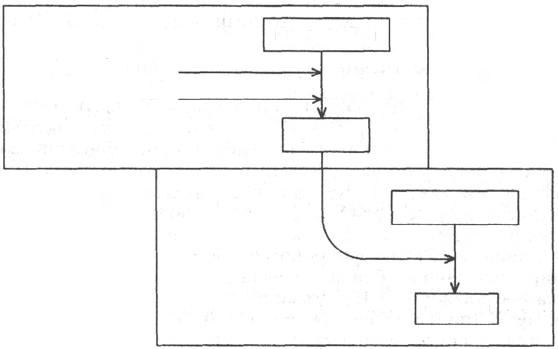
По мере снижения в эритроцитах концентрации бикарбоната из плазмы
крови в них поступают новые порции ионов НСО
3
–
, а в плазму выходит
эквивалентное количество ионов Сl
–
. Концентрация бикарбоната натрия
в плазме крови в легочных капиллярах быстро падает, но одновремен-
но в плазме повышается концентрация хлорида натрия, а в эритро-
цитах свободный гемоглобин превращается в калийную соль оксигемо-
глобина.
Итак, в форме бикарбоната при участии гемоглобина эритроцитов
транспортируется с кровью к легким более 80% от всего количества
углекислого газа.
СИСТЕМА СВЕРТЫВАНИЯ КРОВИ
Способность крови свертываться с образованием сгустка в просвете крове-
носных сосудов при их повреждении была известна с незапамятных времен.
Создание первой научной теории свертывания крови в 1872 г. принадлежит
А.А. Шмидту. Первоначально она сводилась к следующему: свертывание
крови – ферментативный процесс; для свертывания крови необходимо при-
сутствие трех веществ: фибриногена, фибринопластического вещества и
тромбина.
В ходе реакции, катализируемой тромбином, первые два вещества,
соединяясь между собой, образуют фибрин. Циркулирующая в сосудах
кровь не свертывается по причине отсутствия в ней тромбина.
В результате дальнейших исследований А.А. Шмидта и его школы,
а также Моравица, Гаммарстена, Спиро и др. было установлено, что
образование фибрина происходит за счет одного предшественника – фибри-
ногена.
Проферментом тромбина является протромбин, для процесса свертыва-
ния необходимы тромбокиназа тромбоцитов и ионы кальция.
Таким образом, через 20 лет после открытия тромбина была сформули-
рована классическая ферментативная теория свертывания крови, которая
в литературе получила название теории Шмидта–Моравица.
Схематически теория Шмидта–Моравица может быть представлена
в следующем виде:
599
I фаза
Тромбокиназа
Са
2+
Протромбин
Тромбин
II фаза
Фибриноген
Фибрин
Протромбин переходит в активный фермент тромбин под влиянием
тромбокиназы, содержащейся в тромбоцитах и освобождающейся из них
при разрушении кровяных пластинок, и ионов кальция (I фаза). Затем под
влиянием образовавшегося тромбина фибриноген превращается в фибрин
(II фаза). Сравнительно простая по своей сути теория Шмидта–Моравица
в дальнейшем необычайно усложнилась, обросла новыми сведениями,
«превратив» свертывание крови в сложнейший ферментативный процесс.
Современные представления о свертывании крови
При повреждении кровеносного сосуда кровотечение может продолжаться
различное время. Если сосуд небольшой, то кровотечение быстро прекра-
щается, происходит гемостаз. Выделяют 4 фазы гемостаза.
Первая фаза – сокращение поврежденного сосуда.
Вторая фаза – образование в месте повреждения рыхлой тромбоци-
тарной пробки, или белого тромба. Имеющийся в участке повреждения
сосуда коллаген служит связующим центром для тромбоцитов. При агрега-
ции тромбоцитов освобождаются вазоактивные амины, например серото-
нин и адреналин, а также метаболиты простагландинов, например тром-
боксан, которые стимулируют сужение сосудов.
Третья фаза – формирование красного тромба (кровяной сгусток).
Четвертая фаза – частичное или полное растворение сгустка.
Различают три типа тромбов, или сгустков. Белый тромб образуется из
тромбоцитов и фибрина; в нем относительно мало эритроцитов. Формиру-
ется он в местах повреждения сосуда в условиях высокой скорости крово-
тока (в артериях). Второй вид тромбов – диссеминированные отложения
фибрина в очень мелких сосудах (в капиллярах). Третий вид тромбов – крас-
ный тромб. Он состоит из эритроцитов и фибрина. Морфология красного
тромба сходна с морфологией сгустков, образующихся в пробирке. Крас-
ные тромбы формируются in vivo в областях замедленного кровотока при
отсутствии патологических изменений в стенке сосуда или на измененной
стенке сосуда вслед за инициирующей тромбоцитарной пробкой.
Установлено, что в процессе свертывания крови участвуют компоненты
плазмы, тромбоцитов и ткани, которые называются факторами свертыва-
ния крови. Факторы свертывания, связанные с тромбоцитами, принято
обозначать арабскими цифрами (1, 2, 3 и т.д.), а факторы свертывания,
находящиеся в плазме крови,– римскими цифрами (I, II, III и т.д.).
Факторы плазмы крови
Фактор I (фибриноген) – важнейший компонент свертывающей системы
крови, так как биологической сущностью процесса свертывания крови
является образование фибрина из фибриногена. Фибриноген состоит из
3 пар неидентичных полипептидных цепей, которые связаны между собой
дисульфидными связями. Каждая цепь имеет олигосахаридную группу.
Соединение между белковой частью и углеводными компонентами осуще-
ствляется посредством связи остатка аспарагина с N-ацетилглюкозамином.
Общая длина молекулы фибриногена 46 нм, мол. масса 330000–340000.
Синтезируется данный белок в печени, концентрация его в плазме крови
человека составляет 8,2–12,9 мкмоль/л.
Фактор II (протромбин) является одним из основных белков плазмы
крови, определяющих свертывание крови. При гидролитическом расщепле-
600
