Барков Ю.А., Зверев О.М., Перминов А.В. Сборник задач по общей физике
Подождите немного. Документ загружается.

41
Скорость v колеблющейся точки определяем, взяв первую
производную смещения х по времени:
d
ω
cos
ω
d
x
vAt
t
==
.
Учтем, что v
max
= Aω(cosϕ = 1), и подставим это выражение
в уравнение энергии W
к,max
:
22
к,max
ω
.
2
mA
W
=
Найдем амплитуду колебаний
12
ω
W
A
m
= .
Выразим амплитуду через период Т, учитывая что
2π
ω
T
= :
2
2π
Т
W
A
m
= .
Произведем вычисления:
ω = π
с
–1
;
4
2
1210
0,045
3,14 10
A
−
−
⋅
==
м.
2.
Записываем уравнение гармонических колебаний для дан-
ной точки:
х = 0,045sinπt.
3.
Второй закон Ньютона
|F
max
|
= ma.
Ускорение колеблющейся точки найдем, взяв первую произ-
водную скорости по времени:
2
d
ω
sin
ω
.
d
v
aAt
t
==−
42
Максимальное ускорение (при sinωt = 1)
|a
mах
| = Aω
2
.
Запишем выражение силы:
|F
mах
| = mAω
2
.
Произведем вычисления:
F
mах
= 0,01 ⋅ 0,045 ⋅ 3,14
2
Н = 4,44 · 10
–3
Н.
№ 2. Складываются два колебания одинакового направления,
заданные уравнениями:
x
1
= cosπ(t + 1/6),
x
2
= 2cosπ(t +1/2)
(длина в см, время в с). Определить амплитуды, периоды и началь-
ные фазы складывающихся колебаний; написать уравнение резуль-
тирующего колебания.
Р е ш е н и е.
1. Запишем уравнение гармонического колебания в общем виде:
x = A cos
0
2π
φ
.
t
T
+
(1)
2. Приводим заданные уравнения в соответствие с общим
уравнением:
х
1
= A cos
π
π
,
6
t
+
(2)
х
2
= A cos
π
π
.
2
t
+
(3)
3. Сравним уравнения (2) и (3) с (1). Из сравнения:
А
1
= 1 см;
А
2
= 2 см.
2π
t
T
= πt;
2π
t
T
= πt; ⇒ T
1
= 2 c; T
2
= 2 c.
ϕ
01
= π/6 рад = 30°; ϕ
02
= π/2 рад = 90°.
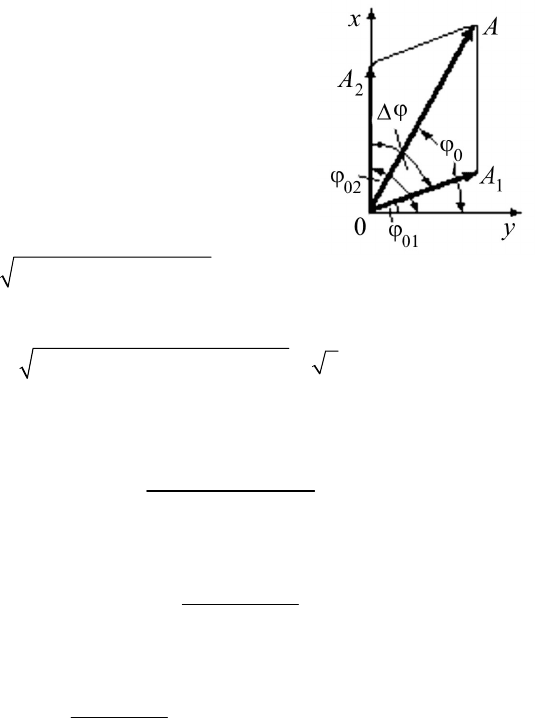
43
Для написания уравнения результирующего колебания необ-
ходимо определить параметры результирующего колебания:
T, А, ϕ
0
.
1. Так как периоды колебаний одинаковы, период результи-
рующего колебания будет тот же:
T = 2c.
2. Для определения амплитуды ре-
зультирующего колебания
А удобно вос-
пользоваться векторной диаграммой. В сис-
теме координат
х0y откладываем под углами,
соответствующими начальным фазам, век-
торы амплитуд
1
А
G
и
2
А
G
. На них, как на сто-
ронах, строим параллелограмм, диагональ
которого и будет амплитудой результирую-
щего колебания. Ее величину определим,
используя теорему косинусов:
А =
22
12 12
2cosφ
.
AA AA++ ∆
Подставим числовые значения:
22
1 2 2 1 2cos(90 30 ) 7 2,6
A =++⋅⋅ °−°== см.
Начальную фазу результирующего колебания определяем
по тангенсу угла ϕ
0
:
112 2
0
112 2
sinφ
sin
φ
tgφ
cosφ
cos
φ
AA
AA
+
=
+
,
откуда начальная фаза
112
11
sinφ
φ
arctg
cos
φ
A
A
A
+
=
.
Подставляем данные:
1sin30 2
φ arctg arctg2,88=71 0,4π
р
ад
.
1cos30
°+
==°=
°
Таким образом, параметры результирующего колебания найдены:
А = 2,6 см; Т = 2 с; ϕ = 0,4π рад.

44
Запишем закон колебания:
2π
2,6cos 0,4π
,
2
xt
=+
или
x = 2,6 cosπ(t + 0,4).
№ 3.
Материальная точка участвует одновременно в двух вза-
имно перпендикулярных гармонических колебаниях, уравнения ко-
торых имеют вид:
x = cosπt, (1)
y = 2cos
π
2
t
(2)
(амплитуда – в см, время – в с).
Определить траекторию точки.
Р е ш е н и е.
Для определения траектории необходимо получить зависи-
мость координат
y = f (x). Для этого из уравнений (1) и (2) следует
исключить время. Применив формулу косинуса половинного угла:
α
1cos
α
cos ,
22
+
=
можно записать
y = 2
π
1cos
π
cos
22
tt
+
=±
.
Так как cosπ
t = x(1),
1
2;
2
x
y
+
=±
у =
22,
x±+
или
y
2
= 2 +2x.
45
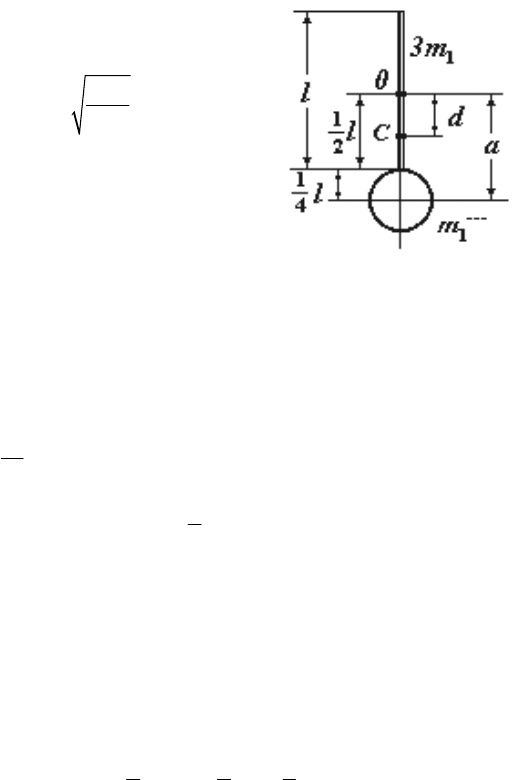
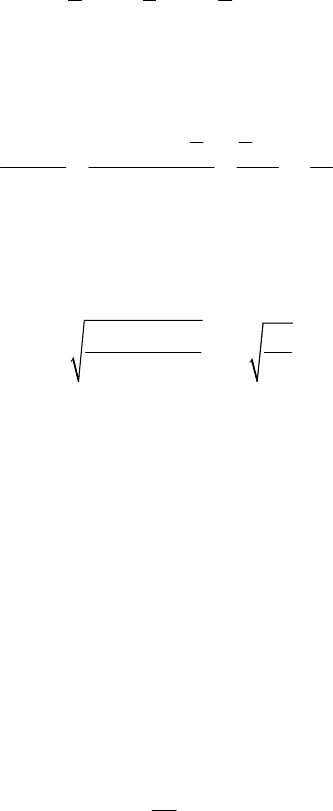
№ 4. Физический маятник представляет собой стержень дли-
ной
l = 1 м и массой 3m
1
с прикрепленным к одному из его концов
обручем диаметром
D = l/2 и массой m
1
. Горизонтальная ось маят-
ника проходит через середину стержня перпендикулярно ему. Оп-
ределить период
T колебаний этого маятника.
Р е ш е н и е.
1. Период колебаний физического
маятника
2π
,
I
T
mgd
= (1)
где
I – момент инерции маятника отно-
сительно оси колебаний;
m – его масса;
d – расстояние от центра масс маятника
(точка
С) до оси колебаний (точка О).
2. Определим момент инерции сис-
темы. Момент инерции маятника равен сумме моментов инерции
стержня
I
1
и обруча I
2
:
I = I
1
+ I
2
. (2)
Момент инерции стержня относительно оси, перпендикуляр-
ной стержню и проходящей через его центр масс, определим по
формуле
2
1
1
.
12
Iml
= В данном случае m = 3m и
2
1
1
.
4
Iml
=
Момент инерции обруча находим по теореме Штейнера:
I
2
= I
0
+ ma
2
,
где
I
2
– момент инерции обруча относительно произвольной оси;
I
0
– момент инерции относительно оси, проходящей через центр
масс обруча параллельно заданной оси;
а – расстояние между ука-
занными осями.
22
2
21 1 1
35
.
448
l
Im ml ml
=+ =
46
Найдем момент инерции системы, подставив выражения
I
1
и I
2
в формулу (2):
222
111
157
.
488
I
ml ml ml=+=
3. Найдем расстояние
d от оси колебаний до центра масс ма-
ятника:
11 1
11 1
33
30
3
44
.
3416
ii
i
mmlm
mx
dll
mmmm
⋅+
== ==
+
∑
∑
4. Определяем период колебаний
Т, подставив в формулу (1)
момент инерции маятника
I, расстояние d, массу системы (m = m
1
+
+ 3
m
1
= 4m
1
):
2
1
1
(7 /8) 7
2π
2
π
,
4 (3/16) 6
ml l
T
mg l g
==
Т = 2,17 с.
№ 5.
Волна распространяется по прямой со скоростью v = 20 м/с.
Две точки, находящиеся на этой прямой на расстоянии l
1
= 12 м
и l
2
= 15 м от источника волн, колеблются по закону синуса с оди-
наковыми амплитудами
А = 0,1 м и с разностью фаз ∆ϕ = 0,75π. Найти
длину волны λ; написать уравнение волны; найти смещение указан-
ных точек в момент времени t = 1,2 с.
Р е ш е н и е.
1. Точки, находящиеся друг от друга на расстоянии, равном
длине волны λ, колеблются с разностью фаз, равной 2π; точки, на-
ходящиеся друг от друга на любом расстоянии ∆l, колеблются
с разностью фаз
∆
∆φ
2
π
λ
l
=
.
47
Решим это уравнение относительно λ:
2π
λ
φ
l
=∆
∆
,
где ∆l – расстояние между точками, равное 3 м.
Подставим значения величин:
2π
λ 3
0,75π
=
= 8 м.
2. Запишем уравнение плоской волны:
s = Asin(ωt – kx),
где k – волновое число 2π/λ,
или s = Asinω(t –
l
v
).
2π
ω
λ
T
vT
=
=
решая систему относительно ω, получаем:
1
2π 2π 20
ω
5
π
c.
λ
8
v
−
⋅
== =
Уравнение волны
s = 0,1sin5π(t –
20
l
).
3. Найдем смещение s, подставляя в это уравнение значения t и l:
s
1
= 0,1sin5π(1,2 – 12/20) = 0,1sin3π = 0;
s
2
= 0,1sin5π(1,2 – 15/20) = 0,1sin2,25π = 1sin0,25π = 0,071 м.
Варианты заданий приведены на стр. 213–249.

48
ГЛАВА 2. МОЛЕКУЛЯРНАЯ ФИЗИКА
И ТЕРМОДИНАМИКА
2.1. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
Любое вещество состоит из огромного числа мельчайших частиц,
сохраняющих все химические свойства данного вещества. Эти мель-
чайшие частицы называются
молекулами. Сами молекулы состоят из
более простых частиц –
атомов. Например, молекула воды Н
2
О состоит
из трех атомов: одного атома кислорода и двух атомов водорода. Если
различного вида молекул известно огромное число (миллионы), то раз-
личных атомов совсем немного. В настоящее время известно 105 раз-
личных видов атомов, причем в природе их встречается 88, а 17 получе-
но искусственным путем. Это атомы так называемых химических эле-
ментов. Размеры молекул и составляющих их атомов чрезвычайно
малы: если представить их в виде шариков, то их радиус имеет числен-
ное значение порядка 10
–10
м. Зато число частиц в веществе очень вели-
ко. В одном грамме воды, например, содержится 3,3·10
22
молекул.
Массы атомов и молекул тоже малы, поэтому их удобнее из-
мерять не в килограммах, а в специальных единицах. Эта единица
называется
атомной единицей массы [а.е.м.]. Согласно современ-
ным измерениям 1 а.е.м. = 1,66·10
–27
кг.
В молекулярной физике удобно использовать понятие
коли-
чества вещества. Единица количества вещества называется молем.
По определению, моль любого вещества – это такое количество ве-
щества, которое содержит столько же молекул (или атомов, если
вещество состоит из одноатомных молекул), сколько их содержится
в 0,012 кг углерода
6
C
12
. Из определения моля следует, что моль
любого вещества состоит из одинакового числа молекул. Это число
называется
числом Авогадро N
A
. Масса одного моля вещества назы-
вается его
молярной массой µ [кг/моль]. Ясно, что µ = m
0
N
A
.Число
молекул в m [кг] вещества
ν
µ
AA
m
NN N
=⋅ = .

49
2.2. ЗАКОНЫ ИДЕАЛЬНОГО ГАЗА
Идеальным газом называется такой газ, в котором силами
взаимодействия
молекул и размерами молекул можно пренебречь.
Время от времени молекулы сталкиваются между собой, но столк-
новения происходят настолько редко, что большую часть времени
молекулы газа движутся равномерно и прямолинейно. Чем более
разряжен реальный газ, тем ближе его свойства к свойствам иде-
ального. Для такого газа оказывается возможным получить зависи-
мость между его макроскопическими параметрами p, V и
Т, рас-
сматривая движение одной молекулы, а затем усредняя это движе-
ние по огромному числу составляющих этот газ молекул.
Задачи на расчет параметров состояния газов можно разде-
лить на две основные группы. К первой следует отнести задачи,
в которых рассматриваются два или несколько состояний газа по-
стоянной массы и к которым, следовательно, применимо уравнение
объединенного газового закона (уравнение Клапейрона):
1
122
12
pV pV
TT
⋅⋅
= .
Вторую группу составляют задачи, в условии которых дана
масса газа или рассматриваются процессы, в которых масса газа
изменяется.
I. Если по условию задачи даны два состояния газа и при пе-
реходе газа из одного состояния в другое его масса не меняется, то для
решения задачи можно рекомендовать следующую последовательность:
1. Составить схему, отметив каждое состояние газа, указать
параметры
р, V, Т, характеризующие эти состояния. Определить из
условия, какой из этих
трёх параметров не меняется. В общем слу-
чае могут изменяться все три параметра.
2. Записать для данных двух состояний уравнение объединен-
ного газового закона. Если какой-либо параметр считается неизмен-
ным, уравнение автоматически переходит в одно из трех уравнений,
выражающих закон Бойля-Мариотта, Гей-Люссака или Шарля.
3. Представить в развернутом виде параметры
р
1
, V
1
, р
2
, V
2
,
выразив
их через заданные величины. Естественно, что речь идет
о параметрах, заданных косвенно (например, V = m/ρ или
р = F/S).

50
4. Записать математически все вспомогательные условия
и решить полученную систему уравнений относительно неизвест-
ной величины.
В задачах на газовые законы рекомендуется пользоваться
только абсолютной температурой и сразу же переводить значения
температуры по шкале Цельсия в значения по шкале Кельвина.
II. Если по условию задачи дано только одно состояние газа
и требуется определить какой-либо параметр этого состояния или
же даны два состояния с разной массой газа, то рекомендуется по-
ступать так:
1. Установить, какие газы участвуют в paссматриваемых
процессах.
2. Для каждого состояния газа составить уравнение Менде-
леева – Клапейрона. Если дана смесь газов, то это уравнение запи-
сывают для каждого компонента. Связь между значением давле-
ний отдельных газов и давлением смеси устанавливается законом
Дальтона.
3. Записать математически дополнительные условия задачи
и решить полученную систему уравнений относительно искомой
величины.
Основные формулы
1. Уравнение Менделеева – Клапейрона (уравнение состояния
идеального газа)
ν .
µ
m
p
VRTRT==
где m – масса газа; µ – молярная масса газа; R – молярная газовая
постоянная; ν – количество вещества;
Т – термодинамическая тем-
пература.
2. Опытные газовые законы, являющиеся частными случаями
уравнения Менделеева – Клапейрона для изопроцессов:
а) закон Бойля-Мариотта (изотермический процесс:
Т = const,
m = const)
pV = const,
