Запорожан В.М., Цегельський М.Р. Гінекологічна патологія: Атлас
Подождите немного. Документ загружается.


3. Шийка матки
69
відмічатися болісність шийки матки при пальпації.
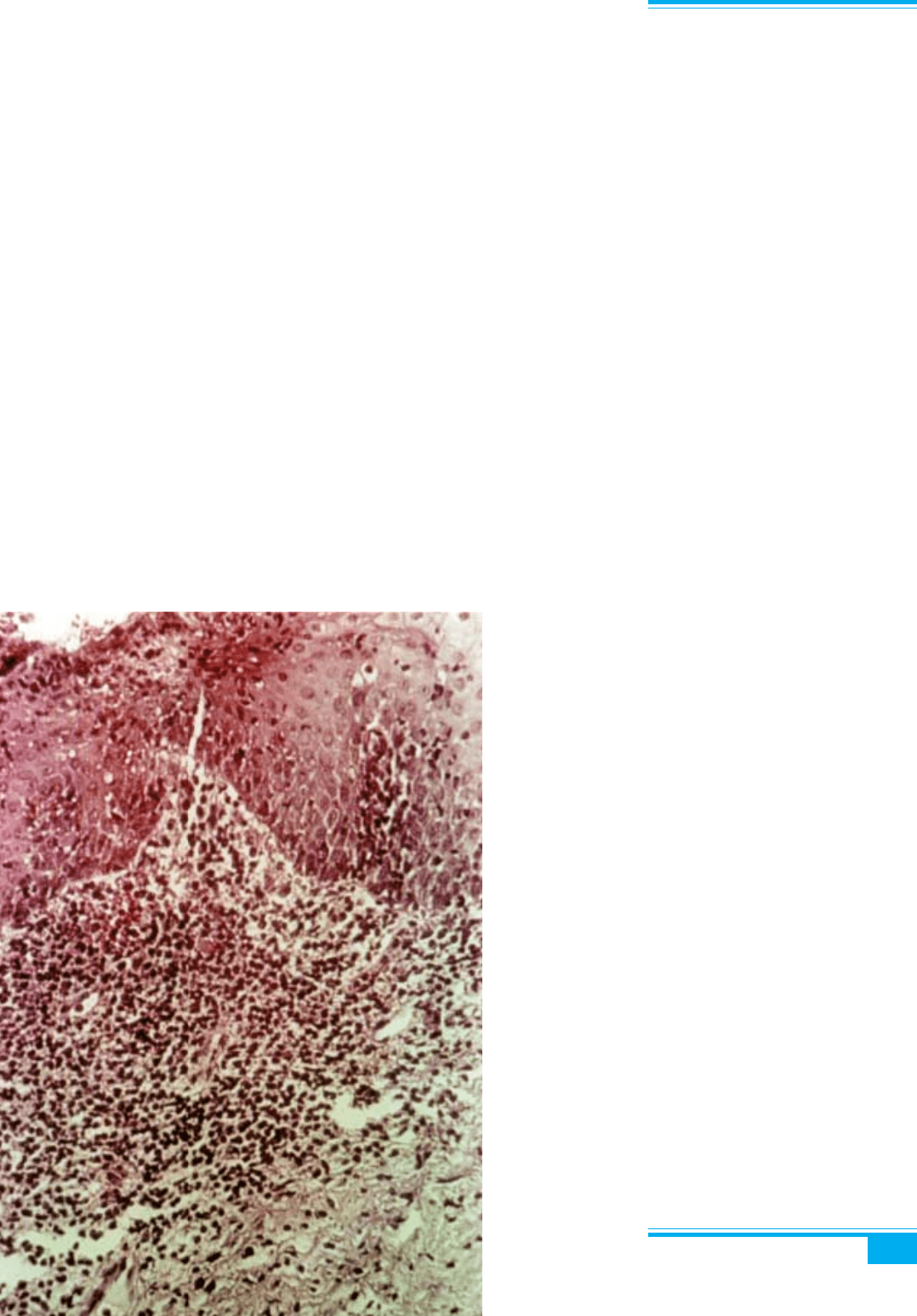
Гістологічні ознаки цервіциту — набряк строми і за-
пальна інфільтрація нейтрофілами; можуть спостеріга-
тися поверхневі ерозії або виразки. Етіологічний діаг-
ноз підтверджується результатами бактеріоскопічного
дослідження вологих мазків, бактеріологічної, імуно-
гістохімічної і, за необхідності, культуральної діагно-
стики та інших методів.
Хронічний цервіцит часто помилково сприймаєть-
ся за ектопію циліндричного епітелію на екзоцервіксі
(так звану ерозію), може бути причиною диспластич-
них змін епітелію шийки матки. Клінічними ознаками
хронічного цервіциту є гіперемія, набряк слизової обо-
лонки шийки матки, наботові кісти (ovulae Nabothii),
тривалі слизово-гнійні виділення.
Гістологічне дослідження: ознаками хронічного
цервіциту є набряк, інфільтрація підслизового шару
шийки матки лімфоцитами, поліморфноядерними лей-
коцитами, моноцитами і плазматичними клітинами,
ушкодження і десквамація епітелію, формування
поліпів шийки матки (рис. 3.4), кіст, плоскоклітинна
метаплазія (рис. 3.5).
Персистенція Trichomonas vaginalis часто призво-
дить до розвитку хронічного цервіциту. При гістологіч-
ному дослідженні виявляється інтенсивна лімфоцитар-
на і плазмоцитарна інфільтрація навколо колаптоїдних
судин, що проходять безпосередньо під епітелієм. Епі-
теліальні зміни включають розширення ядра і перинук-
леарний набряк (рис. 3.6).
Хронічний трихомонадний цервіцит може прогресу-
вати до фолікулярного цервіциту з утворенням лімфоїд-
них фолікулів. Gardnerella vaginalis може також спри-
чинювати розвиток хронічного цервіциту.
Хламідійний цервіцит супроводжується слизово-
гнійними жовтувато-зеленкуватими виділеннями з цер-
вікального каналу і, як і при трихомонадній інфекції,
часто асоціюється з розвитком фолікулярного цервіци-
ту (утворення субепітеліальних і перигландулярних
лімфоїдних фолікулів).
Діагноз підтверджується результатами імуногісто-
хімічного або культурального дослідження.
Лікування цервіцитів полягає в проведенні етіо-
тропної загальної та місцевої антибактеріальної те-
рапії.
Рис. 3.4. Хронічний цервіцит і
поліп. Запальні зміни в слизовій обо-
лонці ендоцервіксу поблизу зовніш-
нього зіва: набряк, клітинна інфільт-
рація, кісти, десквамація епітелію, ут-
ворення поліпа
Рис. 3.5. Хронічний кістозний цер-
віцит і плоскоклітинна метаплазія епі-
телію шийки матки
Гінекологічна патологія
70
Герпетична інфекція шийки матки може бути без-
симптомною, хоча нерідко супроводжується герпетич-
ними ураженнями вульви і піхви, які звичайно є боліс-
ними. Первинне ураження шийки має вигляд пухирця,
який швидко розривається з утворенням некротичної
чітко окресленої виразки. Виразка може мати ознаки
вторинного інфікування. При гістологічному дослі-
дженні навколо виразки виявляються грануляційна
тканина та інфільтрат з лімфоцитів, нейтрофілів і
гістіоцитів. Уражені клітини можуть бути багатоядер-
ними, зі специфічними інтрануклеарними еозинофіль-
ними герпетичними включеннями («око сови»).
Лікування полягає в загальному та місцевому за-
стосуванні ацикловіру.
Цитомегаловірусний цервіцит може бути діагнос-
тований за результатами цитологічного дослідження
вагінальних мазків (характерні внутрішньоядерні та
інтрацитоплазматичні включення в епітеліальних і ен-
дотеліальних клітинах). Може спостерігатися щільний
лімфоцитарний і плазмоцитарий інфільтрат у стромі.
Це захворювання частіше виявляється в імуноскомп-
рометованих осіб і супроводжується цитомегаловірус-
ними ураженнями жіночого генітального тракту інших
локалізацій.
Лікування включає призначення системних і місце-
вих антивірусних препаратів.
Сифілітичний цервіцит спочатку має вигляд пооди-
нокого безболісного твердого шанкру, поверхня яко-
го вкрита виразками. У зв’язку з відсутністю клінічної
симптоматики захворювання часто залишається нероз-
пізнаним. Вторинний сифіліс шийки матки супрово-
джується хронічною гранулематозною запальною ре-
акцією, наявністю багатоядерних велетенських клітин
і спірохет. У деяких випадках вторинний і третинний
сифіліс шийки матки призводить до ущільнення і де-
формації шийки матки, що потребує диференційної
діагностики з інвазивним раком.
Лікування проводиться препаратами пеніциліну.
Туберкульозний цервіцит є рідкісним ускладненням
і розвивається вторинно після туберкульозного саль-
пінгіту й ендометриту.
Макроскопічне дослідження: виразка або гіпертро-
фічне ураження шийки матки нагадує карциному. Під
час гістологічного дослідження виявляються класичні
туберкульозні гранульоми з лімфоцитами, епітеліоїд-
ними і велетенськими клітинами та центральними ка-
зеозними некрозами, ідентифікуються мікобактерії ту-
беркульозу (бацили Коха).
Лікування включає специфічну антитуберкульозну
терапію.
Актиномікоз шийки матки спричинюють Actinomy-
ces israelii, грампозитивні анаероби. Він може бути по-
в’язаний з використанням внутрішньоматкової спіралі.
Мікроскопічне дослідження: актиномікоз шийки
матки представлений гранулами, які складаються з
розгалужених грампозитивних ниток, що утворюють
«палісад».
Лікування проводиться антибіотиками широкого
спектра дії (пеніциліни тощо).
Післяпроменева атипія — атипові зміни плоского
або залозистого епітелію, які можуть виникати через
тижні й роки після променевої терапії. Макроскопічні
зміни виявляються нерівністю контурів слизової оболон-
ки шийки матки, фіброзом, ущільненням або стенозом.
Мікроскопічне дослідження: плоскі та залозисті
клітини мають рясну цитоплазму, гіперхромні ядра з
«брудним» хроматином, що різняться за формою і роз-
мірами. Ядерно-цитоплазматичне співвідношення низь-
ке, спостерігаються дегенерація клітин, цитоплазма-
тичні вакуолі і клітинні некрози. Мітотичні фігури зви-
чайно відсутні. Часто післяпроменеві зміни виникають
у стромі і кровоносних судинах.
Доброякісні пухлини
і пухлиноподібні стани
Мікрозалозиста гіперплазія. Під мікрозалозистою
гіперплазією розуміють непухлинну проліферацію ен-
доцервікальних залоз (варіант нормального ендоцер-
віксу).
Рис. 3.6. Трихомонадний цервіцит.
Інтенсивна лімфоцитарна і плазмоци-
тарна інфільтрації навколо колап-
тоїдних судин під епітелієм. Розши-
рення ядер, перинуклеарний набряк
3. Шийка матки
71
Етіологія і гістогенез. Мікрозалозиста гіперплазія
розвивається внаслідок естрогенної або прогестероно-
вої гормональної стимуляції (застосування оральних
контрацептивів, естрогенів, прогестерону; вагітність).
Частота. Цей стан найчастіше виявляється у
жінок репродуктивного віку і лише в 5 % випадків —
у постменопаузальному.
Клініка і діагностика. Захворювання має безсимп-
томний перебіг; рідко пацієнток можуть турбувати ва-
гінальні виділення або кровотечі. Звичайно цей стан
не можна визначити під час обстеження, хоча інколи
мікрозалозиста гіперплазія має вигляд «ерозії» або ма-
ленького поліпа в ділянці зовнішнього зіва.
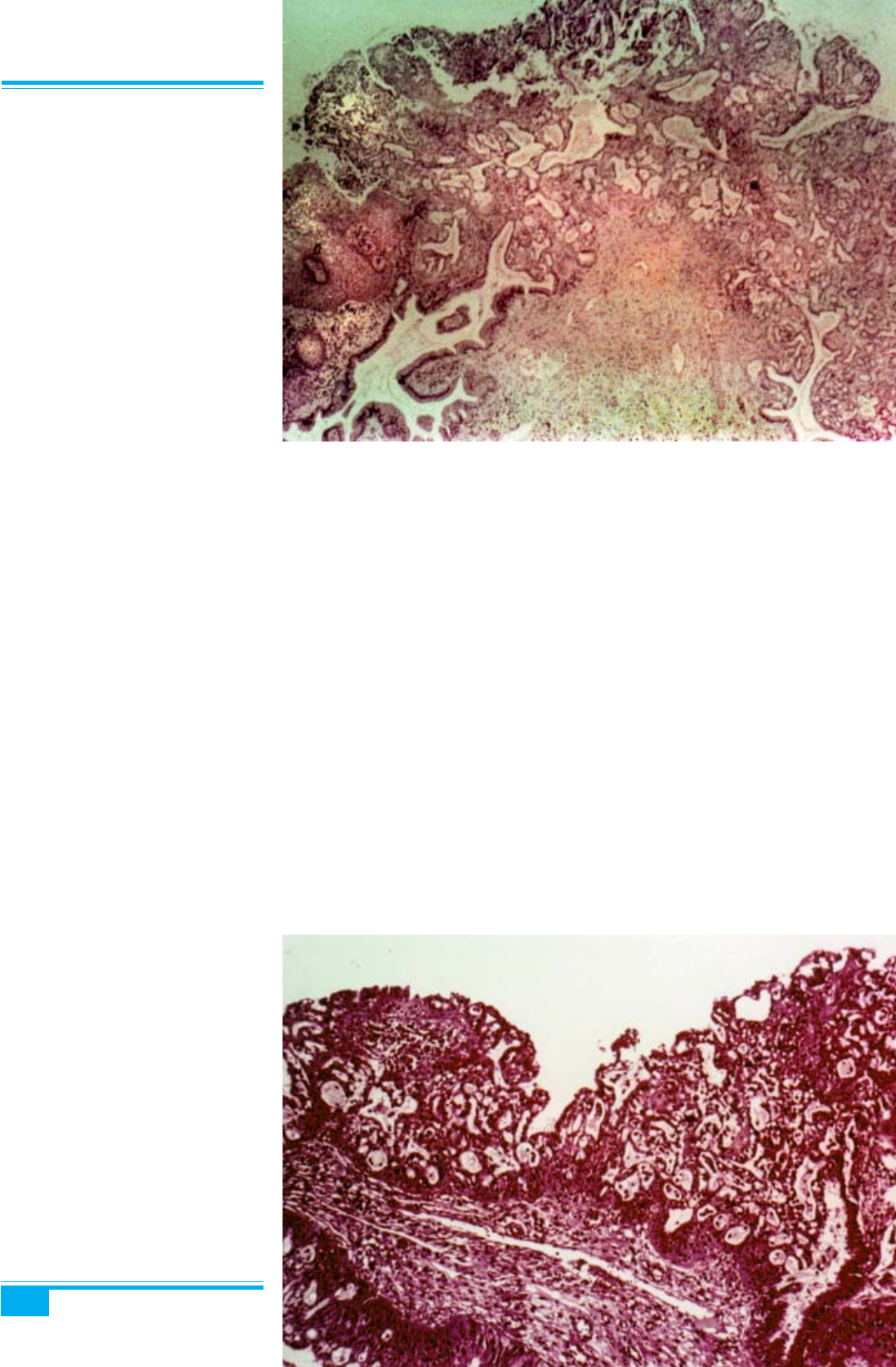
Гістологічне дослідження: мікроскопічне дослі-
дження дає змогу спостерігати щільно напаковані за-
лози (залоза в залозі), їх розміри варіюють від малень-
ких круглих до великих, кістозних, варіабельної фор-
ми (рис. 3.7), вистелені кубоїдальним, циліндричним
або сплощеним епітелієм (рис. 3.8). Строма має озна-
ки гострого і хронічного запалення та мукоїдної
інфільтрації. Клітини містять під’ядерні вакуолі, ма-
ленькі ядра і невиразні ядерця. Мітози рідкісні або
відсутні. Інколи помітні ознаки плоскоклітинної мета-
плазії.
Незвичними гістологічними рисами можуть бути
солідна, трабекулярна структура залоз, едематозна,
гіалінізована строма з поодинокими агрегатами епіте-
ліальних клітин (псевдоінфільтрат). Трапляються інші
клітинні типи (веретеноподібні, полігональні клітини
з рясною еозинофільною цитоплазмою, клітини з інтра-
целюлярним муцином, що нагадують перснеподібні), а
також легкий або помірний ядерний плеоморфізм
(атипова поліпоїдна мікрозалозиста гіперплазія).
Диференційний діагноз проводять зі світлоклітин-
ною аденокарциномою ендоцервікального типу (ха-
рактерні клітини з рясною, багатою на глікоген цито-
плазмою, виразна клітинна атипія, часті мітози, іму-
нореактивність до карциноембріонального антигену
(виражена явна інвазія).
Лікування за відсутності атипових рис захворюван-
ня звичайно не потребується.
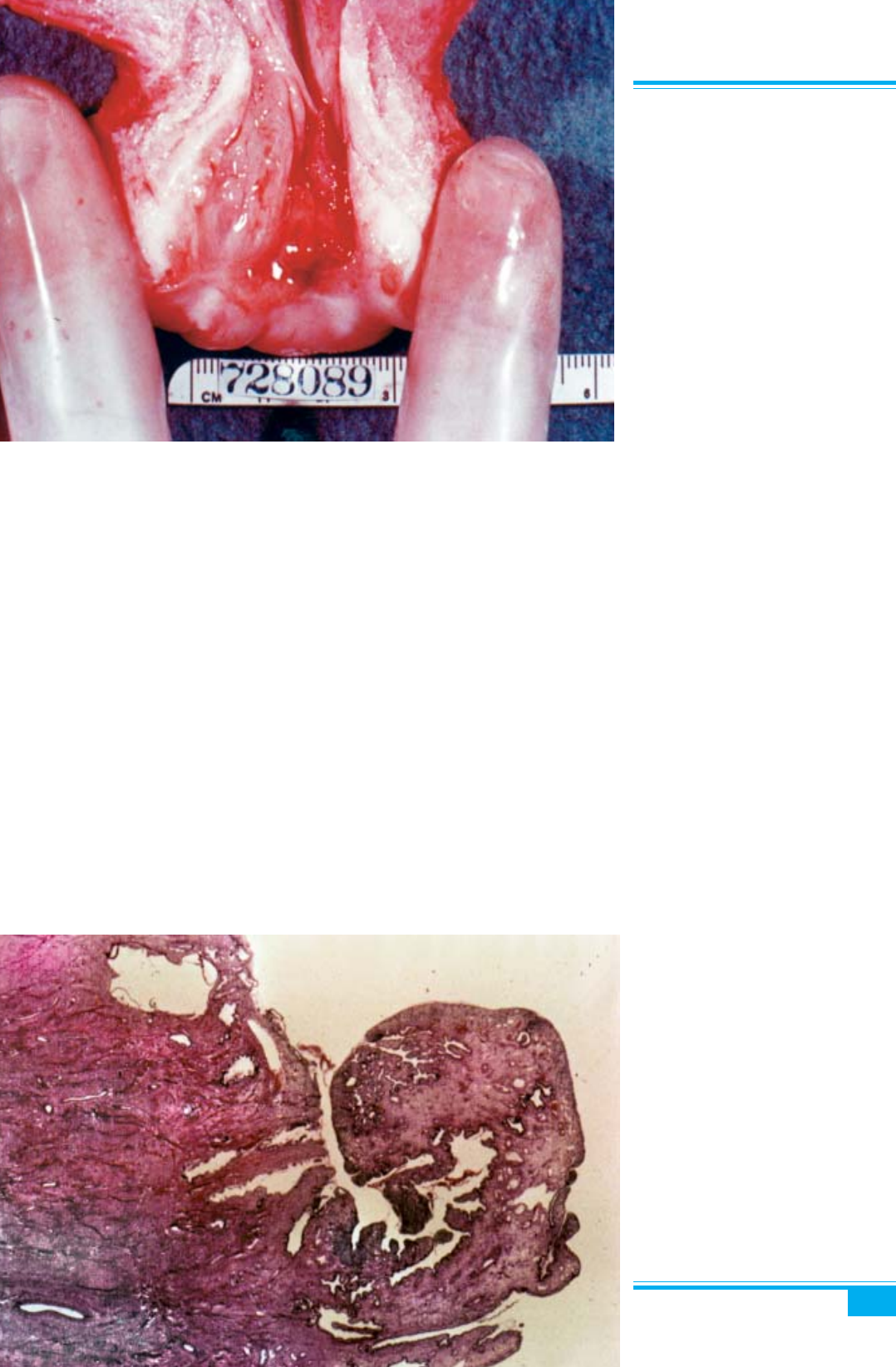
Ендоцервікальний поліп — локалізована проліфе-
рація ендоцервікальних залоз і строми шийки матки,
яка може бути наслідком хронічного запального про-
цесу. Поліп має вигляд ніжного гладенького червоно-
го пальцеподібного утворення і локалізується в церві-
кальному каналі (рис. 3.9).
Рис. 3.7. Мікрозалозиста гіперпла-
зія епітелію шийки матки. Численні
маленькі нерівномірні залози, висте-
лені кубоїдальним епітелієм
Рис. 3.8. Мікрозалозиста гіперпла-
зія епітелію шийки матки. Проліфера-
ція циліндричного епітелію ендоцер-
віксу
Гінекологічна патологія
72
Ендоцервікальний поліп виявляється досить часто.
Понад 90 % пацієнток з ендоцервікальним поліпом у
віці 40 років і більше. У 75 % випадків поліп є без-
симптомним; решта пацієнток скаржаться на контактні
кровотечі або піхвові виділення. У 80–90 % випадків
поліп поодинокий, його діаметр не перевищує 1 см. У
90 % випадків поліп не має ознак структурної та
клітинної атипії.
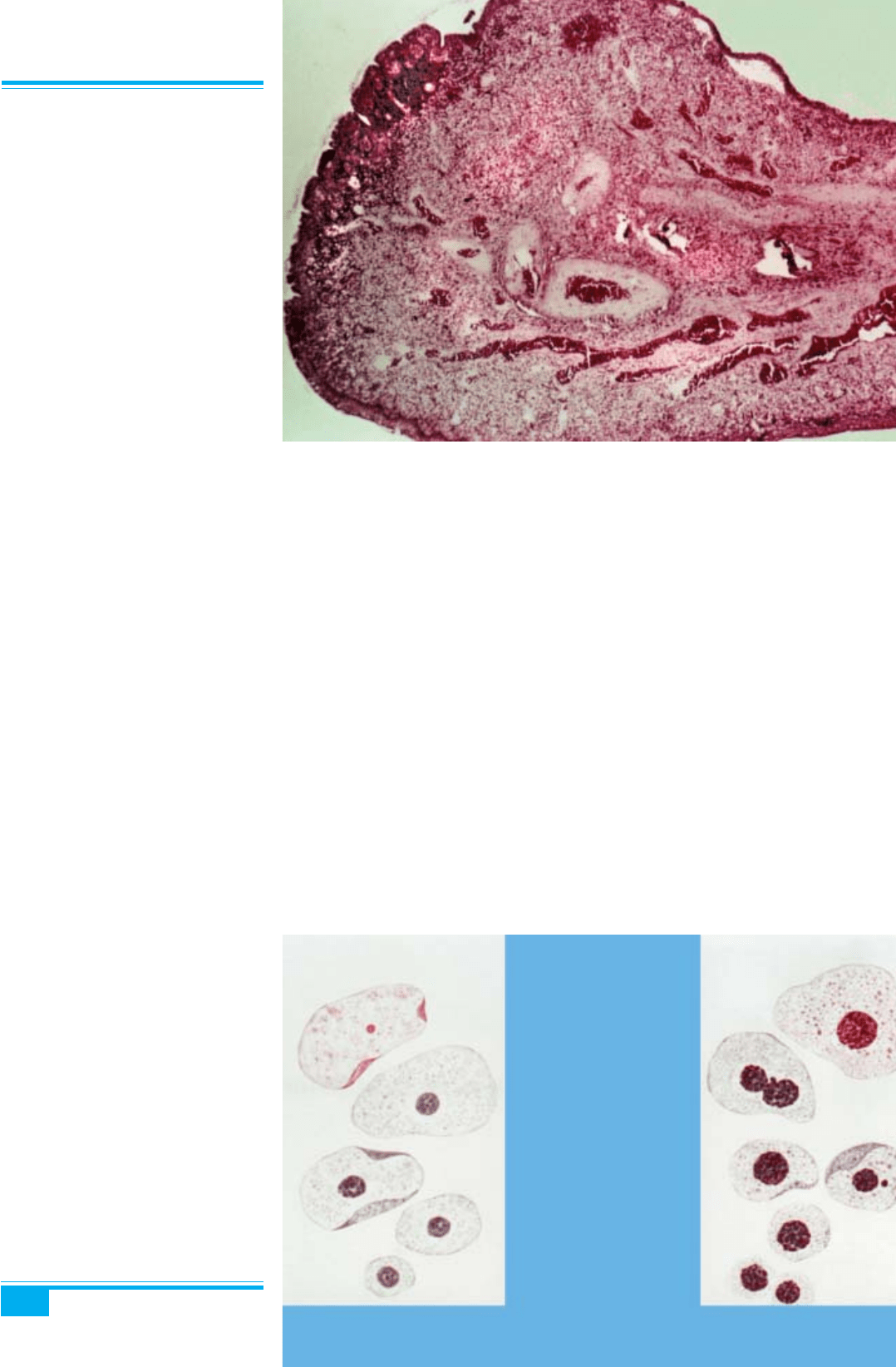
Мікроскопічне дослідження: поліп вкритий муци-
нозним циліндричним епітелієм, якщо розміщується ви-
соко в цервікальному каналі, або метапластичним
плоским епітелієм — низько розміщені поліпи. Строма
едематозна, містить запальний інфільтрат і тов-
стостінні судини (рис. 3.10, 3.11). Стромальні клітини
інколи мають дуже виразні ядерця. Мітотична ак-
тивність є мінімальною. Малігнізація поліпа можлива
в 0,2–0,4 % випадків.
Диференційний діагноз з інвазивною карциномою,
субмукозною лейоміомою, поліпом ендометрія (на-
явність ендометріальних залоз і строми), ембріональ-
ною рабдоміосаркомою (відсутність атипових клітин
з гіперхромними ядрами, наявність добре розвинутих
ендоцервікальних залоз свідчать на користь поліпа)
проводять за допомогою гістологічного дослідження.
Наботові кісти — слизові ретенційні кісти шийки
матки, які утворюються внаслідок перекриття ендоцер-
вікальних залоз плоским епітелієм, переважно в
нижній третині шийки матки. Можуть дуже варіюва-
ти за розмірами (від 3 мм до 3 см); вистелені цилінд-
ричним або плоским епітелієм (типові ендоцервікальні
залози) (див. рис. 3.4). Вони подібні за розмірами і фор-
мою, не мають ознак клітинної атипії і перигландуляр-
ної стромальної реакції. Ці кісти звичайно є безсимп-
томними і не потребують лікування, хоча можуть бути
ознакою хронічного цервіциту.
Ендометріоз шийки матки має вигляд синюватих
вузликів і часто локалізується в місцях попередньої
біопсії або електрохірургічного втручання. Виникає
внаслідок імплантації менструального ендометрія і
може бути поверхневим (субмукозним) або глибоким.
Глибокий ендометріоз шийки матки часто продов-
жується на дугласове заглиблення і супроводжується
розповсюдженим тазовим ендометріозом.
Мікроскопічне дослідження: виявляються ендомет-
ріальні залози і строма, можливі осередки геморагій і
запальної інфільтрації. У цьому разі, а також при на-
явності мітотичної активності ендометріальних залоз
Рис. 3.9. Поліп шийки матки. Еде-
матозні зморшки слизової оболонки
ендоцервіксу в цервікальному каналі
Рис. 3.10. Поліп шийки матки. Ви-
разний набряк строми
3. Шийка матки
73
може виникнути необхідність провести диференційну
діагностику з ендоцервікальною залозистою диспла-
зією або аденокарциномою in situ.
Стромальний ендометріоз — нетиповий варіант ен-
дометріозу, що характеризується виключним або май-
же виключним розвитком стромального компонента.
Мікроскопічне дослідження: чітко окреслені цент-
ри стромального ендометріозу складаються з поверх-
невих клітин цервікальної строми, маленьких крово-
носних судин і екстравазатів еритроцитів (інколи не-
обхідна диференційна діагностика з саркомою ендо-
метріальної строми).
Лейоміома шийки матки є доброякісною пухлиною
з гладких м’язових волокон, розміщених пучками. Ча-
стіше виникає в задній стінці шийки матки. Макро- і
мікроскопічні ознаки подібні до таких при лейоміомі
матки.
Злоякісні пухлини
Інвазивний плоскоклітинний рак
шийки матки та його попередники
Інтраепітеліальна плоскоклітинна проліферація,
яка призводить до малігнізуючих змін плоского епіте-
лію шийки матки, характеризується зміною або втра-
тою полярності різних шарів епітелію, клітинною ана-
плазією (порушення дозрівання клітин, кератинізація
клітин глибоких шарів епітелію, поява парабазальних
клітин у верхніх шарах), ядерним плеоморфізмом і ано-
мальними мітозами (рис. 3.12). Для визначення цього
процесу застосовують різні класифікаційні системи
(табл. 3.1). Поняттю дисплазія (легка, помірна і тяж-
ка, або карцинома in situ) відповідають терміни церві-
кальна інтраепітеліальна неоплазія (CIN І, II і III сту-
пеня) і плоскоклітинне інтраепітеліальне ураження
(низький ступінь ризику — low grade squamous
intraepitelial lesion, LGSIL) відповідає легкій дисплазії
і CIN I; плоскоклітинне інтраепітеліальне ураження
високого ступеня ризику (high grade squamous
intraepitelial lesion, HGSIL) відповідає помірній та
Рис. 3.11. Поліп шийки матки з за-
паленням. Помітні набряк строми,
кілька великих судин. Залози відсутні
Рис. 3.12. Типи диспластичних
клітин. Різні ступені зрілості цитоп-
лазми, збільшення ядер
НОРМАЛЬНІ КЛІТИНИ
ПРОМІЖНІ
ПОВЕРХНЕВІ ЗРОГОВІЛІ
ПОВЕРХНЕВІ
ДИСПЛАСТИЧНІ КЛІТИНИ
БАЗАЛЬНІ
ПАРАБАЗАЛЬНІ
Гінекологічна патологія
74
тяжкій дисплазії, або CIN II, CIN III і карциномі in
situ).
Етіологія і патогенез. Первинним фактором ризи-
ку розвитку інтраепітеліальних плоскоклітинних ура-
жень шийки матки вважають ВПЛ-інфекцію. Іншими
факторами ризику, а вони звичайно є кофакторами, які
збільшують ризик інфікування ВПЛ, є початок стате-
вого життя до 17 років, численні статеві партнери, три-
вале вживання оральних контрацептивів, рання перша
вагітність, зростання кількості пологів (високий пари-
тет), низький соціально-економічний статус, захворю-
вання, що передаються статевим шляхом (герпес, го-
норея, хламідіоз, трихомоніаз); аномальні результати
цитологічної діагностики вагінальних мазків; куріння,
імуносупресія (включаючи серопозитивність до віру-
су імунодефіциту людини). Факторами ризику з боку
статевого партнера є кондиломи статевого члена, чис-
ленні сексуальні партнери, рак шийки матки у попе-
редньої партнерки.
Інтраепітеліальні плоскоклітинні ураження низько-
го ризику (наприклад, гострокінцеві кондиломи) зви-
чайно асоційовані з ВПЛ низького онкогенного ризи-
ку (типи 6 або 11) та інколи з ВПЛ-інфекцією середньо-
го ризику (типи 31, 33 або 35) або, рідко, з ВПЛ 18.
Вони звичайно не є анеуплоїдними і мають низький ри-
зик розвитку інвазивного плоскоклітинного раку ший-
ки матки.
Інтраепітеліальні плоскоклітинні ураження високо-
го ступеня ризику здебільшого пов’язані з ВПЛ висо-
кого онкогенного ризику (типи 16, 18) і, рідко, з ВПЛ
середнього ризику. Вони зазвичай є анеуплоїдними і
мають значні шанси прогресії в інвазивний плоско-
клітинний рак.
Гіпотетичний механізм ВПЛ-залежної трансфор-
мації клітин можна подати у вигляді схеми (рис. 3.13).
Неінтегрована вірусна ДНК існує в циркулярній
плазміді, в якій два трансформуючих гени (Е6 і Е7) ло-
калізуються безпосередньо нижче вірусного «мозку» —
верхнього регуляторного центру. У неінтегрованій
стадії продукти Е2-гена пригнічують експресію Е6- і
Е7-генів. Якщо ураження стає інвазивним, циркуляр-
ний геном плазміди розколюється майже посередині
Е2-гена, відтворюючи лінійний фрагмент вірусної хро-
мосоми. В ній частина Е2-гена локалізується вище
верхнього регуляторного центру і втрачає дієздат-
ність. Але ця лінеаризація зберігає нормальну функцію
двох трансформуючих генів — Е6 і Е7 — і приводить
до суперекспресії онкогенних білків.
Гіпотетичний механізм індукованої онкогенним ти-
пом ВПЛ генної мутації також можна подати у вигляді
схеми (рис. 3.14) Протягом реплікаційного циклу кліти-
ни перебувають у фазі G1 завдяки двом важливим ан-
тионкогенам — р53 і pRB, тимчасом як хромосомна
цілісність перевіряється ендонуклеазами. Якщо ж ВПЛ-
інфекція високого ризику, то білок, який визначається
ВПЛ-E6-геном, блокує р53, а протеїн, який детермі-
нується ВПЛ-E7-геном, блокує ретинобластомний ан-
тионкоген (pRB). Генетично ушкоджені клітини підда-
ються мітотичному діленню. З часом ці генетичні по-
милки можуть поширюватись (ампліфікуватись) до ут-
ворення великих хромосомних ушкоджень, які виявля-
ються при ДНК-мікроспектрофотометрії.
Частота. У зв’язку з «сексуальною революцією»
кінця 70-х рр. минулого століття частота дисплазії зро-
стає у підлітків і молодих жінок, які почали активне
статеве життя до 20 років, і становить 0,5–6,5 %. Так,
протягом 1978–1988 рр. частота плоскоклітинних
інтраепітеліальних уражень зросла в 10 разів. Завдя-
ки впровадженню скринінгових програм сьогодні
істотно зменшилась частота інвазивного плоскоклітин-
ного раку шийки матки.
Клініка і діагностика. Інтраепітеліальні плоско-
клітинні ураження шийки матки можуть виявлятися під
Таблиця 3.1
Класифікаційні системи неопластичних
плоскоклітинних інтраепітеліальних
уражень шийки матки
Легка дисплазія CIN I LGSIL
Помірна дисплазія CIN II HGSIL
Тяжка дисплазія CIN III HGSIL
Карцинома in situ CIN III HGSIL
Плоскоклітинне
інтраепітеліальне
ураження
(Bethesda system)
Дисплазія,
карцинома in situ
Цервікальна
інтраепіте-
ліальна
неоплазія
Рис. 3.13. Гіпотетичний механізм
злоякісної трансформації клітин під
впливом вірусу папіломи людини:
CIN — цервікальна інтраепітелі-
альна неоплазія; ВПЛ — папіломаві-
рус; URR — верхній регуляторний
регіон; Е2, Е6, Е7 — регуляторні гени
CIN
Пізній регіон
Репресія Е2
Ранній регіон
URR
Е7
Е6
Епісомальний
ВПЛ
Е2
Зростання транскрипції Е6 і Е7
ДНК господаря
URR
Е2 Е6 Е7 Е2

3. Шийка матки
75
час кольпоскопії і підтверджуватися результатами ци-
тологічної діагностики цервікальних мазків та гісто-
логічного дослідження біоптатів.
Диспластичні процеси шийки матки можуть мати
клінічні «маски» хронічного цервіциту, ектропіону.
Кольпоскопічними ознаками дисплазії є ацетобілий
епітелій, йоднегативні зони, пунктація, мозаїка, ано-
мальні судинні зміни тощо (рис. 3.15–3.17).
Диспластичні зміни звичайно розвиваються в зоні
плоскоклітинно-циліндричного з’єднання (зона транс-
формації), причому передня губа шийки матки ура-
жується вдвічі частіше, ніж задня. Близько 10 % інтра-
епітеліальних уражень розвиваються в ендоцервікаль-
ному каналі без поширення на плоскоклітинно-цилін-
дричне з’єднання. Інтраепітеліальна неоплазія розпов-
сюджується вздовж базальної мембрани шляхом пере-
міщення метапластичних і залозистих епітеліальних
клітин. Звичайно уражаються ендоцервікальні залози.
HGSIL охоплюють більші площі епітелію і мають
більше шансів розповсюдження на ендоцервікальний
канал, ніж LGSIL. Інтраепітеліальні плоскоклітинні
ураження високого ступеня ризику здатні переміщува-
ти зону трансформації і розповсюджуватися на різну
відстань в ендоцервікальний канал. Рідко HGSIL роз-
повсюджуються на ендометрій, маткові труби і поверх-
ню яєчника, у виключних випадках можуть бути асо-
ційовані з інвазивним плоскоклітинним раком цих ло-
калізацій.
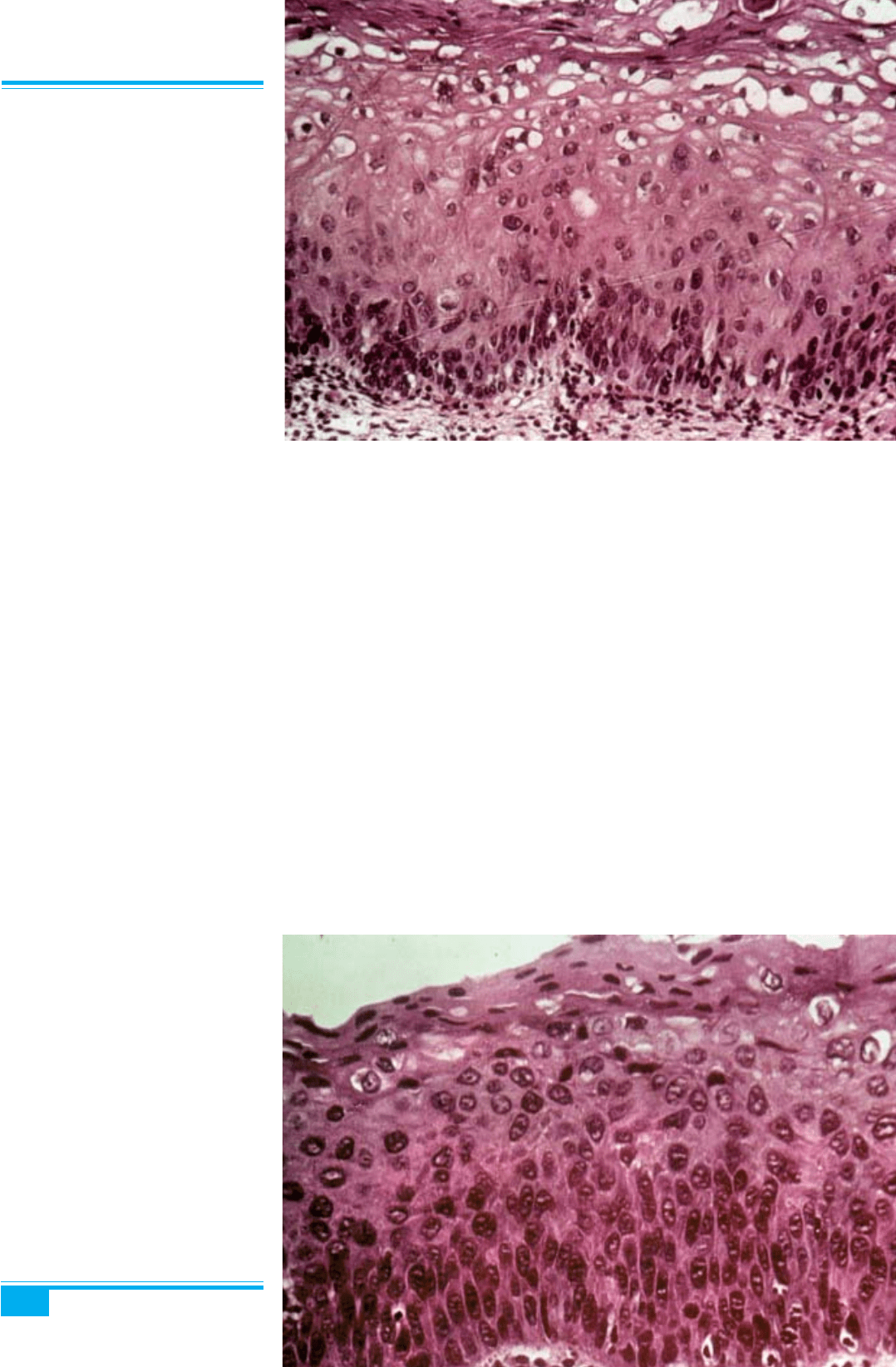
Легка дисплазія (CIN І, LGSIL). При мікроскопіч-
ному дослідженні виявляються диспластичні зміни
(див. рис. 3.12), які охоплюють не більш ніж 1/3 товщі
плоского епітелію (рис. 3.18). У верхній частині епі-
телію звичайно виявляють ознаки койлоцитозу (варі-
ації клітин за розміром і формою, стовщення клітин-
них мембран, перинуклеарна світла цитоплазматична
зона — сяйво різного розміру та форми, оточена обід-
ком щільної цитоплазми, ядерна атипія — так звана
койлоцитарна атипія). Центрально або ексцентрично
розміщені ядра койлоцитів також варіюють за розмі-
ром (розширені або маленькі та пікнотичні) і формою,
мають нерівні контури, спостерігається гіперхромазія,
двоядерні і багатоядерні клітини, вакуолізація цито-
плазми, розширення базальної зони клітин (рис. 3.19).
Ядра є більш одноманітними за формою й інтенсивні-
стю гіперхромазії, ніж при інтраепітеліальних плоско-
клітинних ураженнях високого ступеня ризику. Міто-
тичні фігури трапляються часто і можуть бути трипо-
лярними. В нижній третині епітелію і, інколи, в середній
третині, виявляється позитивна реакція на Кі-67.
При інтраепітеліальних ураженнях високого ступе-
ня ризику патогномонічною рисою є ядерна атипія в
усіх епітеліальних шарах, звичайно з відсутністю до-
зрівання клітин. При деякому ступені дозрівання
клітин або наявності койлоцитарної атипії ураження
звичайно належать до CIN II; а відсутність цих рис
свідчить про CIN III.
Помірна дисплазія (CIN II, HGSIL). Клітинні зміни
є проміжними між CIN I і CIN III і охоплюють нижні
2/3 епітелію. Ядерні зміни є більш виразними. Втрата
парабазальних клітин поширюється на середню трети-
ну товщі епітелію (рис. 3.20). Численні аномальні ядра
трапляються і у верхніх шарах епітелію. Ядерні зміни
— розширення ядра, скупчення хроматину, гіперхро-
Регулюється р53 і рRB
Мітози
G1
Syn
G0
G2
Рис. 3.14. Гіпотетичний механізм ВПЛ-залежних
клітинних мутацій: G0–G1–G2 — фази росту клітини;
р53, рRB — білки-антионкогени
Рис. 3.15. Легка дисплазія шийки
матки. Кольпоскопічна картина пунк-
тації

Гінекологічна патологія
76
Рис. 3.16. Помірна дисплазія ший-
ки матки. Кольпоскопічна картина
білих плям
Рис. 3.17. Тяжка дисплазія шийки
матки. Кольпоскопічна картина мо-
заїки
Рис. 3.18. Діаграма диспластичних
змін епітелію шийки матки (кореляція
різних термінологічних понять):
LGSIL — плоскоклітинне інтра-
епітеліальне ураження низького ризи-
ку; HGSIL — плоскоклітинне інтра-
епітеліальне ураження високого ризи-
ку; CIN — цервікальна інтраепітелі-
альна неоплазія
LGSIL
Койлоцитоз CIN I
Нормаль-
ний
плоский
епітелій
CIN II CIN III
Помірна Тяжка Карцинома
in situ
Дисплазія
М’яка
HGSIL
Базаль-
на мем-
брана
3. Шийка матки
77
мазія, полі- і плеоморфізм — є менш вираженими, ніж
при CIN III. Спостерігаються кілька мітотичних фігур,
але аномальні мітози є відносно рідкісними. Койлоци-
тозні зміни є менш виразними, ніж при CIN I. Як пра-
вило, ядра при CIN II займають 60–80 % загальної
площі верхньої половини товщі плоского епітелію.
Тяжка дисплазія (CIN III, HGSIL) характеризуєть-
ся втратою стратифікації епітелію. Диспластичні па-
рабазальні клітини займають майже всю товщу епіте-
лію (понад 2/3). Базальний шар клітин розміщується
лише вздовж базальної мембрани (рис. 3.21). Ядерні
зміни — розширення гіперхромних ядер, нерівність
контурів ядра, скупчення хроматину, ядерний полі- і
плеоморфізм, численні мітози, в тому числі аномальні
в усіх шарах. Ядра займають понад 81 % верхньої по-
ловини товщі плоского епітелію. Рідко HGSIL містять
внутрішньоклітинні краплі муцину (плоскоклітинно-
муцинозне інтраепітеліальне ураження). Реакція на
Кі-67 є позитивною від 2/3 до всієї товщі плоского епі-
телію.
Близько 15 % випадків HGSIL співіснують з
LGSIL, особливо при інфікуванні ВПЛ проміжного
ступеня ризику (ВПЛ 31).
Iнтраепітеліальний рак (сarcinoma in situ ) харак-
теризується, крім відсутності диференціації усіх шарів
епітелію (рис. 3.22), частим розповсюдженням дисплас-
тичних змін на ендоцервікальні залози і навіть повним
заміщенням залоз. Клітини можуть бути маленькими,
недиференційованими (рис. 3.23) або мати більші роз-
міри й ознаки незначного дозрівання (рис. 3.24), але
всі вони мають анапластичні риси. Звичайно перифе-
ричний відділ залоз є рівним і гладким, що свідчить
про відсутність ураження базальної мембрани та ін-
вазії в строму (рис. 3.25, 3.26).
Постменопаузальна плоскоклітинна атипія звичай-
но виявляється у жінок віком понад 50 років і харак-
теризується виразним перинуклеарним сяйвом, не
більш ніж двократним збільшенням розмірів ядра,
гіперхромазією, появою багатоядерних клітин (псевдо-
койлоцитоз). Псевдокойлоцитозні зміни при постмено-
паузальній плоскоклітинній атипії можуть бути помил-
ково сприйняті за LGSIL, але постменопаузальна плос-
коклітинна атипія є завжди негативною до ВПЛ. По-
рівняно з койлоцитарною атипією, при постменопау-
зальній плоскоклітинній атипії розміри ядер менш ва-
ріабельні (двократне збільшення порівняно з трикрат-
Рис. 3.19. Легка дисплазія епітелію
шийки матки. Аномальні ядра, вакуо-
лізація цитоплазми. Деяке розширен-
ня парабазального шару, але в межах
нижньої 1/3 поверхні епітелію. Ба-
зальний шар клітин збережений
Рис. 3.20. Помірна дисплазія епіте-
лію шийки матки. Більш виразні
ядерні зміни. Зона парабазальних
клітин розповсюджується на середню
третину товщі епітелію

Гінекологічна патологія
78
Рис. 3.21. Тяжка дисплазія епітелію
шийки матки. Зона парабазальних
клітин розповсюджується майже на
всю товщу епітелію. Базальний шар
клітин епітелію збережений. В кліти-
нах помітні мітози, паракератоз і дис-
кератоз
Рис. 3.22. Карцинома in situ ший-
ки матки. Анапластичні зміни клітин
з відсутністю диференціації на всіх
рівнях. Клітини варіюють за розміра-
ми і ступенем диференціації
Рис. 3.23. Дрібноклітинна карци-
нома in situ шийки матки. Домінують
недиференційовані дрібні клітини
