Троян Е.Н., Бахтина И.А. Теплотехника
Подождите немного. Документ загружается.


11
N =
,
1
∑
n
i
N
а мольная доля i-гo компонента будет
равна N
i
/ N.
В соответствии с законом Аво-
гадро объемы моля любого газа при оди-
наковых р и Т, в частности при темпера-
туре и давлении смеси, одинаковы. По-
этому приведенный объем любого ком-
понента может быть вычислен как произ-
ведение объема моля µν
i
на число молей
этого компонента:
=
i
V м
ii
Nv ,
а объем смеси – по формуле
=
V м vN ,
Тогда
N
N
r
V
V
i
i
i
==
и, следовательно, задание смеси газов
мольными долями равнозначно заданию
ее объемными долями.
Газовая постоянная смеси газов.
Просуммировав уравнения (1.11) для
всех компонентов смеси, получим:
∑∑
=
n
iii
n
i
TRmgpV
11
.
Учитывая (1.8), можно записать:
pV = mR
см
T, (1.14)
где
∑
=
n
iiсм
RgR
1
. (1.15)
Из уравнения (1.14) следует, что
смесь идеальных газов также подчиняет-
ся уравнению Клапейрона.
Поскольку в соответствии с (l.6)
R = 8314/ µ,
то из (1.15) следует, что газовая по-
стоянная смеси, Дж/(кг·К),
R
см
= 8314
∑
n
i
g
1
/ µ
i
. (1.16)
Кажущаяся молекулярная масса
смеси. Выразим формально газовую по-
стоянную смеси R
см
по формуле (1.6),
введя кажущуюся молекулярную массу
смеси µ
см
:
R
см
= 8314/ µ
см
. (1.17)
Сравнивая правые части соот-
ношений (1.16) и (1.17), найдем:
∑
=
n
ii
см
g
1
/
1
µ
µ
(1.18)
Просуммировав соотношения (1.12) для
всех компонентов, заменив предварите-
льно V
i
, m
i
и R
i
их значения
ми, получим
выражение для кажущейся молекуляр-
ной массы смеси, заданной объемными
долями:
µ
см
=
∑
n
i
r
1
µ
i
. (1.19)
Соотношение между объемными
и массовыми долями. Из определения
массовых долей следует, что:
i
см
i
см
iii
i
r
N
N
m
m
g
µ
µ
µ
µ
=== .
Учитывая (1.19), получаем:
∑
=
n
ii
ii
i
r
r
g
1
µ
µ
. (1.20)
Поскольку
r
i
= V
i
/ V = N
i
/ N = N
i
/
∑
n
i
V
1
,
то
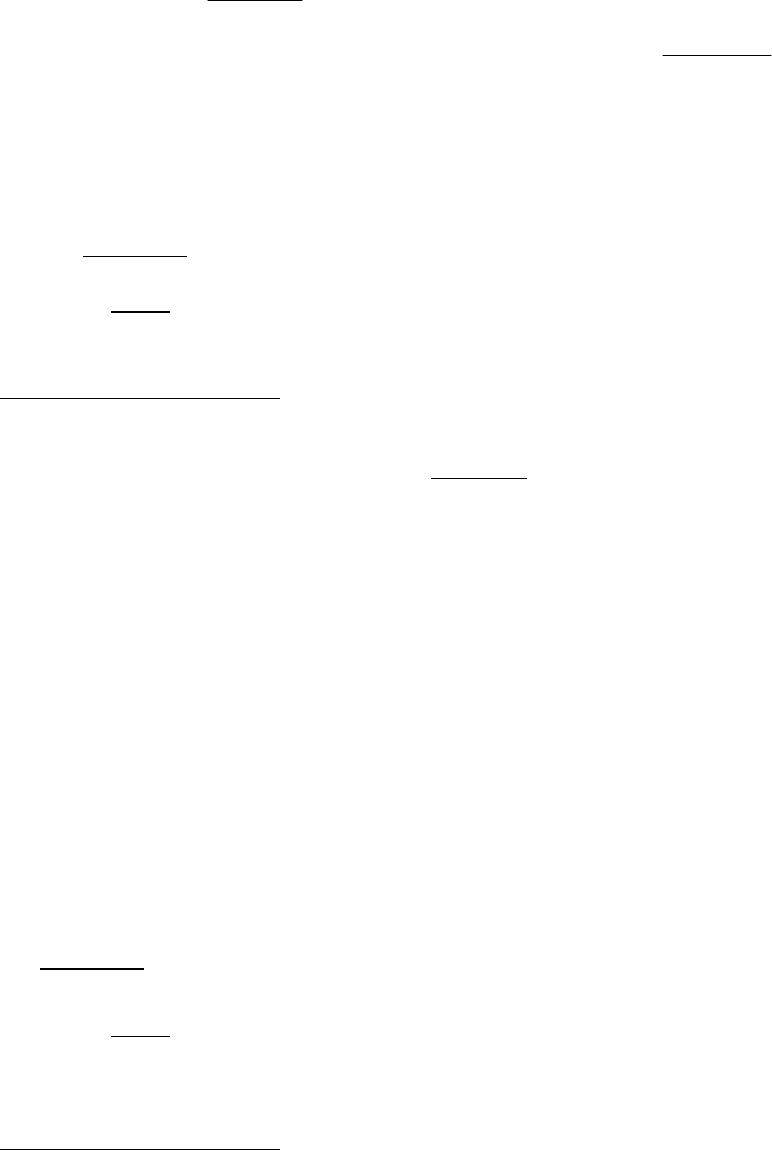
12
∑
=
n
ii
ii
i
m
m
r
1
/
/
µ
µ
.
Разделив числитель и знаменатель
правой и левой частей этой формулы на
массу смеси m, получим:
∑
=
n
ii
ii
i
g
g
r
1
)/(
/
µ
µ
. (1.21)
Примеры решения типовых задач
Задача 1.1
Дано:
Р
изб
= 0,13 МПа
Р
атм
= 90660 Па
t = 25 ˚С
Найти абсолютное давление пара в котле, если мано-
метр показывает Р
изб
= 0,13 МПа, а атмосферное давление
по ртутному барометру составляет Р
атм
= 90660 Па при тем-
пературе t = 25 ˚С.
Р – ?
Решение:
Показания ртутных барометров, манометров и вакуумметров приводят к темпера-
туре 0 ˚С по формуле:
Р
0
= Р·(1 – 1,72 ⋅ 10
–4
·t),
где Р
0
– давление при температуре 0 ˚С; Р – давление при температуре t, ˚С; 1,72·10
–4
–
коэффициент объемного расширения ртути.
Из формулы Р
изб
= Р – Р
атм
находим:
Р = Р
атм
+
Р
изб.
Показания барометра получено при температуре
t = 25 ˚С. Это показание необходимо
привести к 0 ˚С.
Р
0
= Р·(1 – 1,72·10
–4
·t) = 90660·(1 – 1,72·10
–4
·25) = 90270 Па = 0,09 МПа.
Тогда абсолютное давление пара в котле:
Р = 0,09 + 0,13 = 0,22 МПа.
Задача 1.2
Дано:
Р
в
= 56 кПа,
t = 20 ˚С;
Р
атм
= 102,4 кПа,
t = 18 ˚С
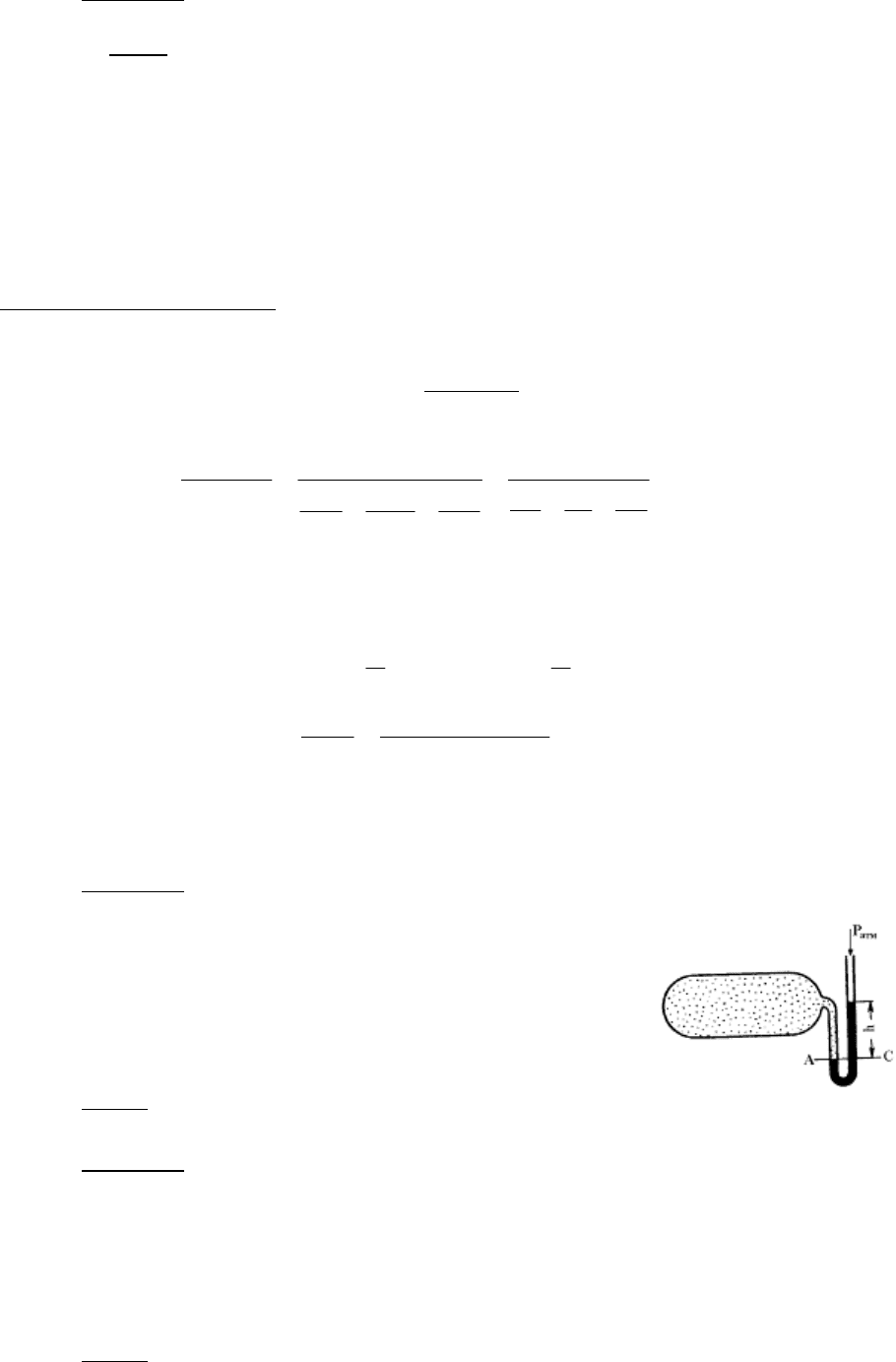
Ртутный вакуумметр, присоединенный к сосуду
(рисунок 1.1), показывает разрежение Р
в
= 56 кПа при тем-
пературе ртути в нем t = 20 ˚С. Атмосферное давление по
ртутному барометру Р
атм
= 102,4 кПа при температуре ртути
t = 18 ˚С.
Определить абсолютное давление в сосуде.
Р – ?
13
Решение:
Рисунок 1.1.
Разрежение в сосуде , приведенное к 0 ˚С,
Р
в
0
= 56·(1 – 1,72·10
-4
·20) = 55,8 кПа,
а атмосферное давление, приведенное к 0 ˚С,
Р
атм
0
= 102,4·(1 – 1,72·10
-4
·18) = 102,1 кПа.
Из формулы Р
в
= Р
атм
– Р находим:
Р = Р
атм
0
– Р
в
0
= 102,1 – 55,8 = 46,3 кПа.
Задача 1.3
Дано:
l = 180 мм = 0,18 м
α = 30˚
ρ = 800 кг/ м
3
Р
атм
= 1,02 бар =
= 1,05 ⋅ 10
5
Па
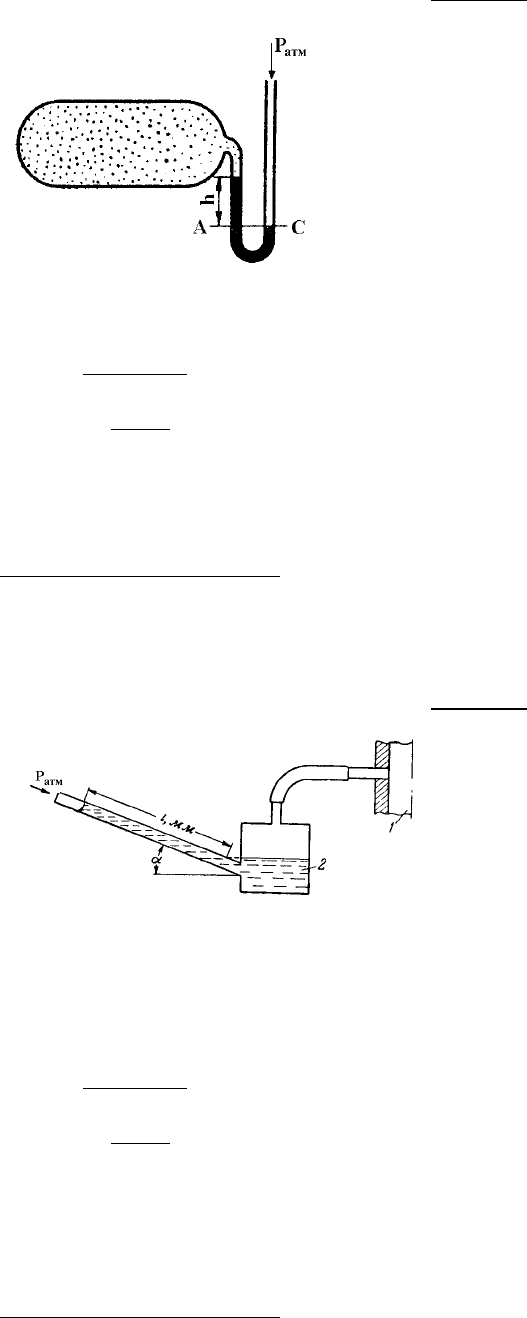
Для измерения малых избыточных давлений или раз-
режений применяются микроманометры. Принципиальная
схема этого прибора представлена на рисунке 1.2.
Определить абсолютное давление в воздухопроводе,
если длина l жидкости в трубке микроманометра, наклонен-
ной под углом α = 30˚, равна 180 мм.
Рабочая жидкость – спирт с плотностью ρ = 800
кг/м
3
. Показание барометра, приведенного к 0 ˚С, Р
атм
=
1,02 бар.
Р – ?
Решение:
Рисунок 1.2. – К задаче 1.3.
1 – воздухопровод; 2 – микромано-
метр, заполненный спиртом.
Абсолютное давление в воздухопроводе
Р = Р
атм
+ Р
изб
,
где Р
изб
= ρgh = ρ·g·l·sin α, тогда Р
изб
= Р
атм
+
+ ρ·g·l·sin α = 1,02 + 800·9,81·0,18·sin 30˚·10
-5
=
= 1,027 бар.
Задача 1.4
Дано:
V = 20 л = 0,02 м
3
Р
1
= 10 МПа = 10⋅10
6
Па
t
1
= 15 ˚С
Р
2
= 7,6 МПа = 7,6⋅10
6
Па
t
2
= 25 ˚С
µ
О2
= 32 кг/ кмоль
Баллон с кислородом емкостью 20 л находится под
давлением 10 МПа при температуре 15 ˚С. После израсходо-
вания части кислорода давление понизилось до 7,6 МПа, а
температура до 10 ˚С.
Определить массу израсходованного кислорода.
∆
m – ?
14
Решение:
Из уравнения состояния идеального газа (1.4)
T
R
VP
m
⋅
⋅
= .
Следовательно, до расходования кислорода его масса составляла
12
1
1
TR
VP
m
O
⋅
⋅
=
,
а после израсходования
22
2
2
TR
VP
m
O
⋅
⋅
=
.
Таким образом, расход кислорода
−⋅=−=∆
2
2
1
1
2
21
T
P
T
P
R
V
mmm
O
,
где R
О2
= 8314/ µ
O2
, т.е.
−⋅
⋅
=∆
2
2
1
1
2
8314 T
P
T
P
V
m
О
µ
;
616,010
27310
6,7
27315
10
8314
3202,0
6
=⋅
+
−
+
⋅
⋅
=∆m
кг.
Задача 1.5
Дано:
r
CO2
= 0,123;
µ
CO2
= 44 кг/ кмоль
r
O2
= 0,072;
µ
О2
= 32 кг/ кмоль
r
N2
= 0,805;
µ
N2
= 28 кг/ кмоль
P = 100 кПа = 10
5
Па
t = 800 ˚С
Объемный состав сухих продуктов сгорания топлива
(не содержащих водяных паров) следующий: 12,3% СО
2
,
7,2% О
2
, 80,5% N
2
.
Найти кажущуюся молекулярную массу смеси и га-
зовую постоянную, а также плотность и удельный объем
продуктов сгорания при давлении 100 кПа и температуре
800 ˚С.
µ
см
, R
см
,
ρ
c
м
,
ν
см
– ?
Решение:
Кажущуюся молекулярную массу определяем из уравнения (1.19)
µ
см
=
∑
⋅
n
ii
r
1
µ
= r
СО2
·µ
СО2
+ r
O2
·µ
O2
+ r
N2
·µ
N2
=
0,123⋅44 + 0,072⋅32 + 0,805⋅28 = 30,3 кг/кмоль.
Газовую постоянную – из уравнения (1.17)
R
cм
= 8314/ µ
см
= 8314/ 30,3 = 274 Дж/(кг·К).
Удельный объем находим из уравнения состояния идеального газа (1.3)
ν
см
= R
cм
·T/ Р = 274⋅(800 + 273)/ 10
5
= 2,94 кг/м
3
.
Находим плотность
ρ
см
= 1/ ν
см
= 1/ 2,94 = 0,34 кг/м
3
.
15
Задача 1.6
Дано:
g
H2
= 0,3;
µ
H2
= 2 кг/кмоль
g
CO2
= 0,1;
µ
CO2
= 44 кг/кмоль
g
N2
= 0,6;
µ
N2
= 28 кг/кмоль
P = 0,1013 МПа =
= 0,1013⋅10
6
Па
t = 400 ˚С
Определить значение кажущейся молекулярной мас-
сы, газовой постоянной и плотности при температуре 400 ˚С
и давлении 0,1013 МПа. Смесь газов задана следующим
массовым составом: 30% Н
2
, 10% СО
2
, 60% N
2
.
µ
см
, R
см
,
ρ
c
м
– ?
Решение:
Кажущуюся молекулярную массу определяем из уравнения (1.18)
838,5
28
6,0
44
1,0
2
3,0
11
/
1
2
2
2
2
2
2
1
=
++
=
++
==
∑
N
N
CO
CO
H
H
n
ii
см
gg
g
g
µµµ
µ
µ
кг/кмоль.
Газовую постоянную определяем из уравнения (1.17)
R
cм
= 8314/ µ
см
= 8314/ 5,838 = 1424 Дж/(кг·К).
Плотность находим из уравнения
TR
P
⋅=
ρ
, т.к.
ρ
ν
1
= .
106,0
)273400(1424
101013,0
6
=
+⋅
⋅
=
⋅
=
TR
P
ρ
кг/м
3
.
Задачи для самостоятельного решения
Задача 1.7
Определить абсолютное давление в сосуде (рису-
нок 1.3), если показание присоединенного к нему ртутно-
го манометра равно 66,7 кПа, а атмосферное давление по
ртутному барометру составляет 100 кПа. Температура
воздуха в месте установки приборов рана 0 ˚С.
Ответ:
Р = 0,1667 МПа.
Рисунок 1.3. – К задаче 1.7.
Задача 1.8
Определить абсолютное давление пара в конденсаторе паровой турбины, если по-
казание присоединенного к нему ртутного вакуумметра равно 94 кПа, а показание ртутно-
го барометра, приведенное к 0 ˚С, 99,6 кПа. Температура воздуха в месте установки при-
боров t = 20 ˚С.
Ответ:
Р = 5,9 кПа.

16
Задача 1.9
Из ресивера 1 (рисунок 1.4) воздух поступа-
ет в коллектор двигателя 2. Разрежение в ресивере
измеряется вакуумметром с наклонной трубкой.
Угол наклона трубки к горизонтали 30˚, вакуум-
метр заполнен водой.
Определить абсолютное давление Р (Па) в
ресивере, если длина воды в трубке вакуумметра
300 мм, а давление окружающей среды 1000 гПа.
Ответ:
Р = 0,983⋅10
5
Па.
Рисунок 1.4. – К Задаче 1.9.
1 – ресивер; 2 – коллектор двигателя.
Задача 1.10
В баллоне, вместимостью 0,1 м
3
находится кислород при давлении 6 МПа и темпе-
ратуре 25 ˚С. После того, как из него была выпущена часть газа, показание манометра ста-
ло 3 МПа, а температура понизилась до 15 ˚С. Определить массу выпущенного и плот-
ность оставшегося в баллоне кислорода, если давление окружающей среды 1000 гПа.
Ответ:
∆m = 3,61 кг; ρ
2
= 41 кг/м
3
.
Задача 1.11
Генераторный газ имеет следующий объемный состав: 7% Н
2
; 2% СН
4
; 27,6% СО;
4,8% СО
2
; 58,6% N
2
.
Определить массовые доли, кажущуюся молекулярную массу, газовую постоян-
ную, плотность при температуре 15 ˚С и давлении 0,1 МПа.
Ответ:
g
H2
= 0,005; g
CH4
= 0,012; g
CO
= 0,289; g
CO2
= 0,079; g
N2
= 0,615;
µ
см
= 26,7 кг/кмоль; R
см
= 311 Дж/(кг·⋅К); ρ
cм
= 1,12 кг/м
3
.
Задача 1.12
Массовый состав смеси следующий: 18% СО
2
, 12% О
2
, 70% N
2
.
До какого давления нужно сжать эту смесь, находящуюся при нормальных услови-
ях, чтобы при температуре 180 ˚С 8 кг ее занимали объем, равный 4 м
3
.
Ответ:
Р = 0,24 МПа.
2 Первый закон термодинамики
2.1 Внутренняя энергия
Внутренняя энергия системы
включает в себя:
1) кинетическую энергию посту-
пательного, вращательного и колеба-
тельного движения частиц;
2) потенциальную энергию вза-
имодействия частиц.
Внутренняя энергия есть некото-
рая, однозначная функция состояния те-
ла, т.е. любых двух независимых пара-
метров, определяющих это состояние:
U =
ϕ
1
(p, V); U =
ϕ
2
(p, Т);
U =
ϕ
3
(V, Т).
17
Внутренняя энергия сложной си-
стемы определяется суммой энергий от-
дельных ее частей, т.е. обладает свойст-
вом аддитивности. Величина
u = U/ m
называется удельной внутренней энергией
и представляет собой внутреннюю энер-
гию единицы массы вещества. Она вы-
ражается в Дж/кг.
Поскольку внутренняя энергия
есть функция состояния тела, то ее изме-
нение
∆
u в термодинамическом процессе
не зависит от характера процесса, а опре-
деляется только начальным и конечным
состояниями тела:
12
2
1
uuduu −==∆
∫
,
где u
1
— значение внутренней энергии в
начальном состоянии, а u
2
— в конечном.
Математически это означает, что беско-
нечно малое изменение внутренней энер-
гии du есть полный дифференциал и; ес-
ли выразить внутреннюю энергию в виде
функции удельного объема и темпера-
туры, то
+∂∂= dTTudu
ν
)/(
dvdvdu
T
)/(+ . (2.1)
Внутренняя энергия идеального
газа, в котором отсутствуют силы взаи-
модействия между молекулами, не зави-
сит от объема газа или дав
ления
[ ,0)/( =∂∂
T
vu
T
pu )/( ∂∂ = 0], а определя-
ется только его тем
пературой, поэтому
производная от внутренней энергии иде-
ального газа по температуре есть пол-
ная производная:
dTduTuTu
p
/)/()/( =∂∂=∂∂
ν
. (2.2)
Для большинства задач техниче-
ской термодинамики важно не абсолют-
ное значение внутренней энергии, а ее
изменение в различных термодинамиче-
ских процессах. Поэтому начало отсчета
внутренней энергии может быть выбрано
произвольно. Например, внутреннюю
энергию идеальных газов принято счи-
тать равной нулю при t = 0 ˚C.
2.2 Работа деформации
Работа в термодинамике, так же
как и в механике, определяется про-
изведением действующей на рабочее тело
силы на путь ее действия.
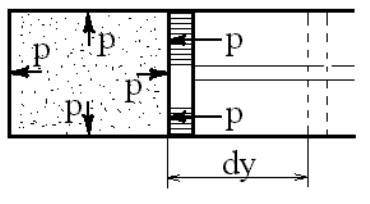
Рассмотрим газ, заключенный в
цилиндре с подвижным поршнем площа-
дью F (рисунок 2.1). Если газу сообщить
некоторое количество теплоты, то он бу-
дет расширяться, совершая при этом ра-
боту против внешнего давления р, оказы-
ваемого на него поршнем. Газ действует
на поршень с силой, равной pF, и со-
вершает элементарную работу
δ
L =pFdy,
перемещая поршень на расстояние dy. Но
Fdy представляет собой увеличение объ-
ема системы, следовательно,
δ
L = pdV. (2.3)
При конечном изменении объема
∫
=
2
1
V
V
pdVL . (2.4)
Рисунок 2.1. – К определению ра-
боты деформации.
Работа L против сил внешнего
давления, связанная с изменением объема
системы, носит название работы дефор-
мации. Поскольку Р – величина положи-
тельная,
δ
L и dV всегда имеют одинако-
вые знаки:
18
если dV > 0, то и
δ
L > 0, т.е. при
расширении работа тела положительна,
при этом тело само совершает работу;
если же dV < 0, то и
δ
L < 0, т. е.
при сжатии работа тела отрицательна: это
означает, что не тело совершает работу, а
на его сжатие затрачивается работа из-
вне.
Единицей измерения работы в СИ
является джоуль (Дж).
Отнеся работу деформации к 1 кг
массы рабочего тела, получим:
l = L/ m;
δ
l =
δ
L/ m = pdV/ m =
= pd(V/ m) = pdv. (2.5)
Величина l, представляющая со-
бой удельную работу, совершаемую сис-
темой, содержащей 1 кг газа, равна:
∫
=
2
1
v
v
pdvl . (2.6)
Поскольку в общем случае р – ве-
личина переменная, то интегрирование
возможно лишь тогда, когда известен за-
кон изменения давления p = p(v).
Формулы (2.3) – (2.6) справедливы
только для равновесных процессов, при
которых давление рабочего тела равно
давлению окружающей среды.
В термодинамике для исследова-
ния равновесных процессов широко ис-
пользуют р,v – диаграмму, в которой
осью абсцисс служит удельный объем, а
осью ординат – давление. Поскольку со-
стояние термодинамической системы оп-
ределяется двумя параметрами, то на
р,v – диаграмме оно изображается точ-
кой.
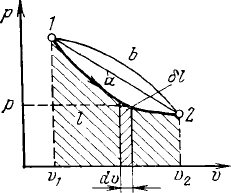
Рисунок 2.2. – Графическое изо-
бражени
е работы деформации в
р,v – координатах.
На рисунке 2.2 точка 1 соответст-
вует начальному состоянию системы,
точка 2 – конечному, а линия 12 – про-
цессу расширения рабочего тела от v
1
до
v
2
.
При бесконечно малом изменении
объема dv площадь заштрихованной вер-
тикальной полоски равна pdv =
δ
l, следо-
вательно, работа процесса 12 изобража-
ется площадью, ограниченной кривой
процесса, осью абсцисс и крайними ор-
динатами. Таким образом, работа изме-
нения объема эквивалентна площади под
кривой процесса в диаграмме р,v.
Каждому пути перехода системы
из состояния 1 в состояние 2 (например,
12, 1а2 или 1b2) соответствует своя рабо-
та расширения: l
1b2
> l
1a2
> l
12
. Следова-
тельно, работа зависит от характера тер-
модинамического процесса, а не является
функцией состояния системы в отличие
от давления, температуры и т.д. С другой
стороны,
∫
pdv зависит от пути интегри-
рования, и, следова
тельно, элементарная
работа
δ
l не является полным диффе-
ренциалом и не может быть представлена
соотношением, аналогичным (2.1).
Работа всегда связана с переме-
щением макроскопических тел в про-
странстве, например перемещением
поршня, деформацией оболочки, поэтому
она характеризует упо
рядоченную
(макрофизическую) форму передачи
энергии от одного тела к другому и явля-
ется мерой переданной энергии.
Поскольку величина
δ
l пропор-
циональна увеличению объема, то в каче-
стве рабочих тел, предназначенных для
преобразования тепловой энергии в ме-
ханическую, целесообразно выбирать та-
кие, которые допускают значительное
увеличение объема. Этим качеством об-
ладают газы и пары жидкостей. Поэтому,
например, на тепловых электрических
станциях рабочим телом служат пары во-
ды, а в двигателях внутреннего сгорания
– газообразные продукты сгорания того
или иного топлива.
19
2.3 Теплота
Помимо макрофизической формы
передачи энергии – работы существует
также и микрофизическая, т.е. осуществ-
ляемая на молекулярном уровне форма
обмена энергией между системой и ок-
ружающей средой. В этом случае энергия
может быть передана системе без совер-
шения работы. Мерой количества пере-
данной энергии служит теплота.
Теплота может передаваться либо
непосредственным контактом между те-
лами (теплопроводностью, конвекцией),
либо на расстоянии (излучением), причем
во всех случаях этот процесс возможен
только при наличии разности температур
между телами.
Как будет показано ниже, элемен-
тарное количество теплоты
δ
Q, так же
как и
δ
L , не является полным дифферен-
циалом в отличие от дифференциала
внутренней энергии dU. За этой матема-
тической символикой скрыт глубокий
физический смысл различия понятий
внутренней энергии, теплоты и работы.
Внутренняя энергия – это свой-
ство самой системы, она характери
зует
состояние системы. Теплота и работа –
это энергетические характеристики про-
цессов механического и теплового взаи-
модействий системы с окружающей сре-
дой. Они характеризуют те количества
энергии, которые переданы системе через
ее границы в определенном процессе.
2.4 Аналитическое выражение первого закона термодинамики
Первый закон термодинамики
представляет собой частный случай все-
общего закона сохранения и превраще-
ния энергии применительно к тепловым
явлениям.
Закон сохранения и превращения
энергии является фундаментальным за-
коном природы, который получен на ос-
нове обобщения огромного количества
экспериментальных данных и применим
ко всем явлениям природы. Он утверж-
дает, что энергия не исчезает и не возни-
кает вновь, она лишь переходит из одной
формы в другую, причем убыль энергии
одного вида дает эквивалентное количе-
ство энергии другого вида.
Пусть некоторому рабочему телу с
объемом V и массой m, имеющему тем-
пературу Т и давление р, сообщается из-
вне бесконечно малое количество тепло-
ты
δ
Q. В результате подвода теплоты те-
ло нагреется на dТ и увеличится в объеме
на dV.
Повышение температуры тела сви-
детельствует об увеличении кинетичес-
кой энергии его частиц. Увеличение объ-
ема тела приводит к увеличению рас-
стояния между молекулами. Так как меж-
ду молекулами реального газа существу-
ют силы взаимного притяжения, то это в
свою очередь ведет к увеличению потен-
циальной энергии частиц. В результате
внутренняя энергия тела увеличивается
на dU. Поскольку рабочее тело окружено
средой, которая оказывает на него давле-
ние, то при своем расширении оно про-
изводит механическую работу
δ
L
против
сил внешнего давления. Так как никаких
других изменений в системе не про-
исходит, то по закону сохранения энер-
гии
δ
Q = dU +
δ
L, (2.7)
т.е. теплота, сообщаемая системе, идет на
приращение ее внутренней энергии и на
совершение внешней работы.
Полученное уравнение является
математическим выражением первого за-
кона термодинамики. Каждый из трех
членов этого соотношения может быть
положительным, отрицательным и рав-
ным нулю. Рассмотрим некоторые част-
ные случаи:
1.
δ
Q = 0 – теплообмен системы с
окружающей средой отсутствует, т.е. те-
плота к системе не подводится и от нее
20
не отводится. Процесс при отсутствии
теплообмена называется адиабатным.
Для него уравнение (2.7) принимает вид:
δ
L = – dU. (2.8)
Следовательно, работа расшире-
ния, совершаемая системой в адиабатном
процессе, равна уменьшению внутренней
энергии данной системы. При адиабат-
ном сжатии рабочего тела затрачиваемая
извне работа целиком идет на увеличение
внутренней энергии системы.
2.
δ
L = 0 – при этом объем тела не
изменяется. Такой процесс называется
изохорным, для него
δ
Q =
δ
U, (2.9)
т.е. количество теплоты, подведенное к
системе при постоянном объеме, равно
увеличению внутренней энергии данной
системы.
3. dU = 0 – внутренняя энергия
системы не изменяется и
δ
Q =
δ
L, (2.10)
т.е. сообщаемая системе теплота перехо-
дит в эквивалентную ей внешнюю рабо-
ту.
Для системы, содержащей 1 кг
рабочего тела,
δ
q = du +
δ
l. (2.11)
Проинтегрировав уравнения (2.7)
и (2.11) для некоторого процесса, полу-
чим выражение первого закона термоди-
намики в интегральной форме:
Q =
∆
U + L и q =
∆
и + l, (2.12)
где
∆
U = U
2
– U
1
,
∆
u = u
2
– u
1
.
2.5 Теплоемкость газов и их смесей
Отношение количества теплоты
δ
Q, полученного телом при бесконечно
малом изменении его состояния, к свя-
занному с этим изменению температуры
тела dT называется теплоемкостью тела
в данном процессе:
C =
δ
Q/ dT.
Обычно величину теплоемкости
относят к единице количества вещества и
в зависимости от выбранной единицы
различают:
1) удельную массовую теплоем-
кость с, отнесенную к 1 кг газа и изме-
ряемую в Дж/(кг·К);
2) удельную объемную теплоем-
кость с', отнесенную к количеству газа,
содержащегося в 1 м
3
объема при нор-
мальных физических условиях, и изме-
ряемую в Дж/(м
3
·К);
3) удельную мольную теплоем-
кость
µ
с, отнесенную к одному киломо-
лю и измеряемую в Дж/ (кмоль·К).
Зависимость между удельными
теплоемкостями устанавливается очевид-
ными соотношениями:
с =
µ
с/
µ
; с' =
µ
с/ 22,4;
с' = с
ρ
н
. (2.13)
Здесь 22,4 м
3
и
ρ
н
– объем одного кило-
моля и плотность газа при нормальных
условиях.
Изменение температуры тела при
одном и том же количестве сообщаемой
теплоты зависит от характера происхо-
дящего при этом процесса, поэтому теп-
лоемкость является функцией процесса.
Это означает, что одно и то же рабочее
тело в зависимости от процесса требует
для своего нагревания на один градус
различного количества теплоты. Числен-
но величина с изменяется в пределах от
+∞ до – ∞.
В термодинамических расчетах
большое значение имеют:
теплоемкость при постоянном
давлении
