Страйер Л. Биохимия. Том 3
Подождите немного. Документ загружается.

на холин. Фермент, катализирующий эту ре-
акцию,- холин-ацетилтрансфераза (холин-
ацетилаза). Далее часть образовавшегося
ацетилхолина попадает в синаптические
пузырьки, а часть остается в цитозоле.
В одном холинергическом синаптическом
пузырьке (обычно 400 А диаметром) содер-
жится около 10000 молекул ацетилхолина.
Изучению синаптической функции значи-
тельно способствовало выделение синапто-
сом из гомогената нервной ткани. Синапто-
сомы представляют собой пресинаптиче-
ские окончания, образующие в процессе
выделения замкнутые структуры. Они пред-
ставляют собой мешочки из пресинаптиче-
ской мембраны, содержащей митохондрии,
цитозоль и синаптические пузырьки.
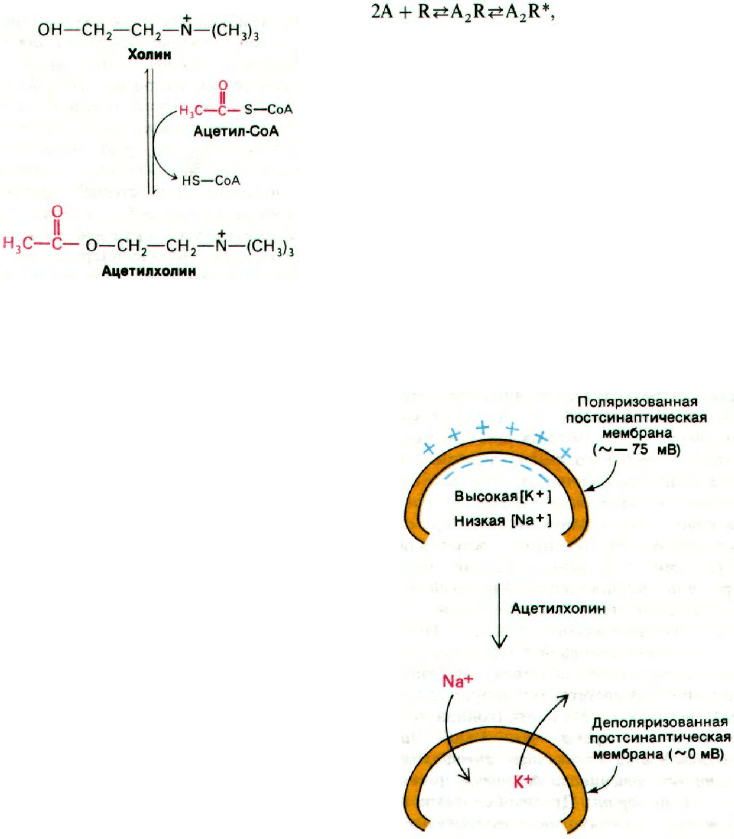
37.4. Ацетилхолин открывает
в постсинаптической мембране каналы
для катионов
Потенциал покоя постсинаптической мем-
браны или мембраны двигательной конце-
вой пластинки составляет примерно —
—75 мВ. При взаимодействии ацетилхо-
лина со специфическими рецепторами про-
исходит резкое изменение проницаемости
этих мембран (рис. 37.7). В течение 0,1 мс
значительно возрастает проводимость как
Na
+
, так и К
+
, и возникает сильный ток
Na
+
внутрь клетки и более слабый ток К
+
из клетки. Ток Na
+
в клетку приводит к де-
поляризации постсинаптической мембраны
и инициирует возникновение потенциала
действия в соседнем (постсинаптическом)
нейроне или мышечном волокне. Ацетилхо-
лин раскрывает катионные каналы только
одного типа, характеризующиеся почти оди-
наковой проницаемостью для Na
+
и К
+
. Ес-
ли поток Na
+
при действии ацетилхолина
оказывается большим, чем поток К
+
, то это
обусловлено лишь большей крутизной элек-
трохимического градиента концентрации
Na
+
по сравнению с К
+
.
Две молекулы ацетилхолина связываются
с молекулой рецептора, вызывая при этом
такие изменения конформации, которые от-
крывают канал. Схематически кинетику
процесса, согласующуюся с эксперимен-
тальными данными, можно описать уравне-
нием
где А - молекула ацетилхолина, R - закры-
тый канал, R* - открытый канал. За полупе-
риод жизни открытого канала, равный всего
лишь 1 мс, по нему проходит примерно 10
4
ионов. Продолжительное воздействие аце-
тилхолина на рецептор приводит к его де-
сенсибилизации: канал закрывается и реак-
ция на ацетилхолин исчезает на длительный
промежуток времени.
37.5. Ацетилхолин высвобождается
квантами
Проведенное Бернардом Катцем (Bernard
Katz) изучение передачи нервного импульса
Рис. 37.7. Ацетилхолин деполяризует
постсинаптическую мембрану
путем увеличения Na
+
и К
+
проводимости.
37. Возбудимые мембраны
и сенсорные системы
331
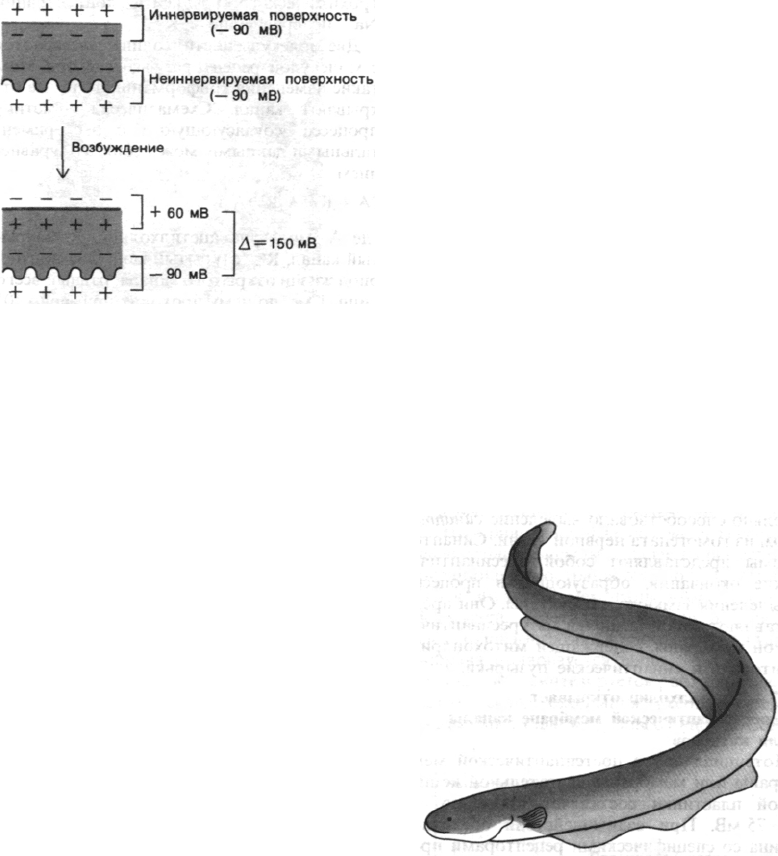
Рис. 37.8. Генерирование напряжения
в электрической пластинке
электрического угря.
в участках нервно-мышечного соединения
показало, что ацетилхолин высвобождается
из пресинаптической мембраны порциями
по 10
4
молекул. Доказательство квантового
высвобождения ацетилхолина было получе-
но при анализе мембранного потенциала
двигательных концевых пластинок, ко-
торым свойственна спонтанная электриче-
ская активность даже в отсутствие стимуля-
ции нерва. Деполяризующие импульсы
с амплитудой 0,5 мВ и длительность около
20 мс возникают залпами. Это так назы-
ваемые миниатюрные потенциалы концевых
пластинок; они возникают случайно с ве-
роятностью, сохраняющейся постоянной на
протяжении длительного времени. Миниа-
тюрный потенциал концевой пластинки вы-
зывается спонтанным высвобождением оди-
ночного синаптического пузырька. Полная
деполяризация концевой пластинки, созда-
ваемая потенциалом действия, обусловлена
синхронным высвобождением примерно 100
«квантов» («пакетов») ацетилхолина за бо-
лее короткое время чем 1 мс. Число
высвобождающихся квантов ацетилхолина
зависит от потенциала действия пресинап-
тической мембраны. Другими словами, выс-
вобождение ацетилхолина представляет со-
бой электрически регулируемую форму се-
креции. Высвобождение ацетилхолина зави-
сит от присутствия Са
2+
во внеклеточной
жидкости. При деполяризации пресинапти-
ческой мембраны происходит вход
Са
2+
,
332
Часть V.
Молекулярная физиология
что способствует слиянию на короткий срок
мембраны синаптических пузырьков с пре-
синаптической мембраной.
37.6. При добавлении ацетилхолина
реконструированные мембранные пузырьки
становятся проницаемыми для катионов
В последние годы сделаны большие успехи
в очистке ацетилхолиновых рецепторов
и реконструировании функционально ак-
тивных мембранных пузырьков. Наиболее
подходящий исходный материал для таких
исследований - электрический орган элек-
трической рыбы, например Torpedo (элек-
трический скат), который очень богат холи-
нергическими постсинаптическими мембра-
нами. Электрический орган образован из
колонок клеток, называемых электрически-
ми пластинками. Одна сторона клеток (ин-
нервируемая поверхность) снабжена нерв-
ными окончаниями и электрически возбуди-
ма. Другая сторона (неиннервируемая по-
верхность) образует многочисленные склад-
Electrophorus electricus, амери-
канский электрический угорь.
ки и электрически невозбудима. Разность
потенциалов, возникающая при стимуляции
электрических пластинок, обусловлена
асимметрией ответа двух поверхностей.
У такой электрической рыбы, как Electropho-
rus, мембранный потенциал иннервируемой
поверхности при возбуждении сдвигается с
—90 до +60 мВ, тогда как на неиннерви-
руемой поверхности сохраняется —90 мВ.
Следовательно, в пик потенциала действия
разность потенциалов между наружными
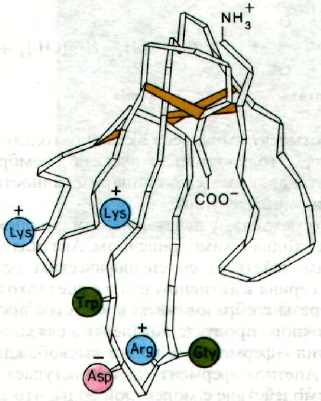
Рис. 37.9. Трехмерная структура нейро-
токсина, блокирующего рецеп-
тор ацетилхолина. Этот нейро-
токсин вырабатывается у мор-
ских змей. (Печатается с любез-
ного разрешения д-ра
Demetrius Tsernoglou и д-ра
Gregory Petsko.)
поверхностями двух сторон составляет
150 мВ (рис. 37.8). Электрические пластинки
электрического органа соединены парал-
лельно, и, следовательно, их разность потен-
циалов складывается. Орган, состоящий из
5000 рядов электрических пластинок, может,
таким образом, генерировать разряд
в 750 В. Интересно отметить, что электриче-
ские пластинки электрического угря эволю-
ционно возникли из мышечных клеток. При
этом они сохранили электрически возбуди-
мую наружную мембрану мышцы, но утра-
тили аппарат сокращения. Электрический
орган Electrophorus - великолепный источ-
ник Na
+
-каналов.
Еще один экзотический биологический
материал оказался бесценным источником
ацетилхолиновых рецепторов. Для того,
чтобы идентифицировать рецептор в смеси
макромолекул, его необходимо специфиче-
ски пометить. Для этого используют нейро-
токсины змей, в частности α-бунгароток-
син из яда одной змеи с о. Тайвань
и кобратоксин (из яда кобры). Указанные
нейротоксины блокируют нейромышечное
проведение, связываясь с рецепторами аце-
тилхолина на двигательных концевых пла-
стинках или на иннервируемой поверхности
электрических пластинок электрического
органа. Нейротоксины представляют собой
небольшие основные белки (7 кДа). Их мож-
но пометить радиоактивным изотопом
с высокой удельной радиоактивностью. Для
этого их либо иодируют иодом-125, либо
превращают в шиффово основание с пири-
доксальфосфатом с последующим восста-
новлением образованного продукта
3
М-боргидридом. Меченый кобратоксин
прочно связывается с ацетилхолиновым ре-
цептором (константа диссоциации - порядка
10
-9
М) и, что особенно важно, практически
не связывается с другими макромолекулами
постсинаптической мембраны. Таким обра-
зом, рецептор ацетилхолина можно специ-
фически пометить радиоактивным атомом.
Путем обработки фрагментов мембраны
неионным детергентом (таким, как про-
изводное полиоксиэтилена твин-80) удалось
солюбилизировать рецепторы ацетилхо-
лина электрического органа. Полученный
раствор фракционировали методами гель-
фильтрации и ионообменной хроматогра-
фии. Последним этапом очистки была аф-
финная хроматография на колонке, содер-
жащей ковалентно связанный кобратоксин.
В итоге был получен рецептор, очищенный
в 10000 раз. Ацетилхолиновый рецептор
представляет собой комплекс массой
270 кДа, состоящий из четырех типов субъе-
диниц. Субъединица 40 кДа метится по
сродству радиоактивными соединениями,
содержащими группу триметиламмония,
что указывает на наличие в ней участка
связывания ацетилхолина. Удалось полу-
чить мембранные пузырьки, содержащие
очищенные рецепторы ацетилхолина; для
этого к раствору рецепторов добавляли
фосфолипиды и затем удаляли диализом де-
тергент. Показано, что радиоактивные ионы
натрия (
22
Na
+
), включенные в процессе ре-
конструирования пузырьков в их внутреннее
водное пространство, высвобождаются при
добавлении ацетилхолина или его аналогов,
например карбамоилхолина (рис. 37.10).
Высвобождение ионов натрия блокируют
бунгаротоксин и обычные антагонисты аце-
тилхолина; следовательно, оно опосредова-
но специфическим взаимодействием ацетил-
холина со связанным с мембраной рецепто-
ром.
37. Возбудимые мембраны
и сенсорные системы
333
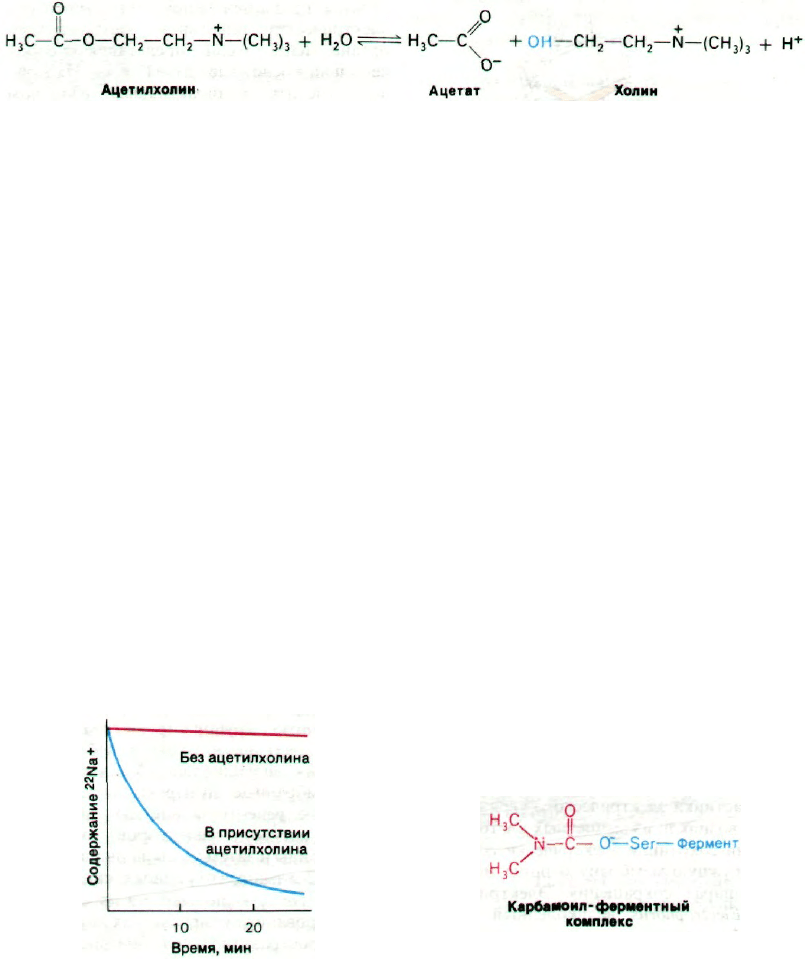
37.7. Ацетилхолин быстро гидролизуется,
и концевая пластинка реполяризуется
Для восстановления возбудимости пост-
синаптической мембраны необходимо вы-
ключение деполяризующего сигнала. Эту
функцию выполняет ацетилхолинэстераза,
открытая Дэвидом Нахманзоном (David
Nachmansohn) в 1938 г. Фермент гидроли-
зует ацетилхолин до ацетата и холина. В ре-
зультате проницаемость постсинаптической
мембраны возвращается к исходному уров-
ню и мембрана реполяризуется. Ацетилхо-
линэстераза локализована в синаптической
щели, где она связана с сетью из коллагена
и гликозамингликанов, поступающих из
постсинаптической клетки. Масса фермента
260 кДа, субъединичная структура - α
2
β
2
.
Ацетилхолинэстеразу можно легко отде-
лить от ацетилхолиновых рецепторов. Фер-
мент характеризуется поразительно высо-
ким числом оборотов, а именно 25000 с
-1
.
Это означает, что одна молекула ацетилхо-
лина расщепляется за 40 мкс. Такое высокое
число оборотов фермента имеет очень важ-
ное значение для быстрого восстановления
поляризованного состояния постсинаптиче-
ской мембраны. Синапсы способны переда-
Рис. 37.10. Ацетилхолин вызывает высво-
бождение Na
+
из реконструи-
рованных мембранных
пузырьков, содержащих аце-
тилхолиновый рецептор. По
оси ординат отложено содер-
жание
22
Na
+
в
синаптических
пузырьках.
334
Часть V.
Молекулярная физиология
вать тысячу импульсов в секунду только по-
тому, что постсинаптическая мембрана
восстанавливает свою поляризованность за
доли миллисекунды.
По механизму действия ацетилхолинэсте-
раза сходна с химотрипсином. Ацетилхолин
взаимодействует со специфическим остат-
ком серина в активном центре ацетилхолин-
эстеразы с образованием в качестве проме-
жуточного продукта ковалентно связанного
ацетил—фермента, а холин высвобождает-
ся. Ацетил—фермент далее вступает во
взаимодействие с молекулой воды, что при-
водит к образованию ацетата и регенериро-
ванного свободного фермента (рис. 37.12).
37.8. Ингибиторы ацетилхолинэстеразы
используются как лекарственные средства
и как яды
Терапевтические и токсические свойства ин-
гибиторов ацетилхолинэстеразы нашли ши-
рокое практическое применение. Алкалоид
из калабарских бобов физостигмин (назы-
ваемый также эзерин) когда-то использовал-
ся при испытании ядом в судилище над кол-
дунами и ведьмами. Физостигмин и род-
ственные ему ингибиторы, например не-
остигмин, являются карбамоильными эфира-
ми (рис. 37.13). Они ингибируют ацетилхо-
линэстеразу путем образования ковалентно-
го промежуточного соединения, которое
очень медленно гидролизуется. Неостигмин
связывается с ацетилхолинэстеразой таким
образом, что его положительно заряженная
триметиламмониевая группа встает
в анионном участке фермента, а карба-
моильная группа оказывается рядом с реак-
ционноспособным остатком серина в участ-
ке этерификации. Далее происходит карба-
моилирование фермента и высвобождается
образующийся спирт. Последующий гидро-

Рис. 37.11. Электронная микрофотогра-
фия ацетилхолиновых рецепто-
ров в постсинаптической мем-
бране.(Печатается с любезного
разрешения д-ра John Heuser
и д-ра Steven Salpeter.)
лиз карбамоильного производного фермента
в отличие от гидролиза ацетил—фермента
происходит с очень низкой скоростью. В ито-
ге активный центр ацетилхолинэстеразы
оказывается прочно заблокированным. Не-
остигмин используется для лечения глау-
комы - болезни глаз, характеризующейся
повышенным внутриглазным давлением.
Механизм терапевтического эффекта сос-
тоит в том, что неостигмин ингибирует аце-
тилхолинэстеразу и тем самым усиливает
действие ацетилхолина.
Еще более мощные ингибиторы ацетил-
холинэстеразы - органические фторфос-
фаты, в частности диизопропилфторфосфат
(ДИФФ). Эти соединения реагируют с аце-
тилхолинэстеразой, образуя высокоста-
бильные ковалентные фосфорил-фермент-
ные комплексы (рис. 37.14). Как и при
взаимодействии с сериновыми протеиназа-
ми, фосфорильная группа ДИФФ связы-
вается с серином в активном центре фер-
мента.
Множество различных органических
фторфосфатов было синтезировано для ис-
пользования в качестве инсектицидов в сель-
ском хозяйстве, а также в качестве отра-
вляющих веществ - нервно-паралитических
ядов в химической войне (рис. 37.15). Эти со-
единения могут вызвать смерть путем оста-
новки дыхания. Наиболее токсичны из
них - табун и зарин. Паратион - инсектицид,
нашедший широкое применение в сельском
хозяйстве.
Путем использования радиоактивного
ДИФФ в качестве метки было определено
число молекул ацетилхолинэстеразы в кон-
цевой пластинке нерва в диафрагмальной
мышце мыши. Плотность фермента соста-
вила 12000 мкм
-2
, что почти равно числу
рецепторов ацетилхолина, определенному
с помощью радиоактивных нейротоксинов.
Таким образом, постсинаптическая мем-
брана очень богата и ацетилхолинэстеразой,
и ацетилхолиновыми рецепторами. При
передаче нервных импульсов, поступающих
с малой частотой, используется только не-
большая доля общего числа молекул фер-
мента. Однако проведение при высокой ча-
стоте импульсации требует участие множе-
ства молекул ацетилхолинэстеразы.
Рис. 37.12. Механизм каталитического
действия ацетилхолинэсте-
разы.
37. Возбудимые мембраны
и сенсорные системы
335
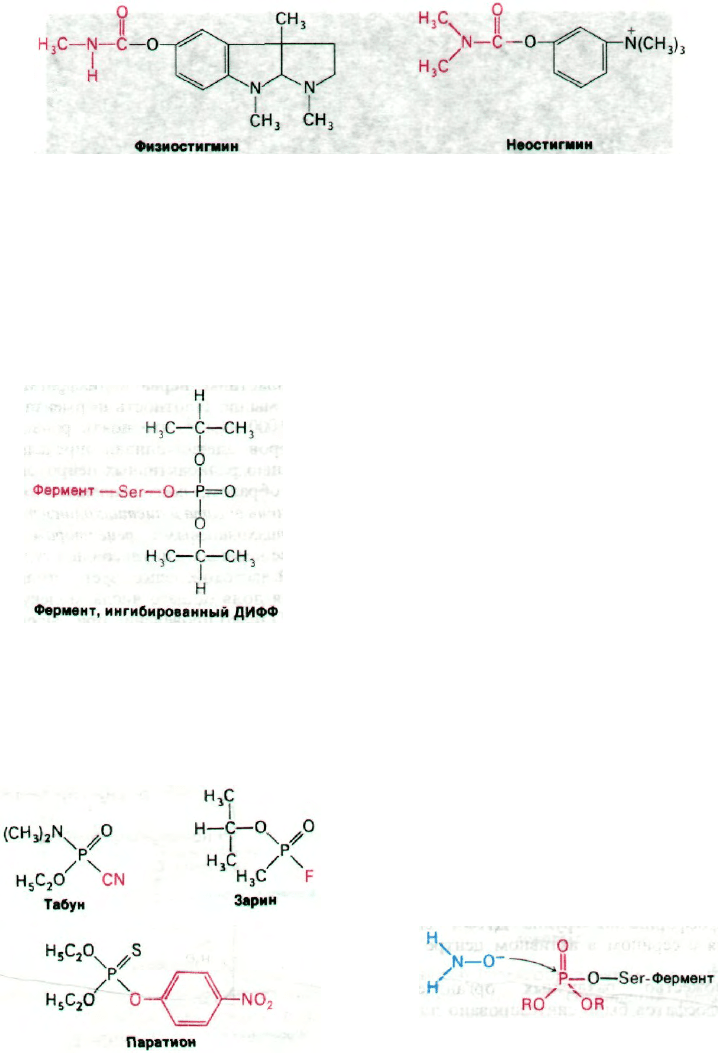
Рис. 37.13. Физостигмин и неостигмин ин-
гибируют ацетилхолинэстера-
зу путем карбамоилирования
серина в активном центре фер-
мента.
Рис. 37.14. Ингибированная диизопро-
пилфторфосфатом ацетилхо-
линэстераза.
Рис. 37.15. Структурные формулы не-
скольких органических фосфа-
тов - ингибиторов ацетилхоли-
нэстеразы.
336
Часть V.
Молекулярная физиология
37.9. Разработка антидота для лечения
отравлений органическими фосфатами
Ацетилхолинэстеразу, ингибированную ор-
ганическими фторфосфатами типа ДИФФ,
можно реактивировать производными ги-
дроксиламина (NH
2
OH). При разработке
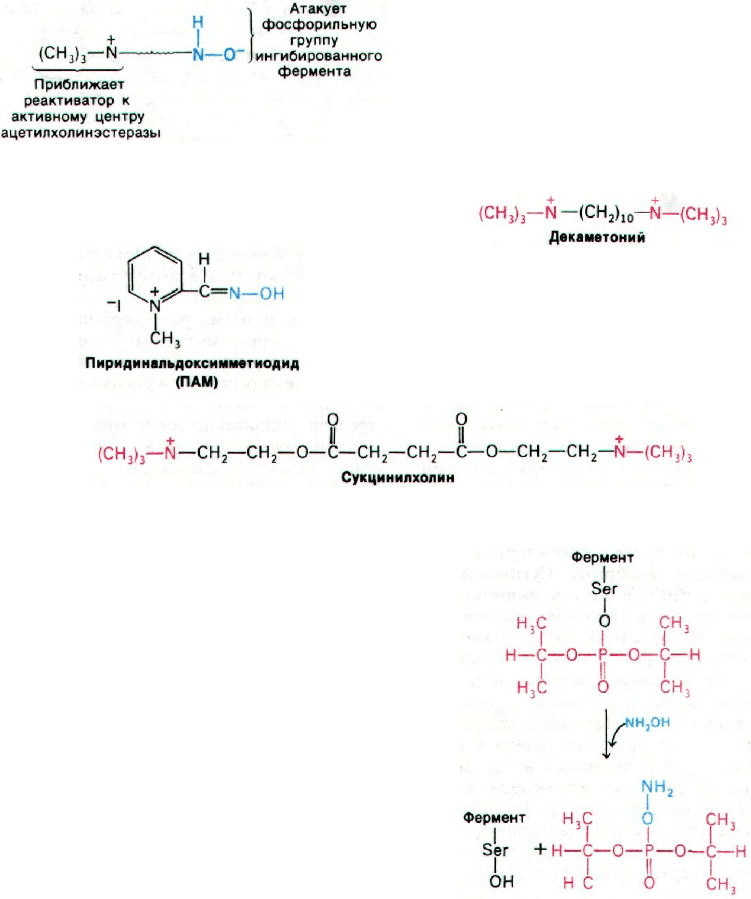
антидота исходили из обнаруженного Ирви-
ном Уилсоном (Irvin Wilson) факта, что ги-
дроксиламин высвобождает фосфорильную
группу, присоединенную к сериновому
остатку ингибированного фермента, и тем
самым реактивирует его (рис. 37.16). Задача
состояла в том, чтобы приспособить эту ре-
акцию для клинического использования.
Однако гидроксиламин нельзя использо-
вать in vivo, поскольку в тех высоких кон-
центрациях, которые необходимы для реак-
тивации ацетилхолинэстеразы, ингибиро-
ванной ДИФФ, он токсичен. Выбранный
Уилсоном подход состоял в том, чтобы най-
ти соединение, обладающее реакционной
способностью гидроксиламина, но со специ-
фичностью и очень высоким сродством
к ацетилхолинэстеразе. Относительно фер-
мента было известно, что на нем есть
анионный участок для связывания положи-
тельно заряженного остатка холина в аце-
тилхолине, и потому представлялось целе-
сообразным синтезировать производное ги-
дроксиламина, содержащее четвертичную
аммониевую группу. Возникал, однако, во-
прос, где должен стоять заместитель: при
атоме кислорода или азота гидроксила-
мина? Было обнаружено, что О-метилги-
дроксиламин лишен способности реактиви-
ровать фермент, тогда как N-метилгидрок-
силамин обладал такой активностью. Ги-
дроксильная группа реактиватора не может
быть замещена, поскольку именно анионная
форма соединения атакует атом фосфора
в ингибированном ферменте.
Следующий и основной этап состоял
в том, чтобы поместить четвертичную ам-
мониевую группу на необходимом растоя-
нии от нуклеофильного атома кислорода.
Более того, требовалось, чтобы по своей
ориентации эти группы были комплемен-
тарны анионному участку и атому фосфора
в ингибированном ферменте.
В качестве реактиваторов были испробо-
ваны многочисленные соединения, содержа-
щие четвертичную аммониевую группу и ги-
дроксиламинную функцию. Наиболее эф-
фективным среди них оказался 2-пири-
динальдоксимметиодид (ПАМ). Это соедине-
ние обладает устойчивой геометрией благо-
даря двойной связи в оксиме, которая спо-
собствует удержанию атома кислорода
в плоскости кольца.
ПАМ реактивирует ингибированную
ДИФФ ацетилхолинэстеразу в принципе по
тому же механизму, что и гидроксиламин.
Однако по эффективности 10
-6
М ПАМ со-
ответствует 1 М гидроксиламина. Такое по-
вышение эффективности в 1000000 раз по-
зволяет использовать ПАМ для лечения
отравлений органическими фосфатами.
Удивительная эффективность ПАМ обусло-
влена оптимальным расположением четвер-
тичной аммониевой группы по отношению
к нуклеофильному атому кислорода. Разра-
ботка этого препарата явилась вехой в раз-
витии рационального подхода к синтезу ле-
карственных препаратов.
37.10. Ингибиторы ацетилхолинового
рецептора
Блокаторами нервно-мышечного проведе-
ния служат также соединения, непосред-
ственно воздействующие на ацетилхоли-
новый рецептор. К ним относится кураре,
который на протяжении столетий использо-
вали южноамериканские индейцы. Вскоре
после возвращения Колумба из Америки
д'Ангера в своем сочинении «De Orbo novo»
отмечал, что «местные жители отравляли
стрелы соком смертельно-ядовитой травы».
Одним из активных компонентов кураре
является d-тубокурарин (рис. 37.17). Тубоку-
рарин ингибирует деполяризацию концевых
пластинок, конкурируя с ацетилхолином за
связывание с рецептором. Аналогичным пу-
тем действуют α-бунгаротоксин и кобраток-
син. В отличие от этого вещества типа дека-
метония соединяются с рецептором ацетил-
холина, вызывая устойчивую деполяризацию
концевой пластинки.
В хирургии в качестве препарата, вызы-
вающего расслабление мышц, используется
аналог ацетилхолина - сукцинилхолин.
Рис. 37.16. Реактивация гидроксилами-
ном ацетилхолинэстеразы, ин-
гибированной диизопропил-
фторфосфатом.
37. Возбудимые мембраны
и сенсорные системы
337
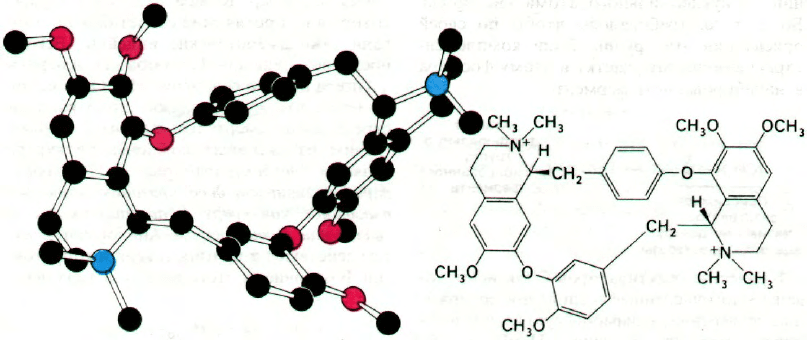
Рис. 37.17. Формула и модель d-тубоку-
рарина.
Сукцинилхолин крайне медленно гидро-
лизуется ацетилхолинэстеразой в пост-
синаптической мембране. Вследствие этого
он вызывает устойчивую деполяризацию
концевой пластинки. В то же время сукци-
нилхолин гидролизуется под действием ме-
нее специфических холинэстераз в плазме
и в печени; эти ферменты назвали плаз-
менными ацетилхолинэстеразами или
псевдохолинэстеразами для того, чтобы от-
личить их от ацетилхолинэстеразы пост-
синаптической мембраны. Сукцинилхолин
удобен тем, что при его использовании не-
рвно-мышечное проведение восстанавли-
вается вскоре после того, как перестают вво-
дить этот препарат. Однако в отдельных
случаях мышечное расслабление и паралич
дыхательных мышц сохраняются на протя-
жении многих часов. Дело в том, что в таких
случаях гидролиз сукцинилхолина у боль-
ных идет крайне медленно из-за сильно
сниженного сродства плазменной холин-
эстеразы к сукцинилхолину. Повышенная
чувствительность к сукцинилхолину [так же
как и памахину (разд. 15.11)] - пример гене-
тически детермированной лекарственной
идиосинкразии.
Если кроликов иммунизировать очи-
щенными ацетилхолиновыми рецепторами,
то спустя несколько недель после иммуниза-
ции у них наблюдается мышечная слабость
338
Часть V.
Молекулярная физиология
и быстрая утомляемость. Объясняется это
тем, что в результате иммунизации у них
вырабатываются антитела, реагирующие
с ацетилхолиновыми рецепторами их соб-
ственных нервно-мышечных соединений.
В итоге число функционально активных аце-
тилхолиновых рецепторов уменьшается, что
приводит к ухудшению нейромышечной
передачи. Развивающееся у этих кроликов
состояние очень напоминает тяжелую бо-
лезнь человека - миастению (myasthenia
gravis), и, действительно, в сыворотке
больных миастенией содержатся антитела,
направленные против собственных рецепто-
ров ацетилхолина. Другими словами,
myasthenia gravis является аутоиммунным
заболеванием, т. е. таким заболеванием, при
котором организм оказывается мишенью
действия собственной иммунной системы.
37.11. К числу нейромедиаторов относятся
также катехоламины и γ-аминомасляная
кислота (ГАМК)
Помимо ацетилхолина, известны и другие
нейромедиаторы. Вещество считается ней-
ромедиатором, если оно удовлетворяет сле-
дующим критериям. Во-первых, ми-
кроинъекции предполагаемого нейромедиа-
тора в синаптическую щель должны вызы-
вать такой же ответ, как возбуждение
пресинаптического нерва. Во-вторых, это ве-
щество должно в больших количествах при-
сутствовать в пресинаптических нервных
окончаниях. В этом отношении наиболее ве-
сомым критерием служит выделение синап-
тических пузырьков, содержащих это веще-
ство. В-третьих, постулированный медиатор
должен высвобождаться из пресинаптиче-
ского нерва в нужное время и в количестве,
достаточном для воздействия на постсинап-
тический нерв.
Этим критериям удовлетворяет ряд кате-
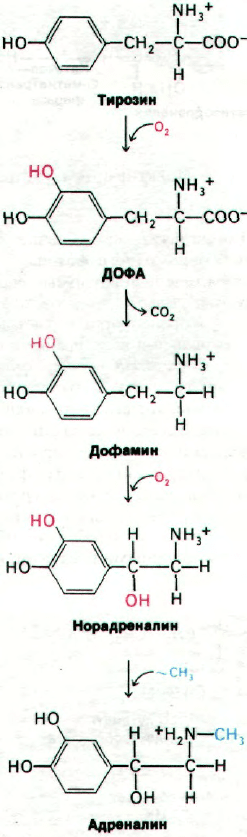
холаминов. Так, норадреналин является ме-
диатором в гладкомышечных соединениях,
которые иннервируются симпатическими
нервами (в отличие от парасимпатических
соединений, в которых нейромедиатором
служит ацетилхолин). Катехоламины адре-
налин и дофамин - два других катехолами-
новых нейромедиатора. Указанные катехол-
амины синтезируются из тирозина в оконча-
ниях симпатических нервов и в надпочечни-
ках (рис. 37.18). Первый этап синтеза (реак-
ция, лимитирующая скорость всего процес-
са) - гидроксилирование тирозина с образо-
ванием 3,4-дигидроксифенилаланина (ДО-
ФА). Данная реакция катализируется тиро-
зин-гидроксилазой - ферментом, аналогич-
ным фенилаланин-гидроксилазе. Активато-
ром молекулярного кислорода при этом
служит тетрагидробиоптерин - кофактор
фермента. Второй этап синтеза - декар-
боксилирование ДОФА, катализируемое
ДОФА-декарбоксилазой (ферментом, со-
держащим пиридоксальфосфат) с образова-
нием 3,4-дигидроксифенилэтиламина (до-
фамина). Далее дофамин гидроксилируется
в норадреналин в присутствии медьсодержа-
щей гидроксилазы. Наконец, из норадрена-
лина в результате метилирования образует-
ся адреналин; фермент, осуществляющий
эту реакцию,- трансметилаза, использую-
щая в качестве донора метильных групп
S-аденозилметионин.
Инактивация катехоламиновых нейроме-
диаторов осуществляется путем метилиро-
вания 3-ОН-группы катехолового кольца.
Реакцию катализирует катехол-О-метил-
трансфераза, использующая S-аденозилме-
тионин в качестве донора метильной
группы. Другой путь инактивации этих ней-
ромедиаторов - удаление аминогруппы
в ходе окисления моноаминоксидазой
(рис. 37.19).
Среди производных аминокислот выя-
влен еще один нейромедиатор. Это γ-амино-
бутират, называемый также γ-аминомасля-
ной кислотой (ГАМК). ГАМК увеличивает
проницаемость постсинаптических мембран
для К
+
и тем самым отдаляет мембранный
потенциал от порогового уровня, при кото-
ром возникает потенциал действия; таким
образом, ГАМК - это тормозный нейроме-
диатор. ГАМК образуется при декарбок-
силировании глутамата в реакции, ката-
Рис. 37.18. Путь биосинтеза катехолами-
новых нейромедиаторов.
лизируемой глутамат-декарбоксилазой
(рис. 37.20). Нетрудно предугадать, что про-
стетической группой этой декарбоксилазы
служит пиридоксальфосфат. γ-Аминобути-
рат инактивируется путем трансаминирова-
ния с образованием полуальдегида янтар-
ной кислоты, который далее окисляется
в сукцинат.
37. Возбудимые мембраны
и сенсорные системы
339

Рис. 37.19. Инактивация норадреналина.
37.12. Для возбуждения палочки сетчатки
глаза достаточно одного фотона
Рассмотрим теперь возбудимые рецепторы,
активируемые светом. У человека имеются
два типа фоторецепторных клеток, назы-
ваемых палочками и колбочками в соответ-
ствии с их формой. Колбочки функциони-
руют на ярком свету и ответственны за
цветовое зрение, тогда как палочки воспри-
нимают слабый свет, но не различают цвета.
В сетчатке глаза человека содержится 3 млн.
колбочек и 1 млрд. палочек. Эти фоторецеп-
торные клетки преобразуют энергию света
в движение атомов, а далее и в нервный им-
пульс. Палочки и колбочки образуют
синапсы с биполярными клетками, которые
Рис. 37.20. Синтез и инактивация γ-амино-
бутирата.
340
Часть V.
Молекулярная физиология
в свою очередь взаимодействуют с другими
нервными клетками в сетчатке. Электриче-
ские сигналы, генерированные фоторецеп-
торными клетками, преобразуются, прохо-
дя по сложной сети нервных клеток
в сетчатке, и затем передаются в мозг по во-
локнам зрительного нерва. Таким образом,
сетчатка выполняет две функции, а именно
трансформирует свет в нервные импульсы
и интегрирует зрительную информацию.
В 1938 г. Зелиг Хехт (Selig Hecht) открыл,
что для возбуждения палочки (клетки) сет-
чатки человека достаточно одного фотона.
Рассмотрим молекулярную основу исклю-
чительно высокой чувствительности этих
клеток. Палочки представляют собой тон-
кие удлиненные структуры диаметром обы-
чно 1 мкм и длиной 40 мкм. Основные
функции этой клетки четко разделены про-
странственно (рис. 37.22). Наружный сег-
мент палочки специализирован для фоторе-
цепции. В нем содержится примерно 1000
дисков, сложенных стопкой (рис. 37.23). Ди-
ски представляют собой закрытые упло-
щенные мешочки толщиной около 160 А.
Эти мембранные структуры насыщены фо-
торецепторными молекулами. Мембраны
дисков и плазматическая мембрана наруж-
ного сегмента не соприкасаются. Тонкая ре-
сничка соединяет наружный сегмент с вну-
тренним сегментом, богатым митохон-
дриями и рибосомами. Во внутреннем
сегменте с очень высокой скоростью выра-
батывается АТР и идет активный синтез
белков. Диски наружного сегмента имеют
срок жизни всего лишь 10 дней и постоянно
обновляются. Внутренний сегмент соприка-
сается с ядром, расположенным рядом
с синаптическим тельцем. Синаптическое
тельце, в котором содержится много синап-
тических пузырьков, образует синапс с би-
полярными клетками.
37.13. Родопсин - фоторецепторный белок
палочек
Для стимуляции фоторецепторных клеток
необходимо поглощение света. Поглощение
фотона света должно вызвать структурные
изменения светопоглошающей группировки
