Плетнев С.В. Магнитное поле: свойства, применение
Подождите немного. Документ загружается.

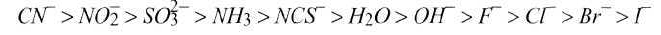
гурации 5d
1
и 4f
1
). Тем не менее магнетохимические исследования позволяют
установить электронную конфигурацию, как, наверное, уже заметил внима-
тельный читатель, соединений переходных металлов, которые составляют
основу химии координационных (комплексных) соединений.
Координационные соединения образуются, как правило, за счет донорно-
акцепторной связи, то есть неподеленные пары электронов лигандов занимают
вакантные места на орбиталях центрального атома. При этом количество не-
спаренных электронов и магнитный момент ионов-комплексообразователей
остается таким же, как и у свободного иона в газовой фазе. Это справедливо
для аквакомплексов переходных металлов, например железа(П) (рис. 4.7.3).
Однако существуют также магнитно-аномальные комплексы, магнитный мо-
мент которых ниже, чем у газообразного иона. Их электронную структуру
можно объяснить в рамках метода валентных связей следующим образом.
Очень многие комплексные соединения имеют координационное число шесть.
Шесть лигандов симметрично расположены в вершинах октаэдра. Для того
чтобы получить шесть гибридных орбиталей, в их образовании должны при-
нять участие шесть валентных орбиталей центрального атома: такое перерас-
пределение электронной плотности называется sp
3
d
2
-гибридизацией (ср. с
sp
3
-гибридизацией атома углерода в алканах, где четыре связи направлены к
вершинам тетраэдра). Обратите внимание, что в образовании гибридных ор-
биталей принимают участие d-орбитали с таким же порядковым номером, что
и s, p-орбитали. Это объясняется тем, что расположенные ниже по энергии
внутренние d-орбитали заняты собственными электронами иона металла. Для
того чтобы занять расположенные ниже по энергии орбитали, лиганды должны
вынудить собственные электроны иона металла спариться и освободить внут-
ренние d-орбитали для так называемой d
2
sp
3
-гибридизации. Это могут сделать
только лиганды сильного поля, образующие прочные связи с ионом металла,
например цианид-ионы в комплексном гексацианоферрате(П) (см. рис. 4.7.3).
Соответственно первый тип комплексов, обладающий высоким магнит-
ным моментом, называется внешнеорбитальным комплексом, а второй тип с
пониженным магнитным моментом — внутриорбитальным комплексом. Это
различие, приводящее к изменению числа неспаренных электронов в комплек-
се, приводит к изменению магнитных моментов внешне- и внутриорбитальных
комплексов соответственно и, вызвано энергетической неравноценностью со-
ответствующих d-орбиталей (обычно ее называют энергией расщепления в
поле лигандов и обозначают А или 10Dq [6]).
По способности образовывать внутриорбитальные комплексы (по величи-
не А) все лиганды можно расположить в ряд, который называется спектрохи-
мическим рядом лигандов
241
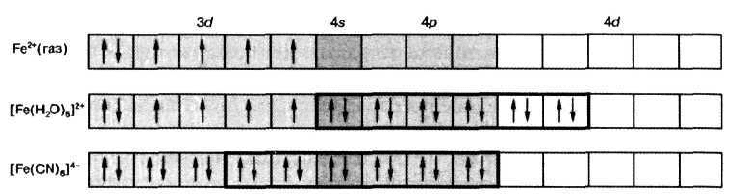
Рис. 4.7.3. Электронное строение внешне- и внутриорбитальных комплексов
железа (II)
Он получил свое название, потому что окраска комплекса зависит от
положения лиганда в этом ряду, и в этом проявляется связь оптических и
магнитных свойств координационных соединений [6].
Таким образом, измеряя магнитную восприимчивость, можно легко су-
дить о степени окисления и геометрии первой координационной сферы в
комплексе. Данные по магнитной восприимчивости ряда ионов переходных
металлов и лантанидов приведены в табл. 2. Видно, что магнитные свойства
3d-ионов в большинстве случаев хорошо соответствуют чисто спиновым зна-
чениям ц5, а для объяснения магнитных свойств лантанидов требуется уже
более сложная модель с привлечением упомянутого выше квантового числа J.
Известно, что большинство важных на практике химических реакций
протекают в растворах, к ним относятся также и реакции комплексообразова-
ния, поэтому в следующем разделе рассмотрим магнитные свойства растворов,
в которых соединения переходных металлов реализуются в виде комплексов.
Магнитная восприимчивость растворов
При переходе от твердого тела к раствору следует учитывать магнитные
восприимчивости растворителя и всех растворенных веществ. При этом про-
стейшим способом такого учета будет суммирование вкладов всех компонен-
тов раствора по правилу аддитивности. Принцип аддитивности - один из
основополагающих принципов в обработке экспериментальных данных. Вре-
менами он даже подводит экспериментаторов, потому что человеческому ра-
зуму трудно представить себе другой механизм взаимодействия разнообраз-
ных факторов, помимо простого их сложения. Любые отклонения от него чаще
связывают с тем, что сам принцип аддитивности выполняется, а компоненты
раствора изменяют свои свойства. Поэтому принимается, что магнитная вос-
приимчивость раствора равна сумме магнитных восприимчивостей отдельных
компонентов с учетом концентрации
242

где с
i
— концентрация (в моль/л), χ
мi
— молярная магнитная восприим-
чивость i-го компонента раствора, коэффициент 1/1000 используется для пере-
хода к молярной концентрации. При этом суммирование производится по всем
растворенным веществам и растворителю [1]. Можно заметить, что вклады
парамагнитных и диамагнитных веществ в измеряемую магнитную восприим-
чивость противоположны по знаку и их можно разделить
При исследовании магнитных свойств одного и того же вещества в разных
растворителях (табл. 3) видно, что они могут заметно зависеть от природы
растворителя. Это можно объяснить вхождением молекул растворителя в пер-
вую координационную сферу и изменением соответственно электронного
строения комплекса, энергий d-орбиталей (А) и других свойств сольватоком-
плекса. Таким образом, магнетохимия позволяет изучать и сольватацию, то
есть взаимодействие растворяемого вещества с растворителем.
В растворах определение χ
м
и μ
eff
координационных соединений позво-
ляет, как это видно из изложенного выше теоретического материала, опреде-
лить ряд структурных параметров (X, S, А), что делает магнетохимические
исследования весьма ценными. Разные комплексы одного и того же иона
металла могут заметно отличаться по величине эффективного магнитного
момента. На примере меди (II) видно, что при комплексообразовании эффек-
тивный магнитный момент увеличивается, а когда образуется димерный ком-
плекс — уменьшается вследствие антиферромагнитного взаимодействия не-
спаренных электронов ионов меди (II).
Таблица 3.
Влияние растворителя на магнитную восприимчивость CoCl
2
при 310 К
Растворитель
Вода
Метанол
Этанол
Триэтилфосфат
Ацетонитрил
см, 10
6
см
3
/моль
10380
10020
9545
9174
9039
μ
eff
, μ
Б
5,07
4,98
4,86
4,77
4,73
Магнитные свойства комплексных соединений меди(И) приведены ниже.
(При записи формул использованы сокращенные обозначения лигандов, при-
нятые в координационной химии: асас -- ацетилацетон СН
3
СОСН
2
СОСН
3
,
H
4
Tart — винная кислота НООС(СНОН)
2
СООН.
243
Вещество
[Си(Н
2
O)
6
]
2+
1,83
[CuClJ
2
] 1,88
[Cu(NH
3
)
4
]
2+
1,89
[Си(асас)
2
]
2+
1,95
[CuH
2
Tart] 1,91
[Cu
2
(HTart)
2
]
2
1,73
Несколько слов о "магнитной" воде, точнее, о водных растворах (по-
скольку даже в дистиллированной воде содержатся примеси, например раство-
ренный кислород, а он парамагнитен). Эта тема, конечно, требует отдельного
рассмотрения, мы затронем ее лишь в связи с магнетохимией. Если магнитное
поле влияет на свойства раствора, а многочисленные экспериментальные
факты (измерения плотности, вязкости, электропроводности, концентрации
протонов, магнитной восприимчивости) свидетельствуют, что это так [7], то
следует признать, что энергия взаимодействий отдельных компонентов рас-
твора и ансамбля молекул воды достаточно высока, то есть сопоставима или
превышает энергию теплового движения частиц в растворе, которое усредняет
всякое воздействие на раствор. Напомним, что энергия магнитного взаимодей-
ствия одной частицы (молекулы) мала по сравнению с энергией теплового
движения. Такое взаимодействие возможно, если принять, что в воде и водных
растворах за счет кооперативного характера водородных связей реализуются
большие льдоподобные структурные ансамбли молекул воды, которые могут
упрочняться или разрушаться под воздействием растворенных веществ [7].
Энергия образования таких "ансамблей", по-видимому, сопоставима с энер-
гией теплового движения и под магнитным воздействием раствор может запо-
мнить его и приобрести новые свойства, но броуновское движение или по-
вышение температуры ликвидирует эту "память" в течение некоторого време-
ни.
Обратите внимание, что, точно подбирая концентрации парамагнитных
веществ в диамагнитном растворителе, можно создать немагнитную жидкость,
то есть такую, средняя магнитная восприимчивость которой равна нулю или в
которой магнитные поля распространяются точно так же, как и в вакууме. Это
интересное свойство пока не нашло применения в технике.
Литература
1. Салъников Ю.И., Глебов А.Н., Девятое Ф.В. Магнетохимия и радиоспект-
роскопия координационных со единений. Казань: Изд-во Казан. ун-та, 1989. С.
4-33.
2. Каганов М.И., Цукерник В.М. Природа магнетизма.М.: Наука, 1982. 192
с. (Б-чка "Квант"; Вып. 16).
244
3. Ракитин Ю.В., Калинников В.Т. Современная магнетохимия. СПб.:
Наука, 1994. С. 18-30.
4. Вульфсон С.Г. Молекулярная магнетохимия. М.: Наука, 1991.262 с.
5. Керрингтон А., Мак-Лечлан Э. Магнитный резонанс и его применение в
химии: Пер. с англ. М.: Мир, 1970. 447 с.
6. Макашев Ю.А., Замяткина В.М. Соединения в квадратных скобках. Л.:
Химия, 1976. 216 с.
7. Сокольский Ю.М. Омагниченная вода: правда и вымысел. Л.: Химия,
1990. 144 с.
Источник: http://www.pereplet.ru/
4.8. Акустомагнитоэлектрический эффект
Акустомагнитоэлектрический эффект - возникновение поперечной
ЭДС под действием УЗ-волны в твердом проводнике, помещенном в магнит-
ное поле. Акустомагнитоэлектрический эффект обусловлен увлечением носи-
телей заряда УЗ-волной (см. Акустоэлектрический эффект) и отклонением
потоков носителей заряда магнитным полем. При прохождении ультразвука
через проводник с биполярной проводимостью (собственно полупроводник,
полуметалл) возникают потоки электронов проводимости и дырок в направле-
нии распространения УЗ. Под действием перпендикулярного к ним магнитно-
го поля эти потоки отклоняются в противоположные стороны. В результате
возникает эдс (или ток в случае электрически замкнутого проводника) в на-
правлении, перпендикулярном к магнитному полю и к УЗ-потоку. Таким об-
разом, акустомагнитоэлектрический эффект в биполярных проводниках ана-
логичен фотомагнитоэлектрическому эффекту с той разницей, что потоки
электронов и дырок обусловлены не градиентом концентрации носителей,
вызванным неоднородным освещением образца, а УЗ-волной.
В монополярных проводниках (примесных полупроводниках) происхож-
дение акустомагнитоэлектрического эффекта сложнее. Если в направлении
УЗ-потока образец электрически замкнут, то имеет место акустоэлектрический
эффект Холла, отличающийся от обычного Холла эффекта тем, что продоль-
ный (диссипативный) ток создается не внешним электрическим полем, а УЗ-по-
током. Если же в направлении распространения УЗ-потока образец разомкнут,
то возникает акустоэлектрическое поле, которое компенсирует действие УЗ-
волны на носители заряда так, что полный электрический ток в направлении
УЗ-потока будет равен нулю. Однако такая компенсация воздействия УЗ-по-
тока акустоэлектрическим полем имеет место не для каждого электрона в
отдельности, а лишь для некоторого "среднего" электрона. Изменение распре-
деления электронов по импульсам под действием УЗ-потока по своему виду
существенно отличается от того, которое вызывается электрическим полем.
Поэтому в зависимости от энергии для одних электронов преобладающим
245
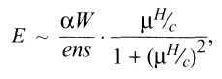
где е — заряд электрона, s — скорость звука, α — коэффициент поглощения
звука, W— плотность потока звуковой энергии, μ — подвижность носителей
тока, п — концентрация носителей тока, Н— напряженность магнитного поля.
Акустомагнитоэлектрический эффект возможен также в планарной кон-
фигурации, когда векторы звукового потока, магнитного поля и акустомагни-
тоэлектрического поля лежат в одной плоскости. В этом случае акустомагни-
тоэлектрический эффект является эффектом, четным по магнитному полю.
Первоначально предсказанный теоретически, акустомагнитоэлектричес-
кий эффект в дальнейшем был обнаружен экспериментально в (биполярных)
полуметаллах (Bi, графит) и монополярных полупроводниках (InSb, Те). По-
добно фотомагнитоэлектрическому эффекту, биполярный акустомагнитоэ-
лектрический эффект может быть использован для измерения скорости по-
верхностной рекомбинации и времени жизни носителей заряда в полупровод-
никах. Изучение акустомагнитоэлектрического эффекта в монополярных
полупроводниках дает информацию о механизмах рассеяния носителей.
4.9. Магнитная анизотропия и магнитострикция
4.9.1. Анизотропия ферромагнетиков
Хотя магнитное взаимодействие является малой поправкой к электричес-
ким обменным силам, обусловливающим самопроизвольную намагничен-
ность, тем не менее, они играют решающую роль во всем сложном комплексе
явлений технического намагничивания. Поэтому выяснение физической при-
роды магнитного взаимодействия в ферромагнетиках имеет не только теоре-
246
оказывается воздействие УЗ-потока, для других — воздействие компенсирую-
щего акустоэлектрического поля. В результате при равенстве нулю полного
акустоэлектрического (продольного) тока в образце будут существовать вза-
имно компенсирующиеся "парциальные" токи, создаваемые группами энерге-
тически различных электронов. Вследствие зависимости времени свободного
пробега электронов от их энергии средние подвижности электронов в этих
"парциальных" токах будут в общем случае различны. Токи Холла, образуемые
этими группами электронов, не будут компенсировать друг друга, и в направ-
лении, перпендикулярном к магнитному полю и УЗ-потоку, возникнут отлич-
ные от нуля акустомагнитоэлектрический ток (если образец замкнут в этом
направлении) или эдс (если образец разомкнут). Величина и даже знак акусто-
магнитоэлектрического эффекта в примесных полупроводниках зависят от
механизма рассеяния носителей заряда.
Акустомагнитоэлектрическое поле по порядку величины равно:
тическое значение, но необходимо и для ясного понимания механизма тех
физических процессов, которые обусловливают всю практическую ценность
явления ферромагнетизма.
Напомним, что ферромагнетиками называются вещества, в которых маг-
нитные моменты ориентированы вдоль выделенного направления.
Монокристаллы ферромагнетиков анизотропны в магнитном отношении.
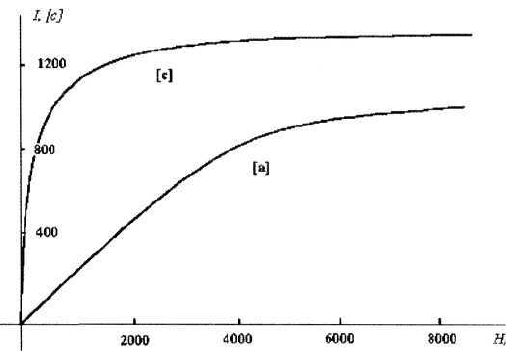
В качестве примера магнитокристаллической анизотропии на рис.4.9.1 приве-
дены кривые намагничивания I(Н) монокристалла кобальта, снятые вдоль
гексагональной оси (ось с) и перпендикулярно к ней (ось а). Как видно из
рисунка, если магнитное поле Н|| с, то достаточно приложить поле в несколько
сот эрстед для того, чтобы намагнитить кристалл до насыщения. При Н_|_ с
насыщение достигается только при Н ~ 10
4
Э.
Наиболее резко магнитная анизотропия, проявляется в кристаллах гекса-
гональной симметрии (Со, Tb, Dy). Из анализа кривых I(Н), снятых по различ-
ным кристаллографическим направлениям, следует, что в ферромагнитных
монокристаллах существуют направления, называемые "осями легкого намаг-
ничивания" (ОЛН), и направления, называемые "осями трудного намагничи-
вания" (ОТН).
Известно, что минимум свободной энергии магнитокристаллической ани-
зотропии достигается, когда намагниченность ориентирована вдоль ОЛН. Для
поворота I
S
из этих направлений требуется затрата определенной работы,
которая приводит к росту энергии магнитной или магнитокристаллической
анизотропии. Энергией магнитокристаллической анизотропии называют ту
часть энергии кристалла, которая зависит от ориентации вектора намагничен-
ности относительно кристаллографических осей.
Рис. 4.9.1. Кривые намагничивания I(H) монокристалла кобальта, снятые
вдоль гексагональной оси (ось с) и перпендикулярно к ней (ось а)
247
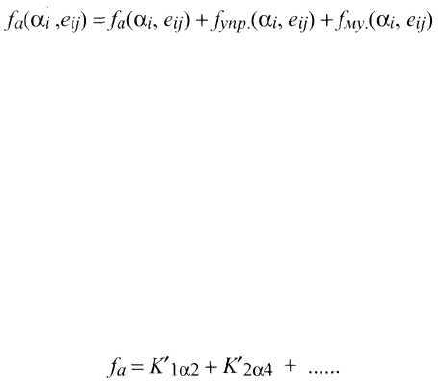
В случае кобальта эта энергия минимальна, если намагниченность направ-
лена вдоль оси с (при комнатной температуре). При вращении намагниченнос-
ти I
S
от оси с энергия анизотропии увеличивается с увеличением угла υ между
осью с и направлением I
S
, достигает максимума при υ=90°, т. е. при I
S
_|_ с, и
затем уменьшается до первоначального значения при υ=180°.
4.9.2. Спонтанная магнитострикция и ее вклад в магнитную
анизотропию
При возможных изменениях ориентации самопроизвольной намагничен-
ности в кристалле изменяются равновесные расстояния между узлами решет-
ки. Поэтому возникают самопроизвольные магнитострикционные деформа-
ции,
т.е.
Опр. При перемагничивании ферромагнетика имеет место магнитное вза-
имодействие электронов, которое влияет на межатомное расстояние, вызы-
вая деформацию кристаллической решетки, что сопровождается изменением
линейных размеров тела и появлением соответствующей магнитоупругой
энергии. Это явление называется магнитострикцией.
В частном случае кубического кристалла в отсутствие внешних напряже-
ний свободная энергия магнитного и упругого взаимодействия (с точностью
до шестых степеней в направляющих косинусах вектора I
S
и вторых степеней
тензора магнитострикционных напряжений), равна сумме энергии магнито-
кристаллической анизотропии f
a
, упругой энергии f
упр
и магнитоупругой энер-
гии
f
му
:
1) Можно феноменологическим путем получить выражение плотности fa
энергии магнитной анизотропии, раскладывая эту энергию в ряд по степеням
направляющих косинусов вектора намагниченности α
i
относительно осей сим-
метрии кристалла. Сначала найдем выражение f
a
для кобальта, имеющего
гексагональную решетку с ОЛН — с, для которого α
i
=α = cos (I
S
,c) = cos υ.
Для гексагональной решетки, обладающей центром симметрии, операция за-
мены α на -α должна оставлять энергию инвариантной относительно такого
преобразования симметрии. Следовательно, в разложении останутся только
члены с четными степенями а, т. е.
(2)
где K'
1α2
и K'
1α4
и т. д. — параметры магнитной анизотропии; f
a
чаще записы-
вают в следующем виде:
248
(1)

(3)
где К
1
и К
2
называют 1-й и 2-й константами магнитной анизотропии. Энергия
анизотропии кристаллов гексагональной системы в общем случае должна
зависеть от азимута φ. Но эта зависимость является очень слабой, и ею обычно
пренебрегают. Для кубических кристаллов, таких как Fe, Ni, энергия анизотро-
пии выражается в функции направляющих косинусов (α
1
, α
2
, α
3
) намагничен-
ности I
S
относительно трех ребер куба:
Кубический кристалл имеет также плоскости симметрии типа {ПО}. От-
ражение в этих плоскостях соответствует преобразованиям
Первым членом разложения энергии анизотропии кубического кристалла
по степеням α
1
, α
2
, α
3
, удовлетворяющим требованиям симметрии (5,6), явля-
ется α
1
2
+ α
2
2
+ α
3
2
, но этот член разложения всегда равен единице и, следова-
тельно, не описывает эффекта анизотропии.
Следующий член (четвертого порядка относительно α
i
), α
1
4
+ α
2
4
+ α
3
4
может быть приведен к виду
(4)
Энергия анизотропии должна быть такой функцией α
1
, α
2
, α
3
, которая
оставалась бы инвариантной при преобразованиях симметрии кубического
кристалла.
В кубическом кристалле плоскости типа [100] являются плоскостями
симметрии. Зеркальное отражение вектора Is в такой плоскости должно остав-
лять функцию fa(α
1
, α
2
, α
3
) инвариантной. Отражение, например, в плоскости
(100) заменяет α
1
на -α
1
оставляя α
2
и α
3
неизменными. Аналогично зеркаль-
ное отражение в плоскостях (010) и (001) изменяет знаки соответственно у α
2
и α
3
. Следовательно, функция fa(α
1
, α
2
, α
3
) должна быть инвариантной отно-
сительно преобразований
(5)
(6)
(7)
так как (α
1
2
+ α
2
2
+ α
3
2
)
2
= 1. Далее, член шестого порядка приводится к виду
249
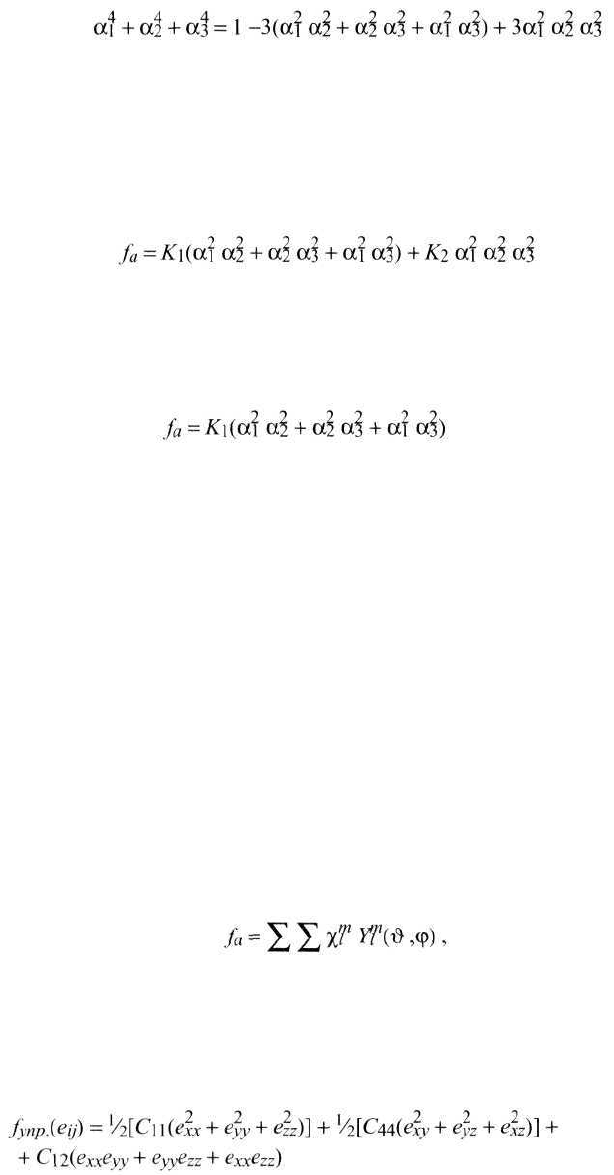
так как (α
1
2
+ α
2
2
+ α
3
2
)
3
= 1.
Энергия анизотропии на единицу объема кубического кристалла с точнос-
тью до членов шестого порядка относительно "i представляется в виде линей-
ной комбинации
Знаки констант анизотропии К
1
и K
2
и их относительная величина опре-
деляют то кристаллографическое направление, которое в данном кристалле
будет "легким".
Если K
1
>0, то первый член в (9) минимален при направлении намагничен-
ности вдоль осей [100], [010], [001], которые в этом случае являются осями
легкого намагничивания.
Если К
1
<0, то осями легкого намагничивания являются оси[111], [I11],
[1I1], [11I], так как первый член в энергии анизотропии (9) минимален, когда
намагниченность расположена вдоль этих осей.
Если учитывать и второй член в (9), то направление диагональной оси
[ 100] в тех случаях, когда К
1
отрицательна и меньше по абсолютной величине,
чем К
2
, также может быть направлением легкого намагничивания.
В заключение отметим, что в ряде случаев удобнее fa раскладывать в ряд
по сферическим функциям Y
m
l
(υ, φ) где υ — полярный угол, φ — азимут
вектора намагниченности по отношению к выбранной оси симметрии. Тогда
Часто членом К
2
α
1
2
α
2
2
α
3
2
, который обычно меньше первого члена в (9),
пренебрегают. Тогда:
(9)
(8)
(10)
(11)
(12)
где χ
l
m
- параметры, аналогичные константам анизотропии. Разложение (11)
справедливо для кристаллов любой симметрии (тип симметрии определяют
величины χ
l
m
, т. е. какие из этих коэффициентов обращаются в нуль).
250
2)
