Меерсон Г.А., Гагаринский Ю.В. (ред.). Металлургия циркония
Подождите немного. Документ загружается.

!
т
-Ё
.я
372
мвтАллуРгия
циРкония
;
ян!4я
нааноднь|й
процесс. ?о
>ке
самое наблюда-
вы3ь|вает
резкое увеличение
п0тенциала
ко''.{
лось
в^случа-е.цобавок
б}Р1
9909_д),
пирокате-
р0зии'
который
остается
более ни3ким'
чем
п!,1
хпна
(0,204
т}{),
моневины
(0,021
[|1),
двузамещен-
тенциал вь|деления
кислорода.
,{
ноцо
фо9Ф{а
аммо.ния
(0,0\м
)
и хлорида натрия
3а исключением
вл14яния' ока3ь1ваем0го
галь*
(0,о4
м).
Бнегшний
вид
п0верхности
электрода
иднь|ми соединениями'
все описаннь|е
явленип.}
п0сле
ан0дирования
не
описан.
наблюдались
при
исполь30вании аз0тнои
кисль'.]
ть!
различнь|х
к0нцентраций.
Разбавленная
азот.
'
ная
кислота
способствует образ0ванию
т0нког0-:
1 |ае,0вес% / [ у"*ся
в большинстве
других
электр0литов.
||ри
-
,25|
/- //
_] более вь:с0ких
концентрациях
Фразуется пленй,
Ё
,'']_
| //
_]
(:т9:'-.]]'.'"5!:^11р]'Р1:'::^.:^Р.*::'Р:
1р9,
х
'""г
! / / :
мата
калия), которая
затем
становится
нерноп,-!
в \ ! /|-$;вес'|. ]
-
';
!
,'|_
{ / /
_|
8лиянпе
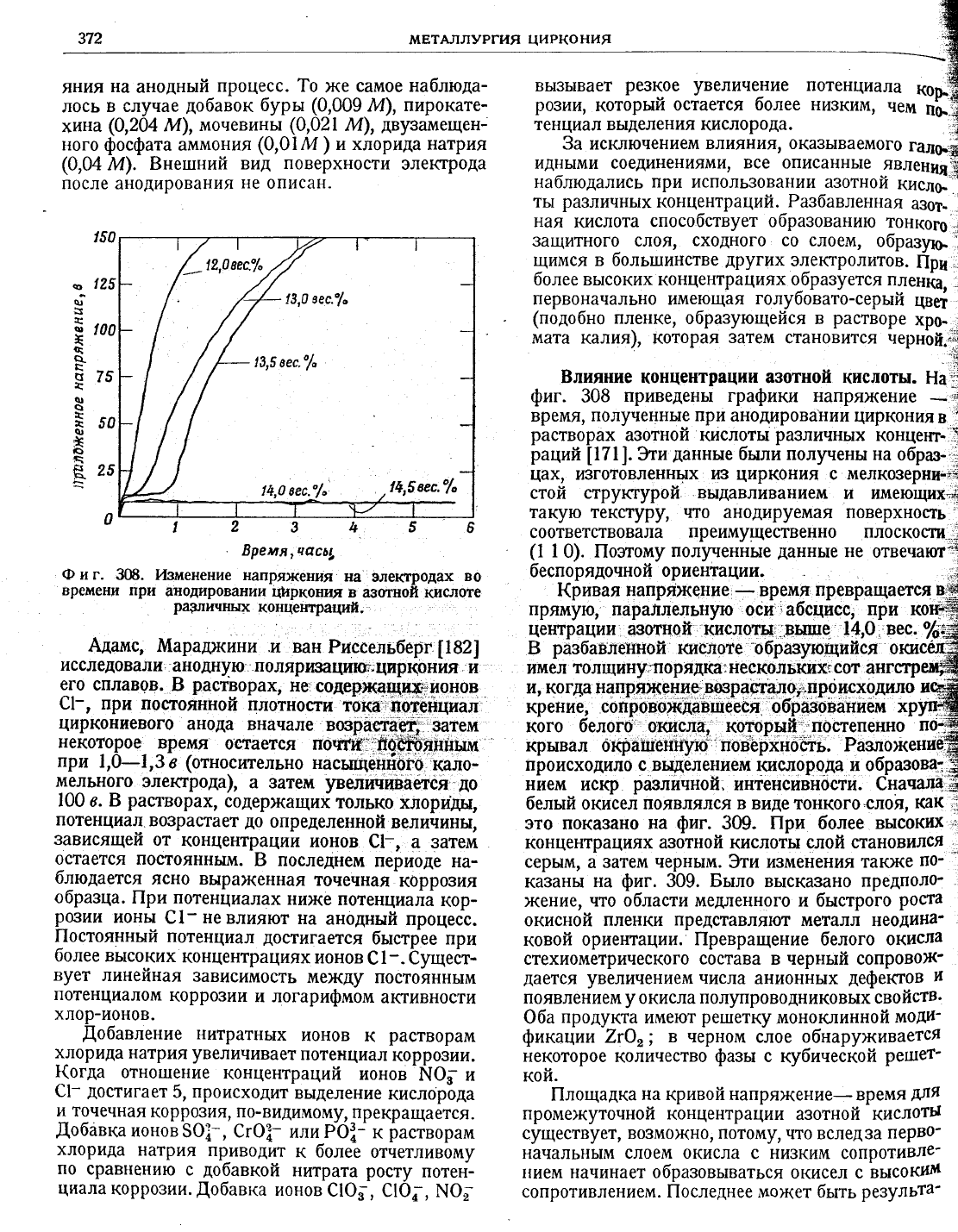
концентрации.а3отной кпслоты.
на1:
в [ ! / / [
ф"..
30в
приведень| графики напря)кени.
-,":
Ё
ло|_
! / /
-|
время' полученные
при
анодировании
цирконияв
"
*
--!
1 | | !
растворах
азотной кислотыразличнь|х
конце:п-ч
в
-1
! / / !
раций|\7\].}ти
данные
были полрены на
образ-
'
ь
2311
/ ] .| ,.----",1
йах,
изготовленных
к}циркония
с мелк0зерни-*
такую текстуру'
что
анодируемая п0верхность'
2
3 4''
5
6
соойветствовала
преимущественно
пл0скостп-;
8ремя,вась9
(1
1
0). ||оэтому
полшенные
даннь|е
не
отвечапог'}
Ф и г.
38. |,1зменение
напряя<ения
на
9лектродах
во
времени при
анодировании
циркония
в а3отной
кис.,1оте
беспоряАонной
ориентации.]!уу,1А9:пу(д 9Р!д9п
д
сч{д[|
]
:'.*
(ривая
напря}|(ение
- Ррем:т
преврат'1ается
Р€
]мую.' папаллельную'оёи',аб€|1!!€€:
пои
кон€
прямую,'
параллельную
оси
;абсцисс,
при
центрации
азотной
кислоты::эы
ше-' |4,0., вес,
ра9]'ичньгх
цонценцпаций.
..
фамс,
1!1араркин,
'
"."
гиёсельоерг
[1в2]
исслед0вали
анодную поляризацилс.цпрйнйя
й
его
сплавов.
8
растБорах,
не
со[е}}|(?4{|Ё$ионов
€1-, при
постоянной
плотности
токатот!Ёцйал"
циркониевого
ан0да
вначале
во3раста9т'
затем
некоторое'
врем'|
остается
почг|{::.й0'-{{фя|1ным
при
1,0-1,3
с
(относ:ттельно
насыйа!йЁо}о-'кало-
м_ельного
эле:орода)'
а 3атеш
рйййБаФёя'до
100
с.
8
растворах'
содер}кащих
только
хлоридд,
потенциал
во3растает
до
определенной
величины'
зависящей
от
концег{трации
ионов
€1=,
а затем
остается постоянным.
Б последнем
периоде
на_
блюдается
ясно выраженная
точечная-коррозия
образца. ||ри
-потенц
иалах
ниже
потенциала
кор_
розии
ионы
€1_
не
влияют
на
анодный
процес1.
|-1остоянный
потенциал
достигается
быстрее при
более вь[соких
концентрациях
ионов
€1_.
ёущеёт_
вует
линейная
3ависимость
ме)кду
постоянным
потенциалом
корро3ии
и логарифмом
активности
хлор-ион0в.
'[обавление
нитратнь!х
ионов
к
раств0рам
]торида
натрия
увеличивает
потенциал
корро3ии.
(огда
0тн0шение
концентраций
и0нов
_\Ф;
и
€1_
достигает
5,
происходит
вь|деление
кислорода
и точечная
к0р
р0зия'
по-
видимому'
-прекраща
ется.
.[об{вка
и0нов$Ф]_,
€гФ!_
или Р0!-'к
раств0рам
хл0рида
натрия
приводит
к
более
0тчетлив0му
п0
сравнению
с
добавкой
нитрата
росту
п0тен-
циала
к0рр0зии..[обавка
и0н0в
€1Ф;,
€19;, |,[Ф;
Б
разбавленной
кислще'образуюшийся
имел
толщину'поряд|€' нескольких сот
ан
и'
когда
напряженце,ц99ра9гадоЁпР! |{сходило
кре!|ие'
:
сопр6ЁожФ ёёёй,',-образоЁ1Ёием
кого
белого" о(,исл{,
-
который-.'постепенно
происходило с выделением
кислор0_да
и о[Разов;[:
нием
искр
разлияной'
интенсйвнбстй. €начада_:
бельгй оки1ел появлялся
в
виде тонкого.сло!т,
пок
:
это пока3а!{о
на
фиг.
3Ф. |[ри более
вБ€Ф(}1)(':
концентрациях
а3отной
кислоты
елой
станов!4лся
серым'
а 3атем
чернь!м.
3ти
изменения так}ке
п0-
ка3ань[
на
фиг.
309. Бьпло вь[сказано предпол0-
}кение'
что области меш|енного
и быстрого
роста
окисной
пленки
представляют
металл
неодина'
'
ковой
ориентации.
||ревращение
белого
окисла
стехиометрического с0става в нерньлй сопровож-
дается
увеличением
числа
анионных
дефекгов
и
появлением
у
окисла
п0лупроводниковых
свойств.
Фба
продукта
имеют
ре{шетку
моно}о1и}!ной
моди-
фикации
7гФ";
в
черном слое обнару>к|\вается
некоторое
к0личеств0
фазьт
с
кубинеской
Решет_
кой.
||лощадка
на
кривой
напряжение_время
А11$
проме}куточной
концентрации азотной
кислоты
существует'
возможно' потому,
что вслед3а
перв0_
начальнь|м сл0ем окисла
с
низким
с0противле_
|{ием начинает образовь|ваться
окисел с вь[соким
сопротивлением. |[оследнее может быть
резуль1а-
14'0 оес.!"'
,!4'$
вес.'/,

гл. ||. коРРозия
циРкония
и вго
сплАвов
373
том
п0степенн0го
израсходования
аз0тной
кисл0-
ть[
на
п0верхн0сти
раздела
кислота-0кисел.
Рот_
мен,
мак-кинней
и
9орнер
[181]
на
кривой
анод-
иое
напряжение-время
в сернокислых
растворах
наблю[али
небольйую
плфадку
при
1,3с
(по
0тно
шению
к Ё
9-Ё
9'$Ф.
электр
оду).'11,лина
это
й
площадки
уменьшалась,
когда
-
к0нцентрация
кислоть[
в0зрастала
от
0,2
до
2,06
н.
Авторьт
объяснили
эти явления
тем' что
по
мере
роста
толщинь|
слоя
пр0исходит
увеличение
падения
напряжения
в
нем
с п0следующим
выделением
кислор0да
в
результате
происходящего
при эт0м
электродного
пр0цесса.
-0Бойства
тонких
пленок.
|юнтершульше
14
Бетц
[167],
а
так)1(е
9арлсби
[183,
184]
исслед0-
вали
толщиЁу
и электрические
св0иства
т0нких
пленок'
полученных
в
разбавл9нцу-х
растворах-
Ротмен,
]у1ат|-(инней
и 9орнер
[181]'
)(а_ккерман
и
€еси{
[1в0],
а
так}ке
ванРиссельберг
[185]
изу-
чали
кривь|е
анодное
напрях(ение*цремя
при
постояннь|х
плотноетях'':!,$!(!
!.!18
ра3личных
электр
0лито
в.
|1о
скольку_;паблюдаемые
п
р
и
т9м
яв
лен\4я
т
ип
ичн
ь|
для
ве{ьм1
разл
ич
нь|х эл
ек.]! Ф:
литов'
мо)кно
сделать.!9а}с1юч.едие:,
91Ф в
9лек;
тр
о
дно
й
р
е
а
кции
п
р
иц!ш,та0т:
}асг!_|
е
тол
ько в0да
;
а
электролит
лишь
сн444ф.},"$9льное:
сопротив-
йе""..
Б
тех
слг{аях'
когда'"с5тшечалй!ь
особьпе
явлен!4я,
например
понижение
,площадки
или
критического
напрях(ения'
-'наолюдаемые
изме-
нения
были
пропорциональны
числу
и0нов,
а
не
общей
кснцентрации
электро
л'1та.
€огласно
}арингу
[186]'
Рысокие
значения
напряжения
в
растущих
тонких
пленках
вь|зва_
ньт
не 0мическим
сопротивлением
сл0я,
а обу_
сл0влень|
поляри3ацией
ионов
Рнутри
окисного
слоя. 3то
3аключение
0сн0вывается
на
т0м'
что
п0сле вь|ключения
тока
напря)кение
падает
не
мгновенн0'
а
с 0пределенной
скор0стью.
9арлсби
[1ш,
[84]
подробно
изучил
ионньтй
и
электроннь|й
токи.
Б
первом
случае
р0ст
сл0я
происх0дит так'
что'
строг0
говоря'
из!\{ерения
в
ста
ци0нар
ном
со стояний
невозможньт.
Фднак0
пр
и
любом
фиксированном
напря)}(ении
ск0рость
р0ста
0кис}той
пленки
в
начале
процесса
является
наибольшей
и
по мере
р0ста
толщинц
пленки
п0-
степенн0
у}1ен
ьша
етёя.
_3лектр
ическа
я
ем ко
сть
€,
обратно
|рспорциональная
толщине
слоя
(см.
нйе),
с
течение*
времени
уменьшается.
3ависи-
]'10сть
€
от
логарифма
времени
графически
вь!ра-
жается
прямой
линией.3то
указьтвает
на
то'
что
сила
ионйого
т0ка
есть экспоненциальная
функ_
||ия
напряженн0сти
поля'
т.
е.
!т:
АевР
'
где
А и Б_к0нстанть]
при к0мнатной
темпера-
т}ре;
Р
-напряженность
поля
в
сл0е
0кисла.
Ф иг.
309.
краип{е,состояния'в|к|днего-
вРца
поверх-
ности
Фрконч!.
_т!о!,!е
ацодир9в.1]щя
Ё
1еч9н{€
.|{есколь-
ких
часоБ
Ёри плотности
тока
1
ла|сх2
и теипературе
25о
в
аз0гной
кнслоте.
[юнтер:шульце
[1
67
]
п0дтверд}1л эту зависимость
д'1я
алюм\4н\4я'
'тантала, нпобуця
и
висмра'
а
9арлсби
[183]
для
циркония.
||олунаемая
толщина
слоя
прямо
пр0порциональна, напря-
жению
?)1
|1|и
кот0р0м
пр0исходит образование
пленки.
_||оллинг
и
9арлсби
[187]
натттли'
что
предельная
толщина окисной
пленки на,цирконии
равна
30
А/а.
3то
свидетельствует о
том'
что сред-
нее 3начение
напряженности
электрического
поля
(Р
:
о'|6), проходящего
через слой окисла тол*
щиной
6
во время
образования
последнего, не
превь|!шает
3,3
.
106
в|см.
1ри
такой напрял(ен-
н0сти
поля
и0нньтй
ток в0зрастает очег{ь
бь:стро.
(абрера
и
йотт
[188]
обосн0вали эту
3ависи-
м0сть
теоретически.
9арлсби
[183]'
исп0льзуя
их
те0рию' п0ка3ал'
чт0 барьер, препятствуюци^й
пр0х0х(дению ионног0
т0ка'
имеет ширину
2,8
А.
9арлсби
сравнил
также
даннь|е
при 20 и 60' и
при1шел
к
заключению'
чт0
критическая
темпера-
тура
по
}:!отту
(вьт:ше
которой
не существует
пре-
дельной
т0лщинь| окисной пленки)
рав1{а
при-
близительно
250".
||ри
налоя<ении слабог0 электр0статическ0г0
поля
ионнь!й
ток близок
к
нулю'
9арлсби п0двер-
гал
цирк0ни["{
анодир0ванию
в течение
6
суток при
пл0тн0сти
тока 5 лка|см2 и
не
обнаружил значи-
тельного
изменения толщинь|
пленки
[183].
при
более высоких
плотностях т0ка'
по
данным
||ол-
€хо.росгпь
Рос,па
плен'сц
$ел
гпооатпо
-
6ельтй
цлц
соетпло-серьт-й
слой

'я
-{
€
374
мвтАллуРгия
циРкония
*
-;
*:::-1:*р':!3,|'91]!.':'т::д^::^::у]:}11_: 111191
."знала
быстро
возрастаец
а 3атем
у".'.-'1
пределах
60-80%'
причем
он в0зр*астает
по
мере
чивается
постепенно
до
предельного
3[?9€!|ис
;
увеличения
плотности
тока (от
0,7
до-6
ма|см2).
Бсли
облрение
прекрач1в5т,
то
ток
быстро-6'!{-
,
Фднако
.напря)к^е'нность
поля
при
образоЁатлт[ъл
)!(ается
д['
более
!,ыс6кой
".''","йй,
-{й
перво- з
'::::+:^
с!''=^у:!,!)
-остается
относительно
посто-
начальньдй
<семновой>
ток,
а
затем
]}1е.(.]1е!ц9
;
янной
в
широких пределах
плотностей
тока'
при
затухает, приближаяськпервоначальн0му3наче-
которь|х
происходит
образование
окисла.
ний.
ме>к!у силой-фототот1а
и
''|р!й.й"остью
а)
3укгпронный тпок.Ёслипосле
тог0
как
р0ст
поля
наблйдается
11и1
завис"йй;;
';;добная
окисной
пленки
при
каком_либо
фиксированном
3ависимости
элехср6нно'го
(темйо',!й/'Б*,,
"'
.
напря)кении
по
существу^
останавливается
более
низкими
значениямй
констайт
ц'ът-].
(не
|{3меняется
в течение
10 мин.),
слой не
Б слрае
фототока
явления
старения
,.
"'ойд!-
:
ра3ру1шаетсяотдействия
искр'
томо)кно
и3мерить
лось.
проходящий
нерез
него
небольгшой
остаточный
б) Ёмкоспь;
Фкисный
слой
на
цирконии
(так
,
ток'
не
оказывающтцй
влияния
на
увеличение
тол-
>ке как и
на
других
металлах'
ш'я
кот6рых
харак_
щины
пленки.
А:[е>кду
силой
этого т0ка
и
напря-
терна
анодна7
реакция
л:
тй!)
"'я<Ё'
&уйй',
,
}.._11.*-.::*щ:.::у:'
3ависимость'-
вь|ра)каемая
в
йачестве
кондёнсатора,
емкост!
к'',ро.о-'о?;;;;:
гиперболическим
синусом
и очень
близкая
кэкс- но
пропорциональн1!
напряжению,
п$и
*''.р'й
'
поненциальной.
Различие
ме>*(ду
ними
несущест-
происходйт
образован,.'.''|
г[о7:.
Бйая
ем-
венно.9помянщаязависимостьсилытокаоткостьдаетсясоотношением
напряжения
выражается
формулой
[184]
$е
!,:2
А'в\т8'Р,
с:;# электростатических
единиц'
|Ае
Ае
и Б"
являются
функциями
температурь|:
*:;
где
$
-
14стинъ1ая
поверхность,
см2;
е
_
диэлек-
,.
ренцшонной
окраске.|\рй
йапряйёйй
йостоянйбго.
]
где
'
Ё (напряжени9/0),,-.*':ц3пря}кенность:
эл€к-
ток!
выше прйб''в:тгЁльйо'5:йтБйпйй:;й;;;;;;
трическ'9ло*'
л!ля-..,в_ слое
ок|{сла
толщиной
0;
слоя'г_|роп0рционалы!а,.1д.и.ц9цыу6.цу1.ш.айрф
е
---зарйд""5*!Ёрбв*;{,*!'
а6солютная
темпера_
нию'тривейоораьующцесяо:саснЁе
плеЁ|сд
окра
|шег1ь]
''
в
тцвета'
'
побёжап$9уц1:,
"
!]$9д9:'йо}Ё]:ейи*
у:**с-б***1119ч{_т'-Р9:-щтз1ч-11к.ука_
окраски
напрякёйие.нё;рерБййБ;;(
3а11!1е н4
Ф],.9г9:
э4 екгро нь1
до
л
ж
н
ы прео
долевать
постоянной
плотности
тоца),,и
т|о
маре
увеличе-
1чег1ет1'глеспсл}
барь9п,
высота
кот6рого^(,|-,
а
н|1я
толщи[{ы
,'."й";-6;'й;;;;;;'';ъ;й'16_'*
1'"'3у?
'3ц111__'.
Аля
цирконпя
0
_
8,375
эв,
следовательность
смень|
"*'ерфер.йцй."йй1_ц!й-
'€
|:
'$,@
А.
|!рило)кенное
поле
слу)1(ит
источни-
то1.
|!ользуясь
соответствфйийи'
справонньлми
:
ком необходуал:уо{ц
энергии.
таблицамй
(см.1иже;,;ъ;й;;;;;";"_;;й;;'
:
Фермилий
[189]
оспаривает
этот в3гляд'
так
слоя
воздуха,
эквивалентного
окисн0му
сл0ю,
каксчитаетболеевероятнь!мтуннельноепрони|еобусловлиБающему-даннуюокраску.,{бсолют]
19:ени:-черч
барьер
такого
ра!мера'
а
не
преодо-
нь|е
измерения
требуютзнания
коффициента пре-
ление
его путем
термического..возбуя<денхця.
!,1з
ломления
п
окисла
и и3менения
фз"|
све1оЁой
-
того,
что
зависимость
|3
;.
от
Р'|'
является
линей-
волны
при
ее
отр_а)кении
от поверхн0сти
ра3дела
ной, Фермилий
заклюнаец
нто
электрон[|а1
про-
металл_окисе,.'9арлсой
по[тв_|ф;-,-;;'
значе-
водимость
имеет
место
в
результате
низкой
кон-
н|4е
п
постоянно
прй
разлиннь|х
толщинах
окис-
центрации
локальнь|х
электроннь|х
уровней
ного
слоя,
образующёгося
при
анодировании,
и
(-\1в/смз),
глубина
кот0рь|х понижается
под
равно
2,2(!,
чт6!'1йй..
со
значением
этой
вели_
влиянием
приложенного
поля.
чины
для
м0ноклинной
модификации
2г9'|\83|.
Ёсли
окисная пленка
выдер}кивается
под
на_
8 более
поздней
р!о'т.
[]йг;;ъ;;,й*|'о,,{-
пря)ке1{ием
в течение
длительного
периода'
то
нк}кое
значение,
равное'1,5.'
т:аблюдается
явление
старения'
сопрово>клаю_
Ёа
фиг.
3:б'Ёройведено
графинеско
е
срав-
щееу
заметным
уменьшением
величины
А'.
нение
имеющихся
даннь|х.
|1олунЁется
лве
груп-
|1од
влиянием
облрет_1я
ультрафиолетовым
пы
кривь[х в
3ависи]}10сти
от
того, производ'4тся
светом
электроннь|й
ток
1ере3
-окисную
пленку
ли
сравнение
окраски
анодной
плеглкй
с
окраской
циркония
увеличивается.
||ри
облунении
ультра-
во3душного
.слоя
в
отраженнот\ц
|1л!4
прохйщем
фиолетовь:м
свет0м
т0нкого
сл0я
окисла
электрон_
с"етё.
гюнтерйул1ц;
; ьъ;ц1
!эо!'"!,йй|
вал!4сь
гл.
|1.
коРРозия
циРкон}'!я
и
вго
сп-']Авов
'>1(
таблице}'{
(винке
[
19
1
],
собравпшим литературные
даннь|е
о 3ависим0сти
толщины от окраски
в
отра-
женн0м
свете.
}той
х<е
таблицей п0льзовался
и
9арлсби
[183].
14з
приведенных
на
фиг.
310
графиков
видно' что
их
результаты
близки
между
с|тбог:.
9арлсби
пользовался так)ке
таблицей
Роллетта
[192]
ш:я
проходящего света.
||оследний
метод
по3воляет
правильно
постро-
ить
кривую,
тогда как
перый не
дает
правильных
Р
е3ул
ьтато
в. Расхо>кде]{и9
р
езультатов,
получен-
!*нх
лвумя
методами'
обусловлено
числом
и3мене-
ний
фазн
световой
волны-на поверхностях
раз_
дела.
}го
положение
иллюстрируется
данными'
полученными
в АЁ.[
с применением
ступе||чатого
при6ора
фирт*ы
с,{,женерал электрик).
8
этом
приборе
на сте[о|янную
пластинку
нанесены
слои
йеар/та
барпая
тол[циной
5ф-4000А
с_тем'
ив6ц
пскпючг:ть
о:ш
шб:сг
ва
с|!ет 1вмевенпя
фвьь
о<
6
ъ
о
Ф
ч
о
ч
6
в
\
:з
з
\
о
е
ц
с
т
Ё
ц
Ф
ч
6
Ф
в
(ь
&
(ъ
шщ{,йе
:€бфф!Ргон$Ёе:$фдФы
-
-{'
ривоцщ]-
к
пере!Фь[в{!нию
перзого,.и'. ш\}ро[9
лорядков
с по_
яв-;:ением
зшпёнф
офаш:фация.
[
1 93
].
Ё
едорогой
ка,
в{о вре1й:к*(
ступеннатшй
прпбор'
шожно
легко ||зготов[{гь'
ис-
{ато
}
{тте}
{то'т}
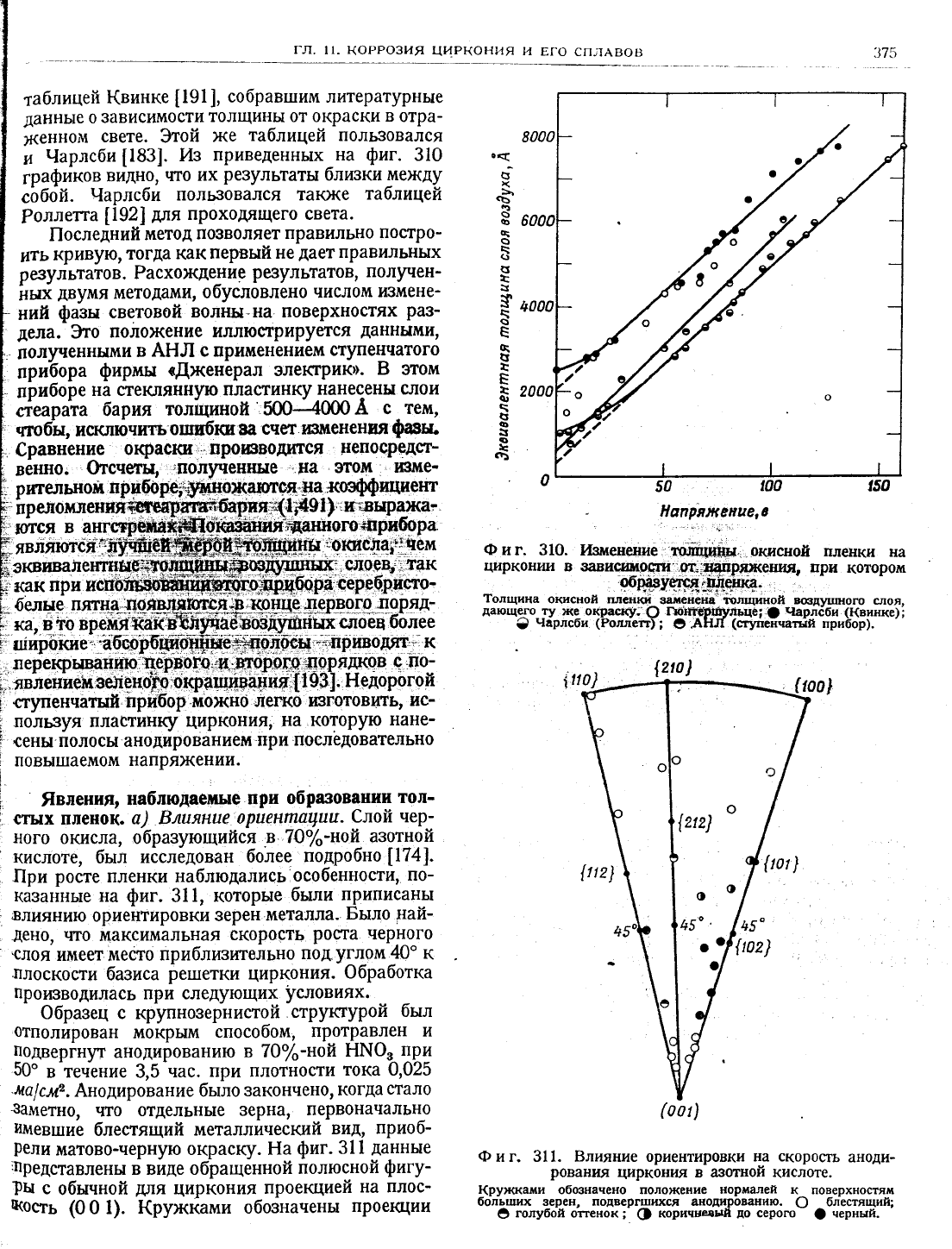
Фиг. 311. 8лияние ориентировки
на скорость
аноди_
ровани'|
цирконш|
в азотной
кислоте.
}(рух<каии
обФначено поло}кение
норма]!ей
к поверхностям
боль|цих зерен, подверг[шцхся анодированию.
о
блестящий;
о
голубой
оттенок;
Ф
коричвевцй
до
серого
(]
черный.
полк}уя
пластинщ
циркония'
на
которую
нане_
сены-
пол0сы анодир0ванием
-при'последовательно
п0вы1шаемом
напрФ|(ении.
9,вленпя,
наблюдаемые
при обршовашип
тол-
стнх
пле[!ок.
а)
Блшянце
трценгпсццш.
€лой
нер-
н0го
окисла,
образующийся'в''7|о/.-ной
азотной
кислоте' был
иёслёдован
более
подробно
[1741.
[1ри
росте
пленки наблюдались
особенности'
по-
казаннь|е
на
фиг.
311, которые
были
приписань[
влиянию
ориейтировки
зерен
металла.
Бьлло
дай-
дено'
что максимальная
скорорть
роста
черн_ого
{лоя
имеет
место
приблизкт0льно
под.
углом
40'
к
.плоскости
базиса
ретшетки
циркония.
Фбработка
про|8водилась
при следующих
условиях.
Фбразец с
крупнозернистой
.стру'(гурой
был
отполирован
мокрым
способом,
протравлен
14
подвергн}т
анодированию
в 70о/'-ной
Ё\Ф'
при
50'
в_течение 3,5
час.
при плотности
тока 0,025
-ла|с;ьР.
Анодирование
бьпло
3акончено'
когда
стал0
-заметно,
что
отдельнь|е 3ерна,
первоначально
имевшие
блестящий
металлический
вид,
приоб-
рели
матово-черную
окраску. Ёа
фиг.
311
данньте
,представлены
в виде обращенной
полюсной
фигу-
}!д
с
обычной
д:тя циркония
проекцией
на плос_
щ0сгь
(0
0
1).
(рухсками
обозначены
прое|щии
[равнение
о[Фаск1'._||ро!380дд{гся непосредсР
в€Ё|!Ф;
'Фгстщп',:полу!еннне
[|а
910!!1
.
[в}1ф
ритФ|ы|о{{
прибофчвцц9$ацг9я
}1а
к00ффш{не[{т
'|репомле[!$яфщтпш&рпя-{;491
)
-
и*"зЁф0(8:
;*ка::*|ого*прш6ора
[{Рд']ч'(ис{'6:.1{е:ш

мвтАллуРгия
циРкония
нормалей
к
поверхн0стям'
п0двергавшимся
ано_
дированию.
Ёаивьтслпая
скорость
наблюдалась
для
ориентаций,
обо3наченнь!х
чернь!ми
круж-
ками.
б) 17ерпо0!1ческпе
явленця.
|1ри
анодировании
цирк0ния
в азотной
кисл0те' концентрация
кот0-
рой
вь:ше
14 вес.
о/.,
наблюдалось
периодическ0е
изменение с0противления
со
временем
[171].
3то
явление
отл{ечалось
ли1шь при
образовании
чер-
н0го
слоя.
?акие
явления
-
не
редкость
при
изучении
ан0дных пленок
[194,
195].
||очти
с
полной
уверенн0€тью
мо)кно
считать,
что
цир-
кониевьлй электрод необратим.
в)
€опоспав/!енце
с
0кс1слен1!ем
прц
ншзкой
пемперапуре.
||оллинг
и 9арлсби
[19б]
изучали
пр0цесс
0кисления
при
100-595'
образцов' на
к0торь!х
предварительнь|м
анодированием
при
различнь|х
напря}кениях
были
с0здань|
пленки
предельной
толщины.
Фни
наш:ли'
что
если тол_
щина
пленки'
полуненной
анодированием,
превь1_
|шает
определенное
значение'
то при
последующем
окислении
образца
на в0здухе
не
наблюдается'
по
крайней мере
в течение
к0роткого времени,
даль-
нейшего
увеличения-ее
толщины.
}4к, при
тем_
пературах
250-450,
дальнейшего
и3менения
т0л_
щинь|
пленки не
происходило;
если после
ан0д_
н0го
окисления
ее то,пцинт
бьггла
равна
от 0
до
3000
А
соответотв€!Ё$;';
Фни,'приш|и
к
заключе_
н
ию' что
в отнош
ении
ск9рост![
окисления пленки'
п0лученнь|е
ан0дированием'
эквйваленты плен-
кам,образующимся..-фхт.оте{с;ге:1ии***а:'воздухе.
(онеино,
это за|о1ючение
не9п'ол|{е
пр11в!1льнц
по
крайней мере
д]|я
окисления]цйркони_я
на
воздухе'
11к
кзк
ранее.
бь:ло
показан9,
йо азо1|может
йли_
ять
на
скорость
коррози[{'.ц:*рдсбй,йЁЁ'.|азе
и в
воде.
|!оллинг
и
9арлсби наблФ.р*й.
так)ке'
что
0краска
пленки,
образующейся::
на
:во3д:де'
пр0_
х0дит через
неск0лько
цветов
побе}*<алости,
за{ем
стан0вится
серо-стальной
и
далее
не
меняется'
тогда
как
пленки,
образованные
анодным
окисле-
нием'
п0следовательно
меняют
гора3до
больц-тее
числ0
интерференци0ннь|х
цветов.
йнтересно
предп0ло}кение'
чт0
в
последнем
случае
состав
окисла прибли>кается
к
стехиометрйнескому
и
благодаря
эт0му
обладает
меньшей
6пособностью
к
погл0щению
света'
чем
0кисел,
образующийся
в
перв0л1 случае.
.е)
€опосгпавлен!1е
с пр0цесс0м
к0рр03пц
в
е0ря-
чей
во0е.
Фсновное
ра3личие
ме>кду
процессом'
пр0исх0дящ}1м
при
анодир0вании'
и
процесс0м
к0ррозии
заключается
в
том'
что напря}кенн0сть
п0ля
вт{утри
пленк}1
в первом
случае
вь|сокая'
а
во
вт0ром
-
низкая.
|!ри
образовании
анодной
пле}!ки
напряженность
п0ля
близка
к
пробив-
ному
напря}кению
для_большинства
диэлектри-
к0в'
т.
е.
к 106
в|см[|97],
инь|ми
словами'
плейка
оказь!вается
под.действием
очень
вь|сок0г0
напря-
)ке}|ия.
3
горяией
в0де
напряженн0сть
п0ля
при
образовании
пленки
во3никает
в
результате
на-
личи|
градиента
химического
потенциала,
кот0-
рый
быстро падает
по
мере
роста
толщины
пленки.
14спользуя
низкие
плотности
тока'
можно
создат|
услов,4я,
близкие
к
усл0виям,
имеющшш
место
п',-
корро5ии.
?аким
образом
бьлло
найдено
?;;
кривь|м напря)кение
на
электродах-время),,|то
на
рост
пленки
сильное
влияние
0ка3ь|вают
сост0_
яние
п0верхности
металла
и
его
состав
[174],
причем
часто
анодир0вание
и процесс
коррозии
Ё
горяией
воде
имеют
общий
характер.
п?л-1лагают,
чт0
это вл|4яние
оща)кает
и3менения
в
элекгро-
-
проводности
слоя
2гФ',
который
мо>кет
дейст'во-
вать
как
п0лупроводник,
приче}1
'его
свойства
зависят
от замещающих
или внедряющихся
при-
месей.
€огласно
теории,
3агнера
относител}но,
реакций
ме)кду
газом
и металлом
[198],
скоростЁ
образования
пленки
есть
функци-я,элелороп!0:,,
водности
и чисел
переноса
электронов
и
ионов
в
,
сл0е
продуктов_
коррозии.
|1оскольку
и3вестн0'
что скорость
диффрии
кисл0рода
в
цйрконий
ве!
,
лика'
ск0рость
корр0зии
мо)кет
ограничиваться
,
т0лько низкой
элекгропроводностью.
.(опустимо
предполо)кить'
что
в пределах
об_
-
ласти,
для
к0торой
справедлив
параболический
]
3акон'
5ор
о-сть процесса
опр
еделяется
диффрией
ионов;
:||ри
более низких
тейпературах
."шй'|аких,.:
ме?а.}|!|Фв;
(3калюминий,
то.рий,
у!ан
и,'шигконий,
*
пей-ствует
логарифмический
зако!*
рос.за,пленкй ;
[175].
9б:вменении
закона
скорости'роста
мо>кно
;
0у[ить*'
!б
.-
Фё[!ёни,]-5лёФронйой.:
Ё|!оводимости'*
оцотфтаэ.
;,'.}]е'ущ}г.ю:8и&
:
элйенты;',
_б-]гадшриятнц
#
влидющио:Ёа,.коррозио!!ную
]стойкбсть;,особенно
€
еслк'
их,
Ёействяе;,ффо_:ойвно,
;цр*,ййй'коли_
Ё
честваь
могщ,'тормозить
процесс
коРрозии,3а
€
счет
Рел!{чения
энергии
активац\4,4
д)\я
проводи-
,.!
мости,.в'окисном
слое.':|1ри
этом важн}ю
ро}:ь
,;!
играют
небольшие
изменейия
в стехиойетрйиес-
ких
соотношениях
окислов
[199].
,
||ри проведении
сравнения
между
поведением
цирк0ния
при
действии
в0здуха
илй
воды
и
его
поведением
при
анодировании
необходимо
пр0_
являть
осмотрительн0сть.
Бьлло
п0казано'
чт0
в
последнем
случае
проду}0ь|
реакции
имеют
куби-
ческую
решетку
'1ли
х<е аморфны
(в
зависимости
0т применяемого
электролита)
[183]'
в т0
время
как
пр0дукт
коррозии
циркония
|{а в0здухе
ил14
в в0де,
как это
указь|валось
в
разд.
<|-{ирко-
ний-кислород))'
имеет
м0но}01инную
струкгур/,
по
крайней
мере при
низких
темп-ературах.
кАтоднь|в
РвАкции
(ривь_:е
катодной
поляризации
дутя
ц\4ркония
изучал\4
}1ур
и сотр.
[168]'
а так}}(е
!,аккерлтагл
и
(.есил
[]80].
йур,
йак-(инней
и
9орнер
[:68]
|43учал\4
кривь|е
катодной
поляри3ации
в
рас-

гл'
|'.
коРРозия
циРкония и
вго
сплАвов
377
тв0рах.
серн0й
кисл0ть|
при
пл0тн0сти
тока
2
-
!0_4
а|
см2
и вь|!1]е.
Фни
наш:ли,
что перен
алря-
)1(ение
вод0рода
на
цирк0н\414
143меняется
с
кон-
центрацией
серной
кислотьт,
тогда
как
пере_
напряжение
на
титане
не
изменяется.
[рафик
уравнения
1афеля
для
титана
бьтл линей!льлй
в
пределах
изуненног!
пл0тности
тока (1_100
ма!.сл2),
в
то
время
как
для
цирк0ния
он бь:л
ли_
нейньтм
ли1шь
в
пределах
15-100
ма|сл2.
0ри
плотности
тока
вьтше
100
ма|см2 они
обнару>ки7тц
нев-0спр0и3водим0сть
отклонений
0т
уравнения
1Ф.'1'
что
бьлло
Фбъяснено
образован!а^ем
7г1
и
7гА
'.
3то
бьтло
подтв
е-р}кде
но
$
е
нтгено
структур-
ным
исследованием
образца
циркония,
к<!торйй
подвергался
катодной
обработке
при
плотности
тока
150
ма|см2
в
т6ненйе
48
час.'|1ри
низких
плотн0
стях
т0
ка откп0
нен
ия
от
уравнен
пя |
аф
еля
были.
объяснень|
тем,
что
катодйьтй
ток,окайлся
не4остато9ным
для
того,
нтобы]сделать
все'
мест-
ные
участки
электрода
катодами
|!одгвер>кдений
этого
о бъясн
ен
ия с'|у)*(ит
ра_
3ъе4аниецирко!тияпри
его
обработке
слаб|тм'ойй.
_- _13*9рчч
и,!е6чл
:вун}ли
кривую.катодной
т9ляР
щ4ций
"Ё*црйтр{лБЁых
раствор{х
хлс|
рида
и
сул
фата
натр!{'!.
;3начения
потенцйалов
йя,
ста-
ционарного
соофФЁйия,
(не
:вменяются
:в:
течение
4 нас.)
былц
|'3мер9цццри-
п9с{ояннь!](:!!.,191но0тях
:о51Р
пределах
з,5
.
10_8-3,5
.
10=|
а|см2.;8
(''э
./и
растворе
хлорида
натри'!'
которь!й
подвер_
гался
АэрЁции,
кат9д*:ая
реакция,
пройсхолив:шЁя
при
плотностц
т0ка.ци>ке
2
.,10_с
а|см2'ограни!{и_
вающей
лиффузию кисл0рода'
состояла
в восста_
новлении
Фэ
Ао
он-.
Бодород
вь[делялся
при
плот'ности
тока
вь|ше
этого
зйачения
(которое
6а-
:1:"]
0т
к0нцентрацич
кислорода).
Ёаклон
пря-
мой
п0
уравнению
?афеля_бьтл
равен
0,12, пере-
напряжение^
водорода
_
0,83
в
при
плотности
:::ь
'',
#
;\!;у];^вол
нь|
при
2.
1 0_
6
а
|
с
м2 бьтло
о0ъяснен0
восстан0влением
окисного
сл0я
на
поверхн0сти.
|{осле
тог0
как водор0д
вь|делялся
в
течение
неск0льких
часов'
поверхн0сть
сделалась
нерной
и твердой.
[-|ри
более
вь!соких
пл0тностях
тока
появлялся
тонкуц|+,
слой.
черн0го
п0рошка.
литв
РАтуРА
1.5|с9ш!с1<
ш.
у.,
€|еп|са|
Б|егпепБ
ап0
11те|г
1
^€огпрошп0з,
р.
628,
Фх{ог0,
1950.
!}
о..-^в.9^1|.
.'._н.,
Р
а
в 1
.|.').
,
Аес.!гат. с!э!тп.,
55,
.
459
(19з6)-
3
пч1Ё-1е
!.Р.,^!|'-ч-:_|
с. о.,
\моо|ап
Б.
Ф.,
.
--Ас!а
€цв!.,
5,
22
(1952).
3. н
з
8
8
с^.,
2-.
рпув.
ёпей.,
|2в,
з3
(1931).
:. п ё
8 8
9.' 4.
рпув.
€!аегп.,
6в',
22[
1:э3о1.
9. ц
а
в 8
с.,
2.
рпуз.
(Аегп.,'78,339
(1о30).'
3:
$
|.'Ё'
'';3"''Ёк;{!;!.:;:Ё:#?с::ч
2.
апог9.
а||дегп.
€!теп',
148.
з45
(1925)_
9.
\г'.|' у.
"}.'
-56ь:её!с1:п
д.
ш.,. уег|<ев
[.
А.,
[гопз.
Ё|ес!гос7еп.
$ос.,
89, :о5
1:о+о1.
-
-
!0.
Р
е
8
о е г т'-!.,.3^1'
1
!.
о.,
7.
апог9.
а!!уеп-
_€!теп.,
!87'"\77
(:эзо>.-
}!:Б-3].д'"];Р+/:э\'!1'|'Ё!1!ь'"';3"''"(31'.}:,..'.
_^ _соо_|81,
А4агс[л
3!,'1953.
!3.
)е
8оег
-|.}{.,
Ёаз1.|.}.,
Рес. 1гау.с!а!п.,55,
зоо
(:озо:._
1{.
['9
8-о_ег'.'.н.,
вцг8егв
!|/.6.,
Раз1
|.Р.'
.- _Ргос.
Асаё.
3с!.
Атпв!ег4агп,39,515'(1936).
"
15.
!е
8оег
.|.
н., гаэс
.|.'о':'
Р;;
пат.
[;;[п., 59,
161
г:одо)."
!0.
Р
1з1'
1.
б.,
епссспв
|ес!а.
Ре|.,6,
з65_371 (19{1);
а0${гас1,
р.
63.
ёз1ег. €!аегп.'ас/:.'
цз.
эт
[тэцо\|
а0$1гасЁ.
о. 12!-.
(!тз!п.
||ее*0|а4,-38,'2
(19а1).
'
'
17.
5
е
у]9'_!^-4.
ш.,- Р
й
:|Б
!
й"
А.-1.,
].-
й!'|аь,
|я т}.т:.'А1'&
*.'.
м|т_1065,
)ш!у
27, \95\.
]9. 8
'з1о|<ег
щ.'-'пер.
ёоб:1ь|-йагс!т
31, 1953.
20.
8с
у.1п
в-!
о
п
-€.'Р.
Р.; м
а;{
!1'з.
|..,
м
а 1'п
е йз
!)-.
|1"
Ртос.
1ц|г.ц;
€оп9г.
Ршге
апё'
Арр[.
€!аеп.
_(|-!аа.)'
1|' з
(1947).
_
21.
Рт
|е6'ег[с['_Ё.,'$!{[|8
!., 2.
апог9.
а!!3еп.
€|тегп.,
!45'
\27'(1925\-
??. |'
с о
6
в Р[.,
.у.-
БрБс.'
рпуз.,
17, 596
(1946).
?1. 1э у
с
:.е-
с:
А.;/.
АБ.
ё//['й':
3;:,.,",1,
)э{]!одд>-
а у*:й'Ё...ъ,.тт?'Ё:ъ*!?*ъ]'
",;]
#;}
ъ13#;
,_
''
88,
з31
(19Ф.
26..}|-9_пгу
л.
Ё.
м.,
1-|рзоп
н..
\['ооз1ег
у. .А.' }[е
|п!9гргей11[лп
о1
:)(_ц3у
0|{|гас1|оп
.
-
РьоЁо8г4р1лв,:'р.
29.._[пс..
;1951.
?!.9!
о1п
Р.' !1тс!й!зс!ё
|(гуо(а11о3ла!и|е,
|,
!е|рз|3,
1906.
?9. !"п
А!:<
е1
ь. в,.,--
7т|увсс3,ц?]|6'о9й1
29.
6о!
0
вс1пгп
!0
1
*.
м(..--!Ё'!пй=-могв!се
|1ёеп-
2*ар:-4каа.
о$!о,^
!'.
!т14!ёсп6;!'{6цгу.
к[азве,
1бй,
-
}г9
8,
7_156 (1927).
.
-_'
:9. у
"г0
|
еу
!{.,'!т1!п'ега!о9.й,в.,21'
169-175
(192в).
31.
Р-ш^{|.
9.,_^
Р.бе11
т.,
э..-апо)у.
о!!рп. ёп'^..,
_
1&,
19
(1929).
2?. 2э'теу .'\[.-Ё.,
Р&ув.
Рет.,
27,
79в
(1926).
3й:й]'ЁЁ}":;;'""1!#|!ё'#:Ё,'^,:\;|',Ё.'{,ч1])'
^- -(!аегп.,
20'
|58 (1948).
35.
$с1:утаг{-а
с.п1.,
уъцн[ап
).А..
€ос|<в 6.
^6.'
&9р.
вм|-793;
0есегп"бег
\7, \95,-
5о.
ц.агпьеу
А.,
спац0гоп
6.. ?}:е
?гапэ1огпа_
.-
'.1|',
о1 7|гсоп1а,
-14_гпе
€оп9г.
с}:!й. |пс., Раг!з,
1934.
б'.
]ш-цггау
Р.,
А|]!эоп
в. в..
А1огп|с
Бпегцу
}(евеагс[:
8з1аб]|з|гпеп1
&ерог1
м/к
1106. й|п!зЁ(л
зв.5:1|.{Ё;Ё];!']'ьРЁ*|;;"#3:,'ь.'Ё?!,;!гос!тетп'.'
4|.
551
(19з5).
99. 9
"ё}
,
+.,
/.
е,|е!4госпегп.,35,676
(1929).
49. 9'е}:п
А.,
$реси1
ш'.,'
2.'Рпув.,
62,'
1
(1930).
11. 9.' чп
п
А.;
.]д
г
8
е
п
5
н., а.еп1/з
'|т,
\тэ
(:эз|!.
42.м,с(}еагу
л.к.'
Боу|е'Ё.
Ё.,
фдрб
.
-
(частное
сообщсние).
43. \[/
| п
[
|
е
г
€., вег
. аецс.|с
!тетп.
6 ез.,23,%42_266в
(
1в90).
4.
\1:к.]9.--9,, .
Бег.
6ец!.
с!аетп. 6еэ., 24,
Раг1 |,
873-899
(1891).
45.
ше0е[;по
в.,
!-!е0!уз
Апп.€!аегп.,395,
149_194
(10!3).
46.
5с
1ттзг^? 8.,-(
о п га0
Б., 8ег.
6ет:!.
с!аетп.
6ев.,
.-
--94в'
2122-2|з3
(1921).
+7.\']^9|зв
^[.,_}!ечщапп
в.,
2. апог9.
а!!9етп.
.^
--9|''п.,.65'
248-27в
(1910).
4.
\:0е|<!т!_0
^Ё.,
|е'ш!з'
$.
.}.,
[!е0!3з
Апп.
^€!аеп.,
371,
366_3в7
(1910).
49.
$ |е-уе
г1э
А.,
6
о11а'А.,
2. апог9.а!!3еп.€!тетп.,
172, |
,1928\.'
50. ш_ььелопсе
А.&.,
Ргос.
Роу.$ос. !-п4.,
\б9А,
.
295
(1937)

з78
мвтАллуРгия
циРкония
51.
$
гп
!1
}:
о. Р.,
Ёу6го9еп
!п
01еЁа|з,
р.
3,
[}:|са9о,
1948.
52.
вошаг6з
п.к.,
ьеуе5чше Р.,
€цб|сс|о{1!
о., |||. 1п*. ]ес[ппо1.,
ошп
Рго]ес1
358_070,
&ер.
13'
1953.
с
53.
6ш1бгапвеп
в. А., Ап0геъу
к.
Р., |аб.
3с!.
&ез.
Рар. 1799' 1954.
54. |4с0ц!1|ап А. |., Ргос.
Роу.
5ос.
[п4., 204А,
300
(1050).
55.
$!еуегЁз
А.,
кое|1
8., 2.апог9.а!!ртп.€!аетп.,
153,
289
(1926).
56.31еуег13 А., 6о1{0 А., 2.
апог9.
о!!9еп-.
€|тетп., 187'
155
(19ю).
57.
н
а
8 8
с., 2.
р!тус.
€!тегп.,11в,
433
(1931).
58. Ё|а1|
м.ш.А., !}1 аг1|п $. |-.н.,пеев
А. !.6.,
|гапв. Рогаёау 3ос.,4\,
ю6
(1945).
59.
6ц|бгап3еп в.А., Ап0гетц
(.Р.,
!й['ез{|п3-
1тоцзе
&ез.
!аб. $с!. Рар.
1818, 1954.
60.
$с1тчлаг\а
€.!с1..,
]ша!:е1{ м.
\!'.,
&ер.
Авсо-
'
з510,
1953.
61.
]т1
аг1|п $. !.н.,
пеез
А. \.0., 7гапв.Рага4ау
$ос., 50,
з43
(1954).
б2.
&
е е в А. !. 6.,
[гапв.
Рага4ау 5ос., 50,
335
(1954).
63. г!1аш!!!!агп.}.,
1(ац|1папп А.к.,
$чш1ге
с.
Р.,
-/.
€!тетп. Рфв.,9'
678
(1941).
с
|
о 1 {' !'9., |!!. 1пв{. ?ес}дпо|.
Ф|.{& Рго!ес1
358-
070'
Рер.
14,
1953.
92.
вп!к9
!..г.,
8|ас|< €.
м.'
-/.
Арр!.
Р7ув.,11,
129
(194о).
93.
6ц|0пег
[.6., ${'оо1еп
1.
А., |гапв.
Ё!ес'
!гос!тегп. 5ос.,
93'
223_2з5
(1948).
94. €цб!сс|оЁ1|
9.,
!.
Агп.€|тетп.3ос.,72'4\з8
(19ю).
95. }!ауев Ё.?.,
&обегзоп
А.н., 7гапз.Ё|ес!г[ь
с!тегп. 8ос.,
96' 142
(1949).
96. ]т{а||е|1 й. ![.,.^!:{_е|воп Ё|.
Р.,
Рарр
с.
А.,
Рер.
8|г1[-77,
|952'
97. {}1
сА0агп
0..}.,
.!г.,
6е|| 6. ш.,
-|.Ре.я.
/т/с{.
8цгеац 3!ап6.,2ц 593
(1942).
101, 339
(1954).
99.
ш а
б е
г
.|.
т.,
!.
€!тетп. Р!туз.,
20'
7у
(1952).
100. н
а
у
е в Ё.
?.
е1 а|.' [). $.
8цгеац
й1пез
?ес}:.
Рго9г.
'
&ер.9,
€оп1гас1
Рцгс!таяе
Фг(ег
]Ф
(33_038)
50-1214
8,
0есегпбег
21,' 1951.
;
101.
о г
а у
п !
е
[
в'
А.,
.],'
Ап..
€7еп.
$ос.,7а
3568
(1950).
102. ма||е1Ё
м.
ш.;
8агоо0у
Ё. м., ше_|оо|
н-
к.,
Р
а
р р
с.
А.,
&ер.
вм|-707,
}.{отегпбег
15,
1951.
103. Р!а|п|[аг
€.
А., 8а16ш!п
[.ф.,
}г.,
Ап.
$ос.
|е$!п9 Р[а|ег!аБ Ргос-,51, 1038
(1951).
104.
Ап0егзоп
€..т.,
науев
Ё.
т.,
ко0егзоп
А.
!.,
(то1|
ш.
.'.,
0. $. 8цгеаш й1пш
&ер.
1пуез{.
4658,
1950.
105. |!Ё{оп Р.в., овьцгп
$.€.,
&ер.АР?&_59,$,
9есегпбег
|2'
1949.
а
{
ъ
.{
4
3
ч
з
!с
:€
.,'
;
:
.:1
64.
65.
070'
Рер.
14'
1953.
\/ап
Аг[е1
А. 8.'
&е!пе
\/ап
Аг[е1
А. 8.,
&е!пе
!\,1е{а|!е, 8ег!|п,
1939.
Ёц[а8а1уа
$., |:{агпбо
_|.,
Ё!е6'го!ес!т.-|.
.'.,
Ё!ес!го!ес!с.-
!,
-
"0;й|,
Ё,-'д'|\9ату.
'
!
68.
Рг
|е6
ег|с1п;Ё., $|1Ё |:
€!тетп.,,1,и''169
(1925).
Рг|е6
ег|Ф1п';Ё.,
'3|11|8
[., 7.
€!теп.,
1,и'
169
(1925).
Ав1е
€.' .}1
оегз
к.,
7..апогР.
ь., 7.
апог9. а!!уеп.
,69.
€., 1!1
о е
г з
&.,
7.
-апог9.
а!!деп.
€!пстп.,
(189о)
'71.
&
и 1!;
!'!1п:.}.!.
2.
р.п3ец.
€Фп., 2{,'
Рщс
|'4
'72.|гоо
73.
тт1/'е
0 е.
?9.
в
е.
ц
9;.'(];:'Ё
б:ег1 Р., 2. Р!тув., 31,
268
(1925).
77.
Б
р
е
г
е
р'
А..
А6а Р|аув[соф[гп.{].
Р. 5. $.. 10. 593_
78. Б
р
е г
е
р';А.;'Ас!а
Рфз!сос!а!тп.
0.Р.5.
$.,
11,
617
(1030).
то.
с-: а ц{;
п
9
Р., 2.
апог9. а!|3егп.
(!аеп.|
208,
401
(1032).
:80.
]у1 а11е1*
м.
ш.,'
8е1!е
.'.,
с|е ап0 в. в.,
!.
Ё|ес!госФтп.
$ос.,
101,
1
(1954).
91. 1о
с {
$.9.,
]:
Атп.€!тегп.
$ос.,72,2914_2915
(1950).
82.
(
е 1 1
е
у
1(.
к.,
ш: 5. 8цгеац
]!1|пев Бц|1.
476, 1949.
83.
к
е
|
| е
у
|(.
к.,
0. $. 8цгеац
]!1!пез 8т_т1|.
щ7,
\95о.
84.
Розв!п1
г. о.,
\[а9пап
0. о.,
Ёуапв
[. Ё.,
[еу|пе 5.,
.|а{{е
1.,
(_].3.
|\,]а1. Бцгеац
${ап0.
€|ге. 500'
1952.
85.
к
е
!
1
еу
(.
к.,
ш.$. 8цгеац
!!1|пе1
(настное
сооб_
шение).
86.
к
е 1 ! е
у
1(.
к.,
ш.5. 8цгеац
}11пев 8ц!|.
4о7,1937.
37.
кцбазсьешв&|
Ф., 8уапв
Ё'. !.
[., йе{а}
1шц|са1
1!еггпос[етп1в1ц,
р.
174,
ш.
у.,
1951.
88. 6ц1бгапзеп
8. А.,
Ап0гетлл
к.
г.,
1йй'ез-
1!п3}пошзе
Рез.
[аб. $с|. Рар.
1810, 1954.
.89.
6ц|бгап$еп
в. А., Ап0гету
к.г.,
[гапз.
А|ммЁ,
185' 515
(1949).
99. !
аз{
.).
!..'_
Роо!е Рг!п!в,
13' л! 1,
22
(194о|.
91.
&аупог
${'. !:!|., Роо!еРг[п!8,
15,х92,3(1943).
\2\.
км_113.
117. со16гпап
к.
м.,
тпо!па$ 0.Ё.,&ер.шАРо-
92,
1954.
118.
Ась1ег |т1.
Р., &ер.
\уАРо-мм-258.
119.
со|0гпап
к.
м.' шАРо
(засгное
сообщение).
120. отш|3[Ё А.
в.,
Роебцс[
А.н., Аш|
(застное
сообщение).
6 о 10
гп а
п
к.
м.,
ти
о
1п
а 9
}. Б'.,
&ер.
шАРр-
мм-184, Ребгшагу
19, 1953.
\\/
а | 0
гп
а
п !. А.,
€о[е
п Р.,
&ер.
шАРо-мом-8'
1!1ау 13, 1954.
123.Р гау Ё' А.,
Реор1ев
Р.
$.,
&ер.
вм1-т-55,
.}апшагу
15, 1951.
124. Р гау Ё. А.
(вастное
сообщение).
125.
к
перре! ). 5.,
&ер.
|[1?-)$1(-1.
126. Ё
ауёв
в.
т.,
*ог1}дшез1 8|ес1го0ете1оргпепЁ
|абога1огу, ш5вм,
Ре91оп
1!, А1бапу, Фге9., Рго9_
гезз
&ерог1з.
\27.во|0гп_ап
к.
м., ]!огпаз Р. 8.
шАРр
(настное
сообшение).
128.
Б у а п в
|-}.
&.,
| гапз. Ё!е6гос!тегп.
3ос.,
91'
547
(1947).
129.
н а ц {
|
е
(.,
Рго3гезз
|п
йе{а| Р}пуэ|св,
9о!. 4,
р.
71'
€
}: а |
гп
е
г
э
Б.
(в0.)'
ш. у., 1953.
130.
&ш1{
о.,
Ёбег{
Р.,
2.
апог9' а!|уеп. €!аетп-,
180,
19
(1929).
122.

г.ц.
1!.
коР!,о3ия.циРкония
и вго
сг1лАвов
:|79
145.
6о!0
' '.
,'!уй'':
146.,1!*{:
_131.
с|||е11
н.ш.,
Роо!еРг!тт!в,
13,
}/'э
1, 1(1940).
11?. в .а
}
п.о. г
_\у.д.,
-Роо!е
Рг!п!з,'
|5,-)х|е 2,
з
(1о43).
'
133. А|пц11
о.в',
5с1'пеег
€.
ь:, ме|о|'!п4.,'68,
343
(1946).
111. ц
г
о | |
![.
-].,
Р![п!п9-
ап4
Р1е!.,
]Ф 27, 262
(194б).
135.
Р.ау.п'ог
ш.м.,
й|п!п9
ап[ ме!.,'лге
эЁ,
э8ц
(\э47).
136.со|0еп
[.3.,
!апе
|.
п',
Ас|<ег!пап
ш.
[., |п4.
Ёп9п9.
€!цегп.',и.
1ою_|939
(1952).
137.
с-ее.
!.
А.,
9о|йеп
[: в.; |
цзбу
Ф. в.,
^|'!.'Ёп9п9-.
€!еп.,
41,
1668_1673
(1949).
138.
со!0еп
|-.
в.,
|п
,,2|гсоп|шгп
айс ?гсоп|цгп
А|оув",
р.
ю5,
А$й'
€|еуе]ап6. 1953.
]99. 1еу|о. _Р. |,
|п4.
Ёп9п9.
€!тей.,42'
639
(1950).
14о.
{', п |^!.8
-ц.
н._
^(Р-с.),
|пё
согго!:оп' нап}ьоой,
р.
347,
[. {.,
1948."
1{1.
во1!6ег
Б.
\[.,
&ер.
^Ёсо-77ж,0есегпбег
12,
1949.
142.
9 г::
гп.-ьзч
в
ь
п.
,.,
!п4.
Ёп9п9' €1еп.,43'878_
288о
(1951).
143.
ш||||агпв
\[.
[., !_}.
$. ]х|ау.
Бп9. Бхр1!.
51а1!оп,
!е9*,ЁР$.€*395>3,
с€5о1-в
(ш5013-
г1в),
Аш9ш#
91-180?. 4ш|-з009,
Аш|--а069,
Аш[-_4103;
Аш[-
-4150'
Аш|--4188,
-|апшагу
1947_]цпе
1948.
167.
сцп1!дегвс[тш|2е
А:,
8е1т'"
Ё.,
Б|е&1го|у1-
(оп0епва1огеп,
8ег||п,
193?;
Апп.
агьог,
м;сп.'
:э{4.
1б8.
]у1.о_о^г1с.
с.,
й
с |( |
п п
е
у
о.$.,
ш;;
;
;;
,.
ё.;
А8[
Рго9гевз
Рер^ог1э
шуа_544,'1950
;
шуо"-й5:
Р999чь.._'
10'
1950;
_{х{9Ф-546,-йагсЁ
30,
1951
;
шуо-547,
.)шпе
22, 1951.
169.
с
а
г |п
о 0'у*
!п!/-.
Р.,
[гапз.
Ё!е6.гос!аегп.
$ос.,
91,
___
-
9ш-31в
!1947).
170.
ша|{ег
!-.'н.,
Ё|ес!г!с!ап,
7|, 1057-1058
(1013).
171.
м^|
з с }п-
_ $.
-!.-,
&-ц
Ё 1п
е г
\\\/.
Ё.,
}.
Ё!ес!гос!теп.
$ос.,
100'
531-537
(1953).
!!?.!.,
цп_8
!.,
А-вРв_&ер.
м1к-тоо
(1951).
173.с}аг|евбу.А.,
Ргос.
РЁув.
$о}.
[пё.,663,
317
(1953).'
|74.
м!зс[
Р.
о.,
г!з!ег
Б.
5.,
Аш!
(неопубли-
-_-
__кованные
данные).
175.
кцбазс1:етцзк!
Ф',
}|ор|<|пв
8.
Б..
Фх|0а_
о
1|оп
о{
йе1а|э
ал0 А|{оув.
г|. у..
:эоз.
176.
с!'|т!во$
.'.,
?}догпа6
о.
в., Ргос.
АЁ€,]!1еЁ.
0оп[.,
йагс[:.
1952:
Рев.
[|}5б&.
\7т.
Р[а|п|1саг
€. А.,
в,|ап:!п
\[. й.,.}г.,
Алп.
'
$ос.
|е$1п9
|у1аег[а!в
Ргш.,
61,103в
(19ъ1):
178.
.|9
$.1
у.,__
0||{шв|оп
шп0
,с!еп!зс1пе..
&еас1!оп
|п
{ез1ео
51о{{еп.
рр.78-8о,
}гф0еп
шп6
&!ра!9, 193?.
179.
9 г
а у п
!
е к
; ][.,
:
;.
гйвг|ьмй.г;.,1!,б,-6Ё_-й)
(195в).
'.
:
:.
''
+
.].'
-
'
18о.
нас[еггпап
Р.;
€ее|1::Ф.'8,,
.!.
Ё!е4гос[аеп.
.5ос.,
101' 419
(19'54)...:.
,
..:'.;'
-',!"''.--.
-
181.-п91^ь
цз-,_
А.,
щск!ппеу
р.
$.,
\['а
г
п
ег
.
^^._
{;,**3,''/т1?1ъ}11Р':
шу-+-ф,
.]апт!гу
з, :эь1
;
182-
А0агпв'6-.]
Б.,-
.],.,,
фага9}п|п!
м.,
9ап
-
ку^5ве1
бег3}:е
Р.,
&ер..'ь-вст]-жээ,.|шпе
!:,
1953.
13!.
3 *] ;
]
: :
в
}
\:,'
*"'1,##[#!#',':,'€{91?;
(1953).
185.9ап
Рувве|бег91те
Р.,
Рер.
Авсш-2зв5.
1я9. !'
ат.|.п
9
ц.
в.,
/.
Ёсессгосп}гп.'ёБс.'
Ф
зб]:бЁа>.
187.
Ро
|.! |
1-в^
)1*|;,
€_!
ат!
ез б
у
н.,
Рго{.
Рп;;.
$;;.
]-п4.'
678, 2о!-2\о
(1954).
188.
€1ь|:^'9.^ц,
ф_ч+|
ш.
Р.,
Рер.
Рго9г.
!п Р!ауз.,
,^^ __12,
|63
(19,4-1949).
189.
у
е г гп
| |
у
е а }.
\./
а'цо !+|фа!!шг9|са,2,
ио
(1954).
190.
с ц
п11п
е'гвсг:ч^п_т.
ь
ъът'"-Ё,'
л''г]Ётв'.',
_6ц
145-161
(1931).
191.
ош|пс[е
6.,
Айпа!еп6ег
Р!аув!*
цп6
(!оетп!е-
Рщ9еп4ог||,
129, \77-21в
(1в661.
192.
п
о 1
! е
11-_ А.'-
|!!а0еу-.
д*йа.
*;вв.
т|!еп,
!\4а1!т.
\ч!цг.у. $!.'77,
Аь1.
1|1,
229
(1878);
}!ап0бшс}л
0ег
-^^
-Р[ув|[,
[о|.
20,
р.
2о.
193.
Б^у
а.п
з. [_}.
-Р',
йе1а|||с
€оггов|оп,
Равэ!т|{у .
ап0
Рго1ес1|оп,
ш. у.,
1946.
194.
]!1
а.п { г
е.
0 |
_(!0.),
Ргосее0|п9в
о{ 1[е [|!г0
!\{ее1|п9,
|п1егпа1!опа|
€огпй!1{ее
о{ Б!ес1гос!егп!са]
[|еггп6]
0-упагп!св^ап0
1(|пе1|св,
вегпе,
:эо],
рр.
эцт_5оэ,
й!1апо,
1952.
195. [-1-|_Ё-.
?[|гь|<
н.
к.,
\[уппе-.|опев
ш. г.
к.,
[гапв.
Рага4ау
$о1:..47.?0.
оээ"с;оэ:':_
196.
Р-о
|-!!-! 8^ }_],,
€ !д
а г
|'е
з б
!
А.,
Аер.
АвпЁ
м/п-1040 (1953).
197.
Р_е
е &
Р.
\[.,
.1г.,
!|е|ес1г!с Р!:епогпепа
!п
!|!д[-
-^^
--\ло|1а9е
€,п-3!пеег!п9,
3-0 е(., ш. у.,
1929.
198.
\[[/ а
8:]
е г_
€,-|п
,,А1огп
мо('епеп6'',
р.
153,
А5й,
€|еуе|ап0,
1951.
199.
у е
г
\]у
е
у
в.
-,.
\[.,
$егп!€оп6шс1|п9
}1а1ег!а!з,
р.
151,
ш. у.,
:о5п.
200.сцп1[дегвс[ч|ае
А.,
8е1э
н., 7.
е,!е*-
'!гос|тетп.,
37'
7%_:134
(19з1).
:|!^ц.,
4 9
|!
е_
ц_гп]Ё
й.'\[:
!
.,
;.782-786
(1953).
.п
$. €.,
.|
г';
Аг
тесь.
'!:'
1':
.'
;:: ,,я
''
ф!оц,
|{а1' !еа0
9щЁа,у,
-*о!
:'1дц
''
'6616',!|е1{|,
!1-411.'-.
.1::+.:.,.
''мйа!в
о. А!!оуз,4'
199_201
752.
\очп_в
ц.
$.,
$1гас[дап
к.
с. А.,
€!аетп.
а.
|пё.,
7,
154_155
(1953).
153.
\[л^е!^ет_€.-,Б"'--Бр'в1е'|п
!. Р',
!.
ме!.€егагп.,
6, 36
(1951).
154.
ь
}-о-'1-&_\\:
(Б0.),
1
!чш10
.!!1е1а|в
Ёап00оо1<,
2-п0
е0.''\[аз[!п91ов,
.|шпе
1952.
155.
3 }л е
р
а г
0 о.
0.'
е1
2|.,
$1ап{ог6 0п|уегв|1у
8с}:оо|
о[ й|пега|
&!епсе, 0!у.
о{ !т1е1а||шг9у,
Р!п{|
$.р. 9{,
А^8'{
€оп{гас1
Ат
(40_1)-1059,
бпо-45,
-|шпе
11, 1951.
:56.
о1:1_$:{ц9
ш31. 1,аб.,1т1ё1.
^!!т.
Фшаг1.
&ер.,
Рер.
опш|-583.
!апцагу 31. 195о.
157.
вуег}л
аг1
}.[.,
-\!
ай шц !в Ё.
|..
Р|па|
Рео.
оп
АЁ€
€оп[гас[
Ат
(30_1)-вв4,
шуо-7оз,
.|шйе
15,
1951.
158.
ке
|
гпап
|-.
п.!
ш|!&!пзоп
\[.
о.,
уа8вее
Р.
|-.'
Рер.
Аш!
_4417.
!ц1у 1950.
1!9. Р_{ чз_г
с
_.
.!.
о.
(на?йноЁ
сообщение).
1б0.ша1!бацгп
н..'.,
2. |1е[а!!1сцп4е,'34,
ф
5,
118-119
(1942\.
161.ш!|&|пзоп
\[.0.
е1
а|.,
!п
А\[]!1е1.)!у.
-0^цаг1.-Рго9|,
&ер.
{ог Рег!о0
.]ш|у_}есегпбег
1949,
Рер.
Аш!
_4364,
Аш[_4399.
-
162.
А-п0егвоп
Р._€::
$1ер!лап
н.
&.,
о&ш[,
Рер.
[8РА-1652,
Рго!есЁ
2-01.
Ацдцз1
1950.
163.
врв{е1п
|.
Р.
(наст!*ое
сооб!цени1 и
неопубли_
_
кованные
данные).
164.
$а |
-*!-а
!.
г.,
ш-6г!!пгшр
о.в.,
Рер.\[лАР!_3,
-
р.
\57,
!апоагу
1,
1950.
165.
коеп|3
п.Р.'
ва|0т:1п
Б.Ё., 8гцзп
в.с.
е1
а|., !(АР|,
/т1е[а!1шг9у
$ес{|оп
(неопубликов:|нные
данные)'
1949_1953.
166.
к
е1гпап
[.
п.,
0гш9ав
Р.
6.
е1 а|.,
&ерог[в

['лава
12
АнАлитичвскАя
химия
циРкония
Рц0
вввдвнив
|1ока
цирколием
не зайу_тересовалась
(омис-
сия по
атомной энергии
сшА|'внимание
хими-
к0в-аналитиков
к
этому металлу
ограничивал0сь
разработкой
методов ёго
отделениА уц
к0личест-
венн0г0 определения
в минералах' тугоплавких
.]|1атериалах и
немногочисленных сплавах. Ёеко-
торь|е
и3 химиков имели
дело
с анализом
порош-
к0
в
цир
кон ия'
пр
именяемыц.в,
качествР
га30 п
огло-
тителей (гл. 2).
,[,9тали,
касающиеся
ряАа
наде)к-
нь|х
методов
отд9ленця
|{,
]в9сов9го
определения
цирк0ни'|,
приведень[ в
руководствах
по хими-
ческому.аналш},[|--,..3];;.РяАР}|их;Р}(0вФАсг8ах
[4,
5
},
Ф$}!.
$'.!.}|ы. ;:
!(040р!йе.щи.5е€(|!$,
;,,
и
тур биди-
метр
ивескиё.
мег0дБ1: ан1{л!в.|.
1
:
]'.
:.
:
-:':.
.'
:;
,:::'
"
:'''1
Б скоре
-'йосл61-н{_чд'*;,оеуцествлен.ия
Ё
с
ш А
программц['
$А9'
пц
-м'фт4л$ургип
циЁ'к0Бй1
цо.
явилась
нёъбхо)!имос!Ё:Б
:'ра6работке,химических
и спектральных методов]
опрёделения
]пРийесей
в металлическом
|{ирконии.
Бьпла с0ставлена
пр0грамма
работ
по.
р_азработке
наде)кных
хищи-
ческих
и
спектральнь!х методов анализа
(иР-
к0ния'
в 0существлении
которои
приняли
учас-
тие
одиннадцать лабораторий1. |!ервонаиально
программа
вь|полнялась под
руководством
Род-
дена
из
лаборатории
(А3
в Ёью-Брат:суике'
вп0следствии
ответственность за эту
работу
бь:ла
в03л0же}{а на йеталлургинеский лроект
}1асса-
чусетск0г0
технологического
инст}1тута' а
рук0"
водств0
работой
поручено
автору этой
главь!.
||робьт измельченного
гидрир0ванног0
цирк0-
ния
бь:ли
п0лучены в й11,1
и
распределень|
для
анализа среди
ука3аннь|х
вь|ше
лабораторий.
-}1аборатория
}(А3 в Ёью-Брансуике снабдила
эти лаборатории образцами окисл0в
для
и3готов-
с
лен|1я
спектральнь]х
эталонов.
||роизводствен-
ная лаборатория
т-12 (8к-Рирк) пригот0вила
срезвьпнайно
чисть1е окисль|
гафния |1
цир-
кония'
и3 кот0рь}х
в
ра3личнцх
лабораториях
1д}готовлялись
спектральнь|е
эталонь|.
Б
результате
объединеннь|х
усилийэтих
лабо-
'раторий
в
настоящее время
ра9работаны
методы
количественн0го
0пределения большинства
при-
месей
в техническом
цирконии.
!ля
определения
в
нем содержания всех элементов;
ис:о:юная
гаф-
ний, применяются
химические и
спектральные
шотоБ.
Аля
опреде.}1ения
гафнця
'р3зработаны
спе}сгральный,
флуоресцентньй
рентгёновский
и
а&ив*'цй6йЁЁ:й
йетодЁ;
'
]
']
::;
1:;
|]
')'
'
.
..
'
;.
'
,.'';^''Ё
;
отвй
йроь,
мЁтдлличвсцоцо1фЁйония
-
!,:''
=.,..
Ё }|}
:!18$отовкА:
А.т[8::А|!А:]|}|3А
' '
_
:1
'::
Фтбор
проб
}|еталлического
цирконпя.
.[,ля
полг!ен
ия
наде)|(цых
р
езультатов
пр
и
пр
ове
дени'4
анали3а
любым
методом
необходимо, итобы
отоб-
Ранная
проба
действительно
со0тветствовала
с0-
ставу
анали3ируемого
материала.
}то особеглно
вая(но
для
губнатого
циркония'
в
к0т0р0м
при-
меси
распределень|
очень
неравномерн0.
|'илберт
и }1оррисон
[6]
разработали
технику
отбора
проб
губиатого
циркония.
}1уталл измель_
чали
до
так0го
с0стояния'
чтобы частиць1
пр0х0-
д!4ли
через
сито с отверстиями 9,5 лл'
при
это'|1
частиць|
ра3мер0м
-20
меш отбрасьтвали.
(вар_
тованием
отбирали
рял
проб весом \,36 ка,
из
которых
прессованием
на
гидравлическом
прес-
се
|*}готовляли
брикеть1
диаметром
окол0
|0$ мм-
€верлением
или обточкой
на токарном
станке
14з этих
брикетов
п0лучали
.
стру}{ку.
Бь:ло
устан0влен0'
что
наиб0лее
правильная
сред:
няя проба
получается
и3 стру)|(ки'
срезанной
с
цилиндрической
поверхности брикета
после
отбрась:вания
стружки,
снятой с п0верхн0стного
слоя.
}стан0влено
также' что этот
мет0д приг0ден
и
д'1я
отбора
проб
от
слитка,
пдлученн0го
дуговой
1
Анл,
Р|нститут им.
Беттела,
лаборатория
фирмы
+Фут
мг:нерал',
коллед}(
1]:т.
Айова,
-}1ос-Аламосская
;:аборатория,
.
мти, |'орное бюро, ФА33, лаборатория
!-12
(Фк-Рид>к),
лабцратория
(А3
в Ёью-Брансуике.

381
12.
АнАлитичвскАя
химия циРкония
гл
плавк0й.
9тобьт
предотвратить
заметное
в3аимо_
действие
цирк0ния
с
азо1ом
и
кисл0родом' реза_
|'*
**''',а
производили
на
малых
скоростях
и
й..т'
соприкосновения
Резца
с
цирк0ниеп1
0хла}1(-
дали
струей
воздуха'
*"'Ё;;
щобу
нухсно
отобрать
от
п^ластин0к'
то
,з
разлиийь:х-
унастков-их
вырубают
кружонки
небольшого
диаметра.
Аля
анализа
на
содерх(а-
ние
кислород'
"
азо}а
металл
)келательно
брать
в
виде
кус0чков.
из
второй
порции
двуокиси'
8
некоторых
лабора-
тория}
применяют
ступки
из
сравнительно
чисто_
го
металлического
ци"ркония,
6днако
они
требуют
частой
п0лировки
рабоней
поверхности'
тРудност}:,
связдннь!в
с
химичвским
АнАли3ом циРкония
[|риготовление
проб
для
ан_ал-[{за'
]т{етоды
полун.""я
проб
для
химического
и
спектраль-
ного
анализов
'6.уйй'го""^
|^о'пщеноц
[т1'
Ёъ;ъ.";;;;'
р
р
в
"л'й
и
со1!'-_[9,
10
]'
|[
ро
бы.пля
спектральн0го
.*йй'
моЁц1_-^9.ч
"
в
фор_
ме
дЁуокиси,
тонкой
металлической
струлски'
кус6й'1ов
металла
или
растворов
его
в
кислотах'
Фбычно
металлический_
цирконий
растворяют
в
йййй*'"'й
кислоте
или
в
смеси
".'
_цР^у^|ч}
минеральныщц
цислотами'
3-]:::Р'"'сской
"'о'р'"'рии
удалось
достичь
полного
растворе_
ния
циркониевои
;й;й
в
80о/'-н^от
*г':*
й.,й.|-,ри.
н4|р9Р!йий
в
кварцевош
'сосуде;
;;;а;ый
'ор{Ёнй]
*'}одильником'
8
[4нсги-
#;;.
Ё;йел1
и
гш}[
йеталл
растворяли.Р
кон_
нж;#^жж*гн&нннйЁ333;}9#"#.т;
Ёй;;"ь"й;'ф6р"Ё
тонких
стрркек
;
одна{9
;ь;;;йе
на'Ёйё!ород
или
азс)[г
металл
л}п!ше
ишеть
в
'виА9
1усонков'
Аля''спепорального
"1'1й.*_
д"уокись
полуяают
прокаливанием
ме_
'^л,и,.ск"1
стружек
на
воздухе'
в
кислороде
или
смеси
кислорода
с
инертным
:1з0м'
,[1
ля
предотврашения
какого-либ0
загря3нения
,рй'
во
времй
ок""""',"ной
обработки
нео0_
х6димо
принишать
со
0тветству|Ф||1и0'
меРы
предо_
;;ф;;"йи.
€тружки
не
3агря3няются
при
про_
каливании'
если
их
поместить
в
платиновую
ло_
дочку
и
нагреват"_"
*,,рш'вой
трубке
или
фре_
Бой]йнои
кЁаршем
муфельной
уу'
'
|10сле
прокаливан1ля
двуокись
-истирают
в
тонкий
порош0к
в
под*одяйей
ступке'
||ослед-
нюю
необходимо
вь:орать
-осмотрительно'
ттобы
й! 11.р"."ить
окисел
]одним
из
элементов'
содер-
}(ание
которых
буп.'
определяться'
Агатовая
ступ
ка
мо >кёт
за
г[:
язн
ить-
ц:
у^'^11':.ч
ъ1
"Ё
]
'1|ля
определения
в
цирконии
небольших
к0ли_
честЁ
друг!'тх
элементов
химически]![
методом'
как
.'',"ий.
требуются
специальные
пРиемь|'
так
как
й}:"сутс|'йе
6ольшого
к0личества
циркония
ме-
йаеЁ
определению
примесей.
су9119сть
цирко-
ния
к
гйдролизу
и
выпадению
к}
раств0ра
в
кол-
лоиппном
состоянии
была
отмечена
Родденом
|э !.
йёй."т:1ее
действие
ион0в
циркония усщаня-
Б{
-
!р;м.вениом
комплексообразовате"2у
!!у
количёственнь!м
отделением
определяемого_
:?*_
мента
от
циркония
.(в
присрствй\1
щ\4
в
отсуг_
стЁие
компл-ексообразователя)'
-'
-Ё,йерош
испо|йоинця
!5омпл9ксообразова-
т.'ейявд'йется[обайениетар1ц1чР:.-ч.^1ц*.1тР':;
;;
?
ЁЁй;;'
а;Ёй;',,,Ёф.'уд*9*#::
.-1!1етодо}{
о
пр
едел
1пь
)[(епе{}о'
:
ко
ло
Р
и,|!с
1
Р
|!ч"!-,ч{'
|*Ё:
::-"-:
эт!а
рйгенты
препятствуют
о
сащд9нию'циркон|{я
а
фпг(а
из
муллита
-
А'Ф,
"
$'-9з.'
всли
3а_
.рй]'*Б]й.
бором
не
приним1ть
во-
Р^т'имание'
то
|,я
".'"р'ния
двуокиси
мохсно
прип{енять
ступку
;;^;й;й'ь;й:
с{упки
из
кфила
вольфра*та
'римЁн'мы
в
т6м
слунае'
если
в]роое
не
опреде-
ляется
содержание
Ёольфрама'
Фднул_орцию
мож-
но
растереть
в
ступке
йз
карбида
во-льфрама'
а
дру'гую
*_
в
агатовой
ступке,
пР1
этом
первую
|БЁ';''
мох(но
использовать
Ал9
определения
кр|мния,
а
анали3на
прочие
элеме1{ты
пр0водить
отдвлвпив
циРкония
.,
]
Фсд ттценше.
8
лп':т9ратуре
,оп1с_1т9-т.1тР.*':
тойо|йления
циркойия
преш'о^са)|(дения'
но
в
большинстве
.,р,?'
не
до!<азано,
9о
вмест9
9
[!ипконием
"*
.',>кд'ются
и
другие
элементы'
;;;;
ы
;
н е
бол ьтших
количествах
]1орядка
микро_
Бы;;.
5о.р,'
[1
1
],
олч1ц'1
::995::,]
9 .19.]:9*
о''й.,.'""
ал|омйни11
по
сле
оса)кдения
циркония
из
кислого
р*."*'р.,рй
пооа"лении
салициловой
кислоты.
3
кст
ра
кшпя.
Ф
р.е
йнду
[
1 2
] у^+11л''':
19|19:::з
отделитЁ
алюминйй
от:
(иркония
экстракциеи
к}Ё6.ро"'та
циркония
и3
кислото
раствора
хлороформ'*,
.д*!й'
в
реагента*_-9-у".
обнару_
)кено
заме'"'.
*''йчест}о
алюминия'
Бейн
[13]
'исполь3овал
очень
чисть:й
купферон
и
достиг
хо-
р'',*''
отделения'
причем
был9^пока3ано'
что
Б
ре'.е*'ах
содер>ки1ся
очень
мало
алюм1417ия'
Большинство
методов
отделения
осн0вано
наэкс-
йр'кц",
органическим
раствор1"_1:*
комплекс_
ного
соединения,
образфмого
определяемым
эле_
ментом'
например д1лти-зоната
меди'
пр|{чем
[]иР-
коний
остается
в
водном
раств0ре'
Бозгонка.
||ри
нагреван|4\4
циркония
в
токе
.у'Бй-га!ооора'зного
хлористого
в0д0р0да
при
температуре
вы1це
450'
возгоняется
7г||,'
3та
г}р2 к!|ия использует
ся
\!|я
определения
кисл0рода
Б;;й;;;т{+_:о],
а
такя(е
{ля
определения
маг_
