Maass P., Peissker P. (ред.) Handbuch Feuerverzinken
Подождите немного. Документ загружается.


[8.1] DIN 55350, Teil 11; Begriffe der Qualitätssicherung, Beuth-Verlag, Berlin
[8.2] DIN/ISO 9001:2000, Qualitätssicherungssysteme Anforderungen; Beuth-Verlag, Berlin
[8.3] Huster, E.: Qualitätssicherung aus der Praxis eines Lohnverzinkers, Galvanotechnik Nr. 8,
1990, Saulgau
[8.4] N. N.: QS-Handbuch, Institut für angewandtes Feuerverzinken GmbH, Düsseldorf,
Selbstverlag
Für die freundliche Unterstützung bei der Bearbeitung dieses Kapitels wird Herrn H. Wieking
gedankt.
8Qualitätsmanagement in Feuerverzinkereien
320
Literaturverzeichnis

H.-J. Böttcher, W. Friehe, D. Horstmann, C.-L. Kruse, W. Schwenk, W.-D. Schulz
9.1
Korrosionschemische Eigenschaften
9.1.1
Allgemeines
Das gute Korrosionsverhalten von Zink ist durch Deckschichten aus festen
Korrosionsprodukten bedingt, die sich im Verlauf der Korrosionsvorgänge aus-
bilden und die eine weitere Korrosion erheblich behindern. Dies ist der Grund für
die Eignung von Zink als Überzugmetall zum Korrosionsschutz von Eisen.
Als primäres Korrosionsprodukt wird bei der Korrosion von Zink zunächst
Zinkhydroxid gebildet, das ebenso wie das unter Wasserabspaltung daraus
entstehende Zinkoxid amphoteren Charakter hat, d. h., es löst sich sowohl in
Säuren nach
Gl. 9.1Zn(OH)
2
+2H
+
⇌ Zn
2+
+2H
2
O
als auch in Laugen nach
Gl. 9.2Zn(OH)
2
+OH
–
⇌ Zn(OH)
3
–
Die Korrosionsgeschwindigkeit von Zink wird im wesentlichen durch die Ge-
schwindigkeit der Auflösung der Deckschicht bestimmt. Sie nimmt sowohl mit
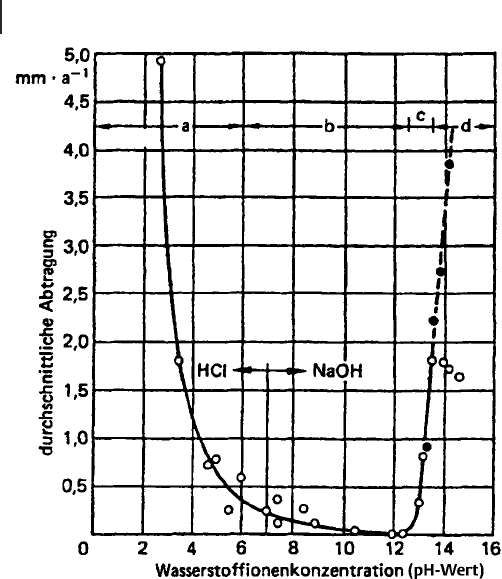
fallendem pH-Wert (Bereich a in Abb. 9.1) als auch mit steigendem pH-Wert
(Bereich c und d) deutlich zu [9.2]. An der Atmosphäre und in Wässern entsteht aus
dem primären Korrosionsprodukt Zinkhydroxid, das nur mäßig schützende
Deckschichten bildet, mit Kohlendioxid nach
Gl. 9.35Zn(OH)
2
+2 CO
2
⇌ Zn
5
(OH)
6
(CO
3
)
2
+2H
2
O
* mit freundlicher Genehmigung des Heraus-
gebers erfolgter Nachdruck des SIZ-Merkblatts
400 [9.1] (teilweise geändert, aktualisiert und
gekürzt)
9
Korrosionsverhalten von Zinküberzügen
*
321
ein basisches Zinkcarbonat, das in seiner Zusammensetzung dem in der Natur
vorkommenden Mineral Hydrozinkit entspricht und sehr gut schützende Deck-
schichten bildet [9.3]. Von Säuren wird es jedoch analog Gl. (9.1) nach
Gl. 9.4Zn
5
(OH)
6
(CO
3
)
2
+8H
+
⇌ 5Zn
2+
+2 HCO
3
–
+6H
2
O
aufgelöst. Bei der Korrosion an der Atmosphäre wird die Geschwindigkeit der
Auflösung der Deckschicht aus basischem Zinkcarbonat durch den Zutritt von
Schwefeldioxid bestimmt, das nach
Gl. 9.5SO
2
+H
2
O + 1/2O
2
⇌ 2H
+
+SO
4
2–
9 Korrosionsverhalten von Zinküberzügen
Abb. 9.1 Korrosionsgeschwindigkeit von Zink in Abhängigkeit
vom pH-Wert der Lösung [9.2]
Anmerkung: Die angegebenen Abtragungsraten wurden in einem
Laborversuch unter Bedingungen ermittelt, unter denen sich
keine optimalen Deckschichten ausbilden können; sie können
deshalb nicht als Grundlage für die Abschätzung der Schutzdauer
von Zinküberzügen herangezogen werden. (Staatl. Material-
prüfungsamt NW, Dortmund [9.1])
322

Wasserstoffionen bildet. In Wässern wird die Auflösungsgeschwindigkeit durch den
Zutritt von Kohlendioxid bestimmt, das nach
Gl. 9.6CO
2
+H
2
O ⇌ H
+
+HCO
3
–
ebenfalls Wasserstoffionen bildet.
In Meerwasser enthalten die Deckschichten vor allem basische Zinkchloride wie
Zn
5
(OH)
8
Cl
2
. Als Folge des Einbaus von basischem Magnesiumchlorid Mg
2
(OH)
3
Cl
weisen die in Meerwasser gebildeten Deckschichten eine gute Schutzwirkung auf.
Das Korrosionsverhalten von feuerverzinktem Stahl unterscheidet sich in den
meisten Fällen zunächst kaum von dem reinen Zinks. Bei gleichförmig abtragender
Korrosion an der Atmosphäre wird die Korrosionsgeschwindigkeit bei Erreichen der
Eisen-Zink-Legierungsphasen normalerweise geringer. Bei Korrosion in erwärm-
tem Wasser kann die Korrosionsgeschwindigkeit bei Erreichen der Eisen-Zink-
Legierungsphasen hingegen erheblich zunehmen, da die kathodische Sauerstoff-
reduktion hier ähnlich wie an Eisen oder Kupfer wesentlich weniger gehemmt ist als
an reinem Zink.
9.1.2
Grundlagen der Korrosion in Wässern
Die Korrosion des Zinks in WässernoderinElektrolytlösungen ist chemisch eine
Oxidationsreaktion. Diese besteht aus zwei parallel ablaufenden elektrochemischen
Teilreaktionen:
I
anodische Reaktion des Metalls unter Bildung von Metallionen
(Metall-Metallionen-Reaktion, Oxidationsreaktion), z. B.
Gl. 9.7Zn ⇌ Zn
2+
+2e
–
I
kathodische Reduktion eines Oxidationsmittels im Medium
(elektrolytische Redoxreaktion), z. B.
Gl. 9.8O
2
+2H
2
O+4e
–
⇌ 4OH
–
Gl. 9.92H
2
O+2e
–
⇌ H
2
+2 OH
–
In neutralen Wässern ist die Reaktion der Gl. (9.8) verantwortlich fürdiekathodische
Teilreaktion der Korrosion. Gegenüber dieser ist die Reaktion der Gl. (9.9) meist
vernachlässigbar langsam und spielt nur in sehr sauerstoffarmen Wässern eine
Rolle.
Ein Maß für die treibende Kraft elektrochemischer Teilreaktionen ist das Potenzial
des Metalls, das dieses in der Elektrolytlösung aufweist. Das Potenzial wird als
elektrische Spannung zwischen dem Metall und einer Bezugselektrode in der
Elektrolytlösung gemessen. Im thermodynamischen Gleichgewicht heißtdas
zugehörige Potenzial Gleichgewichtspotenzial und kann aus thermodynamischen
9.1 Korrosionschemische Eigenschaften
323

Daten berechnet werden. Für die Umwandlung von Zinkmetall zu Zinkionen gilt
folgende Beziehung für das Gleichgewichtspotenzial (Nernstsche Gleichung):
Gl. 9.10U*=U° + 0,03 Ig c (Zn
2+
)[V]
mit dem Standardpotenzial U
o
= –0,763 V. Die Konzentration der Zinkionen c(Zn
2+
)
ist hierbei in mol/l einzusetzen.
Das Standardpotenzial für Zink ist wesentlich negativer als das des Eisens, das
–0,44 V beträgt. Daraus folgt, dass das Zink eine stärkere Korrosionsneigung besitzt
alsdasEisenunddassesbeiKontaktmitdemEisendessenPotenzialinRichtungauf
das Gleichgewichtspotenzial des Eisens verschiebt. Dadurch wird das Eisen gegen
Korrosion geschützt. Man nennt diesen Vorgang kathodischen Korrosionsschutz.
Im kathodischen Korrosionsschutz in Meerwasser werden Zink-Anoden in
großem Umfang eingesetzt [9.58]. FürSüßwässer dagegen sind Zink-Anoden für
den Schutz von Stahl weniger gut geeignet. Dennoch darf davon ausgegangen
werden, dass kleine Verletzungen von Zinküberzügen auf Stahl (z. B. Schnitt-
flächen) auch unter diesen Bedingungen keinen völligen Verlust der Korrosions-
schutzwirkung bedeuten, d. h. freiliegender Stahl wird im Allgemeinen durch die
unmittelbar umgebende Zinkschicht kathodisch geschützt. Dies gilt zumindest
solange, wie die Zinkschicht nicht durch Deckschichten elektrochemisch inaktiv
wird. Die Gleichgewichtspotenziale elektrochemischer Teilreaktionen informieren
über die Möglichkeit bzw. die Richtung einer Reaktion, d. h., Korrosion ist nur
möglich, wenn das Gleichgewichtspotenzial der kathodischen Teilreaktion positiver
ist als das der anodischen Teilreaktion der Metallauflösung. Das ist bei den Gln.
(9.7)–(9.9) auch immer der Fall. Gleichgewichtspotenziale informieren aber nicht
über die Korrosionsgeschwindigkeit und auch nicht über das Potenzial des
korrodierenden Metalls. Letzteres liegt je nach den kinetischen Eigenschaften der
Teilreaktionen zwischen den beiden Gleichgewichtspotenzialen mehr oder weniger
weit vom Gleichgewichtspotenzial der anodischen Teilreaktion entfernt.
Für eine vereinfachte Betrachtung kann man annehmen, dass die Geschwindig-
keiten der elektrochemischen Teilreaktionen eines korrodierenden Metalls auf der
Metalloberfläche örtlich gleich sind. Das ist der Fall der homogenen Mischelektrode.
Die Geschwindigkeiten sind elektrischen Strömen direkt proportional (Faradaysches
Gesetz). Die Potenzialabhängigkeit der Reaktionsgeschwindigkeit der Teilreaktionen
wird durch Teilstromdichte-Potenzial-Kurven wiedergegeben. Diese Kurven schnei-
den die Potenzialachse beim zugehörigen Gleichgewichtspotenzial, weil bei diesem
die Reaktionsgeschwindigkeit Null ist.
In Abb. 9.2 ist dies schematisch wiedergegeben. Kurve (A) ist die Teilstromdichte-
Potenzial-Kurve für die Reaktion der Gl. (9.7) mit dem Gleichgewichtspotenzial U*
A
.
Die Kurven (K1) und (K2) sind die Teilstromdichte-Potenzial-Kurven fürzwei
unterschiedliche kathodische Teilreaktionen nach den Gln. (9.8) oder (9.9) mit den
zugehörigen Gleichgewichtspotenzialen U*
K1
,undU*
K2
. Die Reaktion entspre-
chend der Kurve (K2) ist schneller als die der Kurve (K1). Beispielsweise könnte in
diesem Fall der Sauerstoffgehalt fürdieKurve(K1) kleinerseinalsderfürdieKurve
(K2).
9 Korrosionsverhalten von Zinküberzügen
324
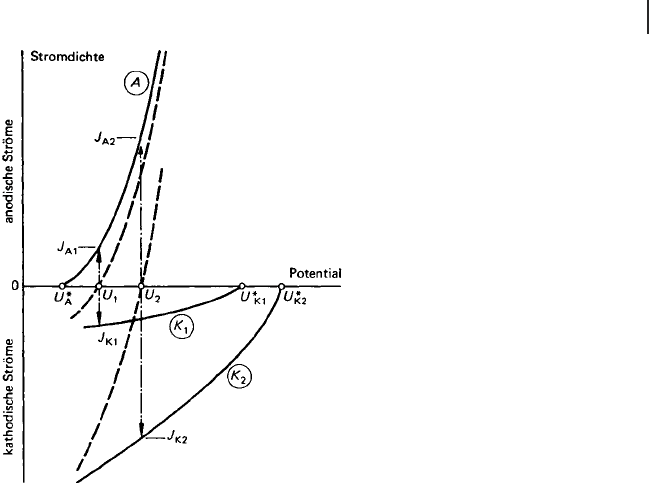
Die jeweilige Addition der anodischen und kathodischen Teilstromdichte-Potenzial-
Kurven führt zu den gestrichelten Summenstromdichte-Potenzial-Kurven mit den
Ruhepotenzialen U
1
und U
2
. Diese Potenziale entsprechen den Korrosions-
potenzialen des frei korrodierenden Metalls, d. h. ohne eine äußere Belastung
durch elektrische Ströme (entsprechend einem Summenstrom gleich Null). Beim
Ruhepotenzial haben die zugehörigen Teilstromdichten gleiche Beträge, die der
jeweiligen Geschwindigkeit der freien Korrosion entsprechen.
Aus Abb. 9.2 ist deutlich zu erkennen, wie beim Übergang von der kathodischen
Teilstromdichte-Potenzial-Kurve (K1) auf (K2), vergleichsweise von geringer zu
hoher Sauerstoffkonzentration des Mediums, die Korrosionsgeschwindigkeit
zunimmt und das Ruhepotenzial positiver wird. Das Ruhepotenzial folgt aus den
kinetischen Eigenschaften der Teilreaktionen und ist somit mit dem Gleichge-
wichtspotenzial der anodischen Teilreaktionen nicht vergleichbar. Eine Korrelation
zwischen diesen beiden Daten kann aber bestehen, wenn die anodischen
Teilstromdichte-Potenzial-Kurven steil verlaufen, d. h., wenn die anodische Teil-
reaktion wenig gehemmt ist. Dann liegen nämlich die beiden Potenziale verhältnis-
mäßig nahe beieinander. Man nennt diesen Zustand den der aktiven Korrosion. Er
liegt im allgemeinen bei korrodierenden Metallen ohne Deckschichten vor. In einem
solchen Zustand befinden sich Zink-Anoden für den kathodischen Schutz in
Meerwasser.
Beim Vorliegen von Deckschichten verläuft die anodische Teilstromdichte-
Potenzial-Kurve wesentlich flacher. Man bezeichnet diesen Zustand als passive
9.1 Korrosionschemische Eigenschaften
Abb. 9.2 Stromdichte-Potenzial-Kurven fürTeil-undSummen-
reaktionen (schematisch) – Einfluss der kathodischen Teilreak-
tion bei aktiver Metallkorrosion (Erklärungen im Text; Mannes-
mann Forschungsinstitut, Duisburg [9.1])
325
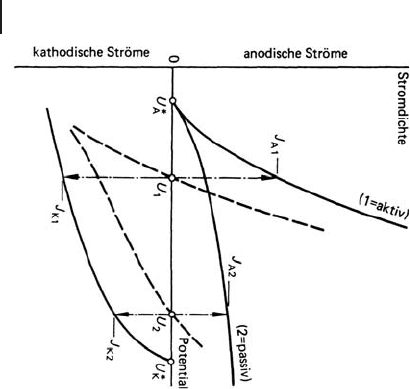
Korrosion. In Abb. 9.3 ist schematisch die Auswirkung der Passivierung wieder-
gegeben. Vereinfachend ist angenommen, dass die kathodische Teilreaktion durch
die Deckschicht nicht beeinflusst wird. Dies entspricht zwar nicht ganz den wahren
Verhältnissen, ist aber füreineNäherungsbetrachtung in diesem Fall zulässig, weil
die Deckschichten auf jeden Fall die anodische Teilreaktion stärker hemmen als die
kathodischen Teilreaktionen.
Entsprechend den ErörterungenzuAbb.9.2folgendurchAdditionder
zugehörigen Teilstromdichte-Potenzial-Kurven die Summenstromdichte-Poten-
zial-Kurven mit den Angaben über das Korrosionspotenzial und die Geschwindig-
keit bei freier Korrosion. Es ist nun zu erkennen, dass durch die Passivierung das
Ruhepotenzial positiver wird und dabei – anders als bei Abb. 9.2 füraktivesMetall–
die Korrosionsgeschwindigkeit abnimmt. Die Verschiebung des Ruhepotenzials ist
in der Praxis als „Potenzialveredlung“ bekannt.
Ferner zeigt Abb. 9.3, dass beim aktiven Metall das Ruhepotenzial in der Nähe des
Gleichgewichtspotenzials der anodischen Teilreaktion, beim passiven Metall
dagegen mehr in der Nähe des Gleichgewichtspotenzials der kathodischen
Teilreaktion liegt. In diesem Fall besteht sicherlich keine Korrelation zwischen
Korrosionspotenzial und dem Gleichgewichtspotenzial der anodischen Teilreaktion.
Da Zink in Süßwässern leicht durch Deckschichten passiviert wird, kommt es für
diese Medien als Anode für den kathodischen Schutz nicht infrage, weil eben das
Potenzial zu positiv ist. In Grenzfällen sehr starker Potenzialveredlung kann das
Potenzial des passiven Zinks sogar positiver als das des aktiven Stahls werden. Dann
besteht bei verzinktem Stahl Gefahr der Lochkorrosion fürdenGrundwerkstoff
Stahl. Solche Fälle sind vor allem fürWarmwässer bekannt [9.4].
9 Korrosionsverhalten von Zinküberzügen
Abb. 9.3 Stromdichte-Potenzial-Kurven fürTeil-undSummen-
reaktionen (schematisch) - Einfluss der Passivierung bei gleich-
bleibender kathodischer Teilreaktion (Erklärungen im Text;
Mannesmann Forschungsinstitut, Duisburg [9.1])
326

Die Korrosionsschutzwirkung durch Deckschichten ist entscheidend davon
abhängig, ob das passiv korrodierende Metall eine homogene Mischelektrode ist
odernicht.WenndieDeckschichtörtlichinihrerWirkungbeeinträchtigtistoderfehlt,
wird das dort ungeschützte Metall durch das relativ positive Ruhepotenzial des
passiven Metalls belastet. Über das Ausmaß der Gefährdung informiert Abb. 9.3
anhand der anodischen Teilstromdichte-Potenzial-Kurve des aktiven Metalls, die die
Potenzialabhängigkeitder Korrosionsgeschwindigkeit direkt angibt.Bei einer örtlich
defekten Deckschicht entsteht letztlich eine heterogene Mischelektrode, die sich aus
einer großflächigenKathodedespassiven MetallsundeinerkleinflächigenAnodedes
aktiven Metalls zusammengesetzt betrachten lässt. Aufgrund der Spannung, die die
Differenz der Ruhepotenziale des passiven und aktiven Metalls (U
2
– U
1
) gibt, fließt
zwischen beiden Bereichen ein Elementstrom, der die Anode stark korrosionsge-
fährdet und die Kathode geringfügig kathodisch schützt. Auf quantitative Be-
trachtungen soll verzichtet werden, zumal dazu Angaben zum Verhältnis der
Flächen und des elektrolytischen Widerstandes erforderlich sind [9.6, 9.58].
Die Ausbildung solcher aktiv-passiv-Korrosionselemente ist die Ursache für
örtliche Korrosion unlegierten Stahls in neutralen Wässern. Zink neigt wesentlich
weniger als Eisen zur Ausbildung von aktiv-passiv-Elementen. In dieser Hinsicht ist
auch die Korrosionsschutzwirkung von Zinküberzügen auf Stahl zu sehen, da der
Korrosionsangriff vergleichmäßigt wird [9.4].
9.1.3
Thermodynamische Grundlagen
Die durch die anodische Teilreaktion nach Gl. (9.7) erzeugten Zinkionen können
mit Ionen des Wassers und mit Wasser selbst zu festen Korrosionsprodukten
weiterreagieren:
Gl. 9.11Zn
2+
+H
2
O ⇌ ZnO + 2 H
+
Vereinfachend sollen im Folgenden nur Ionen des Wassers und keine fremden,
zusätzlich deckschichtbildenden Komponenten betrachtet werden. Das nach der
Reaktion der Gl. (9.11) gebildete feste Korrosionsprodukt ZnO kann sich in
alkalischen WässernanalogGl.(9.12)wiederlösen:
Gl. 9.12ZnO + OH
–
+H
2
O ⇌ Zn(OH)
3
–
Gl. 9.13ZnO + 2 OH
–
+H
2
O ⇌ Zn(OH)
4
2–
Die Reaktionen der Gln. (9.12) und (9.13) beschreiben das amphotere Verhalten des
Zinks. Eine Kombination der Gln. (9.7), (9.11) und (9.12) bzw. (9.13) führt zu
folgenden anodischen Teilreaktionen in alkalischen Wässern:
Gl. 9.14Zn + 3OH
–
⇌ Zn(OH)
3
–
+2 e
–
Gl. 9.15Zn + 4 OH
–
⇌ Zn(OH)
4
2–
+2e
–
9.1 Korrosionschemische Eigenschaften
327
Ferner kann bei mittleren pH-Werten in einer anodischen Teilreaktion festes
Korrosionsprodukt direkt entstehen:
Gl. 9.16Zn + 2 OH
–
⇌ ZnO + H
2
O+2e
–
Bei den Reaktionen (9.7) und (9.11)–(9.16) sind neben den Zinkkorrosions-
produkten Ionen des Wassers und Elektronen beteiligt. Somit ist es naheliegend, die
verschiedenen Reaktionen und ihre Produkte in Potenzial-pH-Diagrammen
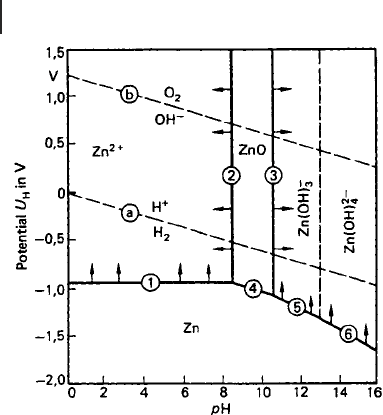
zusammenzufassen [9.7]. Das Ergebnis ist für das System Zink/Wasser bei 25 °C
in Abb. 9.4 dargestellt. Die Koordinaten der thermodynamischen Stabilitätsbereiche
fürZn,Zn
2+
, ZnO und Zn(OH), bzw. Zn(OH)
4
2–
sind der pH-Wert und das
Redoxpotenzial der wässrigen Phase (Elektrolytlösung) sowie das Potenzial des
Metalls. Die in Abb. 9.4 eingetragenen Grenzlinien gelten füreineGesamt-
konzentration gelöster Zink- und Zinkationen von c
0
=10
–6
mol/l (0,065 mg l
–1
). Die
Pfeile geben an, in welche Richtung die Grenzlinien sich verschieben, wenn die
Konzentration c
0
größer wird.
In Abb. 9.4 ist zusätzlich der Existenzbereich des Wassers eingetragen. Die
kathodische Wasserstoff-Entwicklung folgt der Gl. (9.9); die anodische Sauerstoff-
Entwicklung folgt der Gleichung
Gl. 9.172H
2
O ⇌ O
2
+4H
+
+4e
–
Im Beständigkeitsbereich für ZnO liegt eine heterogene Phase aus festem ZnO und
einer Elektrolytlösung vor, deren pH-Wert durch die Abszisse angegeben wird.
Ferner liegen in ihr Zink- und Zinkationen vor, deren Konzentration nach
9 Korrosionsverhalten von Zinküberzügen
Abb. 9.4 Potenzial-pH-Diagramm fürZn/H
2
Obei25°C, 0,1 MPa
und für eine Gesamt-Zinkionen-Konzentration c
0
=10
–6
mol/l,
nach [9.7] (Erklärungen im Text; Mannesmann Forschungs-
institut, Duisburg [9.1])
328

Überschreiten der Grenzlinien (2) und (3) in das Innere des Feldes fürZnOstark
abnimmt.
Da die Linie (a) stets deutlich über der Linie (4) liegt, können Zn und H
2
Oniemals
im thermodynamischen Gleichgewicht nebeneinander bestehen. Entweder reagiert
Zink nach Gl. (9.16) zu ZnO oder das Wasser zersetzt sich nach Gl. (9.9) zu H
2
.Abb.
9.4 informiert über die thermodynamische Beständigkeit von Zink-Metall und von
festen Korrosionsprodukten in Abhängigkeit vom Potenzial und vom pH-Wert. Da
bei den Zink- und Zinkationen kein Wertigkeitswechsel erfolgt, ist auch der
Beständigkeitsbereich des festen Korrosionsproduktes bei vorgegebener Zink-
ionenkonzentration nur vom pH-Wert und nicht vom Potenzial abhängig. Diese
festen Korrosionsprodukte können zwar die Korrosion nicht völlig verhindern, aber
entscheidend vermindern. Nur über diesen Tatbestand informiert Abb. 9.4, nicht
aber über die Güte der Schutzwirkung. Hierzu sind andere physikalische
Eigenschaften, wie Dichtheit und Haftfestigkeit der Schicht, von Interesse, was
aus thermodynamischen Daten grundsätzlich nicht folgt. Das thermodynamische
Stabilitätsdiagramm der Abb. 9.4 gilt nur für die dort angegebenen Komponenten
H
+
,OH
–
,Zn
2+
Zn(OH)
2
,Zn(OH)
4
2–
,ZnO,wobeikeineReaktionsproduktemit
anderen Ionen berücksichtigt sind. Diese Voraussetzung ist aber fürnatürliche
Medien nicht gültig. Eine der wesentlichen Komponenten, die in natürlichen
Medien vorliegen, ist die Kohlensäure und ihre Anionen. Wie in Abhängigkeit von
der Zinkionen-Konzentration der pH-Bereich für feste Korrosionsprodukte durch
Kohlensäure ausgeweitet wird, zeigt Abb. 9.5. Ähnliche Verhältnisse bestehen auch
für andere Stoffe, z. B. Zinkphosphate, basische Salze und Calciumzinkate.
Für etwas eingehendere Betrachtungen der realen Gegebenheiten bei der
Korrosion ist zu beachten, dass die Zusammensetzung der Wässer unmittelbar
an der Grenzfläche Zink/Wasser anders ist als im Wasserinnern. So wird durch die
kathodische Teilreaktion nach Gln. (9.8) und (9.9) der pH-Wert erhöht und durch die
anodische Teilreaktion in der Folge der Gln. (9.7) und (9.11) erniedrigt. Derartige
lokale pH-Unterschiede haben auch bei örtlicher Korrosion bzw. bei nicht
homogener Mischelektrode eine große Bedeutung. Ferner wird durch die
Korrosionsreaktionen nach den Gln. (9.7), (9.14) und (9.15) die Konzentration
der Zink- bzw. Zinkationen erhöht, was zu einer wesentlichen Ausdehnung des
ZnO-Feldes im Sinne der Pfeile in Abb. 9.4 führt. Diese Ausweitung wird
insbesondere in Abb. 9.5 erkennbar.
Die kathodische pH-Werterhöhung nach Gl. (9.9) ist vor allem bei hohen pH-
Werten oder bei sehr hohen kathodischen Stromdichten bedeutsam. Wegen der
Reaktionen der Gln. (9.14) und (9.15) wird das Gleichgewichtspotenzial ent-
sprechend der Linien (5) und (6) in Abb. 9.4 merkbar zu negativeren Werten
verschoben. Dies lässt erwarten, dass ein kathodischer Schutz unmöglich werden
kann, wenn die pH-Werterhöhung das Gleichgewichtspotenzial stärker zu
negativeren Potenzialen verschiebt als die kathodische Polarisation das Metall-
potenzial selbst. Dabei kann es dann durch Kombination der Gln. (9.9) und (9.15)
sogar zu einer kathodischen Korrosion kommen:
Gl. 9.18Zn + 4 H
2
O+2e
–
⇌ Zn(OH)
4
2–
+2H
2
9.1 Korrosionschemische Eigenschaften
329
