Кузин М.И. (ред) Хирургические болезни
Подождите немного. Документ загружается.

общий желчный проток и проток поджелудочной железы в заднюю стенку
двенадцатиперстной кишки. При инвазии опухоли в окружающие ткани вы-
полняют панкреатодуоденальную резекцию. В запущенных стадиях болезни
при общем тяжелом состоянии больных производят паллиативные опера-
ции — билиодигестивные анастомозы (холецистоеюностомию, холедохоею-
ностомию).
13.8. Желтуха
Желтухой называют окрашивание кожи, слизистых оболочек и склер в
желтый цвет вследствие накопления в тканях билирубина, уровень которого
в крови при этом повышается. Желтуха является клиническим синдромом,
характерным для ряда заболеваний внутренних органов. В зависимости от
причины повышения уровня билирубина в крови выделяют три основных
типа желтух: гемолитическую, обтурационную, паренхиматозную (пече-
ночную).
Гемолитическая (надпеченочная) желтуха возникает в результате интен-
сивного распада эритроцитов и чрезмерной продукции непрямого билиру-
бина. Процесс возникает при гиперфункции клеток ретикулоэндотелиаль-
ной системы, прежде всего селезенки, при первичном и вторичном гипер-
спленическом синдроме (см. "Селезенка"). При этом образование непрямо-
го билирубина столь велико, что печень не успевает превратить его в свя-
занный (прямой) билирубин. Гемолитическая желтуха может быть вызвана
также различными веществами, всасывающимися в кровь и способствую-
щими развитию гемолиза: гемолитические яды, продукты распада обшир-
ных гематом.
Печеночная (паренхиматозная) желтуха развивается в результате повреж-
дения гепатоцитов, способность которых связывать непрямой билирубин
крови и переводить его в прямой (билирубинглюкуронид) уменьшается. Об-
разовавшийся прямой билирубин лишь частично поступает в желчные ка-
пилляры, а большая его часть возвращается в кровяное русло. Наиболее час-
тыми причинами печеночной желтухи являются вирусный гепатит, желтуш-
ный лептоспироз (болезнь Вейля), цирроз печени, холангит, отравление не-
которыми видами ядов (четыреххлористый углерод, тетрахлорэтан, соедине-
ния мышьяка, фосфора и т. д.).
Обтурационная, механическая или подпеченочная, желтуха развивается в
результате частичной или полной непроходимости желчевыводящих путей,
нарушения пассажа желчи в кишечник. Обтурационная желтуха чаще обу-
словлена холедохолитиазом, стриктурой протоков, стенозом большого со-
сочка двенадцатиперстной кишки, опухолью головки поджелудочной желе-
зы и желчевыводящих путей.
Дифференциальная диагностика. На практике легче всего поставить диаг-
ноз гемолитической желтухи. При дифференциальной диагностике пече-
ночной и обтурационной желтух возникают довольно значительные труд-
ности.
При гемолитической желтухе кожные покровы приобретает уме-
ренно выраженную лимонно-желтую окраску, кожного зуда нет. Если воз-
никает анемия, отмечается некоторая бледность кожных покровов и слизи-
стых оболочек на фоне желтухи. Печень нормальных размеров или несколь-
ко увеличена; селезенка умеренно увеличена. При некоторых видах вторич-
ного гиперспленического синдрома (см. "Селезенка") иногда выявляют вы-
раженную спленомегалию. Моча имеет темный цвет (повышение концен-
400
трации уробилиногена и стеркобилиногена), реакция мочи на билирубин
отрицательная. Кал интенсивно окрашен в темно-бурый цвет, концентра-
ция стеркобилина резко повышена.
В анализах крови отмечается повышенный уровень непрямого билируби-
на, прямой билирубин не повышен; умеренно выражены анемия, ретикуло-
цитоз, несколько увеличена СОЭ. Печеночные пробы, холестерин крови в
пределах нормы. Уровень сывороточного железа крови повышен.
При печеночной желтухе кожные покровы имеют шафраново-жел-
тый с рубиновым оттенком цвет. Кожный зуд выражен незначительно. Та-
кой характер желтухи отмечают только на ранних стадиях ее развития, а
спустя 3—4 нед и более кожные покровы приобретают желтовато-зеленый
оттенок вследствие накопления в тканях биливердина. Печень увеличена и
уплотнена, болезненна при пальпации (при вирусном гепатите, холангите),
в некоторых случаях (при циррозе печени) она уменьшается и бывает без-
болезненной при пальпации. Селезенка у большинства больных доступна
пальпации, ее увеличение позволяет исключить обтурационный характер
желтухи.
Нередко при печеночной желтухе, обусловленной циррозом печени, по-
являются симптомы портальной гипертензии (варикозное расширение вен
пищевода, геморроидальные кровотечения, расширение подкожных вен пе-
редней брюшной стенки). Цвет кала несколько светлее, чем в норме. При
холестатическим гепатите, сопровождающемся желтухой, кал ахоличен; мо-
ча приобретает темно-бурую окраску.
В анализах крови определяют увеличение СОЭ, повышение уровня пря-
мого и непрямого билирубина, нормальное содержание холестерина. Уро-
вень железа сыворотки крови в норме или несколько повышен, концентра-
ция протромбина снижена. Уровень трансаминаз крови повышен, особенно
сильно — при печеночной желтухе, обусловленной вирусным гепатитом.
Важной отличительной особенностью печеночной желтухи является значи-
тельное повышение уровня фруктозобисфосфат-альдолазы крови (до 10—12
ЕД), в то время как при обтурационной желтухе этот показатель повышен
незначительно. Щелочная фосфатаза крови также повышена, особенно при
вирусном гепатите.
В моче отмечается резкое повышение реакции на уробилин и уробили-
ноген. Билирубинурия имеет перемежающийся характер. При тяжелом по-
ражении печеночной паренхимы билирубинурии нет. Функциональные
пробы печени имеют важное дифференциально-диагностическое значение
только на ранних стадиях развития желтухи. При обтурационной желтухе
длительностью более 4 нед за счет вторичного повреждения гепатоцитов
функциональные пробы изменяются так же, как и при печеночной желтухе.
При обтурационной желтухе кожные покровы приобретают желто-
вато-зеленую окраску, а при обтурирующих желчевыводящие пути опухо-
лях — характерный землистый оттенок. В случае длительного существова-
ния обтурационной желтухи кожные покровы становятся черновато-брон-
зовыми.
При желчнокаменной болезни вначале возникают характерные присту-
пообразные боли по типу печеночной колики, иногда желтуха появляется
на фоне острого холецистита, при опухолях панкреатодуоденальной зоны
без предшествующих болевых ощущений. Кожный зуд особенно выражен
при желтухе, вызванной опухолью, при очень высоком уровне билирубине-
мии. Печень в большинстве случаев не увеличена или увеличена незначи-
тельно. У половины больных с опухолями панкреатодуоденальной зоны вы-
являют положительный симптом Курвуазье. Селезенка при обтурационной
26 - 2375
желтухе не увеличена, не пальпируется, периферические лимфатические уз-
лы также не увеличены. Испражнения имеют светлую окраску, а при пол-
ной непроходимости желчных путей (чаще вызванной опухолью) — ахолич-
ные. Моча приобретает темную окраску цвета пива.
В анализах крови отмечают увеличение СОЭ, лейкоцитоз (при остром
холецистите в сочетании с холедохолитиазом). Концентрация прямого и не-
прямого билирубина в крови резко повышена, особенно при обтурирующих
опухолях панкреатодуоденальной зоны.
При холедохолитиазе, особенно при так называемых вентильных конкре-
ментах, билирубинемия имеет ремиттирующий характер, билирубинурия и
уробилинурия — перемежающийся. При опухолях, вызывающих полную
непроходимость желчевыводящих путей, уробилинурия отсутствует при со-
храненной билирубинурии. Уровень холестерина в крови повышен, концен-
трация сывороточного железа в норме или даже несколько снижена. Транс-
аминазы крови умеренно увеличены, а при длительной желтухе могут воз-
растать. Значительно повышается уровень щелочной фосфатазы, особенно
при желтухах опухолевой природы. Фруктозобисфосфат-альдолаза повыше-
на незначительно, концентрация протромбина в крови снижена.
Особенности клинического течения того или иного вида желтухи обу-
словлены характером заболевания, вызвавшего желтуху. Этот факт создает
дополнительные трудности в дифференциальной диагностике желтух. Кро-
ме перечисленных выше клинических и лабораторных методов, важную
роль в диагностике желтух играют рентгенологические (в том числе и ан-
гиографические), эндоскопические, радиологические, ультразвуковые мето-
ды исследования и компьютерная томография. Они позволяют получить
ценную информацию, необходимую для дифференциальной диагностики
различных видов желтух.
В клинической практике хирург чаще всего имеет дело с обтурационной
желтухой, реже — с печеночной, вызванной холестатическим гепатитом, хо-
лангитом.
Лечение. В предоперационном периоде во время обследования больного
необходимо проводить комплекс мероприятий, направленных на нормали-
зацию нарушенных функций организма, ликвидацию холангита, нарушений
свертывающей и противосвертывающей систем крови. Тщательная пред-
операционная подготовка больных с желтухой позволяет выполнить опера-
тивное вмешательство в более безопасных условиях, уменьшить частоту по-
слеоперационных осложнений.
Обтурационная желтуха является абсолютным показанием к операции.
Выжидание очень опасно, так как приводит к глубокому поражению парен-
химы печени и нарушению ее функций, ухудшению прогноза после опера-
ции вследствие развития инфекции (гнойный холангит) и возможности по-
явления кровотечения, обусловленного недостатком резорбции витамина К.
Срочные показания к операции возникают при гнойном холангите. Даже
при ранних хирургических вмешательствах летальность достигает 5—15 % и
более.
Операции, применяемые при обтурационной желтухе, разнообразны и
зависят от причины и уровня препятствия для оттока желчи.
Холедохотомия с дренированием протока показана при желтухе, вызван-
ной холедохолитиазом. При забытых конкрементах в холедохе чаще прибе-
гают к их эндоскопическому ретроградному удалению. Используют также
экстракцию конкрементов через Т-образный дренаж с помощью петли Дор-
миа, промывание протока через дренаж растворами желчных кислот, гепа-
рина и др.
402
Трансдуоденальная папиллосфинктеротомия показана при стенозирую-
щем папиллите, ущемившихся конкрементах в терминальном отделе общего
желчного протока. В настоящее время обычно производят эндоскопическую
папиллосфинктеротомию для извлечения конкрементов и восстановления
проходимости протока.
Билиодигестивные анастомозы формируют для отведения желчи из
желчных протоков в тонкую кишку при доброкачественных заболеваниях
(стриктуры, трубчатые протяженные стенозы, ранения протоков). При не-
операбельных опухолях желчных протоков наложение анастомозов является
паллиативным вмешательством.
Холецистоэнтеростомию производят в случае проходимости пузырного
протока при неоперабельных опухолях, закрывающих просвет дистальной
части общего желчного протока. Дно пузыря соединяют с выключенной по
Ру петлей тощей кишки или с двенадцатиперстной кишкой.
Холедохо- или гепатикодуоденостомия показана при опухолях, закры-
вающих просвет дистального отдела общего желчного протока, рубцовьгх
стриктурах, трубчатых стенозах его терминального отдела при хрониче-
ском панкреатите. При этой операции общий желчный или общий пече-
ночный проток соединяют анастомозом с выключенной по Ру петлей то-
щей кишки.
Глава 14. ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Поджелудочная железа и желчные протоки в процессе филогенеза формируются вместе с
двенадцатиперстной кишкой. Поэтому довольно часто они поражаются одновременно. Подже-
лудочная железа расположена забрюшинно на уровне I—II поясничных позвонков, занимая
положение между двенадцатиперстной кишкой и воротами селезенки. Длина ее составляет 15—
20 см, ширина 3—6 см, толщина 2—3 см, масса железы в среднем 70—90 г.
В поджелудочной железе различают головку, тело и хвост. Головку огибает двенадцатипер-
стная кишка; тело поджелудочной железы своей передней поверхностью предлежит к задней
поверхности желудка. Эти органы отделены друг от друга узкой шелью — сальниковой сумкой
(bursa omentalis). Задняя поверхность поджелудочной железы предлежит к нижней полой вене,
верхнебрыжеечной вене и одноименной артерии, брюшной аорте, нижняя — соприкасается с
нижнегоризонтальной ветвью двенадцатиперстной кишки. Позади поджелудочной железы в
месте перехода ее головки в тело проходят верхние мезентериальные сосуды, а на уровне верх-
него края железы по направлению к ее хвосту — селезеночная артерия. Селезеночная вена рас-
положена позади железы (рис. 14.1).
Главный проток поджелудочной железы (вирсунгов проток) образуется из слияния мел-
ких дольковых протоков. Диаметр его колеблется от 0,5 до 2 мм в хвостовой части, 2—6 мм —
в области большого дуоденального сосочка. В головке поджелудочной железы вирсунгов
проток соединяется с добавочным протоком. В 10 % случаев добавочный проток берет на се-
бя основную дренажную функцию поджелудочной железы. Взаимоотношения конечных от-
делов общего желчного протока и протока поджелудочной железы различны. Более часто оба
протока образуют общую ампулу, которая открывается на большом сосочке двенадцатипер-
стной кишки (67 %), иногда ампула отсутствует (30 %). Общий желчный проток и проток
поджелудочной железы при этом варианте впадают в двенадцатиперстную кишку раздельно.
Иногда они соединяются друг с другом на значительном расстоянии от большого сосочка
двенадцатиперстной кишки (3 %) и открываются одним отверстием, не образуя ампулу. В
ряде случаев добавочный проток впадает в двенадцатиперстную кишку самостоятельно в ма-
лом дуоденальном сосочке, расположенном на 2—3 см выше большого дуоденального со-
сочка.
Кровоснабжение поджелудочной железы осуществляется ветвями панкреатодуоденальной
артерии (a. pancreaticoduodenalis), которая снабжает кровью большую часть головки. Ветви
верхней брыжеечной артерии обеспечивают кровоснабжение головки и тела, а ветви селезеноч-
ной артерии (a. lienalis) — тела и хвоста поджелудочной железы. Вены идут совместно с арте-
26*
403
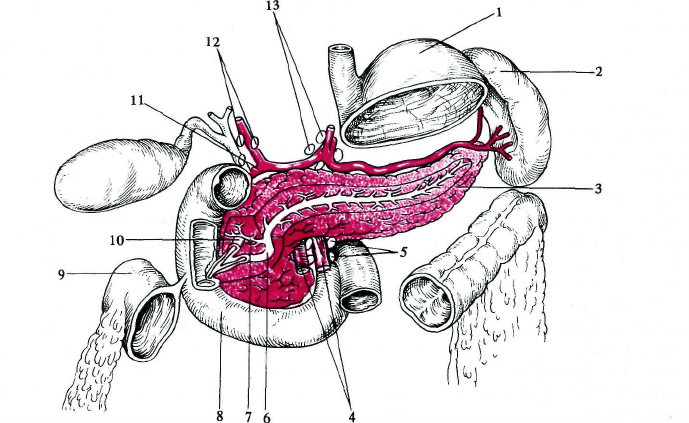
Рис. 14.1. Анатомия поджелудочной железы.
I — желудок; 2 — селезенка; 3 — поджелудочная железа; 4 — верхние брыжеечные артерии и вена; 5 — бры-
жеечные лимфатические узлы; 6 — проток поджелудочной железы; 7 — добавочный проток поджелудочной
железы; 8 — двенадцатиперстная кишка; 9 — толстая кишка; 10 — общий желчный проток; 11 — верхняя
паикреатодуоденальная артерия; 12 — печеночные лимфатические узлы; 13 — парааортальные лимфатиче-
ские узлы.
риями и впадают в верхнюю брыжеечную и селезеночную вены, по которым кровь оттекает в
воротную вену (v. porta).
Лимфоотток происходит в лимфатические узлы, расположенные по верхнему краю подже-
лудочной железы, в воротах селезенки и печеночно-двенадцатиперстной связке. Частично
лимфа оттекает в забрюшинные лимфатические узлы по ходу абдоминального отдела аорты и
нижней полой вены. Лимфатическая система поджелудочной железы тесно связана с лимфа-
тической системой желудка, кишечника, двенадцатиперстной кишки и желчевыводящих путей.
Иннервация поджелудочной железы осуществляется ветвями чревного, печеночного, селе-
зеночного и верхнебрыжеечного сплетений. Имеется тесная связь с иннервацией поджелудоч-
ной железы, двенадцатиперстной кишки, печени, желчевыводящих путей и желчного пузыря,
что во многом определяет их функциональную взаимозависимость.
Паренхима поджелудочной железы состоит из множества долек, отделенных друг от друга
прослойками соединительной ткани. Каждая долька состоит из эпителиальных клеток, обра-
зующих ацинусы. За сутки железа выделяет 1000—1500 мл прозрачного щелочного (рН 7,0—
8,0) панкреатического сока. Особые паренхиматозные клетки поджелудочной железы образуют
скопления величиной 0,1 — 1 мм (панкреатические островки, островки Лангерганса), они име-
ют округлую или овальную форму, хорошее кровоснабжение и иннервацию. Панкреатические
островки не имеют выводных протоков. В них выделяют четыре типа клеток; а, р, 8 и f-клетки,
обладающие различными функциональными свойствами.
ос-Клетки вырабатывают глюкагон, являющийся антагонистом инсулина. (З-Клетки проду-
цируют инсулин, который увеличивает поглощение глюкозы тканями, снижает содержание са-
хара в крови, способствует фиксации гликогена в клетках печени. В противоположность инсу-
лину глюкагон способстаует выделению глюкозы из запасов в клетках печени и поддержанию
уровня сахара в крови на оптимальном физиологическом уровне. 5-Клетки продуцируют сома-
тостатин, оказывающий ингибирующее действие на желчеобразовательную функцию печени,
продукцию желудочного, кишечного сока и внешнесекреторную функцию поджелудочной же-
лезы. Кроме того, соматостатин тормозит секрецию гормона роста. f-Клетки секретируют пан-
креатический полипептид, физиологическая роль которого пока не установлена. Клетки под-
желудочной железы секретируют липокаин, который оказывает липолитическое действие,
предотвращает гиперлипемию и жировую дистрофию печени.
Протеолитические, липолитические и амилолитические энзимы синтезируются и сохраня-
404
ются в ацинарных клетках как гранулы зимогена, отделенные от других протеинов клеток. Эн-
зимы внутри клетки сохраняются в неактивном состоянии, благодаря чему поджелудочная же-
леза не подвергается разрушению.
Поджелудочная железа обладает внешнесекреторной и инкреторной функциями.
Внешнесекреторная функция железы заключается в продукции ацинарными
клетками сока, богатого ферментами и бикарбонатами, обеспечивающими расщепление бел-
ков, жиров и углеводов до ингредиентов, способных всасываться в кишечнике. Протеолитиче-
ские энзимы (трипсин, химотрипсин, карбоксипептидаза и эластаза) выделяются в протоковую
систему железы в неактивном состоянии. В двенадцатиперстной кишке под влиянием фермен-
та энтерокиназы они переходят в активную форму, принимая участие в расщеплении белков
до полипептидов и аминокислот.
Липаза поступает в протоковую систему железы в активном состоянии. Фосфолипаза А вы-
деляется как проэнзим в неактивном состоянии, подвергается активации трипсином в двена-
дцатиперстной кишке. Гликолитический фермент а-амилаза, расщепляющая углеводы до мо-
но- и дисахаридов, выделяется в протоковую систему в активной форме
Регуляция внешнесекреторной деятельности поджелудочной железы осуществляется ней-
рогуморальным путем. Стимулирующее воздействие оказывают блуждающие нервы и некото-
рые гастроинтестинальные гормоны (секретин, холецистокинин-панкреозимин, гасгрин). Тор-
мозное влияние обеспечивают соматостатин и глюкагон.
Эндокринная функция поджелудочной железы осуществляется указанными клетка-
ми островков железы. На долю р-клеток приходится 60—70 % клеточного состава островков.
Основным стимулятором выделения инсулина является пища, богатая белками и углевода-
ми. Компенсаторные возможности поджелудочной железы настолько велики, что лишь при
удалении 70—80 % ее паренхимы могут появиться клинические проявления инсулиновой не-
достаточности (сахарный диабет).
14.1. Аномалии и пороки развития
Добавочная (аберрантная) поджелудочная железа встречается очень
редко, располагается в стенках желудка или двенадцатиперстной кишки,
тощей кишки или ее брыжейке, дивертикуле подвздошной кишки.
Аберрантная железа проявляется клиническими симптомами достаточно
редко. Чаще всего она является случайной находкой при лапаротомии, вы-
полняемой по поводу другого заболевания (как правило, по поводу язвен-
ной болезни или калькулезного холецистита). Следует отметить, что абер-
рантная ткань железы имеет точно такое же строение, как и нормальная
ткань поджелудочной железы, включая и выводной проток, открывающий-
ся в просвет полого органа (желудок, тонкая кишка). Вот почему возможно
развитие острого панкреатита в аберрантной железе, включая и деструктив-
ные формы. Существенно реже наблюдают изъязвление слизистой оболоч-
ки с последующим желудочно-кишечным кровотечением в зоне, где вывод-
ной проток аберрантной железы открывается в просвет полого органа.
Лечение. Добавочную поджелудочную железу удаляют хирургическим
путем.
Кольцевидная поджелудочная железа. Это редкий порок развития, при
котором нисходящая часть двенадцатиперстной кишки оказывается частич-
но или полностью окруженной тканью головки поджелудочной железы.
Двенадцатиперстная кишка при этом сужена, что является причиной час-
тичной хронической дуоденальной непроходимости.
Клиническая картина и диагностика. Наблюдается рвота после приема
пищи. Если препятствие располагается дистальнее впадения общего желч-
ного протока, вместе с рвотой выделяется желчь. Стеноз двенадцатиперст-
ной кишки обычно выявляется в детском возрасте, реже — в зрелом. Часто
кольцевидная поджелудочная железа только является случайной интраопе-
рационной находкой.
Диагноз устанавливают с помощью рентгенологического исследования.
При обзорной рентгеноскопии обнаруживают стеноз двенадцатиперстной
405
кишки с расширением ее проксимальных отделов, скопление газа в лукови-
це двенадцатиперстной кишки и желудке. Наиболее четко патологические
изменения выявляются при проведении релаксационной дуоденографии,
ультразвукового исследования.
Лечение. Хирургическое вмешательство показано при нарушении эвакуа-
ции содержимого из желудка и выраженных клинических проявлениях.
Обычно с учетом местных изменений формируют анастомозы в обход су-
женного участка двенадцатиперстной кишки: анастомоз между расположен-
ным выше сужения расширенным участком дуоденум и участком, располо-
женным ниже; дуоденоеюноанастомоз с расширенным верхним отрезком
кишки. При растянутом подвижном желудке можно наложить гастродуоде-
нальный анастомоз с участком кишки, расположенным ниже препятствия.
Не рекомендуется производить резекцию участка железы во избежание ост-
рого панкреатита или свища.
14.2. Повреждения поджелудочной железы
Различают открытые и закрытые повреждения поджелудочной железы.
Открытые повреждения возникают при огнестрельных и ножевых ранениях,
закрытые — при тупой травме живота. Повреждения могут быть изолиро-
ванными или сочетаться с повреждениями соседних органов (двенадцати-
перстная кишка, желудок, тонкая кишка). Последние виды травмы из-за
особенностей расположения поджелудочной железы наблюдаются чаще.
При закрытых травмах чаще повреждается тело поджелудочной железы, ко-
торое в момент ушиба и повышения внутрибрюшного давления оказывается
более плотно прижатым к позвонкам, чем другие ее отделы.
Различают четыре степени тяжести травм поджелудочной железы:
1) ушиб и кровоизлияние в ткань железы; 2) поверхностный разрыв капсу-
лы и паренхимы поджелудочной железы; 3) глубокий разрыв паренхимы без
повреждения протока поджелудочной железы; 4) разрыв поджелудочной же-
лезы с повреждением протока.
При повреждении головки поджелудочной железы, в которой располага-
ются крупные сосуды, превалируют признаки внутрибрюшного кровотече-
ния, а при повреждении тела и хвоста — симптомы острого посттравмати-
ческого панкреатита и его осложнений (кисты и свищи поджелудочной же-
лезы).
Клиническая картина и диагностика. При массивной травме возникают
кровотечение в брюшную полость, симптомы травматического шока. В бо-
лее поздние сроки появляются признаки травматического панкреатита, а в
случае повреждения полых органов возникает перитонит. Больные предъяв-
ляют жалобы на резкие боли в верхнем отделе живота, иррадиирующие в
спину, нередко носящие характер опоясывающих, тошноту, рвоту.
Диагностика повреждений поджелудочной железы из-за отсутствия па-
тогномоничных симптомов затруднена. Для ранней диагностики целесооб-
разно использовать УЗИ, с помощью которого обнаруживают скопление
крови или экссудата, определить состояние поджелудочной железы и других
органов брюшной полости и забрюшинного пространства. Скопление кро-
ви в брюшной полости можно обнаружить с помощью "шарящего" катетера,
который вводят в брюшную полость через небольшой разрез. В полученной
при этой процедуре жидкости необходимо определить содержание амилазы,
что позволит подтвердить повреждение поджелудочной железы. В условиях
хорошо оснащенной больницы можно воспользоваться лапароскопией, ко-
406
торая позволяет более четко выявить характер повреждения и даже произ-
вести некоторые манипуляции или оперативные вмешательства, такие как
остановка кровотечения из поврежденных сосудов, подведение дренажей к
поврежденной железе и т. п. Наличие значительного скопления крови в
брюшной полости является показанием к срочной лапаротомии.
Лечение только хирургическое. Операция должна проводиться до разви-
тия воспалительных процессов в самой поджелудочной железе, в брюшной
полости и в забрюшинной клетчатке.
При небольших разрывах поджелудочной железы удаляют образовав-
шуюся гематому, ушивают разрывы паренхимы отдельными швами и дре-
нируют сальниковую сумку через контрапертуру в поясничной области.
При повреждении левой половины поджелудочной железы с нарушени-
ем целости протоков производят резекцию ее тела и хвоста.
При размозжении головки поджелудочной железы с разрывом главного
панкреатического протока выполняют панкреатэктомию или панкреатодуо-
денальную резекцию, хотя эти операции довольно сложны и травматичны,
а послеоперационная летальность достигает 60—80 %.
14.3. Острый панкреатит
Острый панкреатит — заболевание поджелудочной железы, возникающее
в результате аутолиза тканей поджелудочной железы липолитическими и
активированными протеолитическими ферментами, проявляющееся широ-
ким спектром изменений — от отека до очагового или обширного геморра-
гического некроза. В большинстве случаев (около 90 %) наблюдается незна-
чительный аутолиз тканей, сопровождающийся только отеком поджелудоч-
ной железы и умеренными болями. В тяжелых случаях возникает жировой
или геморрагический некроз ткани с тяжелыми метаболическими наруше-
ниями, гипотензиеи, секвестрацией жидкости, полиорганной недостаточно-
стью и летальным исходом. После перенесенного острого панкреатита
функции поджелудочной железы, как правило, приходят к норме. При хро-
ническом панкреатите сохраняются остаточные явления с нарушением
функций поджелудочной железы и периодическим обострением.
Среди неотложных хирургических заболеваний органов брюшной полос-
ти острый панкреатит по частоте занимает 3-е место, уступая лишь острому
аппендициту и острому холециститу. Более часто заболевают лица зрелого
возраста (30—60 лет), женщины — в 2 раза чаше, чем мужчины.
Этиология и патогенез. Патогенез острого панкреатита недостаточно изу-
чен. Основной этиологический фактор — аутолиз паренхимы поджелудоч-
ной железы, возникающий обычно на фоне гиперстимуляции экзокринной
функции, частичной обтурации ампулы большого дуоденального сосочка,
повышения давления в вирсунговом протоке, рефлюкса желчи в вирсунгов
проток. Остро развивающаяся внутрипротоковая гипертензия вызывает по-
вреждение и повышение проницаемости стенок терминальных протоков.
Создаются условия для активизации энзимов, выхода их за пределы прото-
ков, инфильтрации паренхимы и аутолиза ткани поджелудочной железы.
У больных желчнокаменной болезнью временное затруднение оттока
желчи приводит к повышению давления и рефлюксу ее в панкреатический
проток. Эти изменения связывают с миграцией мелких конкрементов или
песка (микролитиаз). Благоприятным условием для желчной гипертензии
является наличие общего канала (ампулы) для оттока желчи и панкреатиче-
ского сока. В поддержку этой теории можно привести тот факт, что общий
407
канал (ампула), по данным холангиографии, у лиц, болевших панкреатитом,
наблюдается почти в 90 %, а у лиц с желчнокаменной болезнью, не имев-
ших в анамнезе эпизодов панкреатита, — всего у 20—30 %.
Часто причиной острого панкреатита является чрезмерное употребление
алкоголя и прием жирной пищи. Известно, что алкоголь усиливает тонус и
резистентность сфинктера Одди. Это может послужить причиной затрудне-
ния оттока экзокринного секрета поджелудочной железы и повышения дав-
ления в мелких протоках. Экспериментальными исследованиями доказано,
что энтеральное введение алкоголя повышает давление в протоках подже-
лудочной железы и увеличивает проницаемость стенок мелких протоков для
макромолекул панкреатического сока. Имеются сообщения о том, что круп-
ные молекулы белка могут вызвать затруднение оттока панкреатического
сока. Алкоголь усиливает секрецию желудочного сока и продукцию соляной
кислоты, которая стимулирует продукцию секретина, вызывающего экзо-
кринную гиперсекрецию поджелудочной железы, создает предпосылки для
повышения давления в протоках. Таким образом, создаются условия для
проникновения энзимов в паренхиму, активации протеолитических фер-
ментов и аутолиза клеток поджелудочной железы.
В зависимости от причины внутрипротоковой гипертензии различают
билиарный и алкогольный панкреатит. Эти разновидности панкреатита со-
ставляют 90 % всех панкреатитов. Каждый из них имеет определенные осо-
бенности в клиническом течении и исходе болезни. К более редким причи-
нам развития острого панкреатита относятся открытые и закрытые травмы
живота, интраоперационные повреждения ткани железы, атеросклеротиче-
ская окклюзия висцеральных ветвей абдоминального отдела аорты, пор-
тальная гипертензия, некоторые лекарственные препараты (кортикостерои-
ды, эстрогенные контрацептивы и антибиотики тетрациклинового ряда).
Некроз панкреоцитов и клетчатки, окружающей дольки поджелудочной
железы, в самом начале процесса происходит под влиянием липазы. Липаза
проникает внутрь клетки, гидролизует внутриклеточные триглицериды с об-
разованием жирных кислот. В поврежденных клетках железы развивается
внутриклеточный ацидоз со сдвигом рН до 3,5—4,5. В условиях ацидоза не-
активный трипсиноген трансформируется в активный трипсин, который
активирует фосфолипазу А, высвобождает и активирует лизосомальные
ферменты (эластазу, коллагеназу, химотрипсин и др.). Содержание фосфо-
липазы А и лизолецитина в ткани поджелудочной железы при остром пан-
креатите существенно увеличивается. Это свидетельствует о ее роли в ауто-
лизе ткани железы. Под воздействием липолитических, активированных
протеолитических ферментов появляются микроскопические или макро-
скопически заметные очаги жирового некроза паренхимы поджелудочной
железы. На этом фоне эластаза подвергает лизису стенки венул и междоль-
ковые соединительнотканные перегородки. В результате этого возникаю
обширные кровоизлияния, происходит трансформация жирового панкрео
некроза в геморрагический. Таким образом, протеолитическая и липолити-
ческая фазы развития острого деструктивного панкреатита взаимосвязаны
друг с другом.
К очагам первичного некроза устремляются лейкоциты. Скопление лей-
коцитов вокруг очагов некроза означает развитие защитной воспалительной
реакции, сопровождающейся гиперемией и отеком. Для отграничения оча-
гов некроза и элиминации некротической ткани макрофаги, лейкоциты,
лимфоциты, клетки эндотелия выделяют провоспалительные (ИЛ-1; ИЛ-6;
ИЛ-8) и антивоспалительные (ИЛ-4; ИЛ-10 и др.) интерлейкины, активные
кислородные радикалы. Небольшие очаги некроза в результате этой реак-
408
ции отграничиваются, подвергаются лизису с последующей элиминацией
продуктов распада. Эти процессы вызывают в организме умеренную мест-
ную реакцию на воспаление.
При обширном некрозе макрофаги, нейтрофильные лейкоциты, лимфо-
циты подвергаются избыточной стимуляции, продукция интерлейкинов и
кислородных радикалов возрастает, выходит из-под контроля иммунной
системы. Изменяется соотношение про- и антивоспалительных интерлей-
кинов. Они повреждают не только ткани железы, но и другие органы. Нек-
роз тканей вызывают не столько сами интерлейкины, сколько активные ки-
слородные радикалы, оксид азота (N0) и наиболее агрессивный перокси-
нитрил (ONOO). Интерлейкины лишь подготавливают почву для этого:
снижают тонус венозных капилляров, повышают их проницаемость, вызы-
вают тромбоз капилляров. Изменения в микроциркуляторном русле вызы-
ваются преимущественно оксидом азота. Воспалительная реакция прогрес-
сирует, зона некроза расширяется. Местная реакция на воспаление превра-
щается в системную, развивается синдром системной реакции на воспале-
ние (Systemic Inflammatory Respons Syndrome). Тяжесть состояния больного
коррелирует с высоким содержанием в крови ИЛ-6, ИЛ-8. При повышен-
ной концентрации их в крови с высокой степенью вероятности можно про-
гнозировать полиорганную дисфункцию и недостаточность.
Изменения в микроциркуляторном русле приводят к перемещению зна-
чительной части жидкости организма в интерстициальное пространство.
Происходит обезвоживание, снижается ОЦК, наступают водно-электролит-
ные нарушения и нарушение кислотно-основного состояния. На фоне по-
вышенной концентрации интерлейкинов и гиперферментемии появляются
очаги некроза на сальнике и брюшине. Выпот в брюшной полости содержит
амилазу и другие энзимы поджелудочной железы в высокой концентрации.
Токсичные продукты, циркулирующие в крови, оказывают прямое токсиче-
ское действие на сердце, почки, печень, ЦНС. Тяжесть синдрома системно-
го ответа на воспаление возрастает в соответствии с нарастающей ишемией,
увеличением концентрации N0, цитокинов, гипоксией и дистрофией в
жизненно важных органах. Интоксикация в сочетании с гиповолемией бы-
стро приводит к развитию шока. Возникают диссеминированное внутрисо-
судистое свертывание (ДВС-синдром) и полиорганная недостаточность.
В последующем через 10—15 дней наступает фаза секвестрации и рас-
плавления омертвевших участков. Секвестры и накопившаяся вблизи них
жидкость могут некоторое время оставаться асептическими. Инфицирова-
ние и нагноение их с образованием парапанкреатических и забрюшинных
абсцессов происходят в связи с транслокацией бактерий из просвета пара-
лизованного кишечника, возникающей в ответ на патологические измене-
ния в поджелудочной железе и забрюшинной клетчатке. В позднем периоде
в зоне некроза образуются ложные кисты поджелудочной железы.
Классификация. По характеру изменений в поджелудочной железе выде-
ляют: 1) отечный или интерстициальный панкреатит; 2) жировой панкрео-
некроз и 3) геморрагический панкреонекроз.
Отечная или абортивная форма панкреатита развивается на фоне незна-
чительного, микроскопического повреждения клеток поджелудочной желе-
зы. Фаза отека может в течение 1—2 дней превратиться в фазу некроза. При
прогрессирующем панкреатите развивается жировой панкреонекроз, кото-
рый по мере развития кровоизлияний превращается в геморрагический с
образованием обширного отека в забрюшинной клетчатке и появлением ге-
моррагического выпота в брюшной полости (панкреатогенный асептиче-
ский перитонит). В ряде случаев наблюдаются смешанные формы панкреа-
409
