Коган В.Е., Зенин В.С., Пенкина Н.В. Физическая химия. Часть 2. Химическая кинетика
Подождите немного. Документ загружается.


В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
70
Характерным примером сказанному может служить протекающая по цеп-
ному механизму реакция взаимодействия молекул водорода и иода. Протекание
прямого превращения в соответствии с уравнением (2.11), связанного с одно-
временным разрывом двух связей и образованием двух новых, энергетически
менее вероятно по сравнению со стадией (
a) механизма этой реакции, отве-
чающего уравнениям (2.12). В результате появления активного атома иода про-
текание этой стадии связано с одновременным разрывом и образованием всего
лишь одной связи.
Как уже отмечалось (см. 2.2.1.5), для реакций, развивающихся в условиях
взаимовлияния элементарных актов, наблюдаемая скорость не является резуль-
татом простого суммирования. Другими словами, для таких
реакций, к которым
относятся
цепные и сопряженные реакции, нарушается принцип независимо-
сти, являющийся одним из постулатов химической кинетики.
Цепные реакции
1
– это химические реакции, в которых появление ак-
тивной частицы вызывает большое число превращений неактивных час-
тиц вследствие регенерации активной частицы в каждом элементарном
акте реакции. При этом в ходе реакции активирование одной частицы
приводит к тому, что не только данная частица, но последовательно целый
ряд других частиц вступает в реакцию, в
результате чего кроме продуктов
возникают новые активные частицы
.
Типичные цепные реакции – галогенирование, окисление, полимериза-
ция, ядерные процессы.
Цепными являются также многие процессы, связанные с пищевой про-
мышленностью, а именно: прогоркание жиров, окисление красящих веществ в
процессе созревания красных вин и ряд других.
Активными частицами являются атомы, обладающие неспаренными
электронами, свободные радикалы, несольватированные ионы, возбужденные
молекулы, т. е. частицы с некомпенсированной валентностью.
Большинству цепных реакций свойственны некоторые общие особенно-
сти, отличающие их от других реакций.
Скорость рассматриваемых реакций характеризуется большой чувстви-
тельностью к примесям, которые могут как инициировать и ускорять реакции,
так и тормозить их.
1
Данный вопрос в учебной литературе детально рассмотрен в [2].
Х и м и ч е с к а я к и н е т и к а
71
На скорость многих газовых реакций оказывает влияние присутствие
твердых поверхностей. Чаще всего наблюдается замедление реакции твердыми
поверхностями – стенками реакционных сосудов – и в узких сосудах реакции
идут медленнее, чем в широких. В этих случаях принято говорить о влиянии на
скорость реакции отношения поверхности сосуда
s к его объему V. В соответст-
вии со сказанным газовые реакции обсуждаемого типа замедляются при увели-
чении
s/V. На практике это отношение можно изменить, вводя в сосуд осколки
материала сосуда – стекла, фарфора, кварца. Если в заполненном осколками со-
суде (величина
s/V больше) реакция идет медленнее, то это является признаком,
хотя и не однозначным, ее принадлежности к
цепным процессам.
Начало развитию теории цепных процессов было положено в 1913 г., ко-
гда Боденштейн ввел понятие «
цепная реакция».
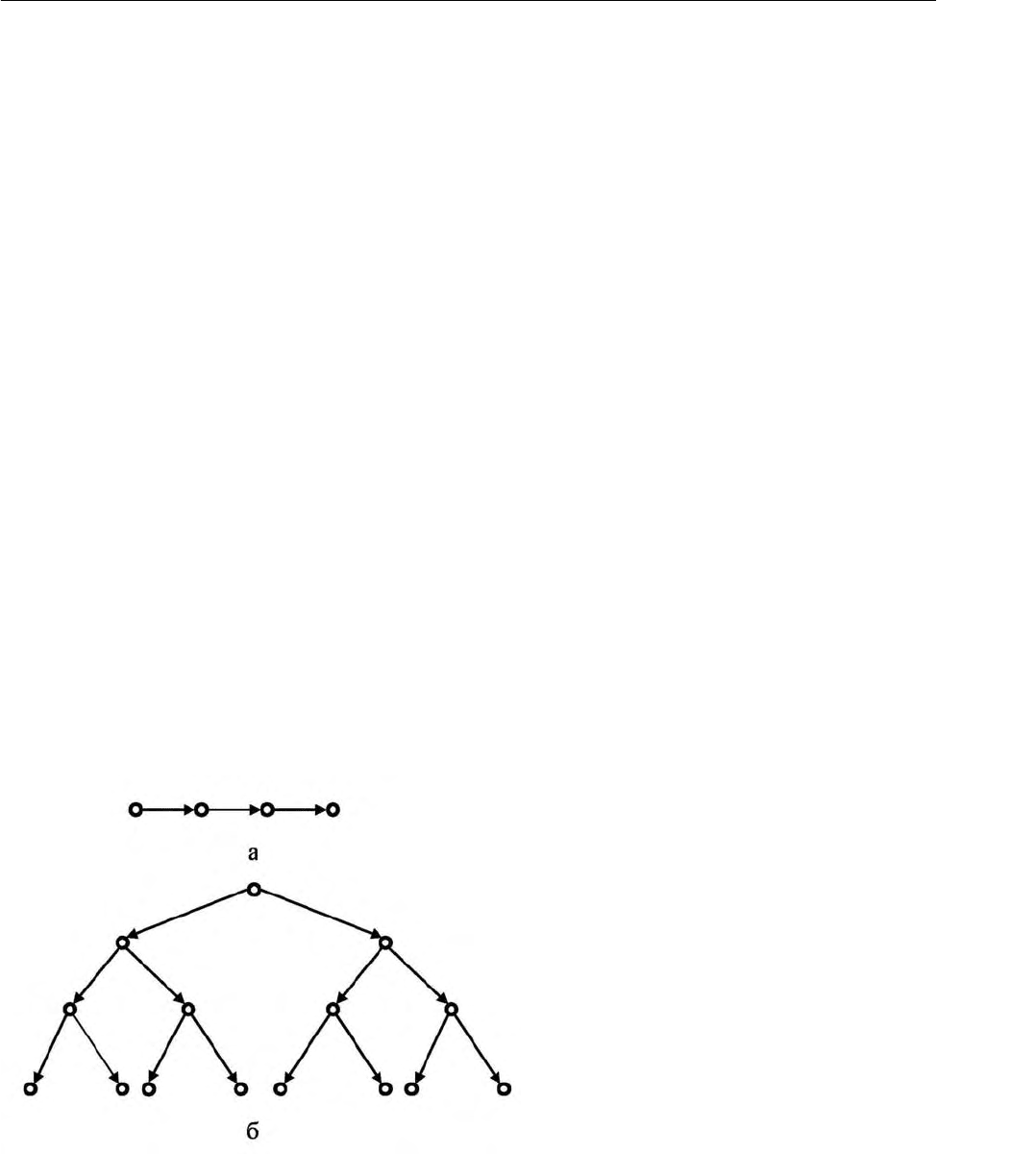
Цепные реакции могут быть с
неразветвленными и разветвленными
цепями
. В каждой промежуточной элементарной стадии неразветвленной цеп-
ной реакции одна активная частица вызывает возникновение лишь одной ак-
тивной частицы, что схематически показано на рис. 2.16, а. Если элементарная
стадия цепной реакции приводит к увеличению числа активных частиц, то ре-
акция относится к разветвленным. На рис. 2.16, б схематически представлена
разветвленная цепь с
удвоением числа активных частиц в каждом элементар-
ном акте.
Любая цепная реакция со-
стоит из трех основных стадий:
зарождения, продолжения и
обрыва цепи.
Рассмотрим протекание ре-
акции с неразветвленными цепя-
ми на примере реакции образования хлористого водорода из молекул водорода
и хлора:
22
HCl 2HCl
+
→ .
Рис. 2.16. Схемы неразветвленной
(а) и разветвленной (б) цепных ре-
акций

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
72
В стадии зарождения (инициирования) цепи образуются активные час-
тицы. Зарождение цепи может быть вызвано различными причинами: распадом
молекулы (молекул) на радикалы; гетерогенными условиями протекания реак-
ции, в частности за счет участия стенок сосуда; инициированием извне, в том
числе под действием света и ионизирующего излучения; добавками специаль-
ных веществ – инициаторов образования свободных радикалов.
В рассматриваемом примере процессом зарождения
цепи является реак-
ция, уравнение которой
2
Cl Cl Cl→+
,
т. е. диссоциация молекул хлора на свободные атомы, обладающие, как извест-
но, повышенной реакционной способностью. Эта реакция может осуществлять-
ся различными путями:
- за счет стенок сосуда в условиях гетерогенной реакции
2
Стенки
д
сосу а
Cl СlCl⎯⎯⎯⎯→+
;
- путем фотохимического инициирования
2
Cl Cl Cl
h
ν
⎯⎯→+
;
- термическим путем при столкновении, скажем, двух молекул хлора
22 2
Cl Cl Cl Cl Cl
←
+→++
(здесь стрелка над молекулой хлора означает повышенное содержание энергии,
затрачиваемой на диссоциацию);
- химическим путем при взаимодействии, например, с атомом натрия при
введении паров последнего в реакционное пространство
2
Cl Na NaCl Cl
+
→+
.
После стадии зарождения цепи следует
стадия продолжения цепи, т. е.
сама цепь. Данная стадия состоит из большого числа повторяющихся элемен-
тарных реакций взаимодействия активных частиц с реагентами. Для рассматри-
ваемой нами реакции она включает повторяющиеся элементарные реакции,
уравнения которых
2
2
Cl H HCl H,
HCl HClCl.
+→ +
+→ +
. (2.154)

Х и м и ч е с к а я к и н е т и к а
73
В результате возникает «цепь» реакций, которая при благоприятных условиях,
например в отсутствии кислорода, может достичь многих тысяч
звеньев. Зве-
ном цепи
называют повторяющуюся совокупность элементарных стадий
(реакций), которые начинаются образованием активной частицы и закан-
чиваются ее регенерацией
. Две элементарных стадии реакции, отвечающие
уравнениям (2.154), которые определяют образование свободного атома водо-
рода
H
и его регенерацию, т.е. переход в HCl, и есть звено неразветвленной
цепной реакции. При этом свободный атом хлора Cl
, образующийся во втором
элементарном акте, дает начало следующему звену. Таким образом, на одну
первично активированную, скажем, под действием света, молекулу
2
Cl образу-
ется не две молекулы HCl, как это имело бы место при обычной бимолекуляр-
ной реакции, а сотни тысяч. Звено цепи может состоять из одной или несколь-
ких элементарных стадий. Поэтому
в более общей форме звено цепи может
быть определено как цикл радикальных превращений с сохранением сво-
бодной
(некомпенсированной) валентности и регенерацией исходной час-
тицы
. Данное определение характеризует как звено рассматриваемого нами
процесса, отвечающее уравнениям (2.154), так и, в отличие от первого опреде-
ления, звено цепи, например, при радикальной полимеризации винилового мо-
номера
2
CH CHX= , состоящее из одной элементарной стадии, уравнение кото-
рой
22
R CH CHX RCH CHX+= →
,
где
R
– макрорадикал.
Третья стадия цепной реакции связана с
обрывом цепи («гибель» актив-
ных частиц). На этой стадии активные валентно-ненасыщенные частицы пре-
вращаются в валентно-насыщенные или, по крайней мере, в частицы, не спо-
собные к продолжению цепи. Обрыв цепи происходит путем захвата активных
частиц стенками реакционных сосудов, третьими частицами, а также другими
путями, в частности при взаимодействии (рекомбинации) активных
частиц. Та-
ким образом, в рассматриваемой системе кроме приведенных выше уравнений
реакций зарождения и продолжения цепи могут протекать также процессы, вы-
водящие из системы активные частицы и ведущие к прекращению развития це-
пи, т. е. к ее обрыву. Они отражаются следующими уравнениями:
2
HHM H M;++ → +

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
74
() ()
() ()
2
2
HHS H S;
Cl Cl M S Cl M S ;
HClMS HClMS,
++→ +
++ → +
++ → +
где M
и S обозначают третью частицу или стенку сосуда.
В результате существования обрыва цепей
число звеньев в каждой це-
пи, называемое длиной цепи, конечно
. Естественно, что в ходе реакции в сис-
теме развиваются цепи различной длины – от очень коротких до очень длин-
ных. Тем не менее при данных условиях реакцию можно охарактеризовать
средней длиной цепи L, зависящей от очень многих факторов – температуры,
давления, примесей, формы сосуда и состояния его стенок и т. д.
Уже из данных выше определений явствует, что, в отличие от неразветв-
ленных цепных реакций, где в процессах продолжения цепи на одну вступаю-
щую в реакцию частицу возникает также единственная частица другого сорта, в
разветвленных цепях имеет место увеличение числа активных частиц. Так, на
стадии продолжения цепи при окислении водорода – реакции гремучего газа –
протекают, в частности, процессы, уравнения которых
2
2
H O OH O;
OH OHH.
+
→+
+
→+
Здесь вместо одного вступающего в реакцию свободного атома появляются две
активные частицы – одна может продолжать цепь, а другая – начать новую. Та-
ким образом, имеет место разветвление цепи. Если оно осуществляется часто,
то даже одна первоначально возникшая цепь может привести к развитию мно-
гих цепей. В предельном случае можно
представить, что разветвление происхо-
дит в каждом звене, и тогда говорят о
сплошь разветвленной цепной реакции.
При частых разветвлениях развитие
химической реакции может носить
лавинообразный характер, условно
изображенный на рис.2.17. В этом
случае скорость реакции, даже при
малом первоначальном числе актив-
Рис. 2.17. Лавинообразное развитие
разветвленной цепной реакции

Х и м и ч е с к а я к и н е т и к а
75
ных частиц, или первичных цепей, может быстро возрасти и процесс завершит-
ся самовоспламенением или взрывом.
Взрыв – это процесс быстрого выделения энергии, связанного с вне-
запным изменением состояния вещества, в результате чего в среде образу-
ется ударная или взрывная волна
. Возникновение цепного воспламенения или
взрыва
1
, как видно из предыдущего изложения, – результат лавинообразного
нарастания числа активных частиц (свободных радикалов) при постоянной
температуре вследствие протекания разветвленной цепной реакции.
Воспламенению горючей смеси предшествует
индукционный период
2
.
Теория разветвленных цепей объясняет это тем, что сначала число цепей может
быть очень мало и реакция незаметна вследствие недостаточной чувствитель-
ности метода анализа. По истечении некоторого времени число цепей возраста-
ет в громадной степени, вследствие упоминавшегося лавинообразного размно-
жения, и следует воспламенение или взрыв. Для этого случая теория дает сле-
дующую зависимость скорости реакции от времени:
(
)
1Ae
ϕτ
=
−v , (2.155)
где
A и ϕ – постоянные, характеризующие реакцию и зависящие от ряда усло-
вий. При выводе уравнения (2.155) теорией цепных реакций не учитывается
уменьшение концентрации реагентов вследствие «выгорания», поэтому стрем-
лению скорости к бесконечности с течением времени не следует придавать ка-
кого-либо физического смысла. Скорость действительно становится очень
большой, но не бесконечной.
На известную
неопределенность понятия «индукционный период» мы
уже указывали при рассмотрении последовательных реакций (см. 2.2.1.5).
Формально индукционный период можно определить как время, в течение
которого скорость реакции возрастает в e раз; экспериментальное опреде-
ление продолжительности индукционного периода фактически зависит от
чувствительности прибора
.
Ранее уже было введено понятие средней длины цепи
L, являющейся
средним числом звеньев цепи, вызываемым одной активной частицей (атомом
1
Цепной взрыв следует отличать от теплового взрыва, который возникает при обычной (не
цепной) экзотермической реакции, когда выделение теплоты при химической реакции стано-
вится больше теплоотдачи.
2
Напомним, что этот термин встречался ранее при рассмотрении последовательных реакций,
а также при описании автокатализа.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
76
или радикалом), возникшей первоначально каким-либо независимым путем –
фотохимическим или другим. Пусть число таких независимо возникающих в
единицу времени в единице объема частиц равно
0
ν
. Очевидно,
0
ν
можно на-
звать
скоростью зарождения цепей.
Скорость цепных реакций зависит от длины цепи, которая, в свою оче-
редь, определяется соотношением скоростей обрыва и продолжения цепи. Об-
рыв цепи в одном из ее звеньев характеризуется
вероятностью обрыва цепи
β
– величиной обратной средней длине цепи. Тогда вероятность продолжения це-
пи будет равна 1−β.
Для цепной неразветвленной реакции длина цепи равна
(
)
1/L
=
−β β, (2.156)
т. е. длина цепи равна отношению вероятностей продолжения и обрыва цепи.
Если вероятность обрыва цепи мала
(
)
1
β
, то вместо уравнения (2.156)
можно записать:
1/
L
=
β . (2.157)
Следовательно, вероятность обрыва цепи
1/
L
β
= . (2.158)
Собственно скорость неразветвленной цепной реакции равна произведе-
нию скорости зарождения цепи на длину цепи:
0
L
=
νv . (2.159)
Отсюда следует, что на каждый акт зарождения цепи приходится
L звень-
ев цепной реакции.
Скорость неразветвленной цепной реакции определяется течением всех
ее трех стадий, поскольку зависит от скорости зарождения цепи и длины цепи.
Последняя связана с условиями продолжения и обрыва цепи.
Скорость разветвленной цепной реакции определяется увеличением во
времени концентрации активных частиц
ν
, т. е. их числа N в единице объема V.
Она может быть представлена следующим кинетическим уравнением:
0 э э
d
kk
d
ν
′
′′
==ν+ν−ν
τ
v , (2.160)

Х и м и ч е с к а я к и н е т и к а
77
где
0
ν – скорость зарождения цепи;
э э
и kk
′
′′
– эффективные константы скорости
стадий продолжения и обрыва цепи соответственно;
ν
– частичная концентра-
ция
1
активных частиц.
Обозначим через
ээ
kk
′′′
ϕ= − , тогда уравнение (2.160) упростится:
0
d
d
ν
=
=ν +ϕν
τ
v . (2.161)
В стадии продолжения цепи
ээ
kk
′′′
>
и 0
ϕ
> . После интегрирования дифферен-
циального уравнения (2.161) с неразделяющимися переменными при условии,
что в начале реакции 0τ= и 0ν= , получим зависимость частичной концентра-
ции активных частиц от времени:
0
(1)e
ϕτ
ν
ν
=−
ϕ
, (2.162)
которая коррелирует с выражением (2.155) для скорости разветвленной цепной
реакции в стадии продолжения.
Если 1ϕτ >> , то уравнение (2.162) можно записать в виде
0
e
ϕ
τ
ν
ν≈
ϕ
. (2.163)
В соответствии с уравнением (2.163) и кривой 1 на рис. 2.18 происходит
быстрое накопление активных частиц. За каждые 1/
ϕ
секунды концентрация
активных частиц (и соответственно скорость цепной реакции) возрастает в
e
раз. За несколько интервалов, равных 1/
ϕ
, реакция будет протекать по взрыв-
ному механизму.
При обрыве цепи
ээ
kk
′′′
<
и 0
ϕ
< . Здесь после интегрирования уравнения
(2.162) при условии, что в начале реакции 0
τ
= и 0
ν
= , получим следующую
зависимость частичной концентрации активных частиц от времени:
0
(1 )e
−
ϕτ
ν
ν= −
ϕ
. (2.164)
В этом случае через некоторое время в системе установится квазистацио-
нарная концентрация активных частиц
∞
ν
(рис. 2.18, кривая 2):
1
В СИ единица измерения частичной концентрации /NV
ν
= – один
3
м
−
(
3
частица/м ).
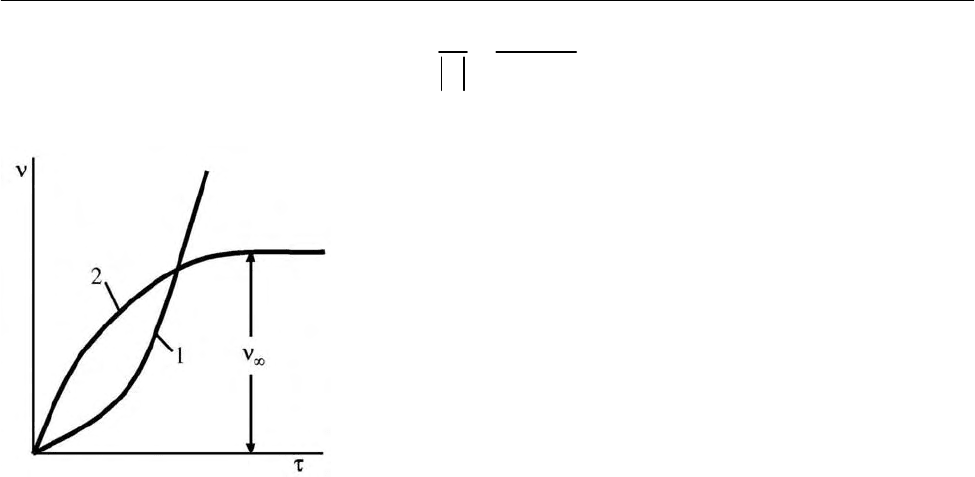
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
78
00
ээ
kk
ν
ν
ν
ϕ
∞
==
′
′′
−
. (2.165)
Таким образом, кинетические уравнения ре-
акций с разветвленной цепью характеризуются
увеличением частичной концентрации активных
частиц (см. рис. 2.18), которое может привести ли-
бо к взрыву (при отсутствии стадии обрыва цепи), либо к установлению неко-
торой постоянной максимальной концентрации активных частиц (при обрыве
цепи).
В зависимости от соотношения между процессами продолжения
(
)
э
k
′
и
обрыва
(
)
э
k
′′
скорость разветвленной цепной реакции и кинетические законо-
мерности, характеризующие рост частичной концентрации активных частиц в
процессе цепной реакции (рис. 2.18, кривые 1 и 2), могут различаться.
Широкие возможности получения активных промежуточных частиц от-
крываются при использовании дополнительных специально подобранных ком-
понентов. Два основных пути использования дополнительных компонентов ос-
нованы на двух фундаментальных
явлениях химической кинетики – катализе и
индукции.
Весьма детальное самостоятельное рассмотрение явления катализа будет
проведено нами несколько позднее (см. 2.4). Здесь же, до того, как перейти к
рассмотрению химической индукции, кратко остановимся на кинетике автока-
талитических реакций.
Автокаталитические реакции – это реакции, самоускоряющиеся од-
ним из продуктов реакции, являющимся катализатором
. Они не являются
каталитическими в прямом смысле. Дело в том, что в них катализатор, образу-
ясь в качестве продукта, накапливается. Следовательно, концентрация катали-
затора не остается постоянной – она увеличивается, т. е. не выполняется один
из основных признаков катализа, а именно: постоянство концентрации катали-
затора, ее неизменность к концу каталитического акта.
Рис. 2.18. Изменение частичной концентрации
активных частиц в цепных разветвленных реак-
циях в зависимости от времени:
1 – стадия продолжения цепи; 2 – стадия обры-
ва цепи

Х и м и ч е с к а я к и н е т и к а
79
Гомогенную элементарную автокаталитическую реакцию в общем виде
можно выразить уравнением
(
)
A
BD DE
+
+→+,
где D – продукт (катализатор).
Зависимость скорости автокаталитической реакции от концентрации, вре-
мени и других факторов, а также кинетические уравнения для реагентов имеют
различный вид для разных механизмов протекания ее по стадиям, а также от
условий ее проведения. Но
общим для закрытых систем является появление
максимума на зависимости скорости реакции от концентрации катализа-
тора или времени и наличие индукционного периода, если начальная кон-
центрация продукта-катализатора мала.
Наличие различных форм уравнения для скорости автокаталитических
реакций делает целесообразным рассмотрение основных из них на примере
конкретных химических реакций, при изучении которых они были получены.
Н. А. Меншуткин обнаружил начальное ускорение образования ацетани-
лида при разложении третичного амилацетата. На графике в координатах «вре-
мя – количество разложенного эфира» была получена S-образная
кривая с точ-
кой перегиба при 50 % разложения эфира. Д. П. Коновалов доказал, что уско-
ряющим действием реакция Меншуткина обязана образующейся уксусной ки-
слоте, и дал уравнение скорости в следующем виде:
()
1
100 2
6
dx
kxxP
d
⎛⎞
== − +
⎜⎟
τ
⎝⎠
v , (2.166)
где x – количество разложившегося эфира в процентах, P – начальная концен-
трация уксусной кислоты,
1
2
6
– отношение молекулярных масс эфира и кисло-
ты.
Оствальд еще до Коновалова дал уравнение скорости гидролиза уксусно-
метилового эфира в присутствии заранее добавленной уксусной кислоты, яв-
ляющейся катализатором:
()()
01 02
dx
kc x c x
d
=
+−
τ
, (2.167)
где
01
c
– начальная концентрация эфира, x – его прореагировавшее количество,
02
c – начальная концентрация уксусной кислоты.
