Коган В.Е., Зенин В.С., Пенкина Н.В. Физическая химия. Часть 2. Химическая кинетика
Подождите немного. Документ загружается.


В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
40
()
()
01 02
dx
kc kc k k x
d
+− +−
=−−−
τ
. (2.61)
Вынося за скобки
(
)
kk
+−
+ , получим
()()
dx
kkLx
d
+−
=
+−
τ
, (2.62)
где через L обозначено
01 02
kc kc
L
kk
+−
+−
−
=
+
. (2.63)
Выражение (2.63), с учетом соотношения (2.60), путем деления числителя и
знаменателя на
k
−
приведем к виду
01 02
1
K
cc
L
K
−
=
+
. (2.64)
Константу равновесия K, исходя из выражений (2.59), (2.60), определяем по
формуле
02 p
01 p
cx
K
cx
+
=
−
(2.65)
на основании экспериментальных данных.
В уравнении (2.62) разделим переменные
()
dx
kkd
Lx
+−
=
+τ
−
(2.66)
и проинтегрируем полученное выражение (2.66) от 0 до x и от 0 до τ . Обозна-
чая
kkH
+−
+
= , (2.67)
получим
1
ln const
L
H
Lx
==
τ−
. (2.68)
Величины
L и H, таким образом, могут быть рассчитаны по выражениям (2.64)
и (2.68) на основании опытных данных. Из системы двух уравнений (2.60) и
(2.67) находим

Х и м и ч е с к а я к и н е т и к а
41
1
H
K
k
K
+
=
+
, (2.69)
1
H
k
K
−
=
+
. (2.70)
Таким образом, обратная задача решена.
Для решения прямой задачи сначала выразим
x из уравнений (2.67), (2.68)
и (2.64) в явном виде
()
01 02
1
1
kk
Kc c
xe
K
−
+τ
+−
−
⎡
⎤
=−
⎣
⎦
+
, (2.71)
а затем, подставив уравнение (2.71) в выражения
101
cc x
=
− и
202
cc x=+, по-
лучим
()
01 02 01 02
1
11
kk
cc Kcc
ce
K
K
−
+τ
+
−
−−
=+
++
; (2.72)
(
)
()
01 02
01 02
2
11
kk
Kc c
Kc c
ce
K
K
−
+τ
+
−
+
−
=−
++
. (2.73)
Значение K находим из соотношения (2.60). Уравнения (2.72) и (2.73) яв-
ляются решением прямой задачи.
Соотношение (2.60) справедливо для обратимой реакции первого поряд-
ка, когда реакция состоит из одной стадии. Константа равновесия обратимых
реакций из двух и более стадий будет определяться константами скоростей
прямой и обратной реакций для каждой стадии. Так, уже
для реакции, состоя-
щей из двух последовательных двусторонних стадий первого порядка, уравне-
ние которой в общем виде
(
)
()
(
)
()
22
11 2 2
11
APB
kk
kk
−−−−
⎯⎯⎯⎯→⎯⎯⎯⎯→
←⎯⎯⎯⎯ ←⎯⎯⎯⎯
v
v v
v
, (2.74)
константа равновесия будет зависеть от четырех констант скорости. Действи-
тельно, при равновесии
1122
0
−−
=− =− =vv v v v . (2.75)
В соответствии с законом действующих масс выразим скорости прямых и об-
ратных реакций в первой и второй стадиях через концентрации. Тогда для со-
стояния равновесия получим
p,A11p,P
0kc k c
−
−= и
2p,P 2p,B
0kc k c
−
−
= . (2.76)
Отсюда

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
42
11 1p,P
p,A
//cc kk K
−
== и
p,B p,P 2 2 2
//cc kk K
−
=
= , (2.77)
где
p
,i
c – концентрация i -го компонента в равновесном состоянии;
1
K
и
2
K
–
константы равновесия для первой и второй стадии. С другой стороны, констан-
та равновесия суммарной реакции равна
p
,B p,A
/
K
cc
=
. Учитывая, что
(
)
(
)
p
,B p,P p,P p,A p,B p,A
// /cc cc cc= , получаем
21
12
21
kk
K
KK
kk
−−
==. (2.78)
Таким образом, константа равновесия двустадийной мономолекулярной
реакции связана с четырьмя константами скорости прямых и обратных реакций
в обоих стадиях.
Для рассматриваемой двустадийной реакции, уравнение которой в общем
виде (2.74), скорость можно представить в виде разности двух выражений, про-
порциональных соответственно концентрациям
A
c
и
B
c
. Действительно, кон-
центрация промежуточного продукта
P
c вблизи состояния равновесия стано-
вится очень малой, что позволяет считать процесс квазистационарным (см.
2.2.1.6), а суммарную скорость образования промежуточного вещества
(
)
P
v
равной нулю:
()
P
1 2 1 2 1A 2B 1P 2P
0kc k c k c k c
−− − −
=+ − −= + − − =vvvvv . (2.79)
Определив
P
c из равенства (2.79)
1A 2B
P
12
kc k c
c
kk
−
−
+
=
+
(2.80)
и подставив его значение в выражение, например, для скорости первой стадии
реакции, уравнение которой в общем виде (2.74), получим формулу
(
)
11A 2B
1A
12
kkc kc
kc
kk
−−
−
+
=−
+
v , (2.81)
которую легко привести к виду
AB
kc kc
+−
=
−v
, (2.82)
где

Х и м и ч е с к а я к и н е т и к а
43
12
12
kk
k
kk
+
−
=
+
и
12
12
kk
k
kk
−−
−
−
=
+
. (2.83)
Выражения (2.83) подтверждают, что у обратимой двустадийной реакции
нет констант скорости
k
+
и
k
−
прямой и обратной реакций в целом. В действи-
тельности
k
+
и k
−
– эффективные величины, которые сложным образом зави-
сят от констант скорости всех стадий. Для более сложных случаев коэффициен-
ты
k
+
и
k
−
зависят от концентрации компонентов. Данный факт является еще
одним подтверждением вышесказанному, так как константа скорости реакции
зависит только от температуры и природы реактантов.
Рассматривая двусторонние двустадийные реакции, следует отметить
принцип детального равновесия: при равновесии в химической реакции
любая элементарная стадия протекает с одинаковой скоростью как слева
направо, так и справа налево
. Из данного принципа следует, что обратная
реакция в тех же условиях
(кроме соотношения концентраций) обязатель-
но протекает через те же стадии, что и прямая
. Например, если реакцию,
уравнение которой в общем виде (2.74), записать в общем виде следующим
уравнением:
(
)
()
(
)
()
22 11
22 11
BPA
kk
kk
−− −−
⎯⎯⎯⎯→ ⎯⎯⎯⎯→
←⎯⎯⎯⎯ ←⎯⎯⎯⎯
vv
vv
, (2.84)
то формульная единица B становится реагентом и превращается в формульную
единицу
A, при этом превращение будет происходить по тому же механизму,
что и реакция, уравнение которой в общем виде (2.74), т.е. через промежуточ-
ное вещество P.
Для многих двусторонних реакций (стадий) константа равновесия велика,
что в соответствии с равенством (2.60) означает превышение константы скоро-
сти прямой реакции над константой скорости обратной реакции. В таких
усло-
виях прямую реакцию можно рассматривать как
практически односторон-
нюю
, и соотношение между константами скорости прямой и обратной реакций
(соответственно и между их скоростями) в общем виде выразить как
g
−+
≤
vv.
Принято считать [1], что к односторонним можно отнести реакции в том слу-
чае, когда 0,01
−+
≤vv. Рассмотрим данный вопрос, имеющий важное практиче-
ское значение, несколько подробнее.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
44
Вышесказанное можно сформулировать следующим образом: если ско-
рость обратной элементарной реакции значительно меньше прямой
(
)
−+
vv и, следовательно, составляет небольшую долю от нее
g
−
+
=
vv (2.85)
(в рассматриваемом случае
0,01g = ), то реакцию, с погрешностью меньше
заданной величины
100 %g , можно рассматривать как практически одно-
стороннюю
(в рассматриваемом случае 100 0,01 1%
⋅
= ). Следовательно, усло-
вием того, что двустороннюю реакцию, уравнение которой в общем виде (2.55),
можно считать практически односторонней, является соотношение
[см. уравне-
ние (2.57)
]
(
)
(
)
01 02
gk c x k c x
+−
−
≥+. (2.86)
Знак равенства означает, что, пренебрегая вторым слагаемым в уравнении
(2.57), т. е. рассматривая реакцию как одностороннюю, мы допускаем погреш-
ность в оценке скорости реакции
v в 100 %g . Знак неравенства указывает, что
эта ошибка меньше 100 %g .
Любая двусторонняя реакция в начальный период может рассматриваться
как односторонняя. Преобразование выражения (2.86)
[с учетом соотношения
(2.60)
] к виду
02
01
cx
k
g
kcx
+
−
+
≥
−
или
02
01
cx
gK
cx
+
≥
−
(2.87)
позволяет получить формулу для расчета максимального значения
max
x
, до ко-
торого реакцию можно рассматривать как практически одностороннюю,
01 02
1
max
gKc c
x
gK
−
=
+
. (2.88)
Расчетную формулу для определения максимального времени
max
τ
, в те-
чение которого реакцию можно рассматривать как практически односторон-
нюю, получаем из выражений (2.67) и (2.68) путем подстановки
max
x
x= :
1
ln
max
max
L
kk Lx
+−
τ=
+−
. (2.89)

Х и м и ч е с к а я к и н е т и к а
45
Как уже отмечалось выше, константа равновесия у многих обратимых ре-
акций очень велика, т.е. в равновесном состоянии (при завершении реакции)
концентрация продуктов во много раз превышает концентрацию реагентов.
Константа скорости прямой реакции при этом значительно больше константы
скорости обратной реакции, а кинетика реакции в течение всего времени ее
протекания может
рассматриваться как односторонняя. В то же время следует
четко понимать, что не может быть строго односторонних реакций или стадий.
При приближении к концу реакции в любой системе, в принципе через беско-
нечно большое время, должно установиться состояние равновесия. Все стадии
сложной реакции при приближении к состоянию равновесия становятся дву-
сторонними,
а скорости прямых стадий – близкими по значению к скоростям
обратных. Поэтому лишь в ограниченном интервале изменения концентраций
при протекании реакции в условиях, достаточно удаленных от состояния рав-
новесия, одностадийная реакция или лимитирующая стадия сложной реакции
может рассматриваться как односторонняя.
Параллельные (конкурирующие) реакции – это реакции, в которых ис-
ходное вещество одновременно претерпевает изменение, по крайней мере,
по двум направлениям
. Более обобщенно можно сказать, что если в системе
одновременно протекает несколько реакций, в которых участвует один и
тот же реагент
(или реагенты), давая различные продукты, то реакции на-
зываются
параллельными.
Среди параллельных реакций широко распространены такие, в которых
одно исходное вещество атакует различные связи в молекуле другого. Так, при
хлорировании углеводородов промежуточная частица – атом хлора – атакует
различные C–H-связи углеводорода, в результате чего параллельно образуется
набор хлорпроизводных. Это используют для оценки относительной реакцион-
ной способности различных C–H-связей молекул по отношению к хлору
и дру-
гим веществам.
Важное методическое значение среди параллельных реакций приобрели
конкурирующие реакции, в которых одно вещество (частица) реагирует с
двумя или более веществами
(частицами), так что каждое из них конкури-
рует в реакции за это вещество
(частицу). Распространенность таких реакций
и обусловила тот факт, что параллельные реакции часто называют конкури-
рующими. Изучение кинетики конкурирующих реакций позволяет охарактери-
зовать относительную реакционную способность ряда веществ (частиц) по от-

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
46
ношению к одному и тому же реагенту. Различные типы конкурирующих реак-
ций рассмотрены, например, в [2].
Примером параллельной реакции является разложение гидроксиламина,
которое одновременно может протекать по двум направлениям:
2322
3NH OH NH N 3H O→++
,
2322
4NH OH 2NH N O 3H O→++.
Мы ограничимся рассмотрением лишь простейших случаев параллельных
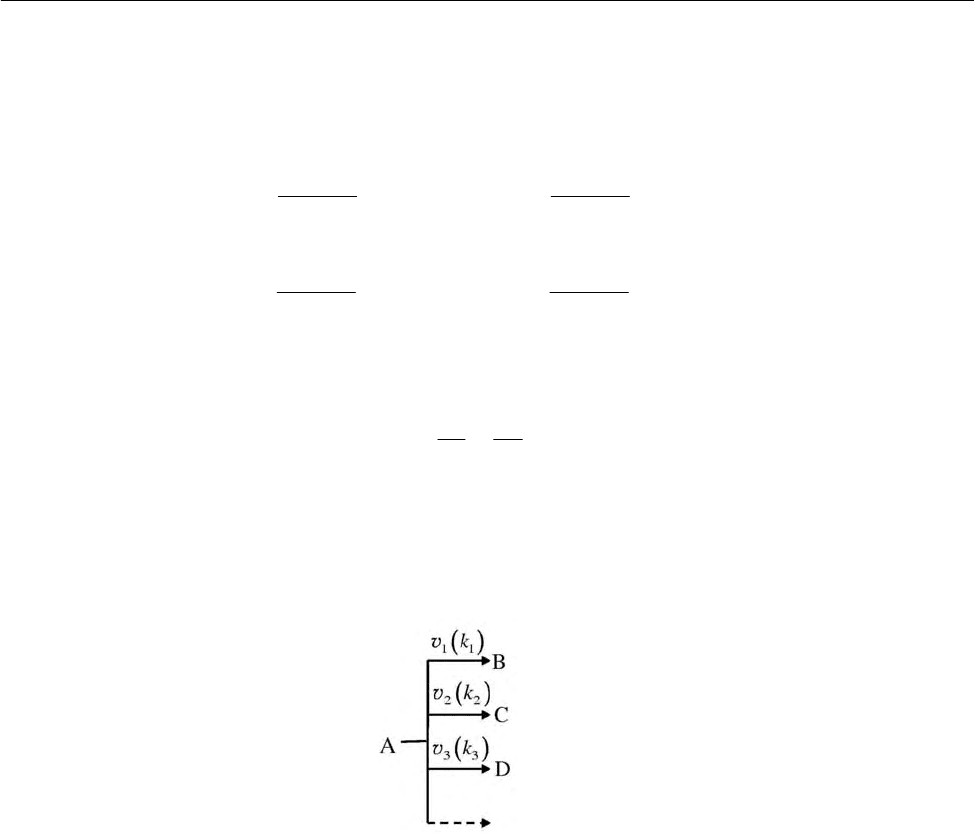
(конкурирующих) реакций. Схему параллельных гомогенных реакций в закры-
той системе, когда реагент A одновременно претерпевает мономолекулярное
превращение в продукты B и D, причем параллельные элементарные односто-
ронние реакции имеют первый порядок по реагенту A, можно представить в
виде
(2.90)
Общая скорость изменения содержания (расходования) реагента A равна
сумме
скоростей реакции по обоим направлениям:
()
1
11 21 1 2 1
dc
kc k c k k c
d
−= + =+
τ
, (2.91)
где
1
c – концентрация реагента A. Уравнение (2.91) после разделения перемен-
ных и интегрирования в пределах от
01
c до
1
c и от 0 до
τ
примет вид
(
)
12
101
kk
cce
−
+τ
= . (2.92)
Скорости образования (получения) продуктов B и D, концентрации кото-
рых соответственно
2
c и
3
c , равны
2
11
dc
kc
d
=
τ
и
3
21
dc
kc
d
=
τ
. (2.93)
Подставляя в выражения (2.93) значение
1
c из уравнения (2.92), получаем
()
12
2101
kk
dc k c e d
−+τ
=
τ и
(
)
12
3201
kk
dc k c e d
−+τ
=
τ. (2.94)
Х и м и ч е с к а я к и н е т и к а
47
Предполагая, что в начале реакции
02 03
0cc
=
= , и интегрируя эти уравнения от
0 до
2
c
(или соответственно от 0 до
3
c
) получаем, с учетом (2.92), следующие
уравнения:
()
()
12
101
1
2011
12 12
1
kk
kc
k
ce cc
kk kk
−+τ
⎡⎤
=− = −
⎣⎦
++
, (2.95)
()
()
12
201
2
3011
12 12
1
kk
kc
k
ce cc
kk kk
−+τ
⎡⎤
=− = −
⎣⎦
++
. (2.96)
Разделив уравнение (2.95) на уравнение (2.91), получим
21
32
ck
ck
=
. (2.97)
Легко видеть, что на трех (или большем числе) параллельных реакций
первого порядка получится результат, сходный с соотношением (2.97). Так, ес-
ли схему параллельных реакций записать в виде
,
(2.98)
то уравнение для концентрации
1
c
реагента A в экспоненциальной форме будет
иметь вид
(
)
123
101
kk k
cce
τ
−++
= . (2.99)
Концентрации продуктов
(
234
,,ccc соответственно для продуктов
)
B, C, D , при
условии их отсутствия в исходной системе, будут относиться как константы
скорости, т. е.
234 123
: : :... : : :...ccc kkk
=
(2.100)
Так, при нитровании фенола идут три параллельные реакции первого порядка
(относительно фенола), а именно образование
орто-, мета- и пара-нитрофенолов.
Экспериментально установлено, что отношение количества трех изомеров ос-
тается постоянным в течение всего процесса:
:: 59,2:3,3:3,75 ::
oo мп мп
cc c kk k==.

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
48
Очевидно, что с наибольшей скоростью образуется орто-изомер, а с наимень-
шей –
мета-изомер.
Введем понятие
интегральной селективности процесса (реакции).
Интегральной селективностью процесса при наличии нескольких парал-
лельных реакций называется отношение концентрации основного
(полез-
ного
) продукта к сумме концентраций всех продуктов, полученных в ре-
зультате процесса,
т. е. применительно к реакции, уравнение которой (2.90),
2
23
c
cc
σ=
+
(2.101)
или, с учетом соотношения (2.97), имеем
1
12
k
kk
σ=
+
. (2.102)
На основании выражения (2.102)
селективность рассматриваемого процесса
равна соотношению константы скорости основной реакции к сумме кон-
стант скоростей основной и побочной реакций
, если продукт B мы считаем
основным (полезным продуктом), а продукт D – побочным продуктом (отходом
процесса). Для рассматриваемого процесса селективность остается постоянной
на протяжении всего времени протекания двух параллельных реакций. Кинети-
ческие кривые компонентов реакции, уравнение которой (2.90), для случая
23
cc> , что означает
12
kk> , т.е. для случая, когда скорость реакции получения
продукта B превышает скорость реакции получения продукта D, приведены на
рис. 2.7. В рассматриваемом случае
главная реакция (как обычно) обладает
большей скоростью, чем
побочная (образование продукта D). Впрочем, при не
слишком большом различии в скоростях, главной (основной) реакцией называ-
ют реакцию, приводящую к получению нужного продукта, хотя бы она и обла-
дала меньшей скоростью.
Таким образом, мы нашли зависимость концен-
трации компонентов A, B и D
от времени [см. выраже-
ния (2.92), (2.95), (2.96)], считая константы скоростей
Рис. 2.7. Кинетические кривые компонентов па-
раллельной реакции, уравнение которой (2.90)
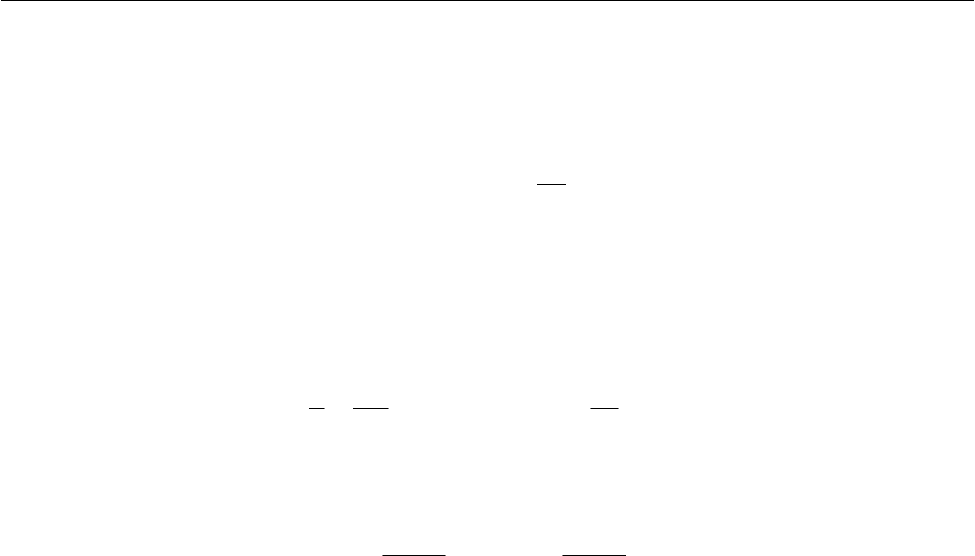
Х и м и ч е с к а я к и н е т и к а
49
обеих параллельных реакций известными, т. е. решили прямую кинетическую
задачу.
Для решения обратной кинетической задачи введем обозначения
12
kk M+= и
1
2
k
N
k
=
. (2.103)
Значения величин
M и N рассчитываем, исходя из опытных данных, по форму-
лам (2.104), получаемым, с учетом введенных обозначений (2.103), из уравне-
ний (2.92) и (2.97)
01
1
1
ln const
c
M
c
==
τ
и
2
3
const
c
N
c
== . (2.104)
Из системы уравнений (2.103) находим
1
1
M
N
k
N
=
+
и
2
1
M
k
N
=
+
. (2.105)
Проведем качественный анализ параллельной реакции, в которой вещест-
во
2
A
вступает во взаимодействие с неустойчивым веществом
1
A
, параллельно
распадающимся с константой скорости
1
k . Уравнения этой реакции в общем
виде следующие:
(
)
(
)
11 2 2
112
A Продукты распада;A A B
kk
⎯⎯⎯→+⎯⎯⎯→
v v
. (2.106)
Если в качестве исходной взята стехиометрическая смесь
1
A и
2
A, в конце ре-
акции не будет наблюдаться 100 %-ное превращение
2
A в B. Это обусловлено
нехваткой вещества
1
A , которое частично израсходуется на побочную реакцию
первого порядка. При исследовании кинетики реакции по накоплению продукта
B или расходованию реагента
2
A через определенное время можно зарегистри-
ровать прекращение (остановку) реакции при наличии непрореагировавшего
реагента
2
A. Наличие избытка реагента
1
A по сравнению с
2
A в исходной сме-
си повышает степень превращения. Однако, как показывает строгий математи-
ческий анализ, в реакционной смеси всегда останется некоторое количество не-
прореагировавшего реагента
2
A, которое тем меньше, чем больше взято реа-
гента
1
A
. На рис. 2.8 показано, как выглядят кинетические кривые накопления
продукта
(
)
3
B c при разных начальных концентрациях реагента
1
A . Для кине-
тических кривых 1, 2, 3 наблюдается соответственно возрастание начальных
