Коган В.Е., Зенин В.С., Пенкина Н.В. Физическая химия. Часть 2. Химическая кинетика
Подождите немного. Документ загружается.


В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
20
22
HBr 2HBr
+
→ . (2.25)
Ее механизм – элементарные стадии, уравнения которых:
(
)
()
()
()
2
2
2
2
Br 2Br;
Br H HBr H;
HBr HBrBr;
2Br Br .
a
б
в
г
→
+→ +
+→ +
→
(2.26)
При этом продукт
(
)
HBr образуется на стадиях
(
)
(
)
и бв, т. е. двумя различ-
ными путями, и общий порядок реакции, уравнение которой (2.25), равен 1,5.
Кинетическое уравнение для реакции n-го порядка (при условии равенст-
ва концентраций всех реагентов и взаимодействия этих реагентов с равными
стехиометрическими коэффициентами) имеет вид
n
dc
==kc
d
−
τ
v , (2.27)
т. е. константа скорости реакции n-го порядка выражается в единицах
[][]
1
концентрация : время
n−
. С учетом использования в кинетическом уравнении
(2.27) молярной концентрации, константа скорости реакции
n-го порядка изме-
ряется в
(
)
11
л / моль c
nn−−
⋅
()
(
)
31
1
м / кмоль c
n
n
−
−
⎡⎤
⋅
⎣⎦
. Следовательно, константы
скорости химических реакций различных порядков имеют разные едини-
цы измерения,
например, константа скорости реакций нулевого порядка изме-
ряется в тех же единицах, что и скорость реакции (см. 2.2.1.1), первого поряд-
ка – в
1
c
−
, второго порядка – в
(
)
л / моль с
⋅
(
)
3
м / кмоль с
⎡
⎤
⋅
⎣
⎦
, а третьего поряд-
ка – в
()
22
л / моль с⋅
()
62
м / кмоль с
⎡⎤
⋅
⎣⎦
1
. Из сказанного ясно, что нельзя сопос-
тавлять константы скорости реакций различных порядков
и что при пере-
ходе от одной единицы измерения концентрации к другой константа ско-
рости реакции первого порядка не изменяется
.
Как уже отмечалось (см. 2.1), стехиометрические уравнения сложных ре-
акций выражают только конечный результат процесса и не отражают истинного
механизма химической реакции. Поэтому порядок сложных химических реак-
1
В СИ константа скорости реакций n-го порядка измеряется в
(
)
()
31
1
м / моль c
n
n
−
−
⋅ ; первого
порядка – в
1
c
−
, второго порядка – в
(
)
3
м / моль с
⋅
и третьего порядка – в
()
62
м / моль с
⋅
.

Х и м и ч е с к а я к и н е т и к а
21
ций, как правило, отличен от суммы стехиометрических коэффициентов реа-
гентов в уравнении реакции. Так, при аналогичности стехиометрических урав-
нений реакций (2.11) и (2.25), для первой из них 2
n
=
, а для второй 1, 5n
=
.
Следует подчеркнуть, что для реакции, уравнение которой (2.11), сумма сте-
хиометрических коэффициентов равна порядку реакции, однако это является
простым совпадением. Тот факт, что реакция, уравнение которой (2.11), подчи-
няется закону действующих масс для реакций второго порядка, обусловлен
другими факторами, которые будут рассмотрены ниже.
Порядок реакции – формальное эмпирическое понятие, его находят из
кинетических
уравнений химических реакций, в то время как молекулярность –
теоретическое понятие, она определяет фактическое число частиц-реагентов,
участвующих в элементарном акте химического взаимодействия.
Только для простых реакций, протекающих в одну элементарную стадию
без участия посторонних формульных единиц, молекулярность и порядок реак-
ции совпадают.
Несовпадение молекулярности и порядка реакции имеет ме-
сто в трех основных случаях: для сложных реакций, для гетерогенных реакций
и для реакций с избытком одного из реагирующих веществ.
Для сложных реакций данное несовпадение определяется различием ме-
жду кинетическим уравнением (2.21) сложной химической реакции и кинетиче-
ским уравнением (2.8) простой химической реакции.
Так, например, мономолекулярные реакции могут иметь как
первый, так
и второй порядок. Элементарным актом многих гомогенных мономолекуляр-
ных реакций, протекающих в газовой фазе, является распад молекулы. Моно-
молекулярный распад претерпевают обычно сложные молекулы, состоящие из
большого числа атомов, причем энергия активации этих реакций сравнительно
велика. Дело в том, что сами по себе такие молекулы устойчивы и, прежде чем
распасться, они должны приобрести избыток энергии благодаря столкновениям
с другими молекулами, движущимися с бóльшими скоростями, т. е. должны
быть активированы.
Механизм протекания мономолекулярных реакций можно приближенно
(полукачественно) объяснить с помощью
теории Линдемана, согласно кото-
рой мономолекулярное превращение является сложным процессом, состоящим
из бимолекулярной стадии активации и мономолекулярного превращения ак-
тивных частиц (подробнее см. 2.2.1.6). Таким образом, распад молекулы, на-
пример диссоциация ацетона

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
22
(
)
() () ()
32
6
ггг
CH CO С H СO→+, (2.28)
идет в две стадии, причем в зависимости от соотношения скоростей этих стадий
(первая – образование активных молекул и вторая – их разложение) суммарная
реакция может иметь как первый, так и второй порядок.
В тех случаях, когда время между столкновениями молекул мало по срав-
нению со временем распада (высокое давление), часть из них
дезактивируется
при соударениях и не успевает распасться. Доля активных молекул остается по-
стоянной, число их оказывается пропорциональным концентрации. Реакция,
скорость которой определяется скоростью второй стадии, т. е. пропорциональ-
на концентрации в первой степени, идет по кинетическому уравнению первого
порядка. Если же время между столкновениями молекул велико по сравнению
со временем,
необходимым для распада возбужденной (активированной) моле-
кулы (низкое давление), т. е. время существования активных молекул мало, то
большинство их распадается, не успев дезактивироваться в результате новых
столкновений. Очевидно, что в этом случае скорость реакции определяется
скоростью первой стадии, т. е. скоростью активации, которая пропорциональна
числу двойных столкновений (квадрату концентрации), и реакция
идет по
уравнению второго порядка.
Рассмотренный пример возможного несовпадения молекулярности и по-
рядка сложных реакций наглядно привел нас еще к одному выводу, крайне
важному при рассмотрении сложных реакций, а именно к выводу о том
, что
для сложных реакций имеет место элементарная (или формально простая)
стадия, кинетические закономерности которой в основном определяют за-
кономерности всего процесса. Такая стадия получила название лимити-
рующей
(скоростьопределяющей).
В рассмотренном примере диссоциации ацетона [уравнение реакции
(2.28)] при высоких давлениях лимитирующей является вторая стадия, а при
низких – первая.
Добавление в реакционное пространство постороннего га-
за ведет к тому, что формульные единицы примеси, участвуя в дезактиви-
рующих столкновениях, устраняют переход реакций первого порядка в ре-
акции второго порядка
.
Прежде, чем перейти к рассмотрению двух оставшихся случаев несовпа-
дения молекулярности и порядка химической реакции, вернемся к реакции,
уравнение которой (2.11), а механизм выражается уравнениями (2.12), но уже в
свете введенного понятия лимитирующей стадии реакции.

Х и м и ч е с к а я к и н е т и к а
23
Механизм этой реакции – последовательность элементарных стадий с не-
устойчивыми промежуточными веществами. Это позволяет рассматривать ее
как одну стадию, т. е. как формально простую бимолекулярную реакцию, отве-
чающую уравнению (2.11). Как уже отмечалось, данная реакция подчиняется
закону действующих масс для реакций второго порядка, что согласуется с на-
личием лимитирующей стадии
( )
б в механизме сложной химической реакции,
который выражается уравнениями (2.12). Рассматриваемая реакция является
сложной последовательной реакцией, протекающей по цепному механизму.
Поэтому наиболее медленная стадия
( )
б , являющаяся элементарной стадией
второго порядка, определяет кинетику и общий порядок реакции, уравнение ко-
торой (2.11), т. е. является
лимитирующей, или скоростьопределяющей ста-
дией
.
Вернемся к рассмотрению случаев несовпадения молекулярности и по-
рядка реакции.
Молекулярность всегда не соответствует порядку реакции для гетероген-
ных реакций. Отмеченное становится понятным с учетом того, что при нахож-
дении реагентов в различных фазах их концентрации уже не определяют число
прореагировавших частиц.
И наконец, в некоторых случаях один из реагентов
присутствует в таком
большом избытке, что расход его в реакции практически не отражается на его
концентрации. Так, например, реакция омыления сложного эфира, отвечающая
уравнению
3252 3 25
Катализатор
CH COOC H H O СHCOOH CHOH+ ⎯⎯⎯⎯⎯⎯→+, (2.29)
осуществляется при значительном избытке одного из исходных веществ – во-
ды, концентрацию которой практически можно считать постоянной. Следова-
тельно, скорость реакции (2.29) в указанных условиях описывается кинетиче-
ским уравнением
325
CH COOC H
kc=v
, (2.30)
т. е. соответствует кинетическому уравнению первого порядка (2.14), несмотря
на участие в реакции двух молекул. Таким образом, реакция, уравнение кото-
рой (2.29), бимолекулярная, но первого порядка.
Еще одним примером бимолекулярной реакции первого порядка является
взаимодействие малахитового зеленого с гидроксид-ионом в присутствии из-

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
24
бытка основания. Кинетика данного взаимодействия изучается студентами при
выполнении лабораторной работы [15].
2.2.1.3. Константа скорости реакции и период полупревращения
для химических реакций различного порядка
Формальная кинетика, несмотря на ограниченные возможности, обуслов-
ленные разграничением реакций по порядку по формальному признаку (сумма
показателей степеней в кинетических уравнениях химических реакций), дает
возможность использовать математические зависимости для нахождения важ-
нейших кинетических параметров: константы скорости и изменения концен-
трации реагирующих веществ с течением времени.
В [15] нами уже рассматривался вывод
кинетических уравнений в инте-
гральной форме на основании кинетического уравнения
n-го порядка (2.27)
(при условии равенства концентраций всех реагентов и взаимодействия этих
реагентов с равными стехиометрическими коэффициентами) для случаев
n = 1
и
n > 1.
В настоящем издании для большей ясности изложения и исходя из основ-
ных практических задач, решаемых студентами при изучении раздела «Хими-
ческая кинетика», рассматриваются возможности формальной кинетики приме-
нительно к реакциям нулевого, первого, второго и третьего порядков.
Как уже было показано (см. 2.2.1.2.),
скорость реакции нулевого порядка
[уравнение (2.24)]
постоянна вследствие практического постоянства кон-
центрации реагента или реагентов
. Исходя из этого понятно, что если в слу-
чае рассмотренного примера омыления сложного эфира водой в разбавленном
водном растворе, выражаемого уравнением
(
)
2.27 , применять эфир, малорас-
творимый в воде и взять его в количестве, обеспечивающем присутствие в сис-
теме эфирного слоя (избыток эфира), то расход эфира будет постоянно воспол-
няться из эфирного слоя, а следовательно, скорость омыления эфира сохранит-
ся постоянной, т. е.
dc
k
d
−
=
τ
, k
=
v . (2.31)
Разделив переменные и проинтегрировав, получим
ckB
=
−τ+ , (2.32)
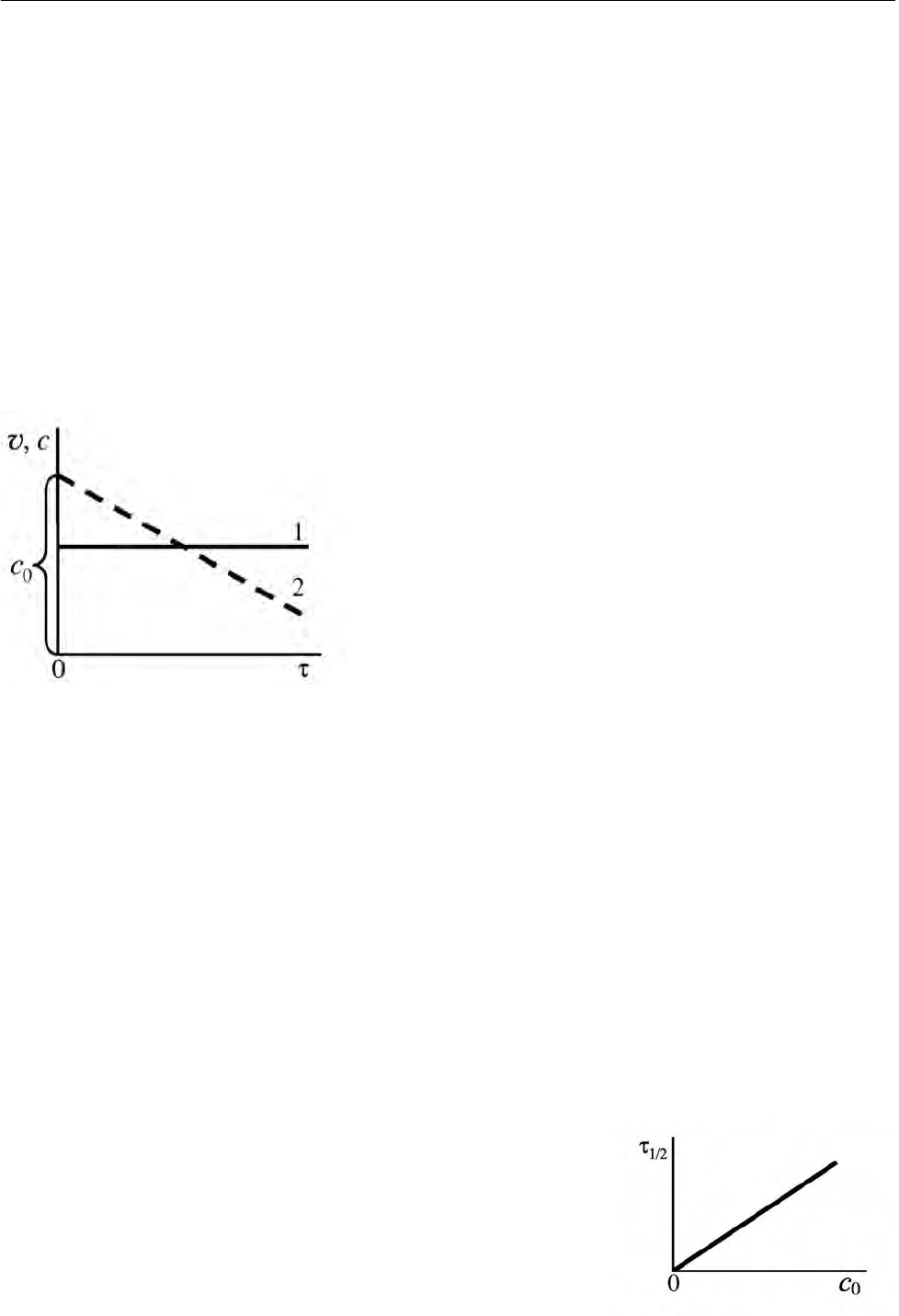
Х и м и ч е с к а я к и н е т и к а
25
где
B
– постоянная интегрирования.
Постоянную интегрирования определим из начальных условий 0
τ
= и
0
cc= . Тогда
0
B
c= , где
0
c – начальная концентрация реагента – эфира в нашем
примере. Подставляя значение
B
в выражение (2.32), получаем кинетическое
уравнение реакции нулевого порядка в интегральной форме
:
0
ckc
τ
=
−+. (2.33)
Изменения скорости реакции и концентрации реагента для реакции нуле-
вого порядка представлены на рис. 2.1.
Скорость реакции нулевого порядка,
как следует из уравнения (2.31), есть
величина постоянная (рис. 2.1, прямая
1), а
концентрация реагента, как видно из уравнения (2.33), уменьшается
линейно
по мере увеличения времени реак-
ции
(рис. 2.1, прямая 2).
Рис. 2.1. Изменение скорости реакции (1) и
концентрации реагента (2) в зависимости от
времени для реакции нулевого порядка
Для характеристики скорости реакции
наряду с константой скорости часто пользуют-
ся
временем, или периодом полупревращения (полураспада в случае радиоак-
тивных процессов)
1/2
τ
, равным промежутку времени, в течение которого
первоначальная концентрация реагента снижается наполовину
0
=/2cc ,
т. е., другими словами, реагирует половина взятого количества вещества.
Для реакции нулевого порядка время полупревращения равно
1/2 0
/2ck
τ
= . (2.34)
Тогда, определяя значение
k из выражения (2.34), с учетом (2.31) получаем
01/2
/2kc
=
=τv
, (2.35)
что находит графическое отображение в виде прямой, исходящей из начала ко-
ординат (рис. 2.2).
Рис. 2.2. Зависимость времени полупревращения ре-
акции нулевого порядка от начальной концентрации
реагента
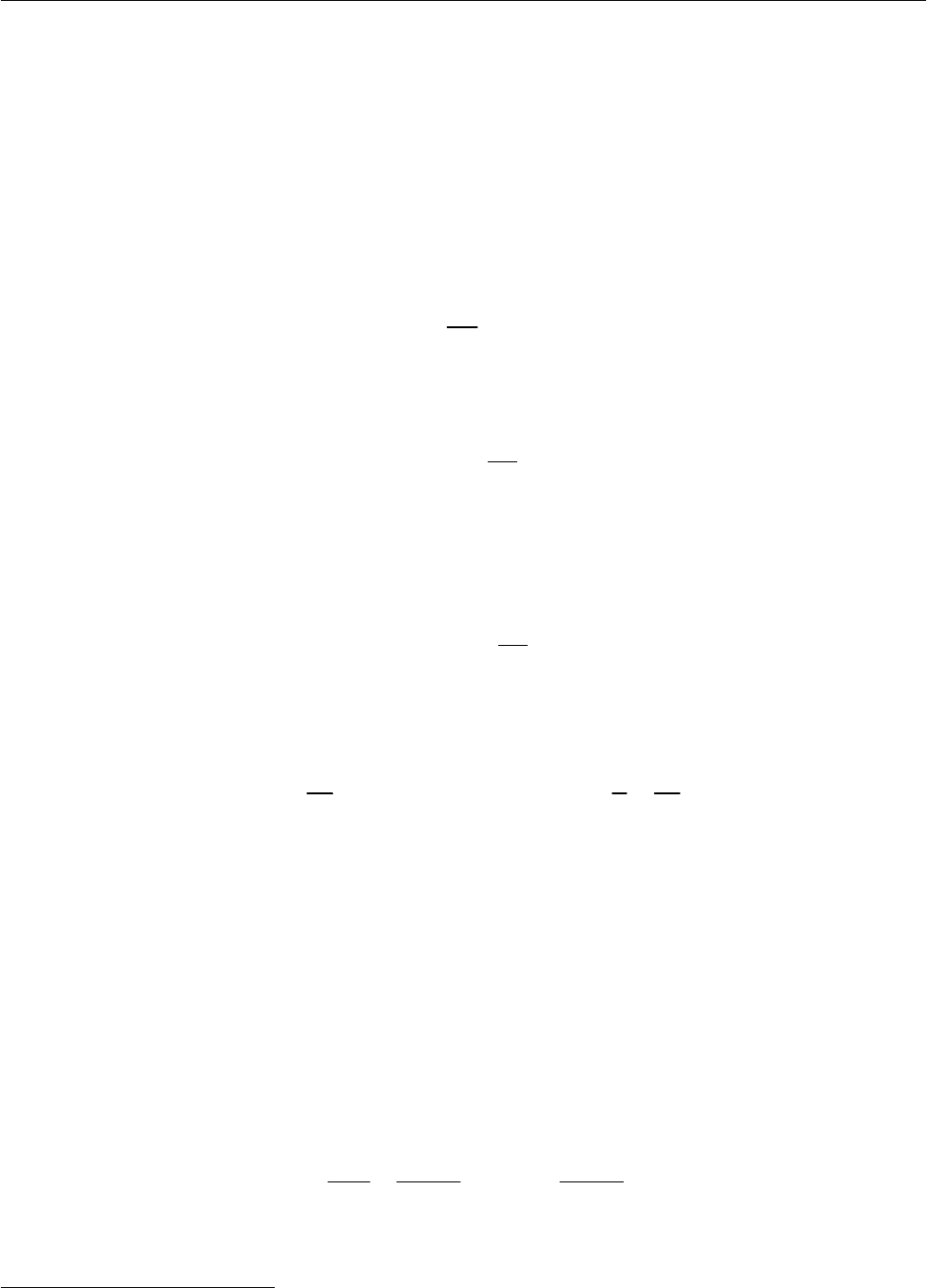
В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
26
Таким образом, можно заключить, что время полупревращения реакции
нулевого порядка прямо пропорционально начальной концентрации реа-
гента
[уравнение (2.34)], а константа скорости химической реакции чис-
ленно равна скорости реакции, причем эти величины обратно пропорцио-
нальны времени полупревращения
[уравнение (2.35)].
Скорость реакции первого порядка, кинетическое уравнение которой
определяется формулой
()
2.15 , с учетом уравнения
(
)
2.4 равна
dc
kc
d
=
−=
τ
v . (2.36)
Разделив переменные
dc
kd
c
τ
=− (2.37)
и проведя интегрирование уравнения (2.37) от 0 до
τ
(левой части) и от
0
c
(на-
чальная концентрация) до
c
1
(текущая концентрация) за время τ (правой части)
0
0
c
c
dc
kd
c
τ
τ=−
∫
∫
, (2.38)
получим
0
ln
c
k
c
τ= ,
0
ln lnck c
=
−τ+ ,
0
1
ln
c
k
c
=
τ
. (2.39)
Формулы (2.39) – различные формы
кинетического уравнения реакции
первого порядка в интегральной форме
. Их потенцирование позволяет полу-
чить зависимость текущей концентрации в экспоненциальной форме:
0
k
cce
−
τ
= . (2.40)
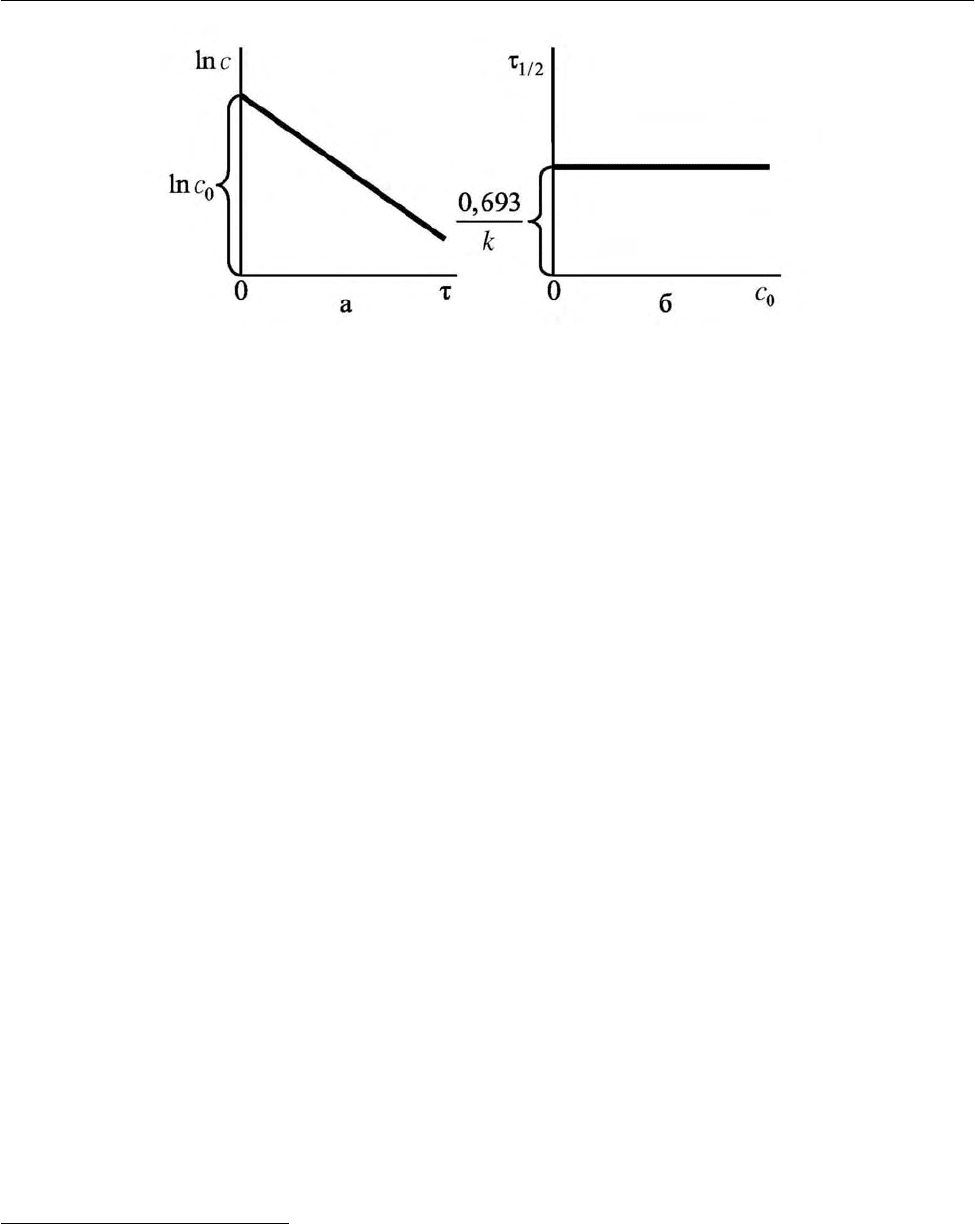
Величина lnc , в соответствии с уравнениями (2.39), линейно зависит от
времени реакции
, что отражает рис. 2.3, а. Уравнения (2.39) позволяют опре-
делить константу скорости реакции и время полупревращения, которые равны
1/2 1/2
ln 2 0,693
k ==
ττ
,
1/2
0,693
k
τ= . (2.41)
1
Для текущей концентрации может быть использовано тождественное обозначение c
τ
.
Х и м и ч е с к а я к и н е т и к а
27
Итак,
время полупревращения реакции первого порядка не зависит от
начальной концентрации реагента
(уравнение (2.41), рис. 2.3, б) и обратно
пропорционально константе скорости реакции
[уравнение (2.41)].
В кинетические уравнения (2.39) входит отношение исходной
0
с
и теку-
щей
с
концентраций, что позволяет при исследовании кинетики реакций ис-
пользовать не абсолютные значения концентраций, а относительные величины,
например процентное содержание прореагировавшего вещества, интенсивность
светорассеяния, оптическую плотность (как в случае выполняемой студентами
лабораторной работы по исследованию кинетики взаимодействия малахитового
зеленого с гидроксид-ионом [15]) и др.
Если необходимо определить
убыль концентрации x реагента за время
τ , то с учетом
0
cc x=− из уравнений (2.39) имеем
(
)
0
1
k
xc e
−
τ
=− . (2.42)
Кинетическое уравнение для простой реакции второго порядка в слу-
чае, когда реагируют одинаковые формульные единицы
1
и
12
cc c== определя-
1
Получаемые здесь результаты могут быть распространены на формально простые реакции
второго порядка по одному из реагентов в предположении, что по другому реагенту порядок
реакции равен нулю (оно находится, например, в избытке), а также и по отношению реакций,
в которых с равными стехиометрическими коэффициентами участвуют две различные фор-
мульные единицы, находящиеся
в реакционном пространстве в равных начальных концен-
трациях.
Рис. 2.3. Зависимость логарифма концентрации реаген-
та от времени процесса (а) и времени полупревращения
от начальной концентрации реагента (б) для реакции
первого порядка

В. Е. Коган, Г. С. Зенин, Н. В. Пенкина
28
ется формулой
(
)
2.17 , которая с учетом уравнения (2.4) принимает следующий
вид:
2
dc
kc
d
−=
τ
. (2.43)
Разделив переменные
2
dc
kd
c
τ
=− (2.44)
и проинтегрировав уравнение (2.44) в пределах от 0 до
τ
и от
0
c до c
0
2
0
c
c
dc
kd
c
τ
τ
=−
∫
∫
, (2.45)
получим
0
11
k
cc
−=τ,
0
11
k
с c
=
τ+ ,
0
0
cc
k
cc
−
=
τ . (2.46)
Формулы (2.46) – различные формы
кинетического уравнения реакции
второго порядка в интегральной форме
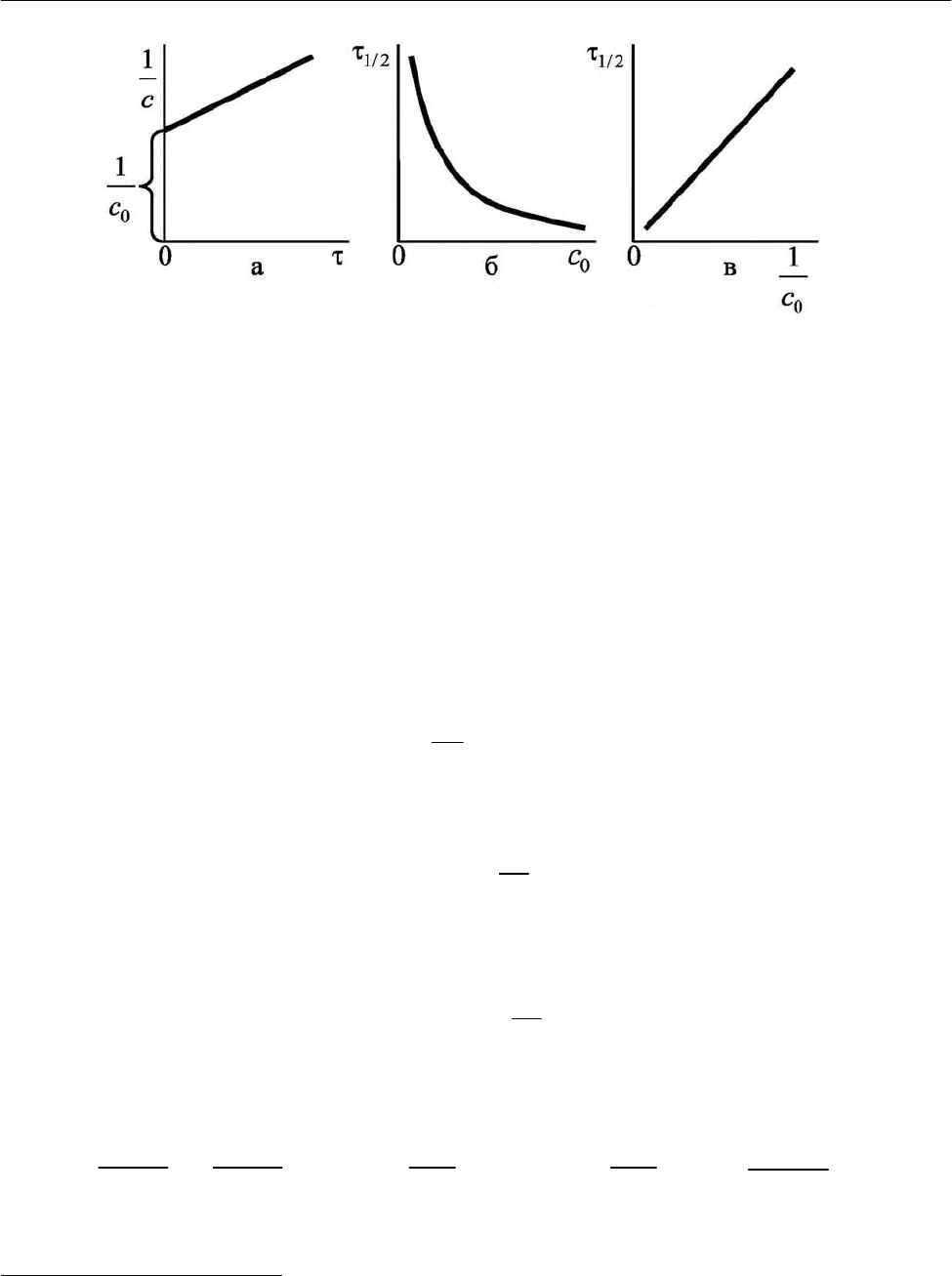
. В соответствии с уравнениями (2.46)
величина
1
с
линейно зависит от времени, что отражает рис. 2.4, а. Уравнения
(2.46) позволяют определить время полупревращения и константу скорости ре-
акции:
1/2
0
1
kc
τ
= ,
1/2 0
1
.
k
c
=
τ
(2.47)
Итак, для реакций второго порядка время полупревращения
(уравнение,
(2.47), рис. 2.4, б, в)
и константа скорости реакции [уравнение (2.47)] обрат-
но пропорциональны начальной концентрации реагента
0
с .
Если необходимо определить убыль концентрации
x регента за время
τ , то с учетом
0
,cc x=− из уравнений (2.46) имеем
0
0
1
1
1
xc
kc
⎛⎞
=−
⎜⎟
τ
+
⎝⎠
. (2.48)
Х и м и ч е с к а я к и н е т и к а
29
Кинетическое уравнение для элементарной реакции третьего порядка
в случае, когда реагируют одинаковые формульные единицы
1
и
123
сс сс===,
определяется формулой
()
2.20 , которая с учетом уравнения (2.4) принимает
следующий вид:
3
dc
kc
d
−=
τ
. (2.49)
Разделив переменные
3
dc
kd
c
τ
=− (2.50)
и проинтегрировав уравнение (2.50) в пределах от 0 до
τ
и от
0
c
до c
0
3
0
c
c
dc
kd
c
τ
τ=−
∫
∫
, (2.51)
получим
22
0
11
22
k
сс
−=τ
,
22
0
11
2 k
с c
=
τ+
,
22
0
22
0
2
cc
k
cc
−
τ= . (2.52)
1
При участии в реакции трех различных формульных единиц подразумевается, что они на-
ходятся в реакционном пространстве в равных начальных концентрациях и участвуют в ре-
акции с равными стехиометрическими коэффициентами.
Рис. 2.4. Зависимость обратной величины текущей концентрации
реагента от времени процесса (а), времени полупревращения от
начальной концентрации реагента (б), и времени полупревраще-
ния от обратной величины начальной концентрации реагента (в)
для реакции второго порядка
