Хаитов P.M., Игнатьева Г.Л. Иммунология
Подождите немного. Документ загружается.

Продолжение таблицы
Факторы
лим-
фоцитарного
иммунитета
Молекулярные
механизмы, опо-
средующие взаимо-
действие лимфоци-
тов с лейкоцита-
ми — исполните-
лями деструкции
Клетки
крови —
исполнители
деструкции
Механизмы
деструкции анти-
генов и собствен-
ных клеток и меж-
клеточного мат-
рикса, с которыми
антигены связаны
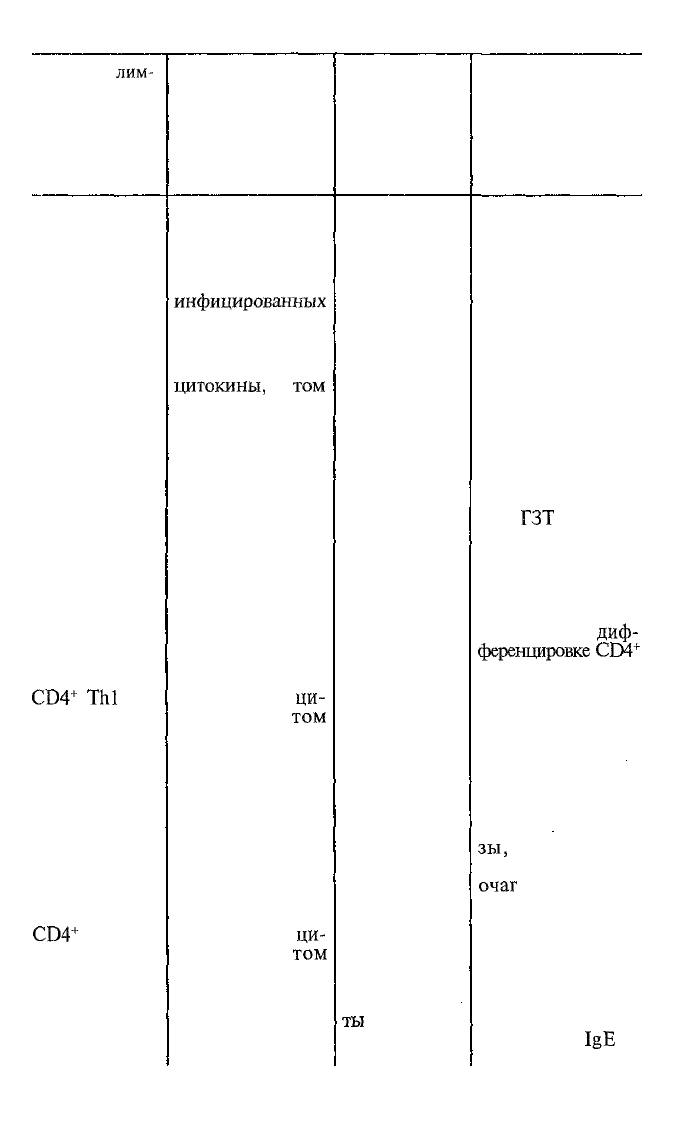
CD4
+
Thl
CD4
+
Th2
клеток своего
организма (в ес-
тественных усло-
виях — вирус-
инфицированных
клеток) и убива-
ют эти клетки
2. Продуцируют
цитокины,
в
том
числе IFN-y
Продуцируют
ци-
токины, в
том
числе IFN-y
Продуцируют
ци-
токины, в
том
числе:
IL-4
Макрофаги.
NK
Макрофаги
В-лимфоци-
ты
1. IFN-y сам по
себе ингибирует
репликацию ДНК,
в том числе ви-
русной
2. IFN-y активиру-
ет макрофаги, чем
способствует реак-
ции
ГЗТ
3. IFN-y активиру-
ет NK к противо-
вирусной «атаке»
4. IFN-y является
кофактором, спо-
собствующим
диф-
ференцировке
CD4
+
Thl
Макрофаги, акти-
вированные IFN-
у, интенсивно
продуцируют и
секретируют ак-
тивные формы
кислорода, ради-
кал NO, протеа-
зы,
которые со-
здают локально
очаг
воспаления,
называемый ГЗТ
Переключает син-
тез иммуноглобу-
линов на
IgE
и
231
Продолжение таблицы
Факторы лим-
фоцитарного
иммунитета
Молекулярные
механизмы, опо-
средующие взаимо-
действие лимфоци-
тов с лейкоцита-
ми — исполните-
лями деструкции
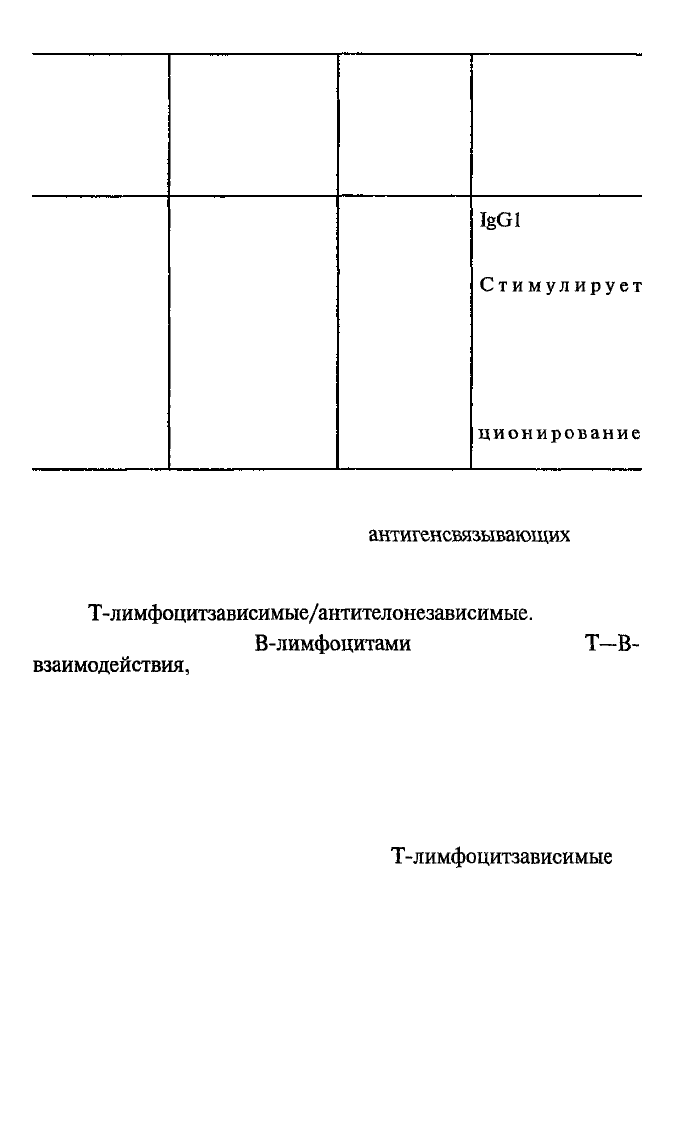
IL-5
IL-10
Клетки
крови —
исполнители
деструкции
Эозинофилы
Макрофаги
Механизмы
деструкции анти-
генов и собствен-
ных клеток и меж-
клеточного мат-
рикса, с которыми
антигены связаны
IgGl
со всеми вы-
текающими по-
следствиями
Стимулирует
эозинофилопоэз в
костном мозге и
активирует эози-
нофилы в перифе-
рических тканях
Ингибирует функ-
ционирование
макрофагов
В соответствии с двумя типами
антигенсвязывающих
рецеп-
торов есть и два типа эффекторных механизмов:
• антителозависимые;
•
Т-лимфоцитзависимые/антителонезависимые.
Выработка антител
В-лимфоцитами
тоже зависит от
Т—В-
взаимодействия,
в этом смысле почти все иммунные реакции
(кроме биосинтеза антител В-лимфоцитами в ответ на тимус-
независимые антигены 1-го типа) можно рассматривать как
Т-лимфоцитзависимые. Но на стадии реализации именно эф-
фекторных механизмов иммунитета разделение их на «анти-
телозависимые» и «Т-лимфоцитзависимые, но антителонеза-
висимые» помогает проще понять конкретные иммунные ре-
акции и процессы.
«По старинке» антителозависимые иммунные реакции на-
зывают гуморальным иммунитетом,
Т-лимфоцитзависимые
—
клеточным иммунитетом.
Деструкцию патогена, т.е. собственно то, что и называют
эффекторной фазой иммунного ответа, надо осуществлять в
тех местах в организме, где он находится — в тканях. Зрелые
неиммунные лимфоциты тропны к периферическим лимфо-
идным органам и тканям и именно и только туда они миг-
рируют по завершении лимфопоэза. Но иммунные лимфоци-
ты имеют уже совсем иные свойства миграции: они нужны в
разных тканях организма, куда проник патоген. Поэтому на
232

мембране иммунных лимфоцитов есть специальные рецепто-
ры, узнающие эндотелий в очагах поражения (воспаления).
Там иммунные Т-лимфоциты останавливаются, претерпевают
экстравазацию и достигают мест локализации поврежденных
патогеном клеток и межклеточного матрикса. Сюда же цито-
кины иммунных Т-лимфоцитов (RANTES и др.) привлекают
из кровотока лейкоциты, которые и будут исполнителями
деструкции патогена. Схема экстравазации лимфоцитов и лей-
коцитов показана на рис. 7.3.
8.1.
Антителозавиеимые
механизмы защиты от патогена
Таких механизмов по крайней мере 6:
• нейтрализация антителами патогенных свойств антигена
самим фактом связывания в комплекс;
• элиминация и деструкция комплексов
антиген—антите-
ло фагоцитами (нейтрофилами и макрофагами);
β деструкция комплексов
антиген—антитело
активирован-
ной системой комплемента;
• антителозависимая клеточная цитотоксичность ΝΚ и
эозинофилов;
• сосудистые и гладкомышечные контрактильные реак-
ции, инициируемые комплексом
антиген—антитело
с
«наймом» тучных клеток и базофилов;
β
реликтовые свойства антител (собственная протеазная
или нуклеазная активность антител).
Сам по себе факт связывания патогена антителом являет-
ся защитным по крайней мере в двух случаях:
• если патоген — сильный яд, антитело при связывании
нейтрализует токсичность;
• если патоген инфекционен (вирус, прион, бактерия), а
антитело, связав его, препятствует инфекции патогена
в клетки тела.
Но и в этих случаях, а тем более во всех остальных, обра-
зование макромолекулярного комплекса
антиген—антитело
это
еще не конец защитной реакции, так как организм не умеет
свободно выводить во внешнюю среду из внутренней макро-
молекулярные комплексы. Их необходимо расщепить до мел-
ких метаболитов. Для этого антитела в составе комплексов
антиген—антитело
«умеют» фиксировать компоненты компле-
мента и активировать его при этом (IgM>IgG3>IgGl). Комп-
лексы
антиген—антитело—компоненты
комплемента в свою
очередь фиксируются на эритроцитах рецепторами для ком-
понентов комплемента, и эритроциты уносят такие комплек-
сы в синусоиды селезенки и печени, где их фагоцитируют и
расщепят макрофаги. Кроме того, комплексы с антителами
233

изотипов
IgGl
и IgG3 прямо через соответствующий FcyRII
на макрофагах и на нейтрофилах будут связаны и фагоцити-
рованы и внутри фагоцитов расщеплены до мелких метабо-
литов.
8.1.1. Fc-рецепторы
Fc-рецепторы
(FcR) — это мембранные молекулы,
'специфи-
чески связывающие иммуноглобулины за их Fc-фрагменты.
Это третий тип иммунорецепторов — плюс к TCR и
BCR.
FcR —
иммунорец&тор
потому, что пусть через посредство
антитела, но клетка — носитель FcR способна связать анти-
ген и прореагировать в ответ на антиген. FcR есть как на
лимфоцитах, так и на всех известных лейкоцитах, и FcR —
та молекулярная материя, посредством которой факторы лим-
фоцитарного иммунитета (антитела) «нанимают» лейкоциты
на деструкцию и элиминацию распознанного антителами ан-
тигена.
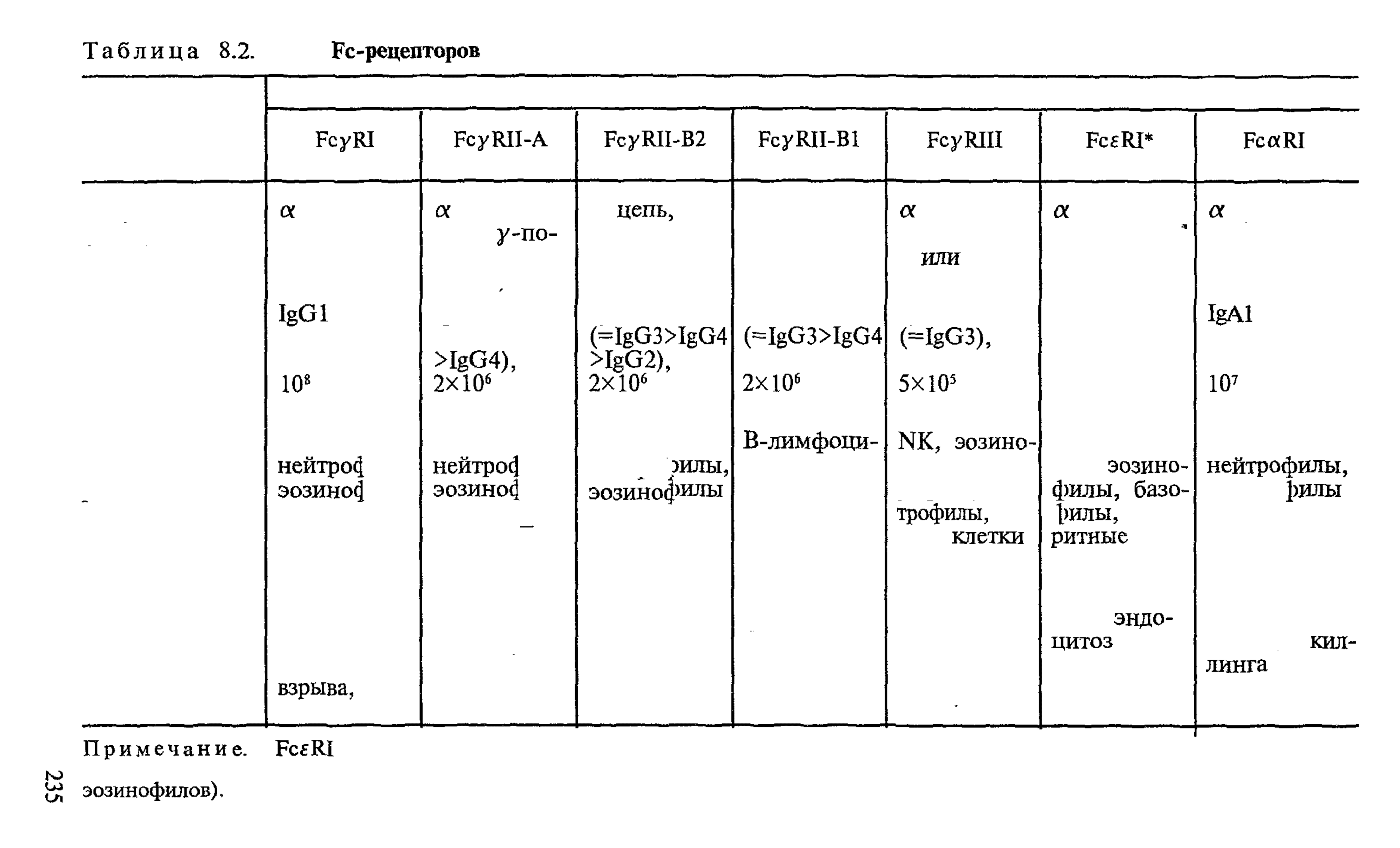
Рассмотрим номенклатуру FcR. Аббревиатура обычно содер-
жит 3, 4 или 5 «компонентов»: Fc — (у, ε,
α,
μ) — (I, II,
III) — (А, В) — (1, 2, 3, ...). «Fc» означает, что лиганд для
связывания — константный фрагмент («хвост») молекулы им-
муноглобулина. Греческая буква обозначает связываемый тип
тяжелой цепи, т.е. изотип иммуноглобулина. Каждый FcR спе-
циализирован по какому-то одному изотипу тяжелой цепи
молекулы иммуноглобулинов. Римская цифра I, II или III
обозначает тип рецептора, типы различаются по аффинности
связи с лигандом. «I» обозначает
высокоаффинные
рецепто-
ры, способные связывать свободные антитела, а не уже ком-
плексы
антиген—антитело.
Такие рецепторы известны только
для
IgE.
По этой причине еще «довоенные» физиологи назы-
вали реагины (тогда эти антитела еще не были идентифици-
рованы как иммуноглобулины класса Е) гомоцитотропнъши
антителами. «И» и «III» обозначают низкоаффинные рецепто-
ры. Это в свою очередь значит, что такие рецепторы не свя-
зывают свободные молекулы иммуноглобулинов, но связыва-
ют только комплексы
антиген—антитело
за Fc-фрагмент им-
муноглобулина. Заглавная латинская буква А, В, С обозначает
тот или иной функциональный вариант FcR. Мы уже писали
в разделе об активации лимфоцитов (6.2.3), что последствия
связывания разных FcR с лигандами различные — активация
или ингибиция функций определенной клетки. Арабская циф-
ра или иные обозначения после латинской заглавной буквы
обозначают генетическую изоформу конкретной молекулы FcR
(либо существует более одного гомологичного гена, либо
имеет место альтернативный сплайсинг первичного
транс-
крипта РНК).
В табл. 8.2 приведена характеристика известных типов FcR.
234
Типы
Свойства
Структура
(цепи, мол.
масса х 1000)
Изотип связы-
ваемого имму-
ноглобулина,
константа дис-
социации
На каких клет-
ках экспресси-
рован
Биологические
эффекты при
связывании
Тип
FcyRI
(CD64)
а
(72 000)
У
IgGl
(=IgG3>
IgG4>IgG2),
10
s
Μ"
1
Макрофаги,
нейтро^
эозинов
)ИЛЫ,
)ИЛЫ,
дендритные
клетки
Стимуляция
эндоцитоза,
фагоцитоза,
дыхательного
взрыва,
кил-
линга
FcyRII-A
(CD32)
а
(40 000)
(есть
у-по-
добный
домен)
IgGl
(>IgG3=IgG2
>IgG4),
2хЮ
6
Μ"
1
Макрофаги,
нейтрос|
эозинов
)ИЛЫ,
)ИЛЫ,
тромбоциты,
клетки Лан-
герганса
Стимуляция
эндоцитоза,
дегрануляция
эозинофилов
FcyRII-B2
(CD32)
1 цепь,
содержит
ITIM
IgGl
(=IgG3>IgG4
>IgG2),
2Х10
6
Μ'
1
Макрофаги,
нейтрос]
эозино^
эилы,
)ИЛЫ
Поглощение
рецептора и
ингибиция
стимуляции
FcyRII-Bl
(CD32)
1 цепь,
содержит
ITIM
IgGl
(-IgG3>IgG4
>IgG2),
2Х10
6
Μ"
1
В-лимфоци-
ты, тучные
клетки
Ингибиция
стимуляции
без погло-
щения ре-
цептора
FcyRIII
(CD16)
or
(50 000
или 70 000);
у
или
ζ
IgGl
(=IgG3),
5Х10
5
Μ'
1
ΝΚ
?
эозино-
филы, мак-
рофаги, ней-
трофилы,
туч-
ные
клеахи
Стимуляция
киллерной
активности
ΝΚ
FcfRI*
а
(45 000)
β (33 000)
ч
У (9000)
IgE
10
10
М-
1
Тучные клет-
ки,
эозино-
с
•
)илы,
базо-
)илы,
денд-
ритные
клет-
ки
Дегрануля-
ция,
эндо-
цитоз
FcaRI
(CD89)
а
(55 000-
75 000)
У (9000)
IgAl
(=IgA2),
ΙΟ
7
Μ"
1
Макрофаги,
нейтро^
ЭОЗИНО(
эилы,
)ИЛЫ
Поглощение
рецептора и
индукция
кил-
линга
Примечание.
*
FcfRI
— это высокоаффинный рецептор для IgE, он связывает свободные антитела класса Е. Известно еще
несколько низкоаффинных рецепторов для IgE (они описаны в разделах, посвященных эффекторным реакциям с участием
эозинофилов),
8.1.2. Антителозависимая клеточная
цитотоксичность
Если антиген как целое (как мишень) — это клетка, то ан-
титела, но только класса G, привлекут своим FC-XBOCTOM
NK,
имеющих для этого соответствующий FcyRIII. Возникнет ком-
плекс
клетка-мишень
— антитело — NK, в котором NK ре-
ализует свою киллерную функцию в отношении клетки-ми-
шени. Это и называют
АЗКЦТ
— антителозависимой клеточ-
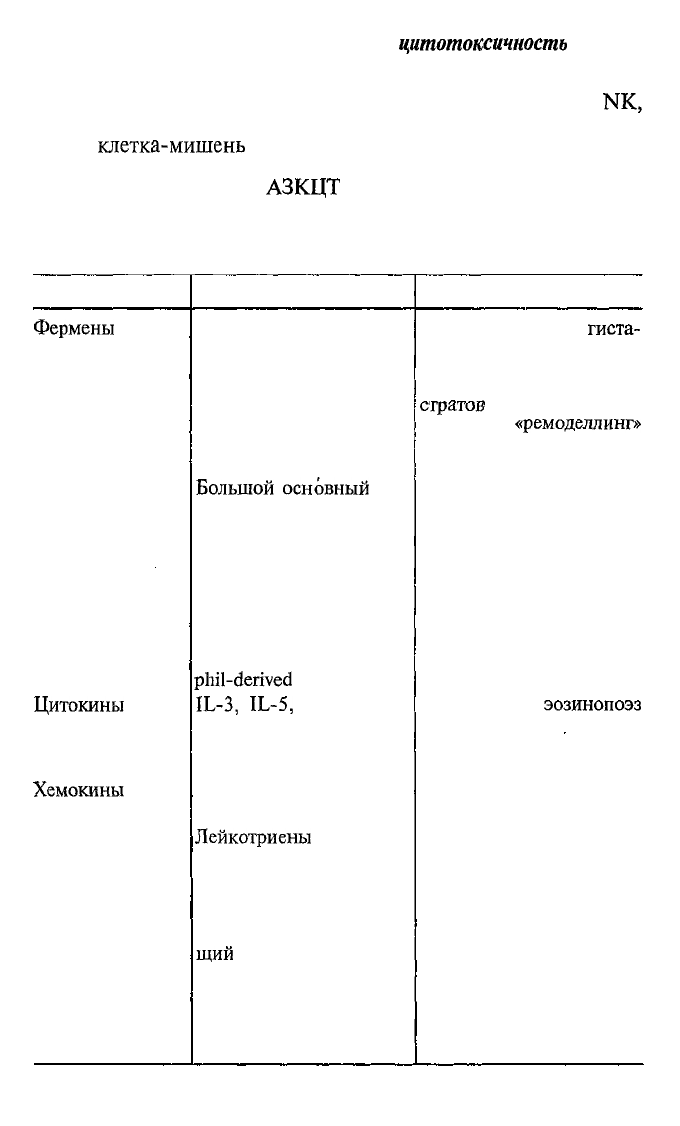
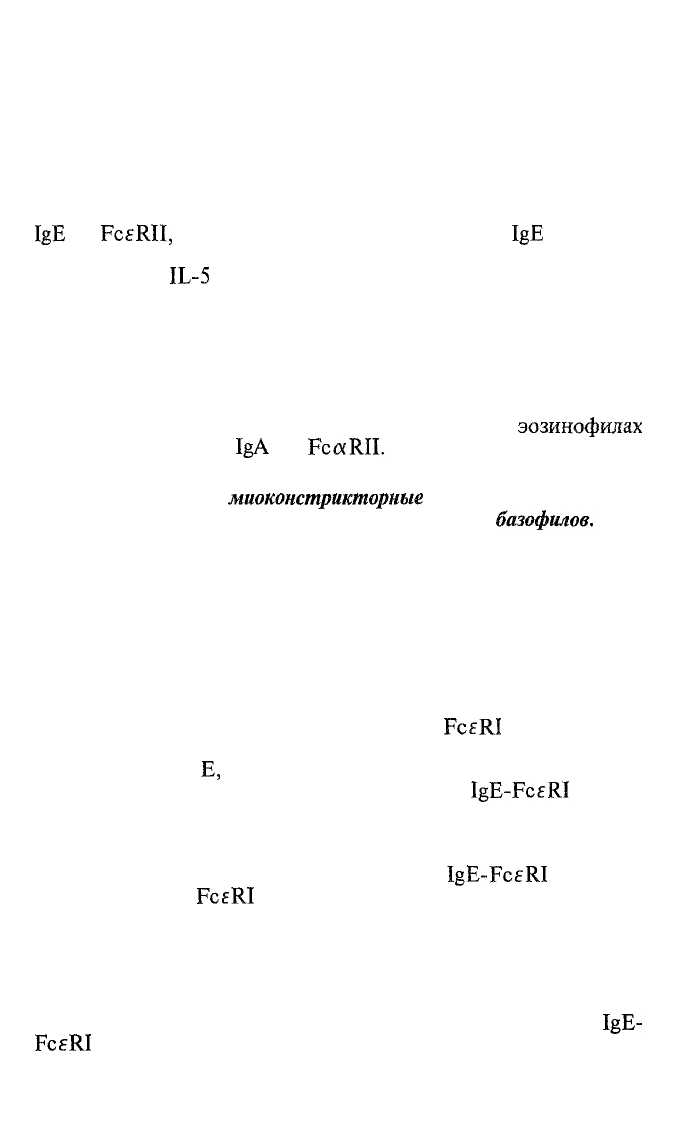
Таблица 8.3. Биологически активные продукты эозинофилов
Тип продукта
Фермены
Токсичные
протеины
Цитокины
Хемокины
Липидные
медиаторы
Конкретные продукты
Эозинофильная
пероксидаза
Эозинофильная
коллагеназа
Большой
основный
протеин (МБР — major
basic protein)
Эозинофильный
катионный протеин
(ЕСР — eosinophil
cationic protein)
Нейротоксин эозино-
филов (ENT — eosino-
phil-derived
neurotoxin)
IL-3,
IL-5,
GM-CSF
IL-8
Лейкотриены
C4 и D4
Тромбоцитактивирую-
щий
фактор (PAF —
platelet-activating factor)
Биологические эффекты
Вызывает выброс
гиста-
мина из тучных клеток;
токсична за счет катали-
за галогенизации суб-
/-ν
|'|\
Q
Т*-ЧТ1
OlJpa-lDJti
Вызывает
«ремоделлинг»
межклеточного вещества
соединительной ткани
Токсичен для гельминтов
и собственных клеток,
вызывает выброс гиста-
мина из тучных клеток
Токсичен для гельминтов
и нейронов
Токсичен для нейронов
Стимулируют
эозинопоэз
в костном мозге; активи-
руют эозинофилы на пе-
риферии
Обеспечивает инфлюкс
лейкоцитов в очаг
Сокращают гладкие
мышцы; повышают про-
ницаемость сосудов, уси-
ливают секрецию слизи
Усиливает продукцию
липидных медиаторов;
активирует нейтрофилы,
эозинофилы и тромбо-
циты; является хемоат-
трактантом для лейкоци-
тов
236
ной цитотоксичностью (по английски ADCC). Механизм соб-
ственно киллерного действия NK на клетку-мишень такой же,
как и киллерный механизм ЦТЛ (порообразование перфори-
ном и индукция апоптоза), и мы опишем его в разделе 8.2.1.
Если патоген — гельминт, уже проникший во внутреннюю
среду, то единственный известный на сегодня механизм са-
нации от гельминтов — это АЗКЦТ, в которой антитела —
класса Ε или А, а клетки-эффекторы — эозинофилы. На эози-
нофилах есть специальные низкоаффинные рецепторы для
IgE
—
FcfRII,
способные связывать комплексы
IgE
с антиге-
нами. Связывание такого комплекса в сочетании с сигналом
от цитокина
IL-5
активирует эозинофил к синтезу и секре-
ции высокотоксичных протеинов, способных убить гельминта.
Активированный эозинофил секретирует ряд биологически
активных продуктов, свойства которых объясняют симптома-
тику так называемых эозинофильных воспалительных процес-
сов (табл. 8.3).
Привлечь эозинофилы в очаг могут комплексы антигенов
с антителами не только класса Е, но и А: на
эозинофилах
есть рецепторы для
IgA
—
FcaRII.
8.1.3. Сосудистые и
миоконстрикторные
реакции,
опосредованные медиаторами тучных клеток и
базофилов.
Гиперчувствительность немедленного типа
Антитела привлекают «к работе» и базофилы, и тучные клет-
ки. На базофилах и тучных клетках есть несколько разных
типов рецепторов для FC-XBOCTOB молекул иммуноглобулинов.
Рецептор FcyRIIB, связывающий иммунные комплексы
антигенов с антителами класса G, является негативным ко-
рецептором, сигнал с которого ингибирует биосинтезы актив-
ных продуктов и дегрануляцию тучных клеток. Активирующим
тучные клетки является иммунорецептор
FCERI
— высокоаф-
финный рецептор для IgE, способный связывать свободные
антитела класса
Е,
до того как они свяжут свой антиген в
комплекс. Таким образом тучные клетки с
IgE-FcfRI
на по-
верхности и с депонированными внутри гранулами биологи-
чески активных веществ находятся «на низком старте» и го-
товы в считанные секунды — минуты выбросить содержимое
гранул в ответ на поступивший на их
IgE-FceRI
антиген.
Точно такой же
FCERI
экспрессирован на базофилах. Гранулы
базофилов содержат такие же биологически активные веще-
ства (по крайней мере основные из известных), что и туч-
ные клетки. Тучные клетки локализованы в соединительной
ткани lamina propria слизистых оболочек, в подкожной соеди-
нительной ткани и соединительной ткани по ходу всех кро-
веносных сосудов, т.е. «подстилают» барьеры. Благодаря
IgE-
FcfRI
они готовы немедленно выбросить биологически актив-
237

ные вещества из своих гранул и тем самым обеспечить не-
медленные сосудистые реакции защитного назначения в ба-
рьерных тканях: гистамин из тучных клеток вызывает локаль-
ное расширение сосудов, повышение их проницаемости, что
способствует отеку ткани и, следовательно, служит попыткой
тампонировать антиген в очаге, не пустить его в системную
циркуляцию.
Кроме того, гистамин, а также лейкотриен D4 и проста-
гландины из тучных клеток вызывают интенсивное сокраще-
ние гладких мышц. Защитный характер этой реакции можно
проиллюстрировать на примере энтеральной инфекции гель-
минтом Heligmosomoides polygyrus на модели на мышах. Орга-
низм нормальных мышей санируется от этого гельминта пу-
тем иммунного ответа с преимущественной дифференциров-
кой Th2 и выработкой антител класса Е. Эти антитела фик-
сируются на тучных клетках слизистой оболочки кишки, в
полости которой обитает гельминт. Антигены гельминта вы-
зывают активацию и дегрануляцию тучных клеток, медиато-
ры которых обеспечивают интенсивную перистальтику, в ре-
зультате чего гельминт выбрасывается из полости кишки на-
ружу. Такая санация не осуществляется при эксперименталь-
ном заражении мутантных или модельных мышей, имеющих
генетические или эпигенетические дефекты в любом из пе-
речисленных выше компонентов защитной реакции [мыши с
тяжелым комбинированным иммунодефицитом — SCID;
мыши с мутацией w/wv, дефицитные по тучным клеткам;
мыши, обработанные антителами к
c-kit
(рецептор для фак-
тора роста клеток-предшественников тучных клеток); мыши
с knock-out по гену липооксигеназы (следовательно, дефицит-
ные по лейкотриенам)].
Медиаторы тучных клеток — биологически активные ве-
щества — делят на 3 группы, которые различаются по сро-
кам выброса из активированной тучной клетки и по предназ-
начению, и биохимическому классу молекул. Одна группа —
медиаторы, депонируемые в гранулах тучных клеток. Они пер-
выми выбрасываются из клетки по сигналу на дегрануляцию.
В составе гранул находятся так называемые вазоактивные ами-
ны (у человека это гистамин, у лабораторных грызунов —
серотонин), а также гепарин, ферменты
(триптаза,
химаза,
катепсин G, карбоксипептидаза) и цитокин TNF-α. Вторая
группа медиаторов вступает в процесс через несколько
чадов
от начала реакции, это липидные медиаторы (лейкотриены,
простагландины, PAF). Третья группа — цитокины
(IL-4,
IL-
13,
IL-3,
IL-5,
GM-CSF). Основные биологические эффекты
медиаторов тучных клеток приведены в табл. 8.4.
Тучные клетки — неоднородная популяция. Выделяют по
крайней мере две их тканевые разновидности. Одна разновид-
ность локализована в слизистой оболочке ЖКТ, их называют
238
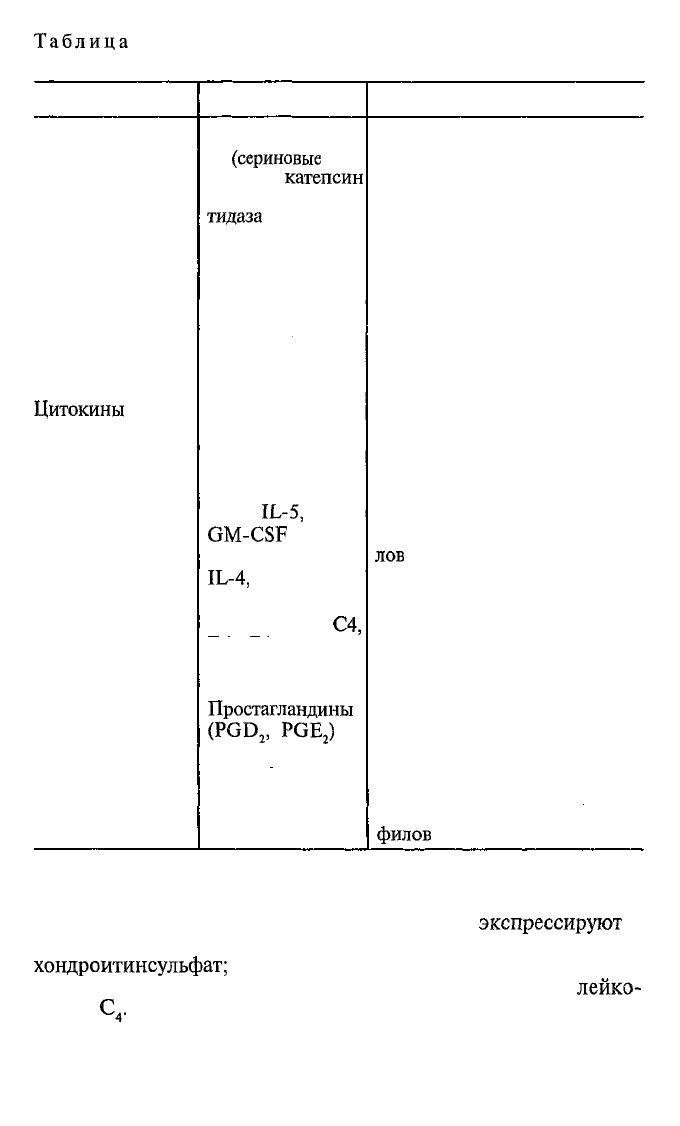
Таблица
8.4. Медиаторы тучных клеток и базофилов и их био-
логические эффекты
Тип медиатора
Ферменты
Вазоактивные
амины
Протеогликаны
Цитокины
Липидные
медиаторы
Примеры
Триптаза и хима-
за
(сериновые
про-
теазы),
катепсин
G, карбоксипеп-
тидаза
Гистамин
(у человека);
серотонин
(у грызунов)
Гепарин, хондро-
итинсульфат
TNF-α
IL-3,
IL-5,
GM-CSF
IL-4,
IL-13
Лейкотриены
С4,
D4, Е4
Простагландины
(PGD
2
,
PGE
2
)
PAF (platelet-acti-
vating factor) —
фактор активации
тромбоцитов
Биологические эффекты
Ремоделлинг матриксного ве-
щества соединительной ткани
Расширение сосудов и повы-
шение проницаемости; сокра-
щение гладких мышц; токсич-
ны для гельминтов
Связывают и удерживают
ионными силами положитель-
но заряженные молекулы био-
генных аминов
Провоспалительное действие:
активирует эндотелий и коа-
гуляцию крови, стимулирует
выработку цитокинов другими
клетками в очаге воспаления
Стимулируют дифференци-
ровку и активацию эозинофи-
лов
Стимулируют дифференци-
ровку субпопуляции Th2
Пролонгированное сокраще-
ние гладких мышц, повыше-
ние проницаемости сосудов,
стимуляция секреции слизи
Усиливает продукцию липид-
ных медиаторов; хемоаттрак-
тант и активатор для тромбо-
цитов, нейтрофилов, эозино-
филов
тучными клетками слизистой оболочки (mucosal mast cells). Их
отличает ряд свойств: из сериновых протеаз
экспрессируют
и
триптазу, и химазу, из протеогликанов в них преобладает
хондроитинсульфат;
секретируют минимум гистамина; из ме-
таболитов арахидоновой кислоты в них преобладает
лейко-
триен
С
4
.
Вторая тканевая разновидность тучных клеток — те, что
локализованы в серозных оболочках полостей тела и в легких.
239
Их называют тучными клетками соединительной ткани
(connective tissue mast cells). Они отличаются по следующим
свойствам: из сериновых протеаз экспрессируется преимуще-
ственно триптаза, из протеогликанов — гепарин, секретиру-
ют много
гистамина,
из метаболитов арахидоновой кислоты
в них преобладает
PGD
2
.
Тучные клетки слизистых оболочек отсутствуют у бестимус-
ных мышей nude. По-видимому, дифференцировка таких кле-
ток зависит от Т-лимфоцитов, а именно от местной стиму-
ляции клеток-предшественников цитокином IL-3. Дифферен-
цировку клеток-предшественников в соединительнотканный
фенотип тучных клеток стимулируют фибробласты.
Как соотносятся в плане дифференцировочного «родства»
тучные клетки и базофилы, сказать трудно. У них одинако-
вые существенные функциональные признаки, такие как на-
личие на мембране высокоаффинного рецептора для
IgE
(FcfRI),
и одинаковый список биологически активных меди-
аторов. Но базофилы циркулируют в крови и мигрируют в
ткани только в очаг воспаления (как нейтрофилы). На базо-
филах экспрессированы молекулы адгезии, важные для homing
в очаг:
LFA-1
(CDlla/CD18),
Мас-1
(CDllb/CD18), CD44.
Тучные клетки — тканевая форма, их никто не видел цирку-
лирующими в крови. Вероятно, что тучные клетки дифферен-
цируются из своей собственной клетки-предшественницы,
коммитируемой к данной дифференцировке на уровне СКК.
Известно, например, что для предшественников тучных кле-
ток специфическим фактором роста является c-kit-лиганд. Про
базофилы известно, что они имеют общую клетку-предше-
ственницу с эозинофилами, следовательно, дифференциров-
ка эозинофилов и базофилов альтернативна.
Тучные клетки и базофилы активируются следующими
сигналами:
• гомотипной агрегацией
FCERI
(комплексом IgE с анти-
геном или антителами к рецептору);
• активированными компонентами комплемента — анафи-
лотоксинами
С5а»С4а>СЗа;
• медиаторами из активированных нейтрофилов;
• нейротрансмиттерами (норадреналином, субстанцией Р).
Действие гистамина. На разных клетках есть различные ре-
цепторы для гистамина —
Н
р
Н
2
и
Н,.
На клетках эндотелия
сосудов экспрессированы рецепторы
Н
г
Вазоактивные эффек-
ты гистамина состоят в следующем: эндотелиальные клетки
претерпевают констрикцию, и плазма выходит из сосуда в
ткани; гистамин стимулирует синтез в клетках эндотелия про-
стациклина и радикала окиси азота (NO·), которые вызыва-
ют расслабление гладких мышц сосудистой стенки и, следо-
вательно, вазодилатацию. Если процесс происходит в коже,
240
