Горохов А.А. Общая химия: Курс лекций
Подождите немного. Документ загружается.

141
+
+=− Н4Ое4ОН2
2
_
2
Метод электролиза используют для рафинирования (очистки) металлов:
меди, серебра, золота, свинца, олова и др. Рассмотрим, например,
рафинирование черного никеля, содержащего примеси цинка и меди, и
служащего анодом в электролизере. На аноде в первую очередь растворяется
металл с наиболее отрицательным потенциалом, так как
0
Cu/
2
Cu
0
Ni/
2
Ni
0
Zn/
2
Zn
EEЕ
+++
<< , то первым растворяется цинк:
+
=
−
2
_
Zne2Zn ,
а затем основной металл – никель:
+
=
−
2
_
Nie2Ni
Примесь меди, имеющая более положительный потенциал, не
растворяется и выпадает в осадок (шлам) в виде частиц металла. В растворе
окажутся ионы Zn
2+
и Ni
2+
, причем
++
<
2
Ni
2
Zn
CС , так как цинк является
примесью.
На катоде в первую очередь осаждается металл с наиболее
положительным потенциалом, т. е. никель, так как
0
Zn/
2
Zn
0
Ni/
2
Ni
EE
++
> . Поэтому на
катоде осаждается чистый никель.
Таким образом, в результате рафинирования никель осаждается на
катоде, медь – в шлам, а цинк переходит в раствор.
Электролизом расплавов соединений получают алюминий, магний,
натрий, литий, бериллий, кальций, а также сплавы некоторых металлов.
К наиболее крупномасштабному электролитическому процессу в
химической промышленности относится электролиз раствора NaCl с
получением газообразных хлора на аноде, водорода на катоде и раствора
щелочи в катодном пространстве. Кроме того, электролизом получают фтор из
расплава смеси HF и NaF, водород и кислород из воды (для снижения
омических потерь электролиз ведут в растворе NaOH), диоксид марганца из
142
раствора MnSO
4
, окислители: пероксид водорода, перманганат калия,
гипохлорит, хлораты, хроматы и т. п., некоторые органические вещества.
Катодное осаждение металлов играет большую роль и в технологии
гальванотехники. Гальванотехника включает гальваностегию (нанесение
покрытий толщиной 5-50 мкм, прочно сцепленных с основой) и
гальванопластику (получение сравнительно толстых, легко отделяющихся
слоев). Гальваностегию используют для защиты изделий от коррозии,
повышения их износостойкости, придания им способности отражать свет,
электропроводности и других свойств, а также для декоративной отделки.
Гальванопластика позволяет получать копии, воспроизводящие мельчайшие
подробности рисунка или рельефа поверхности.
Новая отрасль техники – хемотроника – занимается созданием
электрохимических преобразователей информации, которые применяют в
качестве датчиков сейсмических колебаний земли, усилителей, выпрямителей,
генераторов колебаний тока и напряжения, запоминающих, интегрирующих и
других элементов информационно-вычислительных комплексов.
143
17 Коррозия металлов
Введение.
Классификация и механизм коррозионных процессов.
Типы коррозионных разрушений.
Количественная характеристика коррозионных процессов.
Электрохимическая коррозия в различных средах.
Методы защиты.
Коррозия металлов – разрушение металлов вследствие физико-
химического воздействия внешней среды; при этом металл переходит в
окисленное (ионное) состояние и теряет присущие ему свойства. Примерно
около 15% ежегодно производимого металла расходуется на покрытие
безвозвратных потерь вследствие коррозии и последующего распыления.
Ущерб от коррозии связан не только с потерей больших количеств металла, но
и с порчей или выходом из строя самих металлических конструкций. Велики
также затраты на защитные антикоррозионные мероприятия.
Металлическое состояние для большинства металлов является
термодинамически неустойчивым. Стремление металлов переходить из
металлического состояния в ионное весьма различно для разных металлов и
может быть охарактеризовано по уменьшению свободной энергии при
протекании соответствующей коррозионной реакции в данных условиях. Такую
характеристику в отношении коррозии металлов в растворах можно
приближенно получить на основании величины стандартного
электрохимического потенциала металлов:
I группа. Металлы повышенной термодинамической нестабильности;
могут корродировать даже в нейтральных водных средах, не содержащих
кислорода и окислителей (щелочные и щелочно-земельные металлы, Am, Th,
Np, Be, Hf, Zr и др.).
144
II группа. Металлы термодинамически нестабильные; устойчивы в
нейтральных средах при отсутствии кислорода; в кислых средах могут
корродировать и в отсутствии кислорода (Cd, In, Tl, Mn, Co, Ni, Mo, Pb, Sn).
III группа. Металлы промежуточной термодинамической стабильности
(полублагородные); в отсутствии О
2
и окислителей устойчивы в кислых и
нейтральных средах (Bi, Sb, As, Cu, Hg, Ag).
IV группа. Металлы высокой термодинамической стабильности
(благородные); в нейтральных средах не корродируют и при наличии
кислорода; в кислых средах или средах, содержащих комплексообразователи,
могут корродировать при наличии кислорода или окислителей (Pd, Ir, Pt, Au).
По механизму коррозионного процесса различают два основных типа
коррозии: химическую и электрохимическую.
Под химической коррозией подразумевают взаимодействие
металлической поверхности с окружающей средой, не сопровождающиеся
возникновением электродных процессов на границе раздела фаз. Механизм
химической коррозии сводится к реактивной диффузии атомов или ионов
металла сквозь постепенно утолщающуюся пленку продуктов коррозии и
встречной диффузии атомов и ионов кислорода. По современным воззрениям
этот процесс имеет ионно-электронный механизм, аналогичный процессам
электропроводности в ионных кристаллах. Примером химической коррозии
является взаимодействие металла с жидкими неэлектролитами или сухими
газами в условиях, когда влага на поверхности металла не конденсируется, а
также воздействие на металл жидких металлических расплавов. Практически
наиболее важным видом химической коррозии является взаимодействие
металла при высоких температурах с кислородом и другими газообразными
активными средами (H
2
S, SO
2
, галогены, водяные пары, СО
2
и др.).
Подобные процессы химической коррозии металлов при повышенных
температурах носят название газовой коррозии. Многие ответственные
детали инженерных конструкций сильно разрушаются от газовой коррозии
(лопатки газовых турбин, сопла реактивных двигателей, элементы
145
электродвигателей, арматура печей и т. д.). Большие потери от газовой
коррозии (угар металла) несет металлургическая промышленность.
Стойкость против газовой коррозии повышается при введении в состав
сплава различных добавок (хрома, алюминия, кремния и др.). Например,
сталь содержащая 25 % Cr, 20 % Ni, 1 % Mn, 0,15 % C и 1,0 Si является
жаростойкой (до 950
0
С), а при наличии в стали 30 % Cr и 4-5 % Al она
выдерживает температуру до 1150
0
С. Для защиты железных и стальных
изделий от газовой коррозии поверхность изделия покрывают алюминием
(алитирование).
Под электрохимической коррозией подразумевают процессы
взаимодействия металлов с электролитами (в виде водных растворов, реже с
неводными электролитами, например с органическими электропроводными
соединениями или безводными расплавами солей при повышенных
температурах). Процессы электрохимической коррозии протекают по законам
электрохимической кинетики, когда общая реакция взаимодействия может
быть разделена на самостоятельные электродные процессы: а) анодный процесс
– переход металла в раствор в виде ионов с оставлением эквивалентного
количества электронов в металле; б) катодный процесс – ассимиляция
появившихся в металле избыточных электронов какими-либо
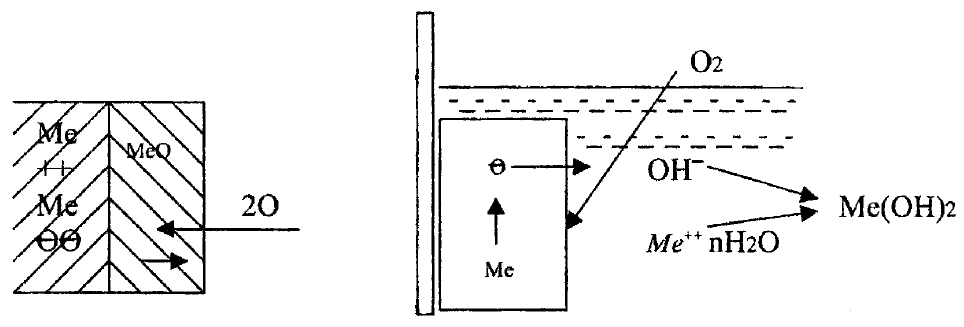
деполяризаторами. На рисунке 6 приведена схема химического (А) и
электрохимического (Б) коррозионного процесса.
А Б
Рисунок 6 – Схема химического (А) и электрохимического (Б)
окисления металлов
146
При равномерном распределении коррозионных разрушений по всей
поверхности металла коррозию называют равномерной; если же значительная
часть поверхности металла свободна от коррозии и последняя сосредоточена на
отдельных участках, то ее называют местной. Наиболее часто встречающиеся в
практике типы местной коррозии описаны ниже.
Язвенная точечная, или питтинговая, коррозия. Основной причиной
подобного коррозионного разрушения является работа коррозионных пар, у
которых катодами являются участки поверхности, находящиеся в пассивном
состоянии, а анодами – участки поверхности в активном состоянии. Этот вид
коррозии особенно опасен для конструкций, где важно сохранение
герметичности или непроницаемости, например, аппараты, емкости,
трубопроводы и т. д. Развитию точечной коррозии благоприятствует
одновременное присутствие в растворе пассиваторов (кислород, окислители) и
сильных активаторов (ионы хлора, брома или йода).
Щелевая коррозия. Причиной развития такой коррозии является
преимущественно анодная работа частично экранированной поверхности
металла по отношению к открытой поверхности металла, играющей роль
катода; коррозионному разрушению в основном подвергается участок
конструкции, находящийся в зазоре (щели), или участок каким-то образом
частично экранированный от внешней среды.
Контактная коррозия – разновидность электрохимической местной
коррозии, когда преимущественно разрушается участок конструкции,
изготовленный из материала, имеющего более отрицательный стационарный
электрохимический потенциал.
Межкристаллическая коррозия. В этом случае коррозионное разрушение
локализуется по границам зерен структуры сплава.
Коррозионное растрескивание возникает при одновременном
воздействии на металл агрессивной среды и механических напряжений. В
металле возникают трещины, приводящие к полному разрушению изделия.
Последние два вида коррозионного разрушения наиболее опасны для

147
конструкций, несущих механические нагрузки (мосты, тросы, рессоры, оси,
автоклавы, паровые котлы и т. д.).
При относительно равномерном типе коррозионного разрушения
скорость коррозии может быть выражена весовым показателем коррозии (К),
равным весу металла (в граммах), превращенного в продукты коррозии за
единицу времени (час или сутки) с единицы его поверхности (м
2
или дм
2
).
Иногда скорость коррозии выражают глубинным показателем коррозии (П), т.
е. средним проникновением коррозионного разрушения в металл (в
миллиметрах) за единицу времени (1 год). Пересчет скорости коррозии от
весового показателя (К) в глубинный (П) или обратно производится по
формуле:
К
76,8
П ⋅
γ
=
, (53)
где
γ
- плотность металла;
К – весовой показатель коррозии, г/м
2
.
ч;
П – глубинный показатель коррозии, мм/год.
Скорости межкристаллитной коррозии, а также коррозионного
растрескивания могут быть количественно оценены механическим показателем
коррозии, например по потери прочности металла за определенное время.
Применяют также и другие приемы для количественной характеристики общей
или местной коррозии (например, измерение возрастания
электросопротивления образцов и некоторых др.).
Различают следующие типы электрохимической коррозии, имеющие
наиболее важное практическое значение.
Коррозия в электролитах. В зависимости от характера среды различают
кислотную, щелочную, солевую и морскую коррозию. По условиям
воздействия жидкой среды на металл этот тип коррозии также характеризуется
как коррозия при полном погружении, при неполном погружении, при
переменном погружении.
148
Почвенная (грунтовая, подземная) коррозия – воздействие на металл
грунта, который в коррозионном отношении должен рассматриваться как
своеобразный дисперсно-пористый, иногда коллоидный электролит.
Характерной особенностью подземной электрохимической коррозии является
большое различие в скорости доставки кислорода (основной деполяризатор) к
поверхности подземных конструкций в разных почвах (в десятки тысяч раз).
Значительную роль при коррозии в почве играют образование и
функционирование микрокоррозионных пар вследствие неравномерной
аэрации отдельных участков, а также наличие в земле блуждающих токов.
Атмосферная коррозия – это коррозия в реальной земной атмосфере. Для
нее характерны все типы коррозионного разрушения металлов (равномерная
коррозия, питтинговая, межкристаллитная и др.). Если влажность воздуха ниже
70%, атмосферная коррозия развивается как низкотемпературное окисление и
быстро затухает вследствие пассивации металла. При влажности выше 70% на
металлах возникают адсорбционные полимолекулярные пленки воды,
благоприятствующие развитию атмосферной коррозии по законам
электрохимической кинетики. При образовании на металлах капельно-жидких
пленок воды (осадки, конденсация водяных паров и т. п.) атмосферная коррозия
подчиняется закономерностям электрохимической коррозии металлов в объемах
электролитов.
Скорость атмосферной коррозии зависит от климатических условий и
состава атмосферы и увеличивается с ростом загрязнения атмосферы
промышленными газами, аэрозолями солей и кислот.
Одним из наиболее широко известных процессов является ржавление
железа. В электрохимическом отношении железо представляет собой
электроотрицательный элемент по сравнению с водородом, кислородом и
другими составляющими атмосферы. Поэтому оно обладает свойствами анода
по отношению к другим точкам катодного характера на поверхности металла.
Если вы внимательно осмотрите лопату, простоявшую некоторое время
на открытом влажном воздухе с налипшей на лезвии грязью, то можно
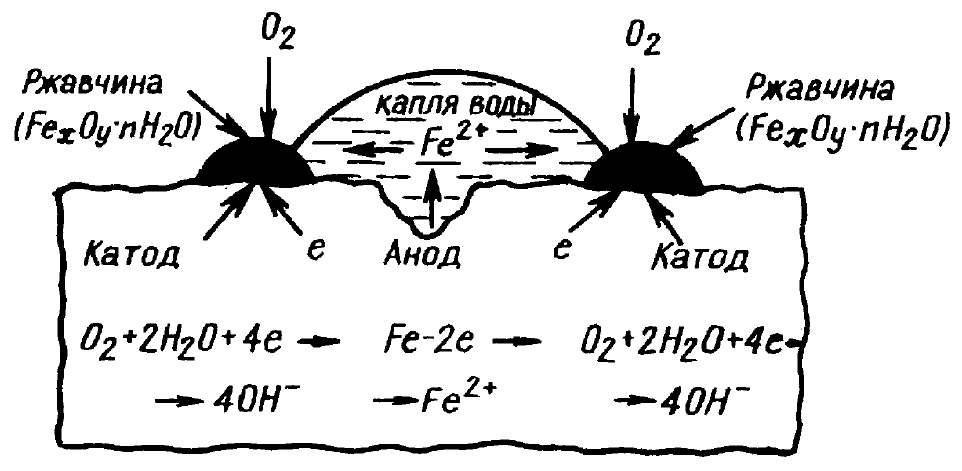
149
заметить, что под грязью на поверхности металла образовались углубления, а
ржавчина появилась повсюду, куда мог проникнуть кислород (О
2
), т. е. на
поверхности, которая лучше всего обеспечена притоком О
2
. Процесс коррозии
очень наглядно иллюстрируется рисунком 7.
Рисунок 7 – Схема коррозии стали при контакте с водой
(атмосферная коррозия)
Наличие мест анодного и катодного характера на поверхности стали
приводит к созданию на ней двух неодинаковых химических окружений. Они
могут возникнуть вследствие наличия примесей или дефектов кристаллической
решетки (по-видимому, обусловленных напряжениями внутри металла).
Сверхчистое железо, в котором количество подобных дефектов сведено к
минимуму, намного меньше корродирует по сравнению с обычным железом
(знаменитая колонна в Дели – высота 7 м, масса 6 т – изготовленная в 415 г. н.
э. не подверглась коррозии до настоящего времени).
Биокоррозия вызывается микро- и макроорганизмами, а также
продуктами их жизнедеятельности, в частности промежуточными и конечными
продуктами биохимических реакций (органические кислоты; NH
3
, H
2
S и др.). В
атмосферных условиях биокоррозию металлов, покрытых лаками, красками
или контактирующих с пластмассами, резиной, кожей, текстилем,
нефтепродуктами и т. д. вызывают плесневые грибки и бактерии, в подземных
150
условиях – чаще всего сульфатвосстанавливающие бактерии, в морских –
различные морские обитатели и бактерии. Для защиты от биокоррозии
используют контактные и летучие фунгициды.
Защита от коррозии осуществляется следующими основными методами:
1) создание условий для образования на поверхности металла при
взаимодействии с агрессивной средой защитных слоев (оксидов, солей),
обеспечивающих пассивность металлов. Формирование таких слоев
достигается легированием металла, введением в среду пассиваторов и
ингибиторов коррозии или с помощью анодной электрохимической защиты.
Защитные слои могут образовываться также при адсорбции органических
ингибиторов из среды;
2) нанесением лакокрасочных, эмалевых, пластмассовых и др. защитных
покрытий на поверхность металлических изделий;
3) понижением содержания в среде веществ, вызывающих или
ускоряющих коррозию, путем специальной очистки или введением добавок,
реагирующих со стимуляторами коррозии;
4) электрохимической защитой;
5) гомогенизирующей термической обработкой металлов и сплавов с
целью получения возможно более однородной структуры;
6) рациональным конструированием, исключающим наличие или
сокращающим число и размеры особо опасных с точки зрения коррозии зон в
изделиях и конструкциях (щелей, сварных швов, застойных участков,
контактов разнородных металлов и др.) или обеспечивающим усиленную
защиту таких зон;
7) повышением термодинамической стабильности системы металл-среда,
например, использованием благородных и полублагородных металлов,
подбором равновесного состава газовых атмосфер, в которых производится
обработка металлов и т. д.
Часто используются комбинированные методы защиты.
