Герасименко В.Г., Герасименко М.О., Цвіліховський М.І. та ін. Біотехнологія
Подождите немного. Документ загружается.

ЧастинаI.Заальнабіотехнолоія
20
Швидкість розмноження клітин і репродукція вірусних
частин прямо пропорційно відбиваються на збільшенні біомаси
і утворенні метаболітів.
Активність і стабільність перебування біооб’єктів в актив
ному стані — найважливіші показники їх придатності для три
валого використання в біотехнології.
Головною ланкою біотехнологічного процесу, який визна
чає його сутність, є клітина. Саме в ній синтезується цільовий
продукт. За влучним висловом Овчіннікова Ю.А. (1985), кліти
на — це мініатюрний хімічний завод, який працює з колосаль
ною продуктивністю, з граничною узгодженістю і за заданою про
грамою. В ній щохвилинно синтезуються сотні найскладніших
сполук, включаючи гігантські біополімери, у першу чергу білки.
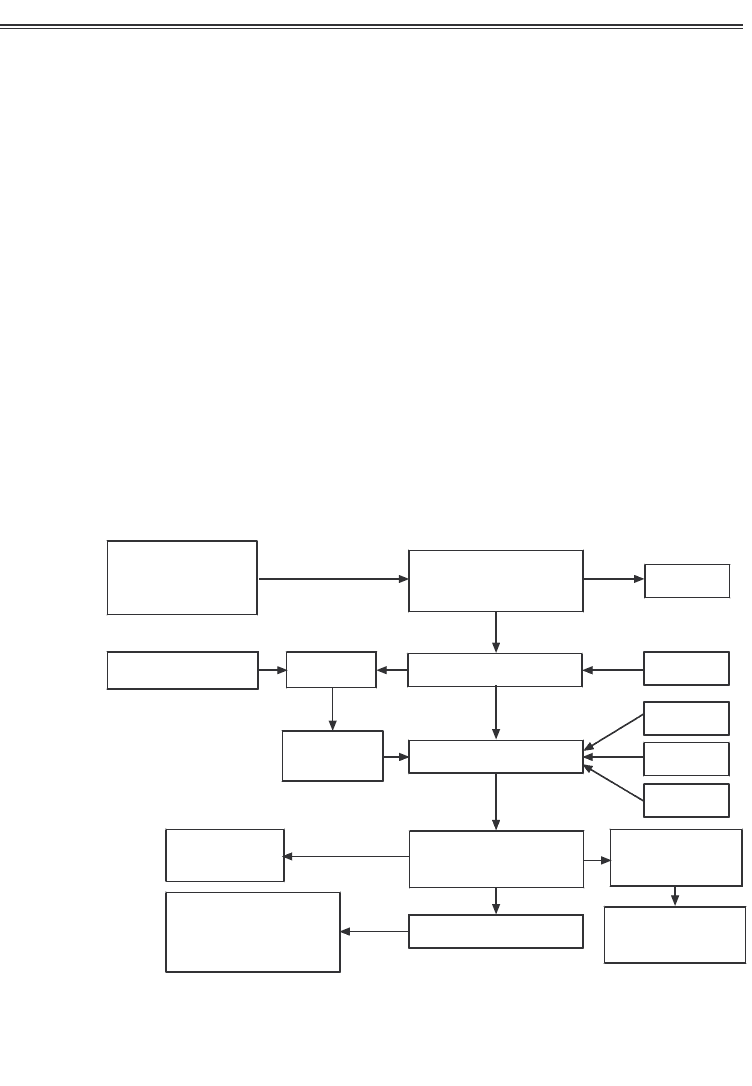
Узагальнена схема одержання біотехнологічної продукції
наведена на рис. 1.3.
Методи біотехнології. Біотехнології притаманні свої
специфічні методи. Це крупномасштабне глибинне культиву
Інредієнти
поживноо
середовища
Біооб’є&т
Іно&#лят
Посівний
матеріал
Стерилізація
Ферментатор
Цільовийпрод#&т
Операціївиділення
цільовоопрод#&т#
Упа&#вання,
зберіання
(транспорт#вання)
Побічні
прод#&ти
Вода
Пара
Вода
Повітря
Пара
Відходи
виробництва
Знеш&одження,
#тилізація
Підотов&а
поживноо
середовища
Рис. 1.3. Приблизна узагальнена схема процесів у біотехнології
(за Єліновим Н.П., 1995)

вання біооб’єктів у періодичному, напівбезперервному або без
перервному режимі та вирощування клітин рослинних і тварин
них тканин в особливих умовах. Біотехнологічні методи куль
тивування біооб’єктів виконуються у спеціальному обладнанні,
наприклад, у ферментерах вирощують бактерії і гриби при одер
жанні антибіотиків, ферментів, органічних кислот, деяких віта
мінів тощо.
У подібних ферментерах вирощують деякі клітини людини
(бласти) для одержання білкаінтерферону, а також деякі види
рослинних клітин. Однак останні частіше вирощують у стаціо
нарних умовах на середовищі з ущільненою (наприклад, агари
зованою) підкладкою у скляних або поліетиленових ємностях.
Інші методи, які використовують у біотехнології, є спільни
ми, наприклад з методами в мікробіології, біохімії, органічній
хімії й інших науках. Особливо потрібно виділити методи клі
тинної і генетичної інженерії, які покладено в основу сучасної
біотехнології.
Відмінністю методів, які використовуються у біотехнології,
є те, що вони повинні виконуватись, як правило, в асептичних
умовах (від грецького а — ні, septicos — гнилісний), тобто з уни
кнення можливості потрапляння у середовище, де культивуєть
ся біооб’єкт, патогенних і сапрофітних мікроорганізмів.
Патогенні види становлять безпосередню небезпеку для за
діяних у виробництві людей і для споживачів кінцевих продук
тів; сапрофітні види можуть виступати конкурентами за пожи
вні субстрати, антагоністами, продуцентами токсичних
речовин, включаючи пірогени.
1.3. МЕТА І ЗАВДАННЯ БІОТЕХНОЛОГІЇ
Першочерговими завданнями біотехнології є створення:
нових біологічно активних речовин і лікарських препаратів
для гуманної і ветеринарної медицини (інтерферонів, інсулі
ну, гормонів росту людини, моноклональних антитіл, вакцин
тощо) для ефективної профілактики, діагностики і лікуван
ня людей і тварин;
Розділ1.Біотехнолоія—наовадисципліна
21

засобів захисту рослин від хвороб і шкідників; бактеріаль
них добрив і регуляторів росту рослин; нових високопродук
тивних і стійких до несприятливих факторів зовнішнього се
редовища сортів і гібридів сільськогосподарських рослин,
одержаних методами генетичної і клітинної інженерії;
цінних кормових добавок і біологічно активних речовин
(кормового білка, амінокислот, ферментів, вітамінів тощо)
для застосування у тваринництві з метою підвищення про
дуктивності тварин;
нових технологій одержання цінних продуктів для викори
стання у харчовій, хімічній, мікробіологічній та інших галу
зях промисловості;
безвідходних і екологічно безпечних технологій утилізації і
біоконверсії сільськогосподарських, промислових, побуто
вих відходів для одержання енергоносіїв (біогазу), високоя
кісного органічного добрива, білкових та вітамінних кормо
вих добавок;
удосконалення і оптимізація апаратури для біотехнологіч
них процесів з метою досягнення максимальних виходів
кінцевих продуктів;
підвищення технікоекономічних показників біотехноло
гічних процесів порівняно з існуючими.
На шляху вирішення поставлених завдань біотехнологію
чекають немалі труднощі, пов’язані з виключною складністю
організації живого. Будьякий біооб’єкт — це цілісна система, в
якій не можна змінити жоден з елементів, не змінюючи інших,
не можна довільно перекомбінувати їх. Будьякий вплив на
об’єкт викликає не тільки бажані, але й побічні ефекти. Перебу
дова геному відразу відбивається на багатьох ознаках організму.
Окрім цього, екосистема — це свого роду цілісна система, і змі
на одного з її компонентів позначається на інших компонентах.
Успіхи, досягнуті у сфері генетичної і клітинної інженерії
на найпростіших біологічних системах (прокаріотних організ
мах), дають надію на подолання цих труднощів.
ЧастинаI.Заальнабіотехнолоія
22

Розділ 2.
МІЖНАРОДНІ СИСТЕМИ GLP І GMP
ЩОДО ЯКОСТІ БІОТЕХНОЛОГІЧНИХ
ПРОДУКТІВ
Система GLP — це зведення правил, які регламентують
проведення стандартизації лікарських препаратів та інших біо&
логічно активних речовин, а система GMP — їх виробництво.
2.1. СИСТЕМА GLP
З метою організації якісного проведення доклінічних ви
пробувань лікарських та інших біологічно активних речовин
(харчових добавок, агрохімікатів тощо) у промислово розвине
них країнах (Англія, Німеччина, США, Франція, Японія та ін
ші) затверджені єдині правила системи GLP (Good Laboratory
Practice). Існує група GLP у Європейському центрі з екології і
токсикології хімічної промисловості; у США система GLP діє з
червня 1979 р. Головним в такій системі є наступне:
1) завчасна розробка стандартної методики проведення випро
бувань або SOP (Standart Operating Procedure) стосовно
усіх його етапів;
2) призначення керівника і відповідальних за кожен вид ви
пробувань;
3) кожному відповідальному виконавцю доручається чітко ви
конувати усі операції у відведених йому межах;
4) результати виконання операцій мають бути внесені у спе
ціальний протокол, датовані і підписані;
5) у разі виконання складних операцій, щоб уникнути поми
лок, рекомендується удаватися до подвійної перевірки;
6) в установленому порядку виконавець доповідає керівнику
про перебіг випробувань. Керівник повинен бути компе
тентним в усіх справах, пов’язаних з випробуваннями;

7) фактичні дані, записи і препарати (речовини) мають збері
гатися у повному порядку, щоб завжди можна було знайти
необхідне;
8) остаточний звіт за змістом має відображати отриманні дані,
а також супроводжуватись обговоренням, складеним відпо
відальним виконавцем; на звіті проставляються дата і під
писи (відповідального виконавця і осіб, які підтверджують
зміст звіту);
9) повинна бути служба якісної оцінки випробувань — QAU
(Quality Assuarance Unit). Особи, задіяні у цій службі, зо
бов’язані проводити внутрішню інспекцію в установленому
порядку і за необхідності видавати рекомендації щодо вдос
коналення процесів проведення випробувань.
На систему GLP спираються у випадках випробування ре
човин: на мікробне зображення; на пірогенність; гостру, підгос
тру і хронічну токсичність, на специфічну токсичність (канце
рогенність), антигенність, лікарську залежність, пошкодження
зародкових клітин; подразнення слизових оболонок шкіри і в
місці введення речовини; мутагенність, тератогенність — від
грецького teratos — чудовисько, урод; цитотоксичність; на без
печність для макроорганізму при введенні in vivo (абсорбція,
розподіл, швидкість виведення, метаболізм); проводять фарма
кологічні випробування з оцінкою фармакокінетики (дія лікар
ської речовини, яка вивчається, на організм) і фармакодинаміки
(вивчення сили дії лікарської речовини).
У зв’язку з необхідністю проведення згаданих випробувань
створюють спеціальні групи: загальну (в тому числі і для кон
тролю за гігієною і санітарією працюючих), мікробіологічну,
для вивчення метаболізму, проведення загальнофармакологіч
них випробувань та загальних клінічних досліджень; патолого
анатомічну, проведення експериментів на тваринах, обробки да
них (з включення управління ЕОМ), з підготовки проб,
аналітичну, з управління дослідженням і, за необхідності, інші.
На кожну групу затверджується керівник, який не повинен по
єднувати свої прямі обов’язки з роботою в групі інспекцій.
Додержання вимог системи GLP має бути підкріплено дос
коналістю організації усіх допоміжних служб і достатнім мате
ріальним забезпеченням. Бажано мати окреме приміщення для
ЧастинаI.Заальнабіотехнолоія
24

проведення біологічних випробувань, де експериментальні тва
рини розміщувалися б у відповідних приміщеннях: для гнотобі
онтів, заражених, контрольних, призначених для роботи з радіо
ізотопами, для карантинізації тощо.
У роботі з тваринами мають враховуватися усі інфекційні
захворювання, які можуть вплинути на результати експеримен
тів. При цьому необхідно мати на увазі і той факт, що окремі
збудники інфекційних захворювань можуть передаватися від
людини до тварин і навпаки. До них належать віруси сказу, лім
фоцитарного хоріоменінгіту, деякі бруцели, сальмонели, міко
бактерії туберкульозу, дизентерійна амеба тощо.
Схвалений препарат (речовина) після лабораторних перед
клінічних випробувань за системою GLP і подальшої клінічної
перевірки дозволяється до випуску в умовах промислового ви
робництва.
2.2 СИСТЕМА GMP
Для забезпечення виготовлення високої якості продукту
Всесвітня організація охорони здоров’я (ВООЗ) у 1968 р.
затвердила «Вимоги до практики якісного виробництва при ви
готовленні і контролі якості ліків і до спеціалістів у сфері фар
мації». Роком пізніше ці вимоги, які ввійшли (з невеликими
змінами і уточненнями) у правила системи GMP (Good Manu
facturing Practice), були рекомендовані Асамблеєю ВООЗ для
міжнародної торгівлі, а в 1971 р. вони були видані як додатки до
другого видання Міжнародної Фармакопеї.
GMP — це єдина система вимог з контролю якості лікарсь
ких засобів з початку переробки сировини до виробництва гото
вих препаратів, включаючи загальні вимоги до приміщень,
обладнання і персоналу. З 1975 р. правила GMP розширені і во
ни стосуються різних хімічних і біологічних речовин, ветери
нарних препаратів; вихідних матеріалів для використання в
дозованих формах, якщо вони включені у законодавства країн
експортерів і країнімпортерів; і, насамкінець, інформації про
безпеку і ефективність перерахованих речовин, матеріалів, пре
паратів.
Розділ2.СистемиGLPіGMPщодояостібіотехнолоічнихпродтів
25

ЧастинаI.Заальнабіотехнолоія
26
З урахуванням видання в 1987 р. провідних вказівок Між
народної Організації Стандартизації (ISO) серії ISO 9000–9004
за системами якості виникла необхідність переглянути існуючі
вимоги GMP. У 1991 р. на спеціальній конференції у Москві
був переглянутий проект вимог GMP, який включає три
частини:
1. «Управління якістю у промисловому виробництві лі
карських засобів: філософія і основні складові».
2. «Практика якісного виробництва і контроль якості».
3. «Додаткові і допоміжні напрями».
Перша частина містить 12 розділів, які стосуються органі
зації контролю за якістю виробництва, санітарії і гігієни, укла
дення контрактів, стандартних робочих методик, оформлення
необхідної документації тощо.
Друга частина містить два розділи — виробництво і кон
троль якості. Стосовно виробництва лікарських засобів вказа
но, що воно має грунтуватися на принципі чіткого додержання
методів ведення технологічного процесу згідно з нормативно
технічною документацією з метою одержання продукту
необхідної якості і згідно з дозволом на його виготовлення і
продаж. По можливості уникати будьяких відхилень від мето
дик або інструкцій. За наявності таких відхилень необхідно по
годження, дозвіл і підпис призначеної відповідальної особи, а за
необхідності залучення служби відділу контролю якості.
Операції з різними продуктами не повинні виконуватись в
одному і тому ж приміщенні, поки не буде усунений ризик пере
мішування або перехресного забруднення.
Доступ у виробничі приміщення можуть мати лише особи,
які зайняті на виробництві. Уникати виготовлення немедичної
продукції у зонах і на обладнанні, призначеному для виготов
лення фармацевтичної продукції. При роботі з сухими матеріа
лами і продуктами необхідно дотримуватися правил техніки
безпеки для попередження виникнення, накопичення і розпов
сюдження пилу, що може призвести до перехресного забруд
нення продуктів, що виготовляються, або до їх мікробного заб
руднення. Мікроби можуть потрапляти у повітря і на частинки
пилу із інших матеріалів і продуктів при їх виготовленні, із заб

руднених обладнання і одягу, шкіри працюючих. Запобігти цьо
му можна шляхом виготовлення кожного цільового продукту в
роздільних зонах (пеніциліни, живі вакцини й інші БАР) або, у
крайньому випадку, виготовлення їх у часі порізно; забезпечен
ня відповідними повітряними шлюзами; захисного технологіч
ного одягу; використання засобів ефективної деконтамінації
обладнання, стін та ін.; використання «закритих систем» вироб
ництва тощо.
Необхідно перевіряти правильність і надійність з’єднання
трубопроводів й іншого обладнання, яке використовується для
транспортування продуктів (матеріалів) з однієї зони в іншу.
Дистильована або деіонізована вода, яка надходить по трубах,
має відповідати санітарномікробіологічним нормативам. Опе
рації з технічного обслуговування або ремонту не мають впли
вати на якість продукції.
Контроль якості продукції стосується процесу забо
ру проб, проведення досліджень, документації та ін. Всі дослі
дження мають проводитися згідно з затвердженими інструкція
ми для кожного матеріалу або продукту.
Забір проб здійснюють таким чином, щоб не забруднити їх
або не піддати небажаному впливові, який позначиться на яко
сті продукту або, навпаки, щоб матеріал, який відбирається, не
був токсичним (шкідливим) для здоров’я оператора.
Для кожної партії продукту до випуску має бути лаборатор
на документація з підтвердженням відповідності кінцевого про
дукту специфікаціям.
Із кожної партії цільового продукту залишають проби на
зберігання терміном, який перевершує на рік строк придатності
продукту. Проби мають зберігатись у такій кількості, щоб мож
на було за необхідності провести щонайменше два повторних
дослідження.
Третя частина вимог GMP включає розділи про стериль
ні фармацевтичні продукти і практику якісного виробництва
основної маси лікарських субстанцій.
Необхідно пам’ятати про те, що особи, які мають підвищену
чутливість до конкретної речовини (діючої або допоміжної) не
повинні входити у групу виконавців. Для них допустима робота
у відділі або цеху упаковки, де відсутній контакт з алергеном.
Розділ2.СистемиGLPіGMPщодояостібіотехнолоічнихпродтів
27

ЧастинаI.Заальнабіотехнолоія
28
У 1991 р. затверджені правила GMP стосовно виробництва
і контролю якості лікарських засобів. Ці правила відповідають
Міжнародній системі GMP і включають наступні розділи:
вступ, термінологія, персонал, будинки і приміщення, облад
нання, процес виробництва, відділ технічного контролю, атеста
ція і контроль виробництва, окремі вимоги до стерильних лікар
ських засобів і описані особливості їх виробництва.
Додержання правил GMP забезпечує випуск якісних про
дуктів і гарантує безпеку споживачам. У 1995 р. за пропозицією
Міжнародної фармацевтичної федерації (FIP) ВООЗ затверди
ла GРP (Good Pharmacy Practice).
Державним департаментом ветеринарної медицини України
проводяться заходи щодо гармонізації існуючої законодавчо
нормативної бази з вимогами Європейського фармацевтичного
законодавства шляхом введення в дію стандартів, які регламен
тують процес виробництва ветеринарних препаратів, дістри
б’юторську діяльність, а також інспекцію виробництва фарма
цевтичної продукції. Одним із етапів розробки стандартів є їх
переклад українською та російською мовами, який здійснюєть
ся провідними вченими і спеціалістами України.
Контрольні питання
1. Що таке біотехнологія і на чому вона базується?
2. Коли виникла біотехнологія і завдяки чому вона пережила
своє друге народження?
3. Які біологічні об’єкти використовуються у біотехнології? Їх
класифікація.
4. Які методи використовуються у біотехнології?
5. Що є завданням біотехнології?
6. Які існують міжнародні системи правил, що регламентують
проведення стандартизації лікарських препаратів та інших
біологічно активних речовин та їх виробництво?
7. Що таке система GLP і для чого вона застосовується?
8. Що таке система GMP і як вона реалізується?

Розділ 3.
ОСНОВИ МОЛЕКУЛЯРНОЇ БІОЛОГІЇ
3.1. НУКЛЕІНОВІ КИСЛОТИ
Усі живі організми є носіями двох типів нуклеїнових ки
слот (НК): рибонуклеїнових (РНК) і дезоксирибонуклеїнової
(ДНК). У вірусах присутній тільки один з двох названих типів
НК: РНК чи ДНК. НК належать до макромолекулярних спо
лук, розмір молекул яких коливається в широких межах. Так,
молекулярна маса транспортних РНК (тРНК) складає близько
2,5 · 10
4
, тоді як молекулярна маса ДНК досягає колосальних
величин — 10
6
–10
9
. Біологічна роль НК полягає у збереженні,
реплікації, рекомбінації та передачі генетичної інформації.
3.1.1. Хімічний склад нуклеїнових кислот
До складу молекул НК входять атоми азоту (15–16 %), фос
фору (8–10 %), вуглецю, кисню і водню. З метою ідентифікації
компонентів, що входять до складу НК, і їхнього кількісного
визначення ДНК і РНК піддають ферментному або найчастіше
кислотному гідролізу, у результаті чого виявляють пуринові
(у молекулі пурину шестичленне кільце піримідину і п’ятич
ленний гетероцикл імідазолу знаходяться в конденсованому
стані, утворюючи біциклічне похідне) (аденін і гуанін) і піримі
динові (тимін, цитозин і урацил) азотисті основи, моноцукри —
пентози (рибозу і дезоксирибозу) та фосфорну кислоту:
Тимін(5-метил-2,4-діо-
&сипіримідин)
Цитозин(2-о&си-4-
амінопіримідин)
Урацил(2,4-діо&сипі-
римідин)
