Гаспарян Л.Г. Общая физика (Конспекты для студентов ФМИФ)
Подождите немного. Документ загружается.

71
Теплоемкость
Удельная теплоемкость вещества c − Это количество теплоты δQ, не-
обходимое для нагревания 1кг вещества на 1 градус Кельвина.
dT
m
Q
c
⋅
=
δ
[ Дж/(кг·К)]
Молярная теплоемкость C
m
− Количество теплоты δQ, необходимое
для нагревания 1 моль вещества на 1 градус Кельвина.
dT
n
Q
C
m
⋅
=
δ
[ Дж/(моль·К)],
где n=m/M − количество вещества, а М – молярная масса вещества.
C
m
=c·M
Различают теплоемкость при постоянном объеме − C
V
, и при постоянном
давлении − C
p
.
Из первого начала термодинамики имеем δQ=dU+δA.
Используя δA=pdV C
m
=δQ/(ndT), для 1 моль газа получаем
C
m
dT=dU
m
+pdV
m
Если V=const,δA=0, то
dT
dU
C
m
V
=
. Используя
RdT
i
dU
m
2
=
, получим
R
i
C
V
2
=
т.е. молярная теплоемкость газа при постоянном объеме C
V
равна изме-
нению внутренней энергии 1 моль газа при повышении его температуры на
1К.
При p=const, из C
m
dT=dU
m
+pdV
m
получим
dT
pdV
dT
dU
C
mm
p
+=
Т.к.
dT
dU
C
m
V
=
и при p=const из pV
m
=RT, имеем pdV
m
=RdT
C
p
=C
V
+R (Уравнение Майера)
Всегда C
p
> C
V
т.к. нагревание при p=const требует дополнительное
количество теплоты для расширения газа, т.к. p=const обеспечивается увели-
чением V.
Из C
V
=iR/2 →
R
i
R
iR
RCC
Vp
2
2
2
+
=+=+=
Параметр
i
i
C
C
V
p
2
+
==
γ
− показатель адиабата или
коэффициент Пуассона
(подробнее см. приложение 5).
Видно, что C
p
и C
V
не зависят от Т и определяются лишь числом свобо-
ды.
Но это справедливо только у одноатомного газа.
Уже у двухатомных газов i=i(T). Например, у водорода при комнатной
температуре по теории
i=i
поступ
+i
вращ
+2i
колеб
=3+2+2
×
1=7, а
RC
V
2
7
=
.
Между тем эксперимент дает;

72
при низких температурах T≈50K, C
V
=(3/2)R,
при комнатных − T≈300K, C
V
=(5/2)R (вместе теоретических (7/2)R),
при очень высоких − T≈6000K, C
V
=(7/2)R.
При низких Т наблюдаются
только поступательное движение
молекул (i=3), а энергии теплового
движения недостаточно, чтобы
«включить» вращательные или
колебательные движения, для
которых необходимы определенные
«квантованные» энергии. Поэтому
соответствующая степень свободы
«замораживается» – к ней
неприменим закон равнорас-
пределения энергии.
При комнатных температурах к поступательным движениям добавляют-
ся вращение молекул и i=5, а при высоких, к этим двум видам движения до-
бавляются еще колебания молекул и i=7.
Второе начало термодинамики
I начало термодинамики не указывает направление протекания термоди-
намических процессов. Можно представить множество процессов, не проти-
воречащих первому началу, в которых энергия сохраняется, но в природе они
не осуществляются. Чтобы определить направление протекания термодина-
мических процессов и ответить на вопрос, какие процессы в природе воз-
можны, а какие нет, вводится понятие энтропии (S) как функции состояния
термодинамической системы. Для определения энтропии рассматривают
приведенное количество теплоты
T
Q
δ
как отношение теплоты Q, получен-
ной телом в изотермическом процессе, к температуре T теплоотдающего те-
ла.
Термодинамический процесс обратимый, если он может происходить
как в прямом, так и в обратном направлении. Любой равновесный процесс
является обратимым, но реальные процессы − необратимые. Обратимый
процесс − это идеализация реальных процессов (физическая модель).
Строгий термодинамический анализ показывает, что в любом обрати-
мом круговом процессе
∫
= 0
T
Q
δ
. (3)
Т. к. если интеграл по замкнутому контуру равняется нулю, то подынте-
гральное выражение есть полный дифференциал некоторой функции, которая
определяется только состоянием системы и не зависит от пути, пройденного
системой. Эта функция
состояния, дифференциал которой является δQ/T, на-
зывается энтропией и обозначается S (термин энтропия, от греч. слов «эн» –
6000
300
50
0
T
C
V
2
7
R
2
5
R
2
3
R
H
2
73
в, «тропе» – превращение – обращенная внутрь, недоступная для дальнейших
превращений, ввел Клаузиус 1865г.). Таким образом,
dS
T
Q
=
δ
.
Из формулы (3) вытекает, что для обратимых процессов ∆S=0.
В термодинамике доказывается, что энтропия замкнутой системы, со-
вершающей необратимый цикл, возрастает: ∆S>0.
Таким образом, энтропия замкнутой системы может либо возрастать
(в случае необратимых процессов), либо оставаться постоянной (в случае
обратимых процессов):
∆S≥0 (неравенство Клаузиуса).
Так как реальные процессы необратимы, то все процессы в замкнутой
системе ведут к увеличению ее энтропии [Второе начало термодинамики
(принципа возрастания энтропии)].
Энтропия может рассматриваться как мера вероятности состояния тер-
модинамической системы.
Все естественные процессы в изолированной термодинамической
системе протекают так, что система переходит от состояний менее веро-
ятных к состояниям более вероятным (которые являются также более бес-
порядочными). Это иное определение второго начала термодинамики.
В процессах, происходящих в замкнутой системе, энтропия не убывает.
В незамкнутых системах энтропия может вести себя любым образом
(убывать, возрастать, оставаться постоянной).
Энтропия (как внутренняя энергия, масса, объем) обладает свойством
аддитивности, т.е. энтропия системы равна сумме энтропий тел, входящих
в систему (в отличие, например, от температуры).
Еще две формулировки второго начала термодинамики
1. Невозможен круговой процесс, единственным результатом ко-
торого является превращение теплоты, полученной от нагре-
вателя, в эквивалентную ей работу (Кельвин
),
S
1
≤
S
2
Менее вероятное
состояние.
Вероятность
N
2
1
~
Более вероятное
cостояние.
Вероятность
N
8,0
≈
где N − число молекул
74
2. Невозможен круговой процесс, единственным результатом ко-
торого является передача теплоты от менее нагретого тела к
более нагретому (Клаузиус).
Первая формулировка указывает, что вечный двигатель второго рода –
периодически действующий двигатель, совершающий работу за счет охлаж-
дения одного источника теплоты – невозможен
11
.
Цикл Карно
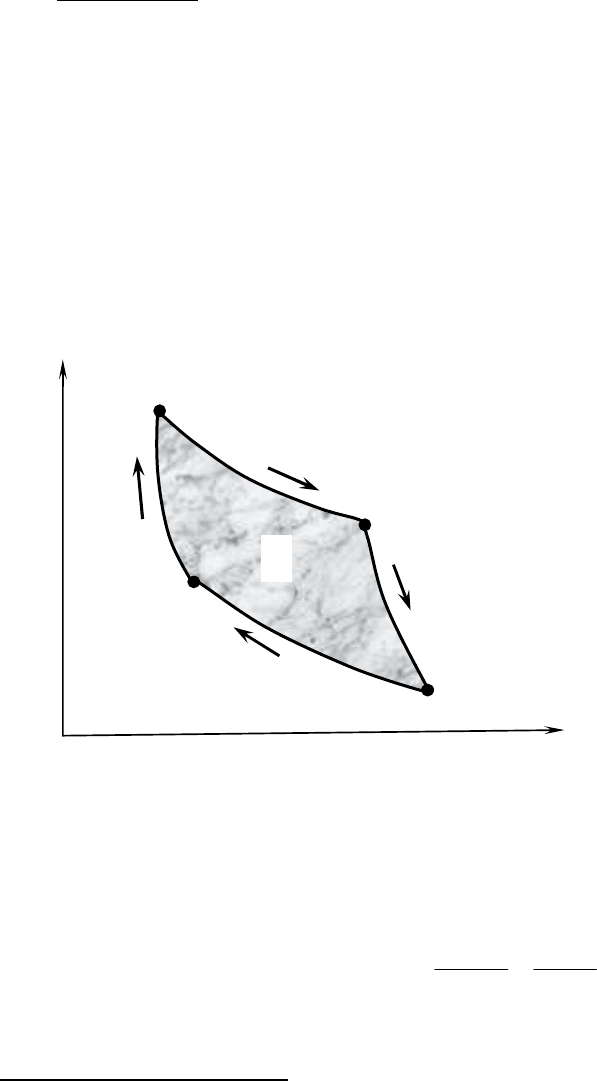
Круговым процессом или циклом называется процесс, в результате ко-
торого система, пройдя через ряд состояний, возвращается в исходное со-
стояние.
На графике круговой процесс изобразится замкнутой кривой, площадь
которой соответствует работе, совершаемой при круговом процессе.
Карно (1796-1832) доказал первую формулировку второго начала термо-
динамики (формулировку Кельвина) и показал, что в результате цикла (цик-
ла Карно, состоящий из двух изотерм {1→2 и 3→4} и двух адиабат {2→3 и
4→1}) газ, получив количество теплоты Q
1
от нагревателя и передав часть
этого количества теплоты Q
2
холодильнику, совершает внешнюю работу,
равную A=Q
1
−Q
2
.
Чтобы совершаемая
работа А не равнялась ну-
лю, необходимо присутст-
вие холодильника, иначе
площадь замкнутого цикла
равна нулю. Действительно,
при отсутствии холодиль-
ника процесс 1→2→3 мож-
но было бы замкнуть (т.е.
получить цикл) только по-
средством процесса
3→2→1. Площадь такого
цикла, а следовательно, и
совершаемая работа будут равны нулю. Таким образом, отдачи части тепло-
ты Q
2
холодильнику является необходимым условием совершения работы.
Иными словами, тепловая машина не может все полученное количество теп-
лоты целиком переводить в работу.
Коэффициент полезного действия (к.п.д.) η такого цикла
1
21
1
21
T
TT
Q
QQ
−
=
−
=
η
, (4)
где Т
1
– температура нагревателя, Т
2
− температура холодильника.
11
Например, в океанских водах содержится колоссальное количество энергии в виде
теплоты. Охлаждение воды океанов на 1
0
дало бы ~10
24
Дж теплоты, что эквивалентно
полному сжиганию 10
14
т угля. Такое количество угля имел бы состав длиной 10
10
км, т.е.
с размером Солнечной системы. Притом за первые 1700 лет такой «перекачки» теплоты
температура воды в океане понизилась бы в среднем на одну сотую долю кельвина.
2
p
2
,V
2
p
3
,V
3
P
4
,V
4
p
1
,V
1
4
1
3
T
2
T
1
V
p
A
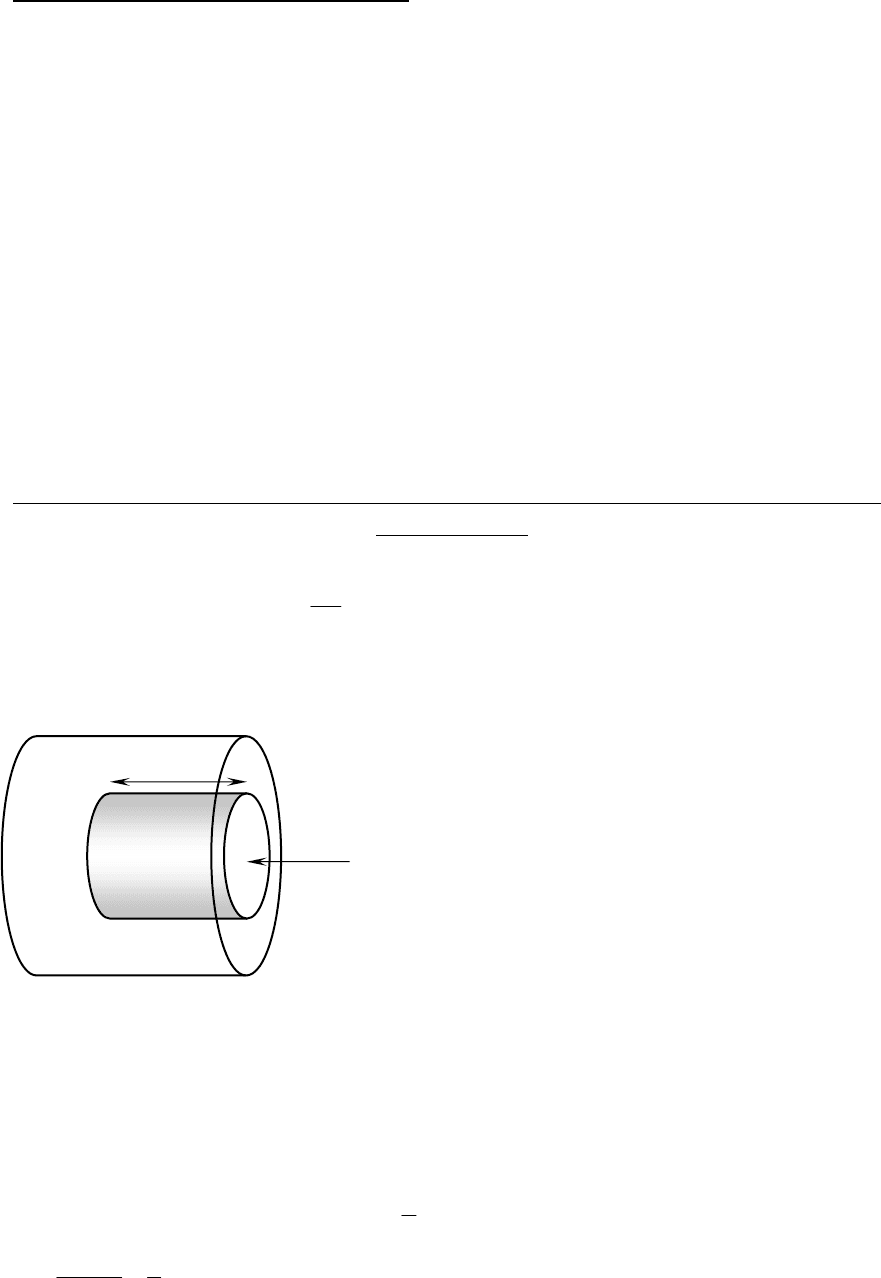
75
Третье начало термодинамики
Или теорема Нернста − Планка.
Энтропия всех тел в состоянии равновесия стремится к нулю по ме-
ре приближения температуры к нулю Кельвина.
0lim
0
=
→
S
T
Так как энтропия определяется с точностью до аддативной постоянной,
то удобно эту постоянную взять равной нулю. Тем более, обычно важ-
ную роль играет разность энтропии.
Приложение 1
Основное уравнение молекулярно-кинетической теории идеальных газов
(ОУМКТИГ)
Давление p=F
n
/∆S, а
dt
Pd
F
=
, где
υ
mP
=
импульс частицы.
Чтобы получить ОУМКТИГ, помня свойства идеальных газов, рассмот-
рим движение молекул в цилиндре с высотой Vdt. При
При каждом соударении молекула,
движущаяся перпендикулярно к плоско-
сти ∆S передает ей импульс m
0
υ−(−m
0
υ)=2m
0
υ (соударение о стенки сосуда аб-
солютно упругое и молекула отскочит с
такой же скоростью υ). За dt время к ∆S
достигнут только молекулы из объема
υdt∆S. Их число n∆Sυdt, где n − концен-
трация молекул.
Реальные молекулы достигают стенки не
только перпендикулярно. Для упрощения расчетов хаотическое движе-
ние молекул заменяем движением вдоль трех взаимно перпендикуляр-
ных направлений, так что вдоль каждого из них в любой момент дви-
жутся 1/3 молекул, из которых половина молекул движутся к ∆S, а поло-
вина, т.е. 1/6 от ∆S. Тогда при столкновении с площадкой эти молекулы
передадут ей импульс
dtSnmdP
υυ
∆⋅=
6
1
2
0
, a давление газа будет
2
0
3
1
υ
nm
dt
S
dP
p =
⋅∆
=
.
Если газ в объеме
V содержит N молекул, движущихся со скоростью υ
1
,
υ
2
,…, υ
N
, то целесообразно рассматривать среднюю квадратичную ско-
рость
Vdt
∆S
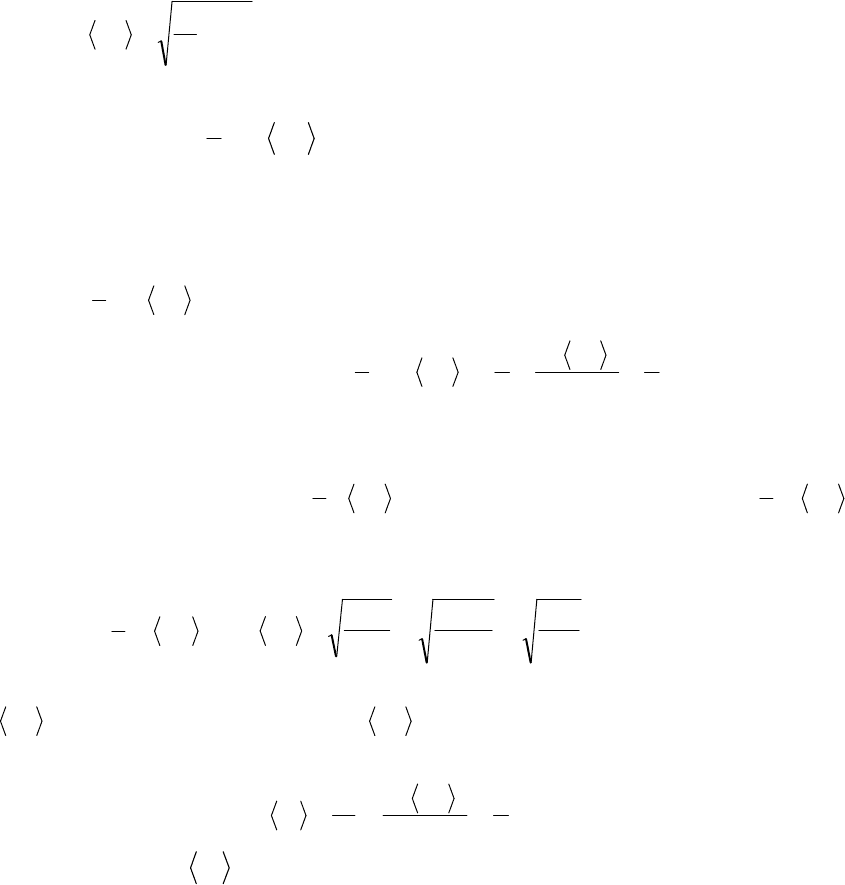
76
∑
=
=
N
i
i
N
1
2
кв
1
υυ
, характеризующую всю совокупность молекул газа.
Тогда
2
кв0
3
1
υ
nmp =
− Основное уравнение молекулярно-
кинетической теории идеальных газов
(Уравнение Клаузиуса).
Более точный расчет дает такую же формулу.
Из
2
кв
0
3
1
υ
nmp =
, учитывая, что концентрация молекул n=N/V, получим:
Е
m
NNmpV
3
2
2
3
2
3
1
2
кв0
2
кв0
===
υ
υ
,
где E − суммарная кинетическая энергия поступательного движения
всех молекул.
Т.к. Nm
0
=m
, то
2
кв
3
1
υ
mpV =
, а для одного моля газа
2
кв
3
1
υ
MpV
m
=
,
где V
m
− молярный объем, а M −молярная масса.
Но из уравнения Клапейрона-Менделеева pV
m
=RT, значит
2
кв
3
1
υ
MTR =
и
M
RT3
кв
=
υ
A
Nm
RT
0
3
=
0
3
m
kT
=
,
т.к. M=m
0
N
A
, k=R/N
A
Например, при комнатной температуре для молекул кислорода
кв
υ
≈480м/с, а для водорода −
кв
υ
≈1900м/с. [(m
0
)
O
2
=16(m
0
)
H
2
]
Средняя кинетическая энергия поступательного движения одной моле-
кулы идеального газа
==
N
E
0
ε
kT
m
2
3
2
2
кв0
=
υ
.
При T=0,
0
0
=
ε
Т.е. при абсолютном нуле прекращается поступательное движение мо-
лекул газа, а следовательно его давление равно нулю. Таким образом,
Термодинамическая температура является мерой средней кинети-
ческой энергии поступательного движения молекул идеального газа.
77
Приложение 2
Распределение Максвелла
По молекулярно-кинетической теории, как бы ни изменялись скорости
молекул при столкновениях, средняя квадратичная скорость молекул массой
m
0
в газе, находящемся в состоянии равновесия при T=const, остается посто-
янной и равной
=
кв
υ
0
3
m
kT
.
Это объясняется
тем, что в газе, находя-
щемся в состоянии рав-
новесия, устанавливает-
ся некоторое стационар-
ное, не меняющееся со
временем распределение
молекул по скоростям,
которое подчиняется
вполне определенному
статистическому закону.
Этот закон выведен
Максвеллом.
Функция распределения молекул по скоростям f(υ) определяет отно-
сительное число молекул
N
dN )(
υ
, скорость которых лежит в интервале
υ
÷
υ+dυ, т.е.
N
dN
df
)(
)(
υ
υυ
=
и
υ
υ
υ
Nd
dN
f
)(
)( =
.
kT
m
e
kT
m
f
2
2
2
3
0
2
0
2
4)(
υ
υ
π
πυ
−
=
.
)(
υ
f
зависит от рода газа (m
0
) и температуры T. Здесь главное, что
2
2
~)(
υ
υυ
A
ef
−
. Площадь
∫
∞
=
0
1)(
υυ
df
и есть условия нормировки.
f(ν)~ν
2
f(ν)~
2
-A
е
υ
N
)dN(
dS
υ
=
υ dυ
<υ>
<υ
кв
> υ
В
f(ν)
<
T
1
f(υ)
υ
2
В
υ
1
В
υ
S
1
T
2
<
S
2
78
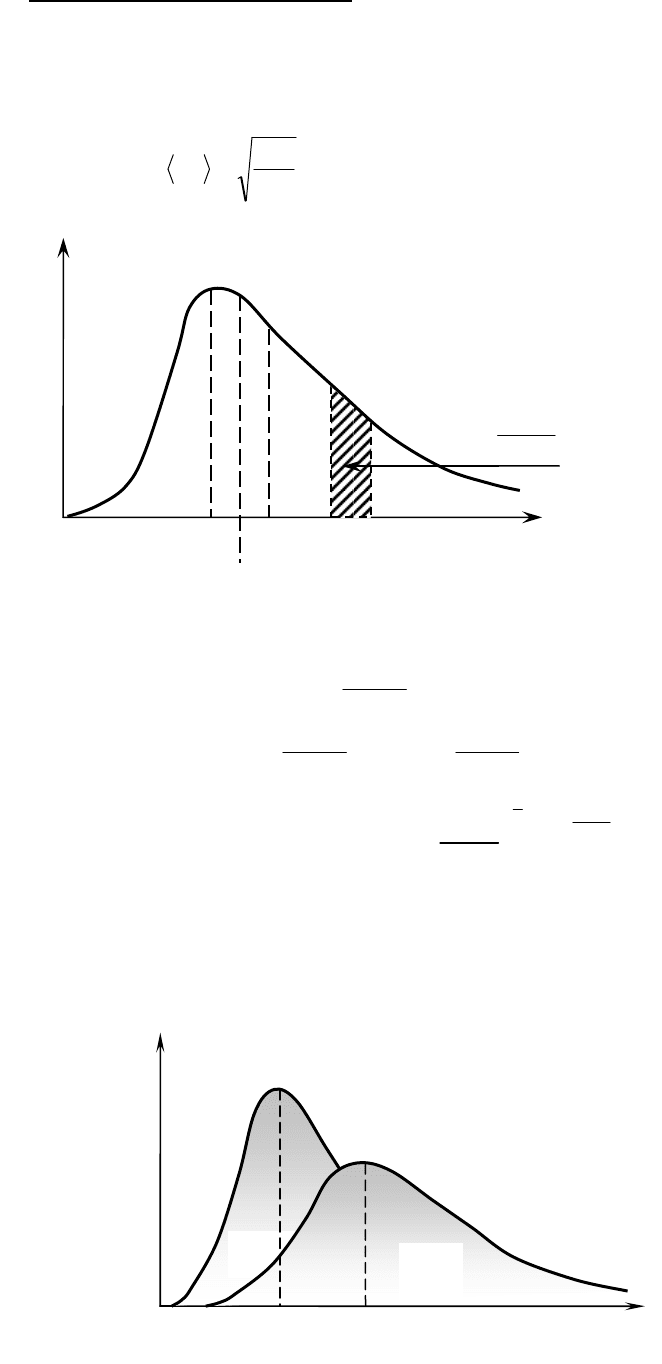
Скорости, характеризующие состояния газа:
1. Наиболее вероятная (максимальная)
M
RT
m
kT
B
22
0
==
υ
.
Из условия
0/)(
=
υ
υ
ddf
определяется
2. Средняя <υ> (средняя арифметическая скорость)
<υ>=
≈===⋅
∫∫
∞∞
M
RT
m
kT
dfdN
N
ππ
υυυυυ
88
)()(
1
0
00
1,13υ
B
3. средняя квадратичная <υ
кв
>=
≈
M
RT3
1,22υ
B
При повышении температуры кривая f(υ)
растягивается и понижается S
1
=S
2
/
Среднее число столкновений и
средняя длина свободного пробега молекул. Вакуум
Среднее число столкновений <z> за 1 с; <z>=
><
υπ
nd
2
2
,
где n – концентрация молекул,
d – диаметр молекул,
<υ> – средняя скорость молекул.
Средняя длина свободного пробега
nd
z
2
2
1
π
υ
=
><
>
<
>=< ℓ
.
Вакуумом называется состояние газа, при котором средняя длина сво-
бодного пробега <ℓ> сравнима или больше характерного линейного размера
r сосуда, в котором газ находится (или размера пространства r ).
Различают:
<ℓ> << r − Низкий вакуум
<ℓ> ≤ r − Средний вакуум
<ℓ> > r − Высокий вакуум (ультраразреженный газ)
<ℓ> >> r − Сверхвысокий вакуум
В лабораториях можно достичь Вакуума.
В космосе нет вакуума, хотя n
косм
<<n
лабор
, но там линейные размеры r ог-
ромные
79
Приложение 3
Барометрическая формула (распределение Больцмана)
При выводе основного уравнения молекулярно-кинетической теории газов и
Максвелловского распределения предполагалось, что внешние силы отсутст-
вуют. Но газы, находясь на Земле, из-за действия гравитационного поля Зем-
ли, имеют другое распределение.
Закон изменения давления с высотой (барометрическая формула) выво-
диться с предположением, что;
– поле тяготения однородно;
– температура атмосферы не меняется с высотой;
–
масса всех молекул воздуха одинакова.
Разность давления p и p+dp равна весу газа, заключенного в объеме ци-
линдра высотой dh с основанием площадью 1м
2
.
p−(p+dp)=ρgdh, ρ=const плотность газа на высоте h.
Из
RT
M
m
pV =
RV
pM
V
m
==
ρ
,
тогда
pdh
RT
Mg
dp −=
или
dh
RT
Mg
p
dp
−=
→
∫∫
−=
2
1
2
1
h
h
p
p
dh
RT
Mg
p
dp
→
)(ln
12
1
2
hh
RT
Mg
p
p
−−=
)(
12
12
hh
RT
Mg
epp
−−
=
− Барометрическая формула.
Когда
h
1
=0, h
2
=h, p
0
=p(0) и p(h)=p
0
h
RT
Mg
e
−
.
Прибор для определения высоты над земной поверхностью называется
высотометром (или альтиметром).
Используя p=nkT, из барометрической формулы
h
RT
Mg
enhn
−
=
0
)(
или
h
kT
gm
enhn
0
0
)(
−
=
.
Т.к. M=m
0
N
A
, R=kN
A
, mgh=W
p
− потенциальная энергия молекулы в поле
тяготения.
kT
W
p
enhn
−
⋅=
0
)(
− Распределение Больцмана
Главное – что внешнее поле было потенциальным, а молекулы имели
одинаковую массу и двигались хаотично.
p
1
p
p+dp
p
2
h
1
dh
h
h
2

80
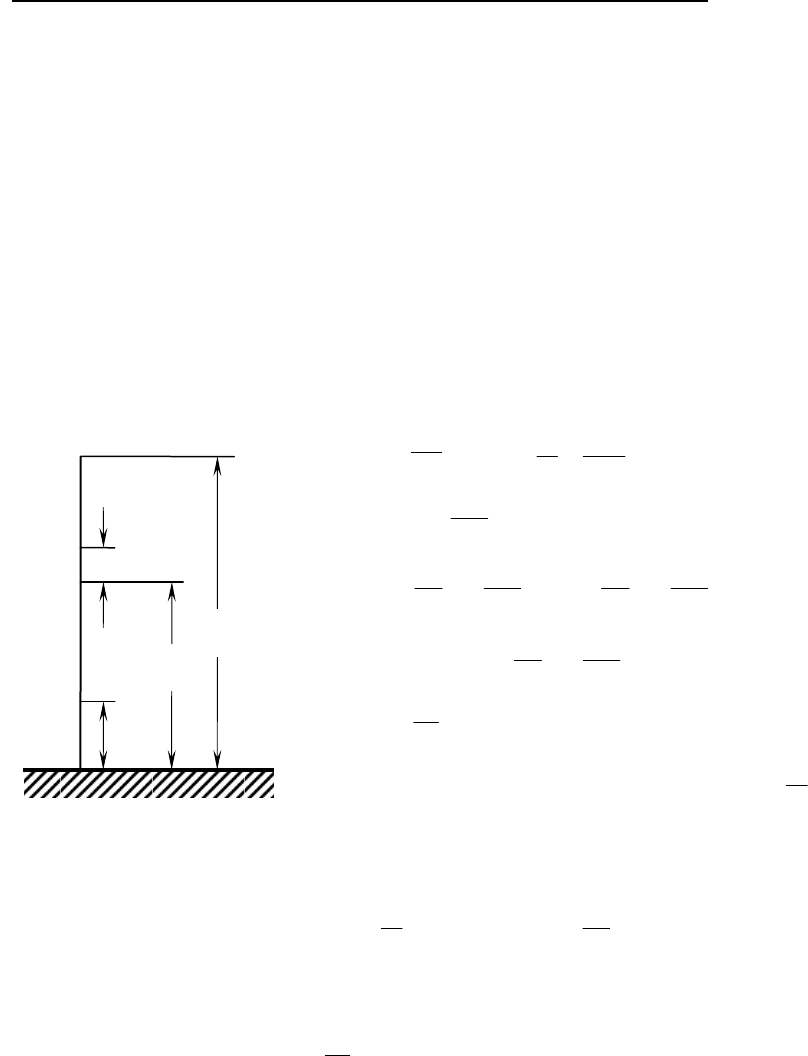
Концентрация
частиц
, n (
см
−3
)
Термопауза
Экзосфера
Высота
h
Стратосфера
Тропосфера
0
n≈2,7·10
1
9
Т,К
250−320 К
150−250 К
500−2500 К
300 К
Согревается от Зем-
ли
Поглощение солнечного
излучения незнач
и-
Поглощение солнечного
коротковолнового излуче-
ния
Источник тепла поглоще-
ние
УФ озоном и
~
ИК
Охлаждение за счет
собственного излучения
В Космосе
-3
см
1~n
; около Солнца
(Галактике)
-3
-3
2
см
10
0
1
~
÷
−
n
Т
180−220
К
10
14
10
7
500−1000
Термосфера
Мезопауза
Мезосфера
Мезопик
или
Стратопауза
Тропопауза
5
0
−
60
7
−
17
80−90
200−300
Масштаб
не
соблюдается
Изменение температуры атмосферы Земли (T) с высотой h
