Эрдман С.В. Техническая термодинамика и теплотехника: Учебное пособие.
Подождите немного. Документ загружается.

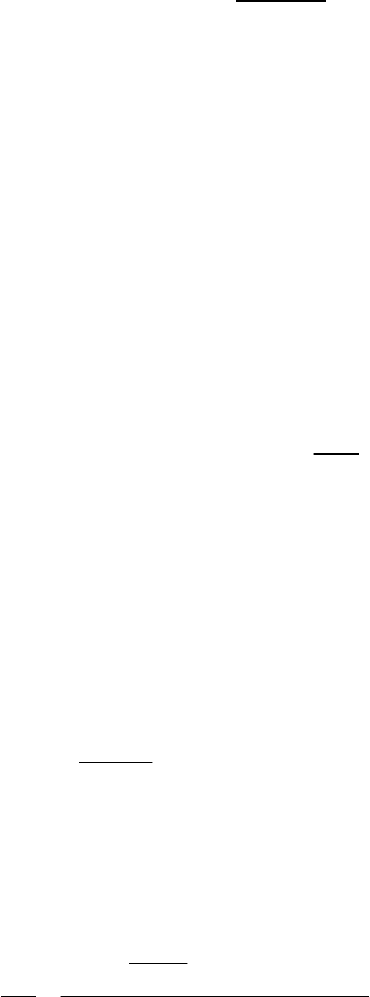
11
После этого можно определить газовую постоянную смеси по
формуле
см
8314,3
,
μ
см
R =
(1.3.6)
или по формуле
см
.
ii
R
у
R
=
⋅
∑
(1.3.7)
Также по формуле определяется плотность смеси
см
ρρ.
ii
х
=
⋅
∑
(1.3.8)
Парциальные давления определяются по уравнениям
см
,.
i
ii ii
R
PxP Py Р
R
=⋅ = ⋅
(1.3.9)
Пример 1. В баллоне емкостью 40л находится кислород при дав-
лении 112 атм по манометру, температура его – 37
о
С, атмосферное дав-
ление равно 736 мм рт. ст. Определить газовую постоянную кислорода,
его массу, удельный объем и плотность.
Решение. По уравнению рассчитываем газовую постоянную:
8314,3
259,82 Дж/кг град
32
R == ⋅
.
Из уравнения состояния идеального газа выразим массу и, подста-
вив абсолютное давление, получим
()
3
736
112 98066,5 40 10
735, 6
5, 68 кг
259,82 273,15 37
P
m
RT
ν
−
⎛⎞
+⋅⋅
⎜⎟
⎝⎠
== =
+
.
По уравнению определяем плотность кислорода:
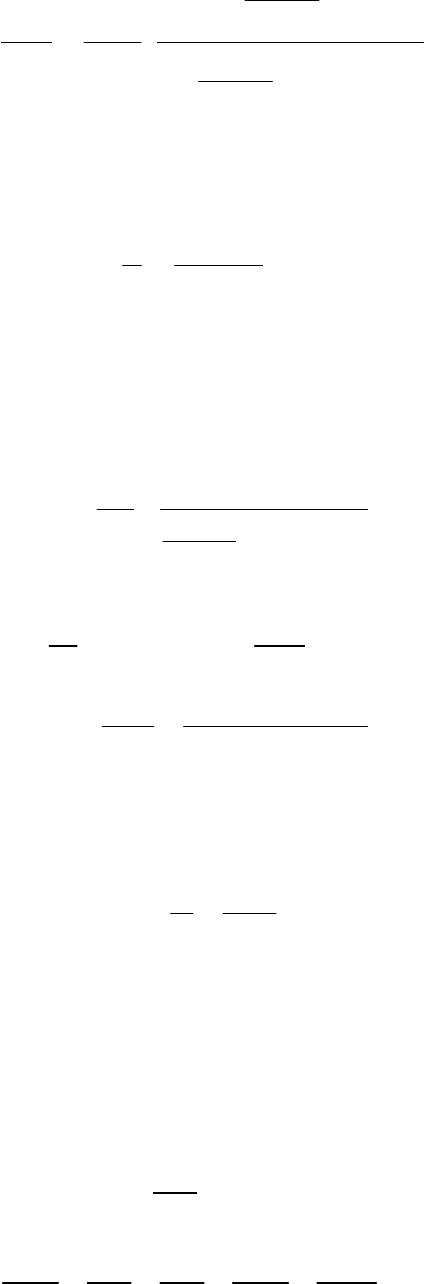
12
3
0
0
0
736
112 273,15
32
735, 6
ρρ 142,21 кг/м
760
22,4
300,15
735, 6
PT
PT
⎛⎞
+
⎜⎟
⎝⎠
==⋅ =
−
.
Зная, что удельный объем – это обратная величина плотности,
найдем удельный объем кислорода:
3
11
0,007 /
ρ 142, 21
мкг
ν
== =
.
Пример 2. Резервуар объемом 8 м
3
заполнен гелием. Определить
количество газа, содержащегося в резервуаре с давлением 0,5 бар и тем-
пературой – 180
о
С. Решить задачу по уравнениям состояния идеального
и реального газов.
Решение. По уравнению идеального газа
5
0, 5 10 8
2,075 кг
8314,3
273,15 180
4,002
P
m
RT
ν
⋅⋅
== =
⋅⋅
.
По уравнению, с учетом коэффициента сжимаемости,
93 2,26
18; π 4,5; 1,03;
50,5
z
τ
== = ≈ ≈
5
0,5 10 8
2, 02
1,03 2077, 7 93
P
m
zRT
ν
⋅⋅
== =
⋅⋅
кг.
По уравнению Ван-дер-Ваальса
333
202 м / ; 0,00575 м /; 3,86 /;a кг b кг м кг
ν
== =
8
2, 07 кг
3, 86
V
m
ν
== =
.
Пример 3. Массовый состав газовой смеси
Н
2
– 4 %; СН
4
– 40 %; С
2
Н
2
– 20 %; СО
2
– 12 %; N
2
– 24 %. Определить
газовую постоянную, молекулярный вес, плотность, удельный объем
смеси и парциальные давления компонентов.
Давление смеси 1,5 бар = 27
о
С.
Решение. Газовую постоянную смеси определяем по уравнению
ун
см ун
i
/ μ
μ
0,04 0, 4 0, 2 0,12 0,24
8314,3 ( ) 528 Д /.
216284428
ii i i i
R
R у Ry Rу
ж
кг град
=⋅=⋅=⋅ =
= ⋅ +++ + = ⋅
∑∑ ∑

13
В формулу для определения молекулярной массы смеси входит
параметр объемной доли смеси. Следовательно, воспользовавшись вы-
ражением, пересчитаем исходную смесь в объемном составе:
2222
HCHN
0,316; 0,110; 0,136;xx х===
42
СHCО
0,395; 0,043;xx==
см
μμ
ii
x
=
⋅=
∑
20,316 160,395 280,110 440,043 280,136 17,732 кмоль/кг.=+ + + + +=
По уравнению можно рассчитать плотность смеси:
см
ρρ.
ii
х
=
⋅
∑
Но вначале нужно определить плотность каждого компонента,
входящего в смесь. Для этого воспользуемся выражением
5
0
0
5
0
μ
1,5 10 273,15
ρρ ;
22,4 1,033 10 300,15
i
ii
PT
PT
⋅⋅
===
⋅⋅
24222
СН
ρ 0,118; ρ 0,944; ρ 1,652; ρ 2,596;
H СН CO
== ==
2
N
ρ 1,652.=
Подставляем полученные результаты и вычисляем:
см
3
ρ 0,118 0,316 0,944 0,395 1,652 0,11 2,596 0,043 1,652 0,136=
0,928 кг/м .
=⋅+⋅+⋅+⋅+⋅
=
Удельный объем смеси при заданных условиях рассчитываем
по уравнению
3
1
1, 077 м / кг.
0,928
ν
==
И наконец, парциальные давления компонентов вычисляем по вы-
ражению
;
ii
Р
xP
=
⋅
2422
СН
Р 0, 474 бар ; 0,593 бар ;0,165бар ;
H СН
РР== =
22
СON
1, 543 бар;0,204бар .РР==
Вопросы и задания для самоконтроля
1. В чем различие между интенсивными и экстенсивными парамет-
рами состояния?

14
2. Какова размерность основных параметров состояния?
3. Как определяются абсолютная температура газа при измерении
температуры в градусах Цельсия и абсолютное давление, когда
оно больше и когда оно меньше барометрического?
4. Сформулируйте основные законы идеальных газов?
5. Газовая постоянная, универсальная газовая постоянная, ее чис-
ленное значение и размерность?
6. Чем отличаются идеальный
газ и реальный? Как это отражается в
уравнениях состояния газа?
7. Как можно пересчитать массовый состав смеси газов в объемный?
1.4. Удельная теплоемкость и способы ее вычисления
Теплота, затрачиваемая на нагревание единицы количества веще-
ства на 1К, называется удельной теплоемкостью вещества. Принято
удельную теплоемкость называть просто теплоемкостью.
В зависимости
от выбранной единицы количества вещества раз-
личают теплоемкости:
3
массовую-,Дж/кг К ; объемную , Дж/м К;СС
′
−
м
мольную-,Дж/моль К.С
Приведенные удельные теплоемкости связаны соотношением
М
22,4
,
μμ
C С
C
′
⋅
==
(1.4.1)
где µ - молекулярная масса вещества.
Теплоемкость рабочего тела или системы зависит от температуры
и характера процесса, в котором происходит подвод или отвод теплоты.
Так как теплоемкость является функцией температуры, то истин-
ное значение ее определяется по формуле
23
o
....,C C at bt ct=++ ++
(1.4.2)
где а, b, c – постоянные коэффициенты, учитывающие физические
свойства газов, приведены в справочной литературе [2,3].
Для технических расчетов по линейной зависимости
o
.CC at
=
+
(1.4.3)
Для средней теплоемкости в пределах температур t
1
и t
2

15
()
2
1
12
.
2
t
to
a
CC tt=+ +
(1.4.4)
Для точных расчетов используются табличные данные и расчет
ведется по формуле
21
2
1
21
21
.
tt
t
oo
t
Ct Ct
C
tt
⋅
−⋅
=
−
(1.4.5)
В зависимости от процесса, который происходит с газом, разли-
чают:
процесс при постоянном объеме газа -
;C
ν
процесс при постоянном давлении газа -
.
Р
C
Зависимость между ними выражается формулами
;
P
CC R
ν
−=
PМνМУН
;CC R−=
(1.4.6)
,
Р
С
k
С
ν
=
(1.4.7)
где R – газовая постоянная;
R
УН
– универсальная газовая постоянная;
k – показатель адиабаты, который в зависимости от атомности
принимает значения: одноатомные газы – 1,67; двухатомные газы –
1,40; трехатомные и многоатомные газы – 1,28.
Для вычисления теплоемкости газа политропного процесса ис-
пользуют зависимость
,
1
n-k
CC
n-
ν
=
(1.4.8)
где n – показатель политропы;
k – показатель адиабаты.
Теплоемкость газовой смеси определяется по формулам
мольная теплоемкость
μμ
;
i
i
CXC
=
⋅
∑
(1.4.9)
массовая теплоемкость
;
i
i
C У C
=
⋅
∑
(1.4.10)
объемная теплоемкость
,
ii
CXC
′
′
=
⋅
∑
(1.4.11)
где Х
i
– объемная доля i-го компонента смеси;
У
i
– массовая доля i-го компонента смеси.
μ
,,
i
ii
CCC
′
- соответственно мольная, массовая и объемная удельная теп-
лоемкости i-го компонента смеси.
Изменением удельной теплоемкости твердых и жидких веществ
при различной температуре практически можно пренебречь, за исклю-
чением случаев изменения температур в очень большом интервале.
16
При отсутствии экспериментальных данных теплоемкости ве-
ществ можно с некоторым приближением определить расчетным путем.
Удельную теплоемкость твердых веществ С
Т
можно вычислить
при помощи правила Коппа:
Т
1
μ.
n
a
a
CC
−
=
⋅
∑
(1.4.12)
Здесь С
а
– сумма атомных теплоемкостей элементов, входящих в
состав вещества, кДж/кг атом град;
μ – масса 1 кмоль, кг/моль.
Атомные теплоемкости приведены в справочной литературе [2,4].
Мольная теплоемкость ароматических СН
2n-6
и алифатических уг-
леводородов гомологических рядов СН
2n
и СН
2n+2
в твердом и жидком
состоянии может быть приближенно определена по уравнению Шем-
ста:
μ
0,993 l 1 ,
98,1
T
CN n
⎛⎞
=⋅ ⋅ +
⎜⎟
⎝⎠
(1.4.13)
где С
μ
– мольная теплоемкость, кДж/кмоль;
N – число атомов в молекуле;
Т – абсолютная температура,
о
К.
Теплоемкость одной жидкости можно определить через теплоем-
кость другой стандартной жидкости по формуле
1/3
12
12
21
λρ
.
λρ
CC
⎛⎞
=⋅ ⋅
⎜⎟
⎝⎠
(1.4.14)
Здесь
1
C - теплоемкость первой жидкости при 20
о
С, Дж/кг К;
λ
1
– коэффициент теплопроводности первой жидкости при 20
о
С,
Вт/м К;
ρ
1
– плотность первой жидкости при 20
о
С, кг/м
3
;
2
22
, λ ,ρC
- соответственно теплоемкость, теплопроводность,
плотность эталонной жидкости.
Пример 1. Составить формулы для расчета средней массовой и
объемной теплоемкостей при постоянном давлении и постоянном объе-
ме для кислорода, если известны формулы для расчета мольной тепло-
емкости:
μ
29,56 0,0034 кДж/кмоль град;
P
Ct=+
μ
21, 25 0,0034 кДж/кмоль град.Ct
ν
=+
Решение. Используем для определения соотношения между теп-
лоемкостями:

17
μμ
;;
μ 22, 4
P Р
P Р
C С
C С
′
==
29,56 0, 0034
0,924 0,000106 кДж/кг град;
32 32
Р
С tt=+ ⋅=+
21, 25 0,0034
0,664 0, 000106 кДж/кг град;
32 32
С tt
ν
=+ ⋅=+
3
29,56 0,0034
1,319 0,000152 кДж/м град;
22, 4 22, 4
Р
Ctt
′
=+ ⋅=+
3
ν
21, 25 0,0034
0,949 0,000152 кДж/м град.
32 32
Ctt
′
=+ ⋅=+
Пример 2. Какое количество теплоты отводится от 1кг дымовых
газов в газоходе котла, если при постоянном давлении температура их
понижается от 900
о
К до 500
о
К. Состав дымовых газов в объемных
процентах: СО
2
– 11 %; О
2
– 7 %; N
2
– 82 %.
Рещение. Количество теплоты, которое отводится дымовыми га-
зами, вычисляется по уравнению [5]:
.
P
QmC T=⋅ ⋅Δ
(1.4.15)
Следовательно, первым этапом расчета будет вычисление массо-
вой изобарной теплоемкости смеси газов
P
C
. Но прежде чем присту-
пить к расчету теплоемкости смеси газов, необходимо по зависимости
рассчитать среднюю теплоемкость каждого газа в заданном интервале
температур. Выписываем по справочным данным значения массовой
изобарной теплоемкости заданных компонентов смеси при температу-
рах 900
о
К и 500
о
К [5]. Тогда
2
CO 900
1, 0463 900 0,9207 500
1, 203 кДж/кг К;
300
900 500
P
C
⋅− ⋅
==
⋅
2
O 900
0,996 900 0,939 500
1, 067 кДж/кг К;
500
900 500
P
C
⋅− ⋅
==
⋅

18
2
N900
1, 0697 900 1,0362 500
1,112 кДж/кг К.
300
900 500
P
C
⋅− ⋅
==
⋅
После пересчета объемного состава смеси на массовый имеем
2
СО
11 44
0,1611;
11 44 7 32 82 28
у
⋅
==
⋅+⋅+⋅
2
О
732
0,0746;
3004
у
⋅
==
2
N
82 28
0,7643.
3004
у
⋅
==
Средняя теплоемкость смеси газов в интервале температур
200÷600
о
С
0,1611 1,203 0,0746 1,067 0,7643 1,112
PP
i
C у C=⋅= ⋅+ ⋅+ ⋅=
∑
1,123 кдж/кг К.=
Подставим рассчитанную теплоемкость в формулу:
11,123 (900 500) 449, 2 кДжQ =⋅−=
Вопросы и задания для самоконтроля
1. Что называется средней и истинной теплоемкостью газов?
2. В каких случаях можно принимать теплоемкость газов величиной
постоянной и не зависящей от внешних условий (давления и темпе-
ратуры)?
3. Объясните физическую причину зависимости теплоемкости реаль-
ных газов от давления и температуры.
4. Почему теплоемкость при р = const больше, чем в процессе при
v =
const ? Какими уравнениями связаны между собой эти теплоемкости?
5. Как определить объемную и массовую теплоемкости газа по его
мольной теплоемкости?
6. Покажите на примере зависимость теплоемкости газа от особенно-
стей термодинамического процесса?

19
7. Почему мольная теплоемкость газа в процессе при р = const изменя-
ется с увеличением атомности газа? Какова ее величина?
8. Почему у разноатомных газов массовые удельные теплоемкости уве-
личиваются при уменьшении их молекулярной массы?
9. В чем разница практического определения теплоемкости газа по
формулам истинной и средней теплоемкости в пределах изменения
температуры
от t
1
до t
2
?
10. Почему разность мольных теплоемкостей μс
р
- μс
v
для всех газов и
их смесей – величина постоянная, а разность массовых теплоемко-
стей с
р
- с
v
зависит от рода газа?
11. В каких пределах может изменяться величина теплоемкости газа и
какой фактор более существенно на нее влияет?
12. Написать уравнение для количества теплоты, выраженное через
среднюю теплоемкость.
13. Объясните величину
2
1
t
m
t
Cp . Как она определяется?
14. Чем отличается теплоемкость идеальных и реальных газов?
15. Как определить среднюю теплоемкость в интервале от t
1
до t
2
, поль-
зуясь таблицами теплоемкостей от 0
о
до t
о
С?
1.5. Первый закон термодинамики
Первый закон термодинамики является частным случаем всеоб-
щего закона сохранения и превращения энергии, согласно которому
энергия не исчезает и не появляется вновь, она лишь переходит из од-
ной формы в другую. Закон сохранения и превращения энергии являет-
ся фундаментальным законом природы, который получен на основе
обобщения огромного количества экспериментальных данных и приме-
ним ко всем явлениям природы, поэтому существует несколько форму-
лировок первого закона термодинамики:
1. Энергия не творится и не исчезает. 2. В любой изолированной
системе общий запас энергии остается постоянным. 3. Нельзя построить
машину, которая работала бы без доставки энергии извне.
Первый закон термодинамики: теплота, сообщенная
термодина-
мической системе, идет на приращение ее внутренней энергии и на со-
вершение внешней работы.
Внутренняя энергия- это свойство самой системы, она характе-
ризует состояние системы. Внутренняя энергия идеального газа состоит
только из кинетической энергии движущихся молекул и является функ-
цией температуры. Изменение внутренней энергии не зависит от харак-
тера процесса
, а определяется лишь начальным и конечным состоянием
системы:
20
()
21
.UC TT
ν
Δ= ⋅ −
(1.5.1)
Работа в термодинамике, также как и в механике, определяется
произведением действующей на рабочее тело силы на путь ее действия:
2
1
L
Pd
ν
=
∫
, (1.5.2)
откуда следует, что:
если dL>0 – работа расширения тела всегда положительна, т. е.
тело само совершает работу;
dL <0 – работа сжатия тела отрицательна, т. е. на сжатие тела за-
трачивается работа извне.
Единицей измерения работы в системе СИ является джоуль (Дж).
Теплота является формой движения мельчайших частиц тела. Пе-
редача теплоты от
одного тела к другому осуществляется либо путем
непосредственного контакта между ними (теплопроводность, конвек-
ция), либо на расстоянии (излучение). Во всех случаях передача тепло-
ты возможна, когда температуры тел различны.
Поэтому теплота и работа – это энергетические характеристики
процессов механического и теплового взаимодействий системы с окру-
жающей средой. Они характеризуют те количества энергии
, которые
переданы системе через ее границы в определенном процессе.
Таким образом, первый закон термодинамики для закрытой тер-
модинамической системы в дифференциальном виде можно записать
так:
dQ = dU + dL
Полученное уравнение является математическим выражением
первого закона термодинамики, каждый из трех членов может быть «+»,
«-» или равен нулю. Рассмотрим некоторые случаи:
1. dQ=0 – теплообмен системы с
окружающей средой отсутствует,
т. е. теплота к системе не подводится и не отводится от нее. Этот про-
цесс называется адиабатным. Уравнение для адиабатного процесса
имеет вид
dL = -dU
2. dL=0 – работа отсутствует, следовательно объем тела не изме-
няется (процесс изохорный). Уравнение для изохорного процесса –
dQ=dU.
Таким образом, количество теплоты, подведенное к системе,
рас-
ходуется на увеличение внутренней энергии системы.
