Эглинтон Дж., Мэрфи М.Т.Дж. (ред.) Органическая геохимия
Подождите немного. Документ загружается.


материала в отдельных главах. Тем не менее это первая книга, в которой
тщательно подобраны и взаимно увязаны специфические вопросы, изучае-
мые этой особой областью науки. Во многих главах даны подробные описа-
ния практических способов извлечения, разделения, исследования и иденти-
фикации органических веществ и индивидуальных соединений, т. е. в книге
сведено воедино множество методов исследования, применяемых в органи-
ческой геохимии. В некоторых случаях приведены краткие словари специаль-
ных терминов. Мы попытались распределить весь объем материала в прибли-
зительном соответствии с уровнем современных знаний в каждой отдельной
области исследования.
Все авторы являются активными исследователями, работающими над
решением проблем, затрагиваемых в написанных ими главах. Описывая
соответствующие вопросы, они преследовали цель составить критические
обзоры по избранным работам, далеко не исчерпывающие все накопленные
данные. Большинство глав снабжено библиографией вплоть до начала
1967 г. Самые важные из работ 1968 г. приведены в дополнениях к списку
литературы. Таким способом мы надеялись несколько компенсировать
задержки, по-видимому неизбежные при составлении и издании книги такого
объема.

ГЛАВА I
ОРГАНИЧЕСКАЯ ГЕОХИМИЯ
(подход химика-органика)
Дж. Эглинтон
Отдел органической геохимии,
Химическое училище
Бристольский университет,
Бристоль, 8, Англия
I. ВВЕДЕНИЕ
Цель написания этой главы — изложение предпосылок и методов «мо-
лекулярной органической геохимии». Этот термин включает определение
характеристик органического вещества на том молекулярном уровне, на
каком оно находится в отложениях и в природных условиях вообще. Наи-
большая вероятность установления прочных связей между соединением
и его прошлой историей возникает тогда, когда структура соединения из-
вестна. Многие из последующих глав иллюстрируют это положение и дают
подробный ключ к литературе.
Быстрым темпам развития органическая химия обязана главным обра-
зом появлению улучшенных методов разделения и правильной характери-
стики индивидуальных соединений, в особенности соединений липидного
(жирорастворимого) типа. В этой главе описаны липиды, полученные из гео-
логических источников — «геолипиды», — а также структурные и причин-
ные связи между ними и биологически синтезированными «биолипидами».
Органическая геохимия, «естественный продукт» органической химии,
рассматривает весь сложный путь углерода в природе. Такие аналитические
методы, как газовая хроматография и масс-спектрометрия, дали химику-
органику возможность изучать компоненты отдельных растений и животных,
работать со сложными смесями соединений, содержащихся в горных поро-
дах. Метод радиоактивной метки, новое средство изучения последователь-
ных биогенетических превращений, должен быть применен и в «геогенетиче-
ских» исследованиях, включая прослеживание хода реакций в геологиче-
ских условиях.
Прочные ковалентные связи углерода (С—С) часто остаются нетронутыми
в течение всего периода накопления и диагенеза отложений; это приводит
к мысли о том, что сохраняется хотя бы часть углеродного скелета липидной
молекулы. Ясно, что протекают окисление, восстановление и другие реакции,
однако изменившиеся молекулы все еще можно коррелировать с молекулами
13

их биологических предшественников по углеродным скелетам. Такие соеди-
нения называют биологическими метками.
Присутствующие в геосфере органические вещества не обязательно
имеют биологическое происхождение. Общий интерес вызывает изучение
подлинно абиогенного вещества, которое имело бы отношение к таким про-
блемам, как возникновение жизни или состав внеземных проб. Органиче-
ская геохимия охватывает все эти вопросы, в том числе изучение природных
сред. Общепринятый термин «биогеохимия» более ограничен по содержанию
и, по мнению автора, относится к изучению роли живых организмов в отло-
жении осадков и образовании минералов.
Органическая геохимия вносит вклад в понимание процессов естествен-
ной эволюции. Одна из ее сторон соприкасается со сравнительной биохи-
мией, изучая приложение последней не только к современности, но и к про-
шедшим эрам. В последнее время в биохимии организмов наметились два
основных направления: 1) исследование образцов горных пород в надежде,
что в них еще хранится некоторая информация в виде структуры протеинов,
вторичных метаболитов и т. д.; 2) изучение современных живых организмов
и проведение филогенетических сравнений, исходя из которых можно попы-
таться вывести эволюционную последовательность в ходе биохимических
процессов; это направление известно под различными наименованиями:
палеобиохимия, эволюционная биохимия, химическая палеогенетика.
Первое направление — прямое исследование ископаемых материалов —
составляет основное содержание этой книги, но с акцентом на вторичные
метаболиты, которые, к сожалению, имеют меньшее значение для эволю-
ционных обобщений, чем нуклеиновые кислоты. Второе направление — эво-
люционная биохимия — добилось значительного успеха в сравнении последо-
вательности аминокислот в некоторых важнейших протеинах, выделенных
из различных образцов. Если одни из этих молекул, например гемоглобин,
заметно изменчивы, то другие, например цитохром «С», характеризуются
малыми различиями.
Органическая геохимия имеет экономическое и социальное значение.
Выявление происхождения ископаемых топлив (торфа, угля, нефти и др.),
их изучение и рациональное химическое использование — вот главные
области применения знаний, накопленных этой дисциплиной. Много инфор-
мации, по-видимому, осаждается в архивах нефтяных компаний и в настоя-
щее время недоступно. Изучение внешней среды, возможно, особенно ценно
для будущего, так как правильное планирование и химический контроль
над использованием природных и созданных руками человека ресурсов
будет становиться все более важным для развития всей цивилизации.
II. ЗНАЧЕНИЕ МОЛЕКУЛЯРНОЙ СТРУКТУРЫ И ИЗОБРАЖЕНИЕ МОЛЕКУЛ
Для того чтобы оценить цели, методы и результаты органической гео-
химии требуется некоторое знание органической химии. Детальное изло-
жение этой дисциплины не укладывается в рамки данной книги, читатель
может обратиться к таким источникам, как монографии [1—7]. Ниже дан
краткий перечень понятий, достаточный для изучения материала, изложен-
ного в настоящей книге.
А. Соединения углерода
Органическая химия — химия соединений углерода. Это название сло-
жилось исторически благодаря тому, что живые организмы избрали углерод
в качестве строительного материала. Четыре тетраэдрически расположенные
14

валентности атома углерода (I) обусловливают возможность существования
бесчисленного ряда трехмерных структур с использованием связей с другими
атомами углерода и с атомами других элементов, например водорода, азота,
серы, кислорода, фосфора и т. д. (рис. 1-1, а). Элементарный углерод в ал-
мазе (II) представляет собой множество трехмерно расположенных атомов,
прочно взаимосвязанных четырьмя ковалентными связями на каждый атом
(зр
3
-орбитали, а-связь). В графите (III) атомы углерода взаимосвязаны
только тремя ковалентными связями (типа sp
2
; а-связи и распределение
л;-электронов), в результате чего образуются плоскости, состоящие из тесно
связанных атомов. Эти плоскости свободно уложены одна над другой и легко
смещаются относительно друг друга. Простая (сг) связь G—С имеет длину
около 1,5 А (1 A = IO
-8
см).
Углеводороды — соединения, состоящие только из углерода и водо-
рода, — содержат связанные между собой атомы углерода, к которым при-
соединено столько атомов водорода, сколько необходимо для насыщения
всех валентностей. Органические соединения можно описывать и изображать
различными способами: общим названием, эмпирической, перспективной,
краткой скелетной и традиционной формулами (рис. 1-1, б). В этане (IV)
наблюдается более или менее незатрудненное вращение вокруг простой
связи С—С. В циклогексане (F) эта вращательная свобода приводит к образо-
ванию кольцевой структуры, которая гибка и может «перескакивать» из одной
предпочтительной формы (конформера) в другую с небольшими затратами
энергии. Однако в адамантане (VI) углеродный каркас жесткий. Сходство
между ячейкой алмаза и адамантановой структурой, а также между графи-
том, бензольной (VII) и фенантреновой (VIII) структурами очевидно. Ана-
логично изображаются соединения, включающие другие элементы (рис. I-I, в).
Изомерные соединения (имеющие одну и ту же эмпирическую формулу),
различающиеся порядком присоединения атомов, называют структурными
изомерами или изомерами положения (например, н- и изобутаны). Изомеры
с различными способами ориентации атомов в пространстве, но с одинаковой
общей структурой носят название стереоизомеров (см. раздел II.Б). В по-
следнем случае возможны различные варианты. Если молекулы компонен-
тов асимметричны и являются зеркальным отражением одна другой, то их
именуют энантиомерами. Если же они не являются зеркальными отображе-
ниями друг друга, их называют диастереоизомерами или диастереомерами.
Особый вид диастереоизомерии — геометрическая изомерия у двойной связи
например, цис- и транс-бутены-2 составляют пару геометрических изомеров).
Б. Стереохимия
Значение стереохимии, вытекающей из жестко направленной природы
валентностей углерода, нельзя переоценить, так как она определяет мно-
жество важнейших характеристик и свойств органических соединений [8].
Хорошо известная оптическая активность органических веществ биологи-
ческого происхождения почти всегда связана с присутствием асимметриче-
ских атомов углерода, т. е. атомов, соединенных с четырьмя различными ато-
мами или группами. Молекулы, содержащие такие атомы, асимметричны
(не имеют ни плоскостей, ни центров, ни осей симметрии*) и существуют
* Это положение автора нуждается в уточнении. Асимметричные молекулы (напри-
мер, трансЛ, 3-диметилциклопентан) могут иметь ось симметрии; более правильным
является термин «хиральные», а не «асимметричные». См. Э. Илиел. Основы стереохимии.
M., «Мир», 1971, с. 17. — Прим. ред.
15
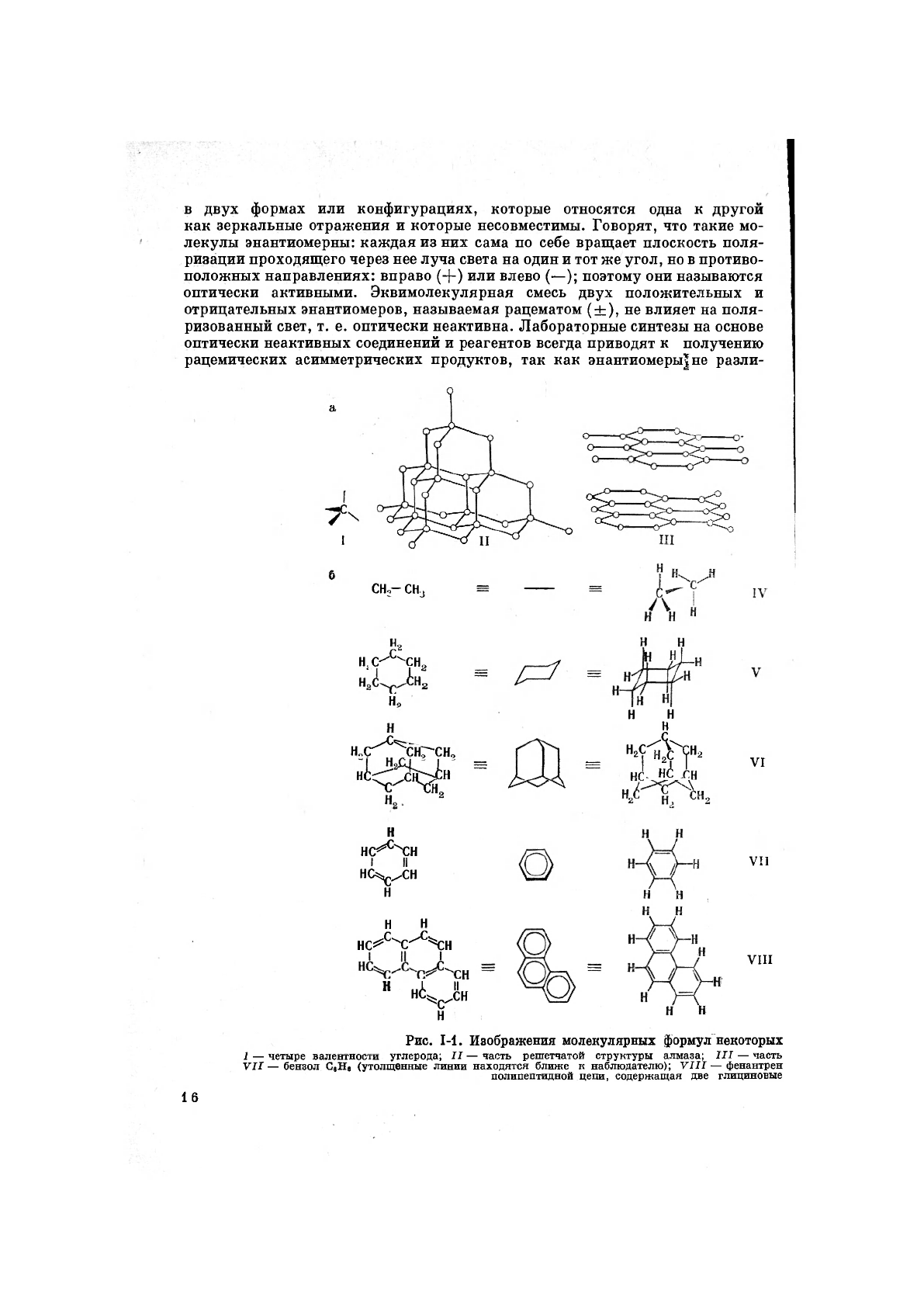
в двух формах или конфигурациях, которые относятся одна к другой
как зеркальные отражения и которые несовместимы. Говорят, что такие мо-
лекулы энантиомерны: каждая из них сама по себе вращает плоскость поля-
ризации проходящего через нее луча света на один и тот же угол, но в противо-
положных направлениях: вправо (+) или влево (—); поэтому они называются
оптически активными. Эквимолекулярная смесь двух положительных и
отрицательных энантиомеров, называемая рацематом (±), не влияет на поля-
ризованный свет, т. е. оптически неактивна. Лабораторные синтезы на основе
оптически неактивных соединений и реагентов всегда приводят к получению
рацемических асимметрических продуктов, так как энантиомеры|не разли-
I
CHq сн
H
i
C-
x
^CH
Н„
НХ-^^СНГ-СН,
H H
H
H
2
C^H
2
VI
H
НС^^СН
HO^CH
H
VIII
H H
нс^с-^Чн
Н
Hi
4
JH
H
Рис. 1-1. Изображения молекулярных формул некоторых
1 — четыре валентности углерода; II — часть решетчатой структуры алмаза; III — часть
VII — бензол С,Н» (утолщенные линии находятся ближе к наблюдателю); VIII — фенантрен
полипептидной цепи, содержащая две глициновые
VIl
1 6

чаются по содержанию внутренней энергии и другим физическим и хими-
ческим свойствам (за исключением асимметрии).
Синтезы под действием ферментов биологического происхождения,
а также синтезы целых клеток или организмов почти неизменно дают один
из энантиомеров. Так, биологический синтез использует только L-амино-
кислоты, причем стереохимический контроль определяется асимметричной
структурой молекул ферментов (которые сами построены только из L-амино-
кислот). Для аминокислот L-ряда характерно замещение, показанное на
рис. 1-2. Группы NHJ и COgf являются активными полярными частями
СО
СО.
2
г 1 •
+ '
u
н—С -NH
H
3
N-C-H
CH
!
CH
3
W
d+r7
'
м
^
7
Рис. 1-2. Абсолютные конфигурации !,-(слева) и D-ала-
нин (справа).
B живых организмах преобладают L-энантиомеры а-аминокислот.
молекулы аланина и, очевидно, непосредственно взаимодействуют с асиммет-
рической поверхностью фермента при таких реакциях, как присоединение
к растущей полипептидной цепи. Оптическая активность органических
соединений служит основным доказательством создания их живыми орга-
низмами.
Если в молекуле больше одного (скажем, п) центра асимметрии, то воз-
можно образование нескольких (2
П
) конфигурационных стереоизомеров.
Их можно сгруппировать в энантиомерные пары (рацемические модифика-
ции) диастереомеров. Однако в некоторых соединениях полного числа (2
П
) сте-
реоизомеров не достигается из-за существования мезосоединений, в которых
н
\ ^
h
ч
А пи ж
+
+
H
3
N-CH
2
-CO
2
- = H
3
N^CO
2
- s 1 IX
н N-CH(CH
3
)-CO
2
= H
3
N COj
T
J-NH—CH
2
-CO-NH-CH(CH
3
)-CO-NH-CH
r
-CO —} XI
— H
0
[ H О
н
О
простых углеводородов (а), а-аминокислот (б) и полипептидов (в).
слоистой структуры графита; IV — этан C
j
H
e
; V — циклогексан C
e
H
12
; VI — адамантан C
10
H
le
;
C
14
H
10
; IX — глицин C
2
H
5
O
2
; X — аланин C
3
HjO
2
(показаны в форме цвиттерионов); XI — часть
и одну аланиновую единицы (-гли-ала-гли-).
2 Заказ 1039 17

одна половина молекулы является зеркальным отражением другой по-
ловины. Ориентация центров по отношению друг к другу в пределах од-
ной молекулы называется относительной конфигурацией. Для определения
абсолютной конфигурации надо знать фактическую ориентацию связей
у центров. Например, в соединении, известном как L (+)-аланин (рис. 1-2),
группа NHJ находится слева, когда метильная и карбоксильная группы
расположены справа от наблюдателя. Существуют такие условные обозна-
чения абсолютной конфигурации асимметрических центров в молекуле:
L и D, а также более новые S (левый) и R (правый).
В. Структурная изомерия
Для каждой из эмпирических формул CH
4
, C
2
H
6
и C
3
H
8
существует
только один способ соединения атомов при условии полного насы-
щения валентностей углерода (4) и водорода (1). Каждой из этих формул
Этаи Пропан н-Бутан И зоб у тан
C
2
H
6
C
3
H
6
C
4
H
10
C
4
H
10
^^ А
н-Пентан 2-Метилбутан 2,2-йиметилпропан
C
5
H
12
C
5
H
12
C
5
H
12
Рис. 1-3. Сокращенные скелетные формулы алканов
C/jHjn+g-
отвечает единственная молекулярная структура. Эти соединения предста-
вляют собой три первых полностью насыщенных углеводорода — алкана.
Этан и пропан формально являются членами гомологического ряда нормаль-
ных (н-) алканов CH
3
(CH
2
)
n
CH
3
, где п = 0, 1, 2, . . ., т. е. при увеличении
числа атомов углерода в молекуле на единицу к ней прибавляется одна мети-
леновая (CH
2
) группа (рис. 1-3). к-Бутан не является единственным углево-
дородом с формулой C
4
H
10
: существует структурно изомерное соедине-
ние — изобутан. Последний не принадлежит к гомологическому ряду «-ал-
канов, так как его углеродный скелет разветвлен.
Количество изомерных алканов С„Н
2га+2
для каждой эмпирической
формулы резко возрастает при увеличении числа атомов углерода (значе-
ния п); так, при п = 5 число изомеров равно 3, при п = 8 — 18, при п =
= 10 — 75. Число возможных алканов (структурных изомеров) с 19 атомами
углерода достигает почти 100 ООО.
III. УСТАНОВЛЕНИЕ СТРУКТУРЫ МОЛЕКУЛ ХИМИЧЕСКИМИ
И ФИЗИЧЕСКИМИ МЕТОДАМИ
А. Выделение и разделение липпдов
Для выявления структуры молекул следует использовать методы, при-
менимые в микромасштабе (скажем, 10~
в
г =
1
мкг), так как количества гео-
липидов, подлежащие изучению, часто очень малы. Проблемы, связанные
с экстракцией геолипидов из содержащего их материала, будут рассмотрены
в последующих разделах.
18

Способы выделения и разделения липидов основываются частично на
заранее известной липидной природе молекул, а частично на количестве
и свойствах присутствующих полярных групп. Углеводородные части
молекул липидов обусловливают растворимость в сравнительно неполярных
органических растворителях, например в изооктане, бензоле, толуоле («по-
добное растворяется в подобном»). Разнообразные полярные компоненты,
входящие в состав липидной молекулы, снижают растворимость в углеводо-
родных растворителях. Эффективны более полярные растворители: эфир,
хлороформ, метанол.
Взаимодействия между молекулярными группировками приводят к уве-
личению растворимости или при наличии жидкой и твердой фаз к адсорбции.
Примерами таких взаимодействий являются возникновение водородных
связей и комплексообразование (рис. 1-4): благодаря образованию водород-
ной связи липид, содержащий гидроксильную группу, лучше растворяется
S+ S- R
1
5+ S- R
1
RO-H -<
R
, CI
3
C-H-O^
r1
Ag— (N0")
(Решетка SiO
2
)—
Рис. 1-4. Ассоциации, возникающие при образовании водородных и я-свя-
зей.
в эфире; по той же причине хлороформ — хороший растворитель для эфиров;
ароматические углеводороды селективно адсорбируются в результате образо-
вания слабого я-комплекса при тонкослойной хроматографии на силикагеле,
импрегнированном ионами серебра (AgNO
3
— SiO
2
).
Липиды, содержащие кислотные или основные группы, обычно выделяют
и отделяют от нейтральных липидов, превращая в соли, ионный характер
которых обусловливает их растворимость в воде. Так, карбоновые кислоты
можно превратить в натриейые или калиевые соли, последние перевести
в водный слой, обработать кислотой и таким образом отделить от нейтраль-
ных липидов. Углеводородные части молекул этих солей сохраняют неко-
торую неполярность, что может приводить к трудностям при разделении:
образованию мыльных пен и т. д. Такие активные группы, как карбоксиль-
ные, легко превращаются в производные, что еще больше меняет полярность,
растворимость и молекулярный вес.
RC0
2
H + CH
2
N
2
> RCO
2
CH
3
-HN
2
. t
Молекулярный вес является важной характеристикой, так как обу-
словливает возможность некоторого разделения в микромасштабе с помощью
адсорбционной или газо-жидкостной хроматографии (ГЖХ). Так, при тонко-
слойной хроматографии (TCX) соединения с большими молекулярными
весами имеют меньшие значения R
f
, т. е. перемещаются на меньшие расстоя-
ния за тот же промежуток времени; при ГЖХ меньшее давление насыщенных
паров более тяжелых молекул приводит к большему времени удерживания —
перемещению на меньшее расстояние к выходу из колонки за то же время.
Молекулярный вес и особенно форма молекул — основные факторы, опре-
деляющие разделение с использованием внедрения в поры синтетических
цеолитов (молекулярных сит), образования кристаллов с мочевиной и тио-
мочевиной (аддуктообразования) и полимерных решеток (хроматографии
с проникновением в гель).
2*
19

Конкретные методики и их применение описаны в гл. II. При изучении
микроколичеств лшгадов приготовленные из них растворы помещают в рас-
творители, делят их на фракции, основываясь на природе и количестве
полярных и гетероатомных групп, а также на представлениях о размере
и форме молекул. В соответствии с некоторыми молекулярными характери-
стиками, главным образом с молекулярным весом, эти фракции, часто пред-
ставляющие собой классы соединений или их производных, делят хромато-
графическими способами, например ГЖХ.
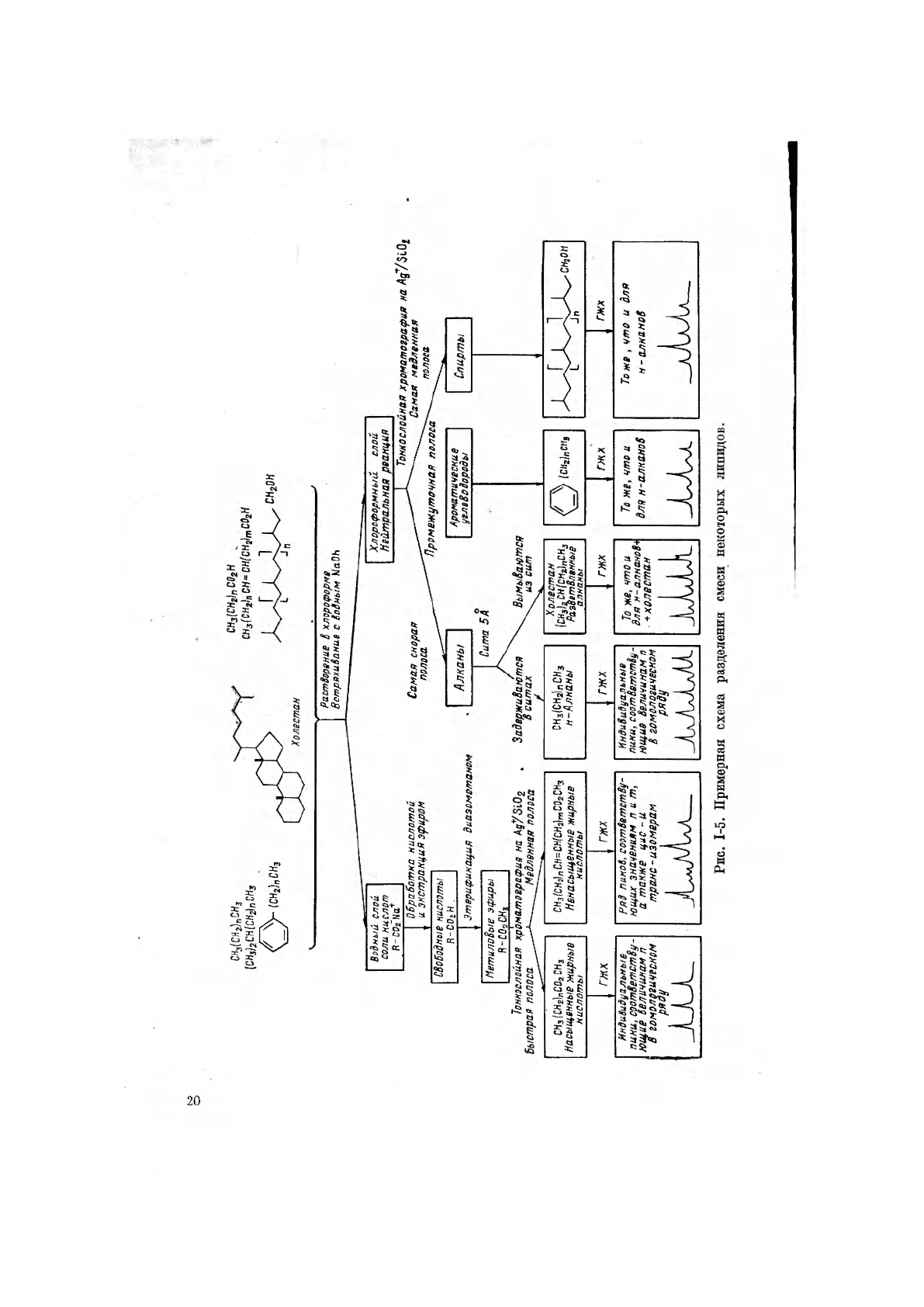
На рис. 1-5 показана примерная схема разделения специфической смеси
липидов. На конечном этапе ГЖХ дает ряд пиков, соответствующих инди-
видуальным гомологам этого класса соединений. По принятой нами схеме,
основанной на разделении на классы соединений, всю смесь переводят в со-
стояние, пригодное для газохроматографического исследования. В описывае-
мом примере смесь обрабатывали диазометаном (кислоты ->- метиловые
эфиры), а затем силилирующим агентом (спирты->-триметилсилилпроизвод-
ные). Образовавшуюся смесь углеводородов, эфиров и триметилсилильных
эфиров анализировали с помощью ГЖХ. Но при этом возникают трудности.
Во-первых, многие пики (соответственно большому количеству соединений)
будут налагаться друг на друга, а, во-вторых, с помощью других методик
(например, тонкослойной хроматографии на силикагеле, импрегнированном
Ag
+
) нельзя получить сведения о присутствующих классах соединений.
По мнению Дж. Opo [9], более результативным является применение газовой
хроматографии высокого разрешения в сочетании с масс-спектрометрией
(ГХ—MC). Благодаря использованию очень эффективных капиллярных
колонок и информации, получаемой от изучения масс-спектров, эта методика
обладает рядом важных преимуществ: она проста и почти лишена помех,
обусловливаемых загрязнениями.
Б. Характеристика и идентификация липидов
Упоминавшиеся ранее ограничения в использовании методов, приме-
нимых в микромасштабе, в еще большей мере относятся к вопросам характе-
ристики и идентификации. (Охарактеризовать органическое вещество —
значит обнаружить некоторые его молекулярные особенности, например
активные группы. Идентификацией называют признание неизвестного ве-
щества идентичным во всех отношениях другому, известному соединению.
Идентификация соединения означает также установление его структуры).
Сведения о строении соединения можно накопить различными путями,
особенно при выделении и разделении. Многое можно узнать по времени
удерживания при ГЖХ на различных стационарных фазах. Столь же ин-
формативной может быть и ТСХ, особенно если на пластинку для прямого
сравнения нанесены стандартные соединения. В сочетании с этими хрома-
тографическими методиками полезно проводить с неизвестным соединением
специфические реакции, приводящие к известным изменениям некоторых
функциональных групп (например, -CO
2
H -CO
2
CH
3
).
Ключевыми при определении структуры, несомненно, являются спектро-
метрические методы. В табл. I-I сведены данные по современным методам
идентификации липидов. Эффективна и очень чувствительна методика, со-
четающая газовую хроматографию с последующей масс-спектрометрией
{см. гл. III).
Как уже отмечалось, полное описание органического соединения кроме
общей структуры призвано определить и стереохимию. В идеальном случае
можно было бы надеяться полностью разделить отдельные чистые компоненты
21
