Дромашко С.Е. Генетика и вирусология
Подождите немного. Документ загружается.

клетки, астроциты и разнообразные линии T и B клеток, мегакариоцитов,
ткань эпителия и др.
Серологические исследования HHV-6 показали повсеместность случаев
HHV-6-инфекции: ее обнаруживали во всех странах, где проводили
исследования. Инфицирование происходит обычно на первом или втором
году жизни, и соответственно около 95% взрослых имеют антитела к HHV-6.
В Соединенных Штатах Америки, Японии установлено, что приобретенная
HHV-6 инфекция встречается преимущественно у младенцев 6–18 месяцев
жизни. Почти все дети инфицируются в возрасте до трех лет и сохраняют
иммунитет на всю жизнь. Наиболее показательно, что инфекция HHV-6,
приобретенная в детском возрасте, приводит к высокой частоте
серопозитивности у взрослых.
HHV-7 – седьмой член семейства Herpesviridае – впервые
идентифицирован в клетках здорового взрослого человека в 1990 г. HHV-7
также входит в состав рода Roseolovirus, подсемейства beta-Herpesvirus, имеет
морфологическое, антигенное и геномное сходство с HHV-6. Он имеет
нуклеокапсид, содержащий ДНК, окруженный плотной оболочкой и
липидным покрытием. HHV-7 прежде всего заражает CD4+ T-клетки, такие
как мононуклеары пуповинной и периферической крови. В эпителиальных
клетках слюнных желез он пролиферирует с выбросом вирусов. Другие
ткани, такие как кожа, молочная железа, легкие, также могут содержать
антиген HHV-7.
HHV-7 является распространенной инфекцией детского возраста,
которая проявляется несколько позже, чем HHV-6, и в более широком
возрастном диапазоне. Серологические исследования показали, что
большинство индивидуумов в Соединенных Штатах инфицируются HHV-7 к
6–10-му году жизни. HHV-7 выделяется в слюне у 95% взрослых, что
указывает на высокий уровень инфицированности населения и склонность
HHV-7 к персистенции. HHV-7 наиболее вероятно передается через слюну, в
которой вирус активно реплицируется.
HHV-8 имеет более давнюю историю. В 1872 г. венгр Мориц Капоши
впервые описал агрессивную пигментированную идиопатическую саркому
кожи. Эта опухоль сегодня хорошо известна как саркома Капоши. Ранее в
США и странах Западной Европы она была редкой патологией, ее частота
составляла менее 0,06 на 100 тыс. человек, пока не возникла эпидемия
СПИДа. Спустя сто лет, в начале 80-х гг., появились сообщения о высокой
частоте саркомы Капоши у гомосексуальных мужчин, впоследствии этот
показатель увеличился до 15–20% у гомосексуальных ВИЧ-зараженных
мужчин. В течение некоторого времени предполагалась вирусная этиология
саркомы Капоши. Ассоциация с HHV-8 и саркомой Капоши не
39

предполагалась, пока. в 1994 г. не открыли герпесвирус, связанный с
саркомой Капоши (KSHV), который сегодня классифицирован как HHV-8 в
пределах подгруппы герпесвирусов гамма-2, группы Rhadinovirus.
Выявлены вариации HHV-8 инфекции, связанные с географическими и
социоэкономическими факторами. Сероэпидемиологические исследования
показали высокие уровни заболеваемости классической саркомой Капоши в
странах Африки, особенно Центральной; низкие – в США, Японии и в
некоторых северных европейских странах, средние – в большинстве
средиземноморских стран. Основная группа риска в США – гомосексуальные
мужчины, у которых серопозитивность составляет около 40%.
Передача HHV-8 происходит различными путями, но, вероятно,
преобладает половой путь, а также передача через слюну. Это
подтверждается выявлением HHV-8 в сперме. Дополнительные пути
заражения обусловлены присутствием ДНК вируса HHV-8 в слюне и
лимфоцитах периферической крови. В Африке, где существует эндемическая
форма саркомы Капоши, инфицирование HHV-8 происходит обычно в
детстве, относительно высокий уровень инфицирования отмечается также в
период становления сексуальной активности. Перинатальный путь передачи
отмечен в странах Африки и на острове Сардиния.
Атипичная пневмония. Этот термин применяется для обозначения двух
различных заболеваний:
• В медицинской литературе под атипичной пневмонией традиционно
понимается воспаление легких, вызванное микоплазмами, хламидиями
или легионеллами и имеющее необычное для него клиническое течение.
• Новая болезнь, выявленная в ноябре 2002 г. в Китае, затем в Гонконге,
получившая там эпидемическое распространение и зарегистрированная к
маю 2003 г. в 30 других странах
(численность заболевших превысила 7 тыс.
чел., умерло – свыше 500), в средствах
массовой информации получила название
атипичной пневмонии. В медицинской
литературе по предложению ВОЗ для
обозначения ее применяется термин
тяжелый острый респираторный синдром,
или САРС (SARS – severe acute respiratory
syndrom).
Возбудитель САРС – неизвестная ранее
разновидность коронавируса (названного так в
связи с внешним сходством вирусной частицы с
короной: круглая форма с шипиками). В
40
Рисунок 11 – Предла-
гаемые в Интернете
средства защиты от
атипичной пневмонии
окружающей среде коронавирусы гибнут в течение нескольких часов, на
пластиковых поверхностях могут сохраняться до двух суток. Заражение
происходит воздушно-капельным путём, главным образом при близком
контакте с кашляющим, чихающим больным. Вирус поражает не только
верхние дыхательные пути, но и бронхи, бронхиолы, вызывая воспалительное
утолщение их стенок, пропотевание жидкости в альвеолы, нарушение
газообмена в лёгких и недостаточное поступление кислорода в кровь. На этом
фоне возникает одно- или двусторонняя пневмония, которую вызывает,
вероятно, бактериальная флора, населяющая дыхательные пути (аутофлора).
Смерть больных (летальность составляет около 7%) обусловлена тяжёлой
дыхательной недостаточностью.
Инкубационный период длится обычно от двух до семи суток, иногда до
10 суток. Болезнь проявляется остро: повышение температуры тела до 38 °С и
выше, озноб, боли в мышцах, головная боль, общая слабость. Примерно у
четверти больных наблюдаются боли в горле и насморк. Возможны
головокружение, тошнота, рвота, боли в животе, жидкий стул. Чаще через
два–три дня состояние больного улучшается, при тяжёлом течении болезни
появляются кашель, сухой или с небольшим количеством мокроты, одышка и
быстро развивается выраженная дыхательная недостаточность. При
непосредственном исследовании больного и рентгенологически выявляют
признаки пневмонии; в гемограмме чаще отмечается лейкопения. Смертность
от атипичной пневмонии составляет 3,6%. У 10-20% заразившихся болезнь
протекает в тяжелой форме и сопровождается осложнениями; 80-90%
заболевших выздоравливают.
Лихорадка, кашель и затрудненное дыхание в сочетании с данными
эпидемиологического анамнеза (контакт с больным или возможность такого
контакта, например приезд из Китая, Гонконга или Тайваня) позволяют
поставить предположительный диагноз тяжёлого острого респираторного
синдрома. При подозрении на САРС больной подлежит госпитализации и
строгой изоляции в специально оборудованном боксе. Проводят
кислородотерапию, искусственную вентиляцию лёгких, лечение
антибиотиками широкого спектра действия, а также противовирусными
препаратами (однако их эффективность не доказана). С целью
индивидуальной профилактики показаны применение противовирусных
иммуностимулирующих препаратов: арбидол, амиксин, закаливание
организма, рациональное питание, поливитамины.
4.2 «Возникающие» вирусные инфекции (вирусы Эбола, Денге,
Хантаан и др.), их свойства и распространение
Речь пойдет в основном о геморрагических лихорадках – группе острых
41
вирусных природно-очаговых болезней, характерным проявлением которых
является повышенная кровоточивость. Возбудители геморрагических
лихорадок относятся к различным семействам РНК-содержащих вирусов. Все
болезни этой группы характеризуются способностью к распространению и
тяжелым течением, относятся к опасным и особо опасным инфекционным
заболеваниям. В настоящее время в группу геморрагических лихорадок
включено 15 болезней, в том числе лихорадки Эбола, Марбург, Ласса, желтая
лихорадка, геморрагическая лихорадка Денге, лихорадка долины Рифт и др.
Это семейство филовирусов, поражающих человека и обезьян, получило
название от латинского слова "filamentous" – длинный, протяженный – в
связи с уникальной для вирусов человека формой их вирионов в виде
длинных цилиндрических палочек. Семейство в настоящее время собираются
разделить на два вида: Эбола-вирусы и Марбург-вирусы.
Вирус Эбола. Этот вирус был идентифицирован в 1976 г., когда
одновременно вспыхнули две эпидемии: на юге Судана (284 случая,
летальность 53%) и на севере Заира (318 случаев, летальность 88%).
Серологические тесты показали, что два штамма, заирский и суданский, не
были одинаковыми. Свое имя вирус получил от реки Эбола, впадающей в
реку Конго. Эпидемия вспыхнула в 55 деревнях, прилежащих к реке, и
внезапно прекратилась. Другой штамм вируса Эбола был выделен в 1989 г. во
время вспышки инфекции в обезьяньем питомнике в Рестоне, США.
Обезьяны были привезены с Филиппинских островов. Четыре сотрудника
американского питомника и четыре – филиппинского были
серопозитивными, но ни у кого из них не развилась геморрагическая болезнь.
Этот рестонский штамм вируса Эбола, или вирус Рестон, по-видимому,
является высокопатогенным для обезьян, но не для человека. Сродни Эбола –
вирус Марбург, который впервые проявился на девять лет раньше, еще в 1967
г. в Европе (Югославия и Германия – города Марбург и Франкфурт), куда
был перенесен на обезьянах, завезенных из Уганды (район оз. Виктория).
Заболели работники фармацевтических заводов, участвовавшие в заборе
почек у экспортированных обезьян. Всего заболел 31 человек, из которых
семеро умерли.
Лишь вирус бешенства, дальний родственник филовирусов, превосходит
их по смертности, достигающей в случае вируса Эбола практически 100% –
при попадании в кровь и отказе или невозможности срочно ввести вакцину.
Вирионы этого семейства многообразны по форме, встречаются
сигмообразные, U-образные формы, однако основной является
палочковидная форма с диаметром 80 нм и длиной от 790 нм (вирус Марбург)
до 970 нм (вирусы Эбола и Рестон). При рассмотрении их поперечных срезов
в электронном микроскопе обнаруживаются внутренний нуклеокапсид
42
(комплекс нуклеиновой кислоты с белками, в основном белком NP)
диаметром 50 нм, окруженный липидной оболочкой, и внутреннее
пространство с малой электронной плотностью диаметром 20 нм. Такие
параметры предполагают спиральную форму нуклеокапсида с пустой
сердцевиной, что подтверждается и видимой продольной периодичностью
вирионов с шагом 5 нм. На поверхности вирионов, образованной липидной
оболочкой, которую вирус заимствует у клетки-хозяина, можно видеть шипы
длиной 10 нм. В состав вирионов входят все кодируемые геномом вируса
белки, что является обычным для большинства вирусов с негативным РНК-
геномом.
Генетический материал вируса представлен одноцепочечной
неинфекционной РНК негативной полярности, что означает неспособность
этой цепи РНК выступать в качестве матрицы для синтеза белка. РНК имеет
молекулярную массу 4,2·10
6
дальтон, что соответствует длине примерно в
19200 нуклеотидов и 1,1% массы всего вириона.
Полные нуклеотидные последовательности геномов вирусов Эбола и
Марбург определены несколько лет назад российскими, германскими и
американскими учеными. В плюс-цепи РНК (она комплементарна геномной
РНК) выявлены семь рамок трансляции белков. Строение генома вируса
Марбург приведено на рисунке 12. Оно сходно со строением геномов вирусов
бешенства и кори, однако имеет некоторые особенности.
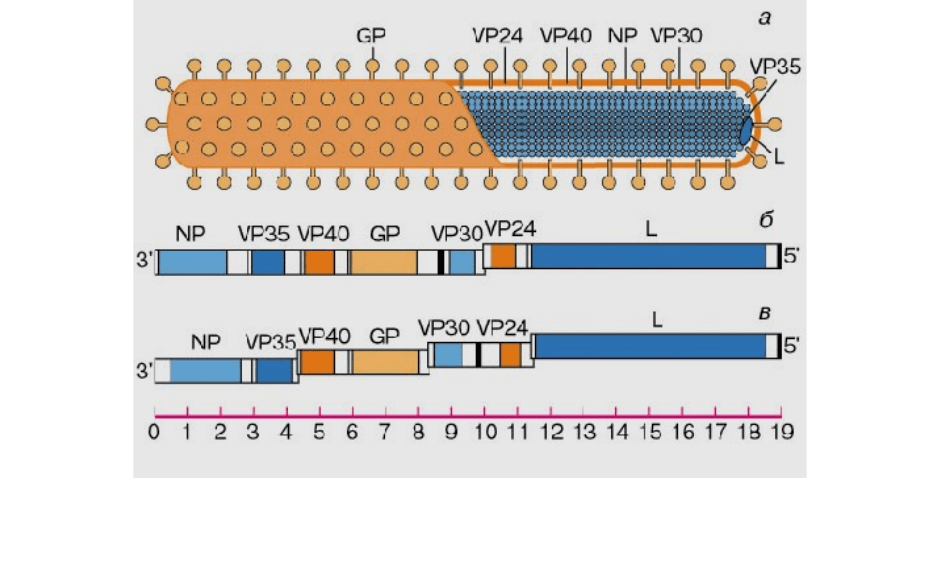
Рисунок 12 – Схема строения вириона филовируса (а), карта генома
вируса Марбург (б) и карта генома вируса Эбола (в)
43

Примечание. На схеме устройства вириона показано, что РНК
находится в составе нуклеокапсида (или "ядра" вируса) и связана с белками
NP и VP30, а белки VP40, VP24 и GP связаны с липидной мембраной. При
этом основным поверхностным белком является белок GP, который
образует шипики на поверхности вириона. Масштабная линейка для карты
генома проградуирована В тысячах нуклеотидов
Каждый белок филовирусов кодируется своей собственной матричной
РНК. В свою очередь эти матричные РНК считываются с минус-цепи
вирионной РНК с помощью вирусспецифической РНК-полимеразы,
кодируемой геном L.
• Гликопротеин (GP) является единственным поверхностным белком
вириона. Его тримеры образуют шипы на поверхности вириона и
отвечают, по-видимому, за первичное присоединение вируса к клетке.
Этот белок сильно модифицирован (в отличие от большинства
аналогичных белков других вирусов) остатками олигосахаридов.
Российские исследователи недавно выявили, что один из участков этого
белка похож по структуре и свойствам на фрагменты белков вирусов
иммунодефицита человека и животных. Предполагается, что это является
одной из причин необычно высокой патогенности филовирусов.
• Внутренний белок VP40 является одним из основных по содержанию в
вирионе белков. Видимо, он выстилает внутреннюю поверхность
липидной мембраны и связан с ней. Одновременно он является наружным
белком нуклеокапсида – "вирусного ядра".
• Внутренний белок VP24 также связан с липидной мембраной. Функция
его неизвестна, но по последним данным он может играть роль при
"раздевании" вируса в процессе его проникновения в клетку.
• Белок нуклеопротеин (NP) имеет ярко выраженный положительный заряд
и связан в вирионе непосредственно с РНК.
• Внутренний белок VP30 является минорным белком вириона, функция его
неизвестна.
• Внутренний белок VP35, по-видимому, играет регуляторную роль при
размножении вирусного генома.
• Полимераза (L-белок) – самый большой по размеру белок вируса. Его
функция – синтезировать матричные РНК с минус-цепи вирионной РНК,
плюс-цепь вирионной РНК на матрице минус-цепи и на поздней стадии
саму вирионную РНК на матрице плюс-цепи. Предполагается, что
некоторые другие вирионные белки также принимают участие в этих
процессах.
До недавнего времени не было ничего известно о способе
44
проникновения этих вирусов в клетки. Однако Марк Голдсмит из
университета Калифорнии и его коллеги провели исследование, в ходе
которого выяснили, что возможным путем проникновения вирусов в клетку
может быть молекула, расположенная в оболочке клетки и отвечающая за
улавливание фолиевой кислоты (витамина группы В), влияющей на рост и
развитие. Многие клетки человеческого организма обладают специальными
рецепторами, которые улавливают этот витамин. Эксперименты,
проведенные учеными, показывали, что гликопротеины, окружающие вирус
Эбола и вирус Марбург, могут соединяться с одним из видов этого рецептора,
позволяя вирусу проскользнуть в клетку.
Азок Энтони из университета Индианы предполагает, что рецепторы
"открываются" для проникновения вируса тогда, когда в организме не хватает
фолиевой кислоты, как это нередко случается у людей, живущих в
развивающихся странах. Это ведет к тому, что при недостатке витамина в
организме остается много свободных рецепторов, а соответственно и много
мест для проникновения вируса.
М.Голдсмит сомневается в применимости больших доз фолиевой
кислоты для тех людей, которые находились в контакте с вирусами, для
профилактики заболеваний. Вместо этого он предлагает метод, пока
разработанный только в лабораторных условиях –применить антитела,
которые созданы для того, чтобы занимать рецепторы фолиевой кислоты, тем
самым заблокировав для вирусов вход в клетки.
Еще один возможный способ предотвращения заболевания, который
может быть разработан на основе результатов этого исследования, состоит в
том, чтобы ввести в организм свободные рецепторы-приманки, которые
смогут улавливать вирус, предотвращая его проникновение в клетки. По
мнению А.Энтони, этот способ может оказаться эффективным, однако
возникает проблема удаления вирусов из крови. В любом случае необходимо
убедиться, что не пострадают другие уязвимые рецепторы.
Вирус Денге (Dengue). Лихорадка Денге (по другому называется
костоломной или суставной лихорадкой) существует в двух самостоятельных
клинических формах:
• лихорадка Денге, характеризующаяся лихорадкой, интоксикацией,
миалгией и артралгией (воспаление в мышцах и суставах), а так же
лейкопенией и лимфаденитом. Боли в суставах и мышцах вынуждают
больного изменить походку – отсюда и название заболевания (от англ.
Dandy – франт);
• геморрагическая лихорадка Денге характеризуется тяжелой
геморрагической диареей, шоком и высокой летальностью.
Источником инфекции служат больной человек, обезьяны и, возможно,
45
летучие мыши.
Возбудитель, выделенный и описанный А.Себином в 1945 г., как и
возбудитель желтой лихорадки относится к вирусам семейства Togaviridae
рода Flavivirus (арбовирусы антигенной группы В), которые содержат РНК,
имеют двухслойную липидную оболочку из фосфолипидов и холестерола,
размеры вириона 40–45 нм в диаметре. Инактивируется при обработке
протеолитическими ферментами и при прогревании выше 60°С, под
влиянием ультрафиолетового облучения. Известно четыре типа вируса Денге,
различных в антигенном отношении. Вирусы Денге имеют антигенное
родство с вирусами желтой лихорадки, японского и западно-нильского
энцефалитов; размножается на культурах тканей и клетках почек обезьян,
хомяков и др. В сыворотке крови больных вирус сохраняется при комнатной
температуре до двух месяцев, а высушенный – до пяти лет.
Передача инфекции человеку осуществляется комарами Aedes aegypti,
обезьянам – A. albopictus. Комар A. aegypti становится заразным через 8–12
дней после питания кровью больного человека и остается инфицированным
до трех месяцев и более.
Болезнь распространена в тропическом и субтропическом поясах
Америки, Африки, Азии и Австралии. Первые эпидемии лихорадки Денге
зафиксированы в Северной Америке в 1780-х гг. В 1779 г. болезнь была
идентифицирована и поучила свое имя. Пандемия началась в 1950-х годах в
Юго-Восточной Азии и продолжалась до 1975 г. За последние 10–15 лет
наблюдается значительное повышение этой заболеваемости в различных
регионах. Сообщалось о значительных вспышках лихорадки Денге в КНР,
Вьетнаме, Индонезии, Таиланде и на Кубе.
46
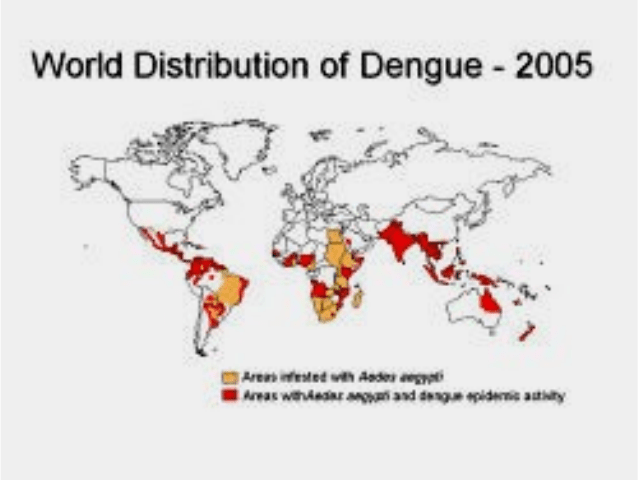
Рисунок 13 – Карта распространения лихорадки Денге
Вирус проникает в организм через кожу при укусе человека зараженным
комаром. На месте ворот инфекции через три–пять дней возникает
ограниченное воспаление, где происходит размножение и накопление вируса.
В последние 12 часов инкубационного периода отмечается проникновение
вируса в кровь. Вирусемия продолжается до третьего–пятого дня
лихорадочного периода. Денге может протекать в классической и
геморрагической формах. Строгой зависимости между типом вируса и
клинической картиной не отмечается. От больных так называемой
филиппинской геморрагической лихорадкой выделялись вирусы Денге
второго, третьего и четвертого типов, при сингапурской геморрагической
лихорадке – все четыре типа, при оценке этиологии таиландской
геморрагической лихорадки одно время писали о новых типах вируса денге
(пятом и шестом). В дальнейшем наличие этих типов вируса не было
подтверждено.
В настоящее время установлено, что геморрагическая лихорадка Денге и
шоковый синдром Денге могут вызывать все четыре серотипа вируса Денге.
В патогенезе заболевания особо важную роль играет внедрение в организм
человека вирусов первого, третьего или четвертого серотипов, за которым
через несколько лет следует и второй серотип. В развитии геморрагической
лихорадки денге особое значение имеют иммунологические факторы.
Усиленный рост вируса Денге второго серотипа происходит в
мононуклеарных фагоцитах, полученных из периферической крови
47
иммунизированных доноров или в клетках неиммунизированных доноров в
присутствии субнейтрализующих концентраций вируса Денге или
перекрестных гетеротипичных антител к флавовирусам.
Комплексы вирус-антитело присоединяются, а затем внедряются в
мононуклеарные моноциты с помощью Fc-рецепторов. Активная репликация
вируса в этих клетках может приводить к серии вторичных реакций
(активация комплемента, системы кинина и др.) и к развитию
тромбогеморрагического синдрома. Таким образом, геморрагические формы
возникают в результате повторного инфицирования местных жителей или
при первичном инфицировании новорожденных, получивших антитела от
матери. Интервал между первичным (сенсибилизирующим) и повторным
(разрешающим) заражением может колебаться от трех месяцев до пяти лет.
При первичной инфекции любым типом вируса возникает классическая
форма Денге. Впервые прибывающие в эндемический очаг заболевают только
классической формой Денге.
Симптомы и течение. Инкубационный период длится от трех до
пятнадцати дней (чаще пять–семь дней). Заболевание обычно начинается
внезапно. Лишь у отдельных больных за шесть–десять часов отмечаются
нерезко выраженные продромальные явления в виде разбитости и головной
боли. Часто в период якобы полного здоровья появляются озноб, боли в
спине, крестце, позвоночнике, суставах (особенно коленных). Лихорадка
наблюдается у всех больных, температура тела быстро повышается до 39–
40°С. Отмечаются резкая адинамия, анорексия, тошнота, головокружение,
бессонница; у большинства больных – гиперемия и пастозность лица,
отекание сосудов склер, гиперемия зева.
Вирусы Хантаан. Острое вирусное природно-очаговое заболевание,
сопровождающееся поражением почек, впервые описано советскими
исследователями на Дальнем Востоке в 1935–1940 гг. Заболевание получило
название «геморрагический нефрозо-нефрит». В это же время подобное
заболевание было описано японскими и шведскими исследователями,
изучавшими его в Маньчжурии. Первый вирус, этиологически связанный с
этими заболеваниями, был описан только в 1978 г. (вирус Корейской
геморрагической лихорадки – вирус Хантаан). Установлена его
этиологическая связь со вспышкой заболевания, произошедшей в 1951 г.
среди 3000 корейских солдат. Тогда смертность от инфекции составила 15%.
Как отдельный род в семействе буньявирусов вирус Хантаан
(Hantavirus), был выделен в 1987 г. Как и его серологические родственники
морфологически и по молекулярной организации подобен другим
представителям семейства. Они относятся к сферическим РНК-содержащим
вирусам диаметром 85–110 нм, однако характеризуются отсутствием
48
