Бойко В.В. (укл.) Фізика. Основні поняття та закони. Лабораторний практикум і збірник задач
Подождите немного. Документ загружается.

Радіус світлих кілець Ньютона у відбитому світлі:
2/)12( λRkr
k
⋅−= (k =1, 2, 3, ...),
де
k – номер кільця; R – радіус кривизни.
Радіус темних кілець Ньютона у відбитому світлі:
λkRr
k
= ( k = 0,1,2,…).
Дифракцією називається явище огинання хвилями перешкод,
які зустрічаються на їх шляху. В більш широкому розумінні – будь-
яке відхилення розповсюдження хвиль поблизу перешкод від законів
геометричної оптики та попадання їх в область геометричної тіні.
Дифракція світла спостерігається при поширенні його біля різких
країв тіл, при проходженні крізь малі отвори і щілини, при зустрічі з
мікронеоднорідностями середовища.
Кут відхилення променів, який відповідає максимуму (світлі
смуги) при дифракції на одній щілині, визначається із умови:
α sinφ = (2k+1)λ/2 (k = 0, 1, 2, 3,…),
де α – ширина щілини; k – порядковий номер максимумів.
Кут
φ відхилення променів, який відповідає максимуму (світла
смуга) при дифракції світла на дифракційній решітці (формула
дифракційної решітки), визначається із умови:
d sinφ = ± kλ (k = 0, 1, 2, 3,…),
де
d – постійна дифракційної решітки.
При дифракції на тривимірних структурах (кристалах) напрямки
дифракційних максимумів визначаються за формулою Вульфа –
Бреггів:
λ
θ kd =sin2
(k= 1, 2, 3,…).
де θ − кут ковзання (кут між напрямком паралельного пучка
рентгенівського випромінювання, що падає на кристал, та атомною
площиною в кристалі);
d – відстань між атомними площинами
кристала.
Наслідком теорії Максвелла є поперечність світлових хвиль
(див.рис.1): вектори напруженості електричного
Е
r
і магнітного
Н
r
полів хвилі взаємно перпендикулярні і коливаються
перпендикулярно вектору швидкості
v
r
розповсюдження хвилі
41
(перпендикулярно променю). Тому для опису закономірностей
поляризації світла достатньо знати поведінку тільки одного із
векторів. Як правило всі міркування ведуться відносно світлового
вектора – вектора напруженості
Е
r
. Світлова хвиля, в якій електричні
коливання (коливання вектора
Е
r
) здійснюються увесь час тільки в
одній площині називається поляризованою.
Закон Малюса:
α
2
0
cosII = ,
де
І
0
–інтенсивність плоскополяризованого світла, що падає на
аналізатор;
І – інтенсивність цього світла після аналізатора; α – кут
між напрямком коливань електричного вектора, який падає на
аналізатор, та площиною пропускання аналізатора (якщо коливання
електричного вектора падаючого світла збігаються з цією площиною,
то аналізатор пропускає це світло без ослаблення).
Закон Брюстера
Відбитий промінь на межі двох діелектриків є повністю
поляризованим при куті падіння
і
Б
, який визначається
співвідношенням:
tgi
Б
= n
21
,
де
і
Б
– кут падіння, при якому промінь, відбившись від діелектрика
стає повністю поляризованим;
n
21
– відносний показник заломлення
другого середовища відносно першого.
Деякі речовини (кварц, цукор, кіновар, водний розчин цукру,
винна кислота, скіпідар, так звані оптично активні) здатні повертати
площину поляризації навколо осі світлового пучка.
Кут повороту площини поляризації монохроматичного світла
при проходженні крізь оптично активну речовину:
а)
φ = αd ( у твердих тілах і чистих рідинах),
де
α – постійна обертання; d – довжина шляху, який пройшло світло в
оптично активній речовині;
б
) φ = [α]cd ( у розчинах),
де
[α] − питоме обертання; с – масова концентрація оптично активної
речовини в розчині, кг/м
3
.
42

5.4. Квантова оптика
Аналіз складу світлового випромінювання показав, що його
розподіл за частотами коливань не відповідає законам випромінюван-
ня, виведеним із хвильової теорії світла. Для пояснення цього факту
М.Планк сформулював гіпотезу, що світло випромінюється певними
порціями енергії – квантами. Енергія кванта визначається за фор-
мулою Планка:
hνε = ,
де
h = 6,62·10
-34
Дж·с – стала Планка; ν – частота коливань електрома-
гнітного випромінювання.
А.Ейнштейн в 1905 р. висунув гіпотезу, що світлове випроміню-
вання має дискретну природу, тобто розповсюджується в просторі та-
кож окремими квантами – частинками світлового випромінювання,
які були названі фотонами.
Випромінювання нагрітими тілами електромагнітних хвиль
за рахунок їхньої внутрішньої енергії називається тепловим випро-
мінюванням.
Теплове випромінювання характеризується суцільним спектром.
Інтенсивність і спектральний склад теплового випромінювання визна-
чається температурою тіла, його складом і станом.
Теплове випромінювання – єдиний вид випромінювання, який
може бути рівноважним. До рівноважних станів і процесів застосову-
ються закони термодинаміки.
Кількісні характеристики теплового випромінювання
1. Спектральна густина енергетичної світності (випроміню-
ваності) тіла – це потужність випромінювання з одиниці площі повер-
хні тіла в інтервалі частот одиничної ширини:
ν
.
dννν,
,
ν
d
dW
R
випр
T
+
= .
Одиниця спектральної густини енергетичної світності
()
2
м
Дж
Tν,
−R .
2. Здатність тіл поглинати падаюче на них випромінювання ха-
рактеризується спектральною поглинальною здатністю:
43

dννν,
.
dννν,
Tν,
+
+
=
dW
d
A
W
погл
.
Ця величина показує, яка доля енергії електромагнітних хвиль,
що падає на одиницю площі поверхні тіла за одиницю часу з частотою
від
ν до ν + dν, поглинається тілом.
Тіло, яке здатне поглинати повністю при будь–якій температурі
усе падаюче на нього випромінювання будь–якої частоти, називається
чорним тілом. Отже, спектральна поглинальна здатність чорного тіла
для усіх частот і температур тотожно рівна одиниці:
1
ν,
≡
А
чорне
Т
.
Поряд з поняттям чорного тіла використовують поняття сірого
тіла. Сіре тіло – це тіло, поглинальна здатність якого менша одиниці,
вона однакова для всіх частот і залежить тільки від температури, ма-
теріалу і стану поверхні тіла
(
)
1
,ν
<== constА
Т
сіре
Т
А
.
Знаючи спектральну густину енергетичної світності, можна ви-
значити інтегральну енергетичну світність (інтегральну випромі-
нюваність), яку називають енергетичною світністю тіла:
∫
∞
=
0
,ν
νdRR
TT
.
Енергетична світність тіла – це енергія, випромінювана з одини-
ці площі поверхні світного тіла за одиницю часу у всьому інтервалі
частот (довжин хвиль) від 0 до ∞.
Закон Кірхгофа
Відношення спектральної густини енергетичної світності до
спектральної поглинальної здатності не залежить від природи тіла;
воно є для усіх тіл універсальною функцією частоти (довжини хвилі)
і температури:
Tν,
Tν,
Tν,
r
A
R
=
.
Із цього закону витікає, що
r
ν,Т
– універсальна функція Кірхгофа
є спектральною густиною енергетичної світності чорного тіла.
Використовуючи закон Кірхгофа, запишемо вираз для енергети-
чної світності чорного тіла:
∫
∞
=
0
dr ν
ν,
R
Te
.
44
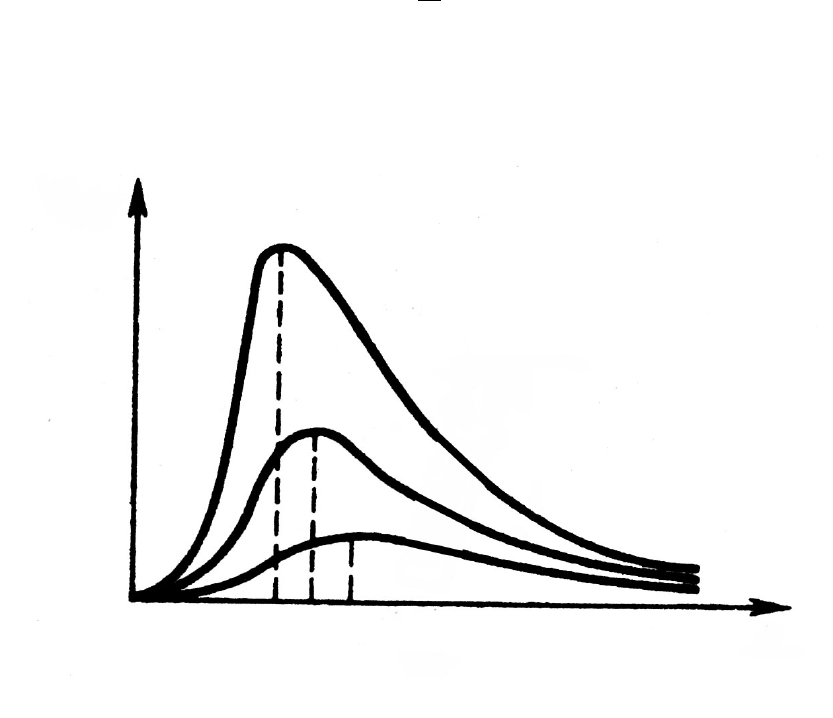
T
1
>T
2
>T
3
T
1
T
2
T
3
λ
1
λ
2
λ
3
λ
r
λ,T
Теплове випромінювання чорного тіла підлягає закону
Стефана – Больцмана і законам Віна, а розподіл енергії в спектрі
теплового випромінювання чорного тіла дає функція Планка.
Закон Стефана – Больцмана. Закон Віна
Енергетична світність чорного тіла пропорційна четвертому
степеню його термодинамічної температури:
4
TR
e
⋅= σ ,
де
σ – стала Стефана – Больцмана. Її експериментальне значення
σ = 5,67·10
-8
Вт/м
2
·К
4
.
Закон Стефана – Больцмана не відповідає на питання про
спектральний склад випромінювання чорного тіла. Із аналізу
експериментальних кривих залежності
r
λ,Т
від довжини λ при різних
температурах витікає, що розподіл енергії в спектрі чорного тіла є
нерівномірним. Всі криві мають явно виражений “max”, який зі
зростанням температури зміщується в бік більш коротких хвиль.
Німецький фізик В.Він встановив залежність:
Т
b
=
max
λ ,
тобто довжина хвилі
λ
max
, яка відповідає максимальному зна-
ченню спектральної густини енергетичної світності
r
λ,Т
чорного
тіла, обернено пропорційнa його термодинамічній температурі
(рис.3),
Рис. 3
45

де b – стала Віна, її експериментальне значення b = 2,9·10
-
3
м·К.
Закони Стефана – Больцмана і Віна є частинними законами теп-
лового випромінювання. На основі революційної квантової гіпотези,
згідно з якою електромагнітна енергія випромінюється і поглинається
у вигляді квантів, М.Планк вивів формулу для спектральної густини
енергетичної світності чорного тіла:
1
1ν2
/ν2
3
Tν,
−
⋅=
kTh
ec
h
r
π
.
Ця формула Планка не тільки узгоджується з експериментом,
але містить усі частинні закони теплового випромінювання, а також
дозволяє розрахувати сталі величини в законах теплового випроміню-
вання.
Гіпотеза світлових квантів випромінювання чорного тіла отри-
мала підтвердження і подальший розвиток при поясненні фотоефек-
ту.
Явище зовнішнього фотоефекту полягає у випусканні речови-
ною електронів під дією падаючого світла.
Закони зовнішнього фотоефекту
1. Сила фотоструму насичення пропорційна освітленості фо-
токатода.
2. Максимальна кінетична енергія фотоелектронів не залежить
від інтенсивності падаючого світла, а визначається тільки
його частотою
ν.
3. Для кожної речовини існує “ червона межа” фотоефекту,
тобто мінімальна частота
ν
0
світла, нижче якої фотоефект
неможливий.
Істотно, що фотоефект є безінерційним.
У рамках квантової теорії фотоефекту кожний світловий квант
(фотон) взаємодіє з одним електроном. Енергія падаючого фотона
hν
витрачається на здійснення електроном роботи виходу А з речовини і
на надання фотоелектрону кінетичної енергії
mv
2
/2.
За законом збереження енергії
2
2
vm
Ahν
+= .
Це рівняння називається рівнянням Ейнштейна для зовнішнього
фотоефекту.
46

З рівняння Ейнштейна випливає, що фотоефект може спостері-
гатися тільки тоді, коли енергія
hν світлового кванта (фотона), що па-
дає на поверхню металу, не менше роботи виходу
А.
Червона межа фотоефекту
ν
0
:
h
A
ν =
0
, або
A
hc
=
0
λ .
де
ν
0
– мінімальна частота світла, при якій фотоефект ще можливий;
λ
0
– максимальна довжина хвиль світла, при якій ще можливий фото-
ефект;
h - стала Планка; с – швидкість світла у вакуумі.
Маса, імпульс фотона. Корпускулярно – хвильовий дуалізм
світла
Енергія фотона
ε =hν. Його маса визначається із універсального
закону взаємозв’язку маси та енергії:
22
c
hν
c
ε
γ
m ==
.
Фотон – елементарна частинка, яка рухається зі швидкістю світ-
ла
с і має масу спокою, рівну нулю.
Імпульс
Р
γ
визначається співвідношенням:
λ
h
c
hν
c
γ
m
γ
P
=== .
Із наведених формул витікає, що фотон, як будь–яка інша час-
тинка речовини , характеризується енергією, масою та імпульсом. Ці
формули зв’язують корпускулярні характеристики фотона – масу, ім-
пульс, енергію – з хвильовою характеристикою світла – його частотою
ν.
Отже, для світла, як і будь–якого електромагнітного випроміню-
вання, притаманні одночасно корпускулярні і хвильові властивості –
корпускулярно-хвильовий дуалізм.
47

РОЗДІЛ 6. ЕЛЕМЕНТИ ФІЗИКИ АТОМА
6.1. Ядерна модель атома. Проблеми моделі
Ядерна модель атома була сформована Е.Резерфордом (1913 р.)
на основі його знаменитих дослідів по розсіюванню
α – частинок у
речовині: в центрі атома міститься масивне позитивно заряджене ядро
розміром близько 10
-15
м; навколо ядра по замкнених орбітах
обертаються електрони в області 10
-10
м, утворюючи електронну
оболонку атома; їх число дорівнює порядковому номеру елемента в
періодичній таблиці хімічних елементів Д.І.Менделєєва.
У рамках законів класичної фізики ядерна модель атома мала дві
проблеми: такий атом виявився нестійким електродинамічно (час
життя порядку 10
-11
с); у результаті випромінювання він давав би
суцільний спектр, що суперечило накопиченим дослідним даним про
спектри випромінювання атомів.
6.2. Спектральні закономірності атома водню. Емпірична
формула Бальмера. Стала Рідберга
Аналіз дослідних даних щодо випромінювання розряджених
газів (спектрів випромінювання атомів) показав, що спектри атомів
лінійчасті, що кожному газу притаманний визначений лінійчастий
спектр, спектральні лінії якого розподілені на групи (серії). Частоти
спектральних ліній окремих серій виражаються певними емпіричними
формулами.
І.Я.Бальмер, швейцарський фізик, підібрав емпіричну формулу
(узагальнена формула Бальмера), яка описує всі серії спектральних
ліній у спектрі атома водню:
)
22
11
(
nm
R −=ν
, (1)
де
m – визначає серію в спектрі; m – 1,2,3,4,5,6, а n – приймає
цілочислові значення, починаючи з
m + 1 ( визначає окремі лінії цієї
серії);
R = 3,29·10
15
с
-1
– стала Бальмера-Рідберга. Ця формула не мала
теоретичного обґрунтування.
6.3. Квантова теорія атома. Атом водню за теорією Бора
Якісно нову – квантову теорію атома побудував датський
фізик Нільсон Бор.
48

У цій теорії несуперечливим чином були зв’язані в єдине ціле
емпіричні закономірності лінійчастих спектрів, ядерна модель атома
Резерфорда, а також ідея Планка про квантовий характер
випромінювання і поглинання атомом світла.
Основою квантової теорії атома є два постулати Бора.
Перший постулат Бора (постулат стаціонарних станів): в
атомі існують стаціонарні стани ( не змінюються з часом), в яких атом
не випромінює енергію. В цих станах атома електрон, рухаючись по
коловій орбіті, повинен мати дискретні квантові значення моменту
імпульсу, які задовольняють умові:
,...),,(, 321
2
e
=
π
= n
h
nvrm
n
(2)
де
e
m − маса електрона; v − його швидкість на n −й орбіті радіуса
n
r ; h −стала Планка.
Другий постулат Бора (правило частот): при переході
електрона з однієї стаціонарної орбіти на другу випромінюється
(поглинається) один фотон з енергією:
mn
EEh −=ν , (3)
де
Е
n
i E
m
– відповідно енергії стаціонарних станів атома до і після
випромінювання (поглинання). Набір можливих дискретних частот
квантових переходів
h
EE
mn
−
=ν
(4)
і визначає лінійчастий спектр атома.
6.4. Розрахунок енергії спектра атома водню за Бором
Перший постулат Бора (2), який виражає правило квантування
стаціонарних орбіт електрона в атомі, а також другий закон динаміки
для руху електрона по коловій орбіті в центрально – симетричному
полі ядра атома водню ( ядерна модель Резерфорда)
2
2
0
2
e
4
1
n
n
n
r
e
r
vm
⋅
πε
=
(5)
утворюють систему двох рівнянь, розв’язок яких дає вираз для радіуса
n –ї стаціонарної орбіти :
49

2
0
2
2
4
em
nr
e
n
πε⋅
=
h
, (6)
де
,...,, 21
2
=
π
= n
h
h
З формули (6) випливає, що кожний атом має нескінченно
велику кількість стаціонарних станів, радіуси орбіт яких
збільшуються пропорційно до
n
2
.
Визначивши повну енергію електрона в атомі водню (а також в
одноелектронних атомах
Не
+
, Li
2+
тощо), яка складається із
кінетичної і потенціальної енергії в полі ядра, з урахуванням
квантових значень радіуса
n – ї стаціонарної орбіти (6) одержимо, що
енергія електрона може приймати тільки такі дискретні значення:
2
0
2
4
2
8
1
ε
⋅−=
h
em
n
E
e
n
, (7)
де знак мінус означає, що електрон зв’язаний з ядром і для його
віддалення від ядра необхідно виконати тим більшу роботу, чим
менше
n (енергія іонізація атома).
Із формули (7) випливає, що енергетичні стани атома
утворюють послідовність енергетичних рівнів. Ціле число
n , яке
визначає енергетичні рівні атома, називається головним квантовим
числом.
Енергетичний стан з
n = 1 є основним станом атома; стани з
n >1 є збудженими. Надаючи n різних числових значень у формулі(7),
одержимо для атома водню можливі рівні енергії Е
n
, схематично
представлені на рис.1.
Енергія атома зі збільшенням
n зростає та енергетичні рівні
наближаються до межі, яка відповідає значенню
n = ∞.
Мінімальна енергія атома при
n =1 (основний стан) Е
1
= −13,55 еВ;
максимальна енергія атома при
n = ∞ Е
∞
= 0.
Для іонізації водню з основного стану необхідно витратити
енергію │
Е
1
│= 13,55 еВ.
6.5. Випромінювання і поглинання світла атомами
В основному стані (
n = 1) атом водню може перебувати як
завгодно довго, а електронна оболонка має сферичну симетрію. В
50
