Белясова Н.А. Биохимия и молекулярная биология
Подождите немного. Документ загружается.

120
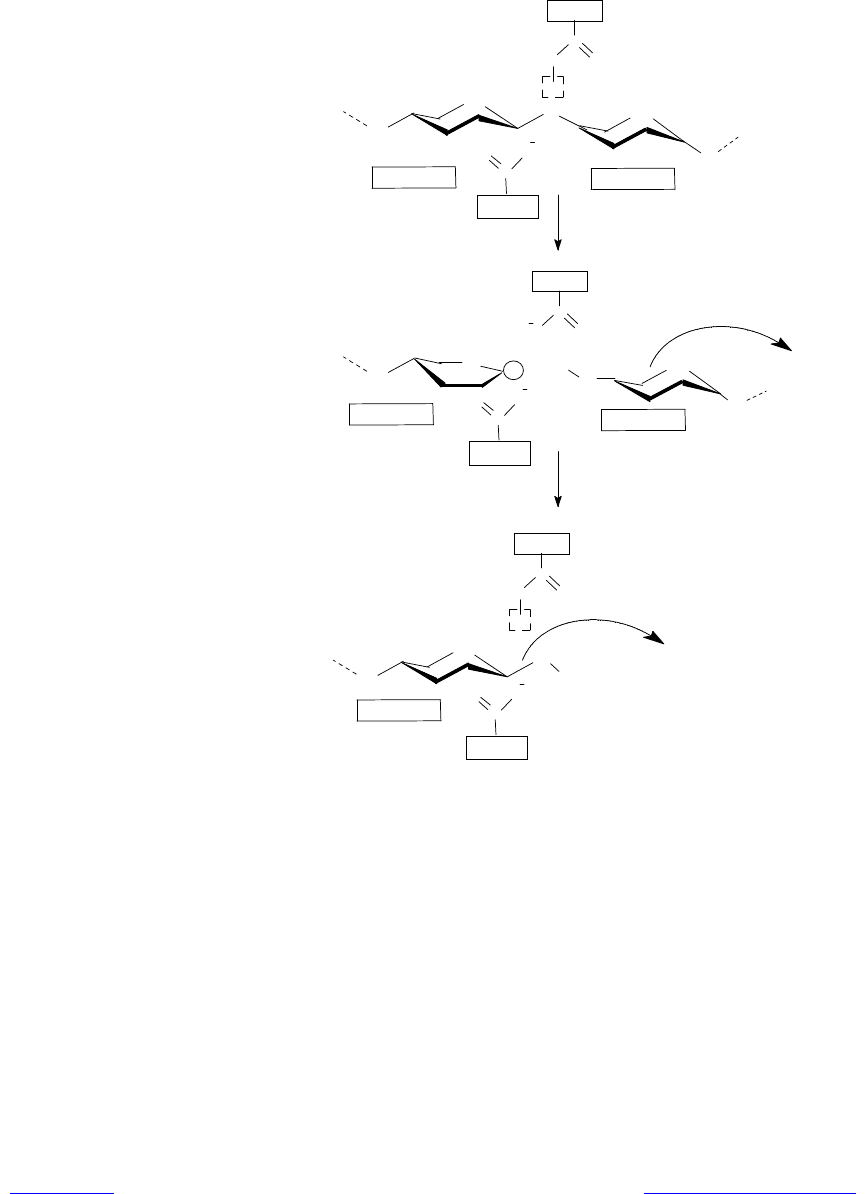
Молекула муреина удерживается в активном центре лизоцима в основном
благодаря водородным связям и гидрофобным взаимодействиям. В непосред-
ственной близости к месту гидролиза гликозидной связи расположены 2 ами-
нокислотных остатка активного центра: глутаминовая кислота, занимающая
35-е положение в полипептиде, и аспарагиновая кислота — 52-е положение в
полипептиде (рис. 6.5).
O
O
O
O
O
O
O
NAM
NAG
участок D
участок Е
O
O
O
NAM
NAG
участок D
участок Е
Покидает область
активного центра
H
2
O
NAM
O
O
O
H
H
Покидает область
активного центра
участок D
C
O
H
O
Glu-35
1
4
O
O
C
Asp-52
Glu-35
O
O
C
+
Asp-52
C
O
O
Glu-35
O
H
O
C
O
O
C
Asp-52
Рис. 6.5. Механизм гидролиза гликозидной связи в молекуле му-
реина с участием фермента лизоцима
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

121
Боковые цепи этих остатков располагаются на противоположных поверх-
ностях «щели» в непосредственной близости к атакуемой гликозидной свя-
зи — примерно на расстоянии 0,3 нм. Остаток глутамата находится в непо-
лярном окружении и не ионизирован, а остаток аспартата — в полярном ок-
ружении, его карбоксильная группа депротонирована и участвует в качестве
акцептора водорода в сложной сети водородных связей.
Процесс гидролиза осуществляется следующим образом. Протонирован-
ная карбоксильная группа остатка Glu-35 предоставляет свой протон глико-
зидному атому кислорода, что приводит к разрыву связи между этим атомом
кислорода и С
1
-атомом сахарного кольца, располагающегося в участке D
(стадия общего кислотного катализа). В результате образуется продукт,
включающий в себя сахарные кольца, находившиеся в
участках E и F, который может высвободиться из комплекса с ферментом.
Конформация сахарного кольца, расположенного в участке D, искажается,
принимая конформацию полукресла, в которой пять из шести атомов, обра-
зующих сахарное кольцо, лежат практически в одной плоскости. Эта структу-
ра соответствует конформации переходного состояния. При этом С
1
-атом ока-
зывается положительно заряженным и промежуточный продукт носит назва-
ние карбоний-иона (карбкатиона). Свободная энергия переходного состояния
уменьшается за счет стабилизации карбоний-иона депротонированной кар-
боксильной группой остатка Asp-52 (рис. 6.5).
На следующем этапе в реакцию вступает молекула воды, которая заме-
щает диффундирующий из области активного центра дисахаридный остаток.
Протон молекулы воды переходит к Glu-35, а гидроксильный ион (ОН
-
) к
атому С
1
карбоний-иона (стадия общего основного катализа). В результате
второй фрагмент расщепленного полисахарида становится продуктом реак-
ции (конформация кресла) и уходит из области активного центра, а фермент
возвращается в исходное состояние и готов осуществить следующую реакцию
расщепления дисахарида (рис. 6.5).
6.4. Свойства ферментов
Характеризуя свойства ферментов, в первую очередь оперируют поняти-
ем «активность». Под активностью фермента понимают такое его количество,
которое катализирует превращение определенного количества субстрата в
единицу времени. Для выражения активности препаратов ферментов исполь-
зуют две альтернативные единицы: международную (Е) и «катал» (кат). За
международную единицу активности фермента принято то его количество,
которое катализирует превращение 1 мкмоль субстрата в продукт за 1 мин в
стандартных условиях (обычно оптимальных). Один катал обозначает коли-
чество фермента, катализирующее превращение 1 моль субстрата за 1 с.
1 кат = 6Ч10
7
Е.
Часто ферментные препараты характеризуются удельной активностью,
которая отражает степень очистки фермента. Удельная активность — это
число единиц активности фермента на 1 мг белка.
Активность ферментов в очень сильной степени зависит от внешних ус-
ловий, среди которых первостепенное значение имеют температура и рН сре-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

122
ды. Повышение температуры в интервале 0—50° С обычно приводит к плав-
ному увеличению ферментативной активности, что связано с ускорением
процессов формирования субстрат-ферментного комплекса и всех последую-
щих событий катализа. Однако дальнейшее повышение температуры, как
правило, сопровождается увеличением количества инактивированного фер-
мента за счет денатурации его белковой части, что выражается в снижении
активности. Каждый фермент характеризуется температурным оптиму-
мом — значением температуры, при котором регистрируется наибольшая его
активность. Чаще для ферментов растительного происхождения температур-
ный оптимум лежит в пределах 50—60° С, а животного — между 40 и 50° С.
Ферменты термофильных бактерий характеризуются очень высоким темпера-
турным оптимумом.
Зависимость активности ферментов от значений рН среды также имеет
сложный характер. Для каждого фермента характерен оптимум рН среды,
при котором он проявляет максимальную активность. При удалении от этого
оптимума в одну либо другую сторону ферментативная активность снижает-
ся. Это объясняется изменением состояния активного центра фермента
(уменьшением или увеличением ионизации функциональных групп), а также
третичной структуры всей белковой молекулы, которая зависит от соотноше-
ния в ней катионных и анионных центров. Большинство ферментов имеют
оптимум рН в области нейтральных значений. Однако есть ферменты, прояв-
ляющие максимальную активность при рН 1,5 (пепсин) или 9,5 (аргиназа).
Активность ферментов подвержена значительным колебаниям в зависи-
мости от воздействия ингибиторов (вещества, снижающие активность) и
активаторов (вещества, увеличивающие активность). Роль ингибиторов и
активаторов могут выполнять катионы металлов, некоторые анионы, пере-
носчики фосфатных групп, восстановительных эквивалентов, специфические
белки, промежуточные и конечные продукты метаболизма и др. Эти вещества
могут попадать в клетку извне либо вырабатываться в ней. В последнем слу-
чае говорят о регуляции активности ферментов — неотъемлемом звене в об-
щей регуляции метаболизма.
Воздействующие на активность ферментов вещества могут связываться с
активным и аллостерическим центрами фермента, а также вне этих центров.
Частные примеры подобных явлений будут рассмотрены в главах 7—19. Для
обобщения некоторых закономерностей ингибирования активности фермен-
тов следует указать, что эти явления в большинстве случаев сводятся к двум
типам — обратимому и необратимому. В ходе обратимого ингибирования в
молекулу фермента не вносится каких-либо изменений после его диссоциации
с ингибитором. Примером служит действие аналогов субстрата, которые
могут связываться с активным центром фермента, препятствуя взаимодейст-
вию фермента с истинным субстратом. Однако увеличение концентрации
субстрата приводит к «вытеснению» ингибитора из активного центра, и ско-
рость катализируемой реакции восстанавливается (конкурентное ингибиро-
вание). Другой случай обратимого ингибирования представляет собой связы-
вание ингибитора с простетической группой фермента, или апоферментом,
вне активного центра. Например, взаимодействие ферментов с ионами тяже-
лых металлов, которые присоединяются к сульфгидрильным группам остат-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

123
ков аминокислот фермента, белок-белковые взаимодействия или ковалентая
модификация фермента. Такое ингибирование активности называется не-
конкурентным.
Необратимое ингибирование в большинстве случаев основано на свя-
зывании так называемых «суицидных субстратов» с активными центрами
ферментов. При этом между субстратом и ферментом формируются кова-
лентные связи, которые расщепляются очень медленно и фермент долго не
способен выполнять свою функцию. Примером «суицидного субстрата» слу-
жит антибиотик пенициллин (глава 18, рис. 18.1).
Поскольку для ферментов характерна специфичность действия, их клас-
сифицируют по типу реакции, подвергающейся катализу. Согласно принятой
в настоящее время классификации, ферменты группируют в 6 классов:
1. Оксидоредуктазы (окислительно-восстановительные реакции).
2. Трансферазы (реакции переноса функциональных групп между суб-
стратами).
3. Гидролазы (реакции гидролиза, акцептором переносимой группы явля-
ется молекула воды).
4. Лиазы (реакции отщепления групп негидролитическим путем).
5. Изомеразы (реакции изомеризации).
6. Лигазы, или синтетазы (реакции синтеза за счет энергии расщепления
нуклеозидтрифосфатов, чаще АТР).
Номер соответствующего класса фермента закреплен в его кодовой нуме-
рации (шифре). Шифр фермента состоит из четырех разделенных точками
чисел, обозначающих класс фермента, подкласс, подподкласс и порядковый
номер в подподклассе.
6.5. Регуляция активности ферментов
Регуляция ферментативной активности — не менее важный для успешно-
го функционирования клетки процесс, чем регуляция экспрессии генов на
уровне транскрипции. Существование этих механизмов позволяет клеткам и
всему организму четко координировать осуществление многочисленных раз-
ветвленных метаболических реакций, обеспечивая наиболее высокий и эко-
номный уровень обмена веществ, а также быструю приспособляемость к ме-
няющимся условиям окружающей среды. При этом регуляция синтеза фер-
ментов является более медленным механизмом, действующим в течение мно-
гих минут или даже часов, в то время как изменение ферментативной актив-
ности происходит мгновенно и действует в течение нескольких минут или
секунд. Регуляцию активности ферментов можно назвать «тонкой настрой-
кой» клеточного метаболизма.
Регуляция ферментативной активности может осуществляться несколь-
кими путями, среди которых наиболее распространены аллостерическая
регуляция и ковалентная модификация.
Аллостерической регуляции подвержены не все ферменты, а лишь те, ко-
торые имеют в составе молекулы аллостерический (от греч. аллос – другой и
стереос – тело, пространство) центр — участок, отличающийся от активного
центра, характеризующийся высоким сродством к регуляторным молекулам.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

124
Подобные ферменты называют аллостерическими. Их активность регулиру-
ется при участии низкомолекулярных веществ (эффекторов), общим свойст-
вом которых является способность к взаимодействию с аллостерическим цен-
тром, что приводит к искажению конформации белковой молекулы. Это ис-
кажение передается активному центру, в результате чего меняются актив-
ность фермента и скорость соответствующей реакции.
Эффекторы могут выполнять роль как ингибиторов активности фермен-
тов, так и их активаторов. Примером ингибирования ферментативной ак-
тивности может служить снижение активности первого фермента пути био-
синтеза триптофана у E.coli — антранилатсинтетазы при избытке в клетке
триптофана. В данном случае триптофан, как конечный продукт названного
биосинтетического пути, служит игибитором активности ключевого фермен-
та, что координирует скорость синтеза этой аминокислоты и позволяет клетке
экономить свои ресурсы. Ведь при избытке триптофана, например, когда он
присутствует в ростовой среде, клетке незачем расходовать строительные
блоки и энергию на его синтез, она может воспользоваться экзогенной ами-
нокислотой. Действительно, экспериментально доказано, что в процессе роста
бактерии преимущественно используют добавленные к ростовой среде ами-
нокислоты, пурины и пиримидины и что эти соединения оказывают ингиби-
рующее действие на свой собственный синтез из молекул-предшественников.
Поскольку в приведенном случае триптофан является конечным продуктом
биосинтетического пути, скорость которого снижается при ингибировании ключе-
вого фермента, такой тип регуляции носит название «ретроингибирование».
Увеличение активности аллостерического фермента при связывании с
эффектором (активатором) можно рассмотреть на примере аспартаттранскар-
бамоилазы (АТКазы), которая катализирует первую реакцию биосинтеза пи-
римидинов. Этот фермент активируется аденозинтрифосфатом (АТР) —
пуриновым нуклеотидом. Следует отметить, что одновременно АТКаза ин-
гибируется одним из конечных продуктов названного биосинтетического пу-
ти — цитидинтрифосфатом (СТР), причем активатор и ингибитор связыва-
ются с одним и тем же аллостерическим центром. Таким образом, с помощью
регуляции активности одного фермента обеспечивается координация синтеза
пуриновых и пиримидиновых нуклеотидов.
Мутационное повреждение аллостерического центра может обусловить
утрату способности фермента связывать молекулы эффекторов и изменять в
ответ на это свою активность. Данное явление используется в селекции мик-
роорганизмов для получения мутантов с десенсибилизированными фермен-
тами. Такие микроорганизмы часто являются продуцентами биологически
активных веществ, и для их отбора используют аналоги метаболитов. Напри-
мер, 5-метилтриптофан так же, как триптофан, способен ингибировать актив-
ность антранилатсинтетазы, но не заменяет триптофан в составе белка. По-
этому бактерии E.coli не способны формировать колонии на синтетической
среде с этим веществом. Однако известны мутанты E.coli, растущие на среде
с 5-метилтриптофаном. Эти бактерии содержат в клетках нечувствительную к
ретроингибированию (десенсибилизированную) антранилатсинтетазу и син-
тезируют триптофан в избыточных количествах, выделяя его во внешнюю
среду.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

125
Еще одним распространенным путем регуляции активности ферментов
служит ковалентная модификация — присоединение или отщепление от фер-
мента небольшой химической группы. С помощью таких модификаций обыч-
но либо полностью неактивная форма фермента становится активной, либо,
наоборот, полностью активный фермент инактивируется. К явлению кова-
лентной модификации относятся: ограниченный протеолиз (укорочение поли-
пептидных цепей), фосфорилирование — дефосфорилирование, аденилиро-
вание — деаденилирование, ацетилирование — деацетилирование и др. На-
пример, гликогенсинтетаза клеток млекопитающих, катализирующая пре-
вращение глюкозы в гликоген, инактивируется после ковалентного присоеди-
нения фосфатной группы к боковой цепи одного из сериновых остатков и
снова активируется при отщеплении фосфата. Другие примеры ковалентной
модификации ферментов описаны в главе 3.
Особый случай регуляции активности ферментов представляют собой бе-
лок-белковые взаимодействия, в которых роль ингибиторов ферментов вы-
полняют особые белки. При таких взаимодействиях блокируется активный
центр фермента. Особое значение ингибирование с помощью белков имеет
для регуляции активности протеиназ, участвующих в посттрансляционной
модификации белков. Это способствует изменению скорости созревания мно-
гих важных для клетки белков, а следовательно, и интенсивности процессов,
в которых последние принимают участие.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

124
Глава 7. КОФАКТОРЫ
В ряде случаев для осуществления катализа ферменты нуждаются в осо-
бых посредниках — кофакторах. Кофакторы представляют собой вещества
небелковой природы, которые функционируют на промежуточных стадиях
ферментативной реакции (или цикла реакций), но не расходуются в ходе ка-
тализа. В подавляющем большинстве случаев кофакторы регенерируются в
неизменном виде по завершении каталитического акта.
Разнообразные по химической природе кофакторы можно разделить на
две основные группы: коферменты (слабо связаны с ферментом и при ката-
лизе отделяются от него) и простетические группы (прочно связаны с фер-
ментной молекулой).
Основные механизмы, согласно которым кофакторы принимают участие в
катализе, следующие:
— выполняют функцию переносчиков между ферментами. Взаимодейст-
вуя с одним ферментом, переносчик акцептирует часть субстрата, мигрирует
к другому ферменту и передает переносимую часть субстрату второго фер-
мента, после чего высвобождается. Такой механизм типичен для большинст-
ва коферментов;
— выполняют роль «внутриферментного» переносчика, что характерно, в
первую очередь, для простетических групп. Простетическая группа присоеди-
няет часть молекулы субстрата и переносит ее на второй субстрат, связанный
в активном центре того же фермента. В данном случае можно рассматривать
простетическую группу как часть каталитического участка фермента;
— изменяют конформацию ферментной молекулы, взаимодействуя с ней
вне активного центра, что может индуцировать переход активного центра в
каталитически активную конфигурацию;
— стабилизируют конформацию фермента, способствующую каталитиче-
ски активному состоянию;
— выполняют функцию матрицы. Например, полимеразы нуклеиновых
кислот нуждаются в «программе» — матрице, по которой строится новая мо-
лекула;
— играют роль промежуточных соединений. Иногда фермент может ис-
пользовать в реакции молекулу кофактора, образуя из нее продукт, но при
этом одновременно за счет субстрата образовать новую молекулу кофактора.
Среди известных в настоящее время ферментов примерно 40% способны
осуществить катализ только при посредстве кофакторов. Наибольшее распро-
странение имеют кофакторы, осуществляющие перенос восстановительных
эквивалентов, фосфатных, ацильных и карбоксильных групп.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

125
7.1. Переносчики восстановительных эквивалентов
Под восстановительными эквивалентами подразумевают обычно атомы
водорода, электроны или гидрид-ионы. Поскольку их перенос осуществляется
в ходе окислительно-восстановительных реакций, соответствующие перенос-
чики называют окислительно-восстановительными кофакторами. Среди них
присутствуют как коферменты, так и простетические группы. Наибольшее
значение и распространение имеют никотинамидные (NAD и NADP) и фла-
виновые (FAD и FMN) кофакторы.
Никотинамидные переносчики восстановительных эквивалентов.
Известно порядка 270 ферментов, использующих никотинамидные окисли-
тельно-восстановительные коферменты в ходе катализа. Этими кофермента-
ми являются никотинамидадениндинуклеотид (НАД, или NAD) и никотина-
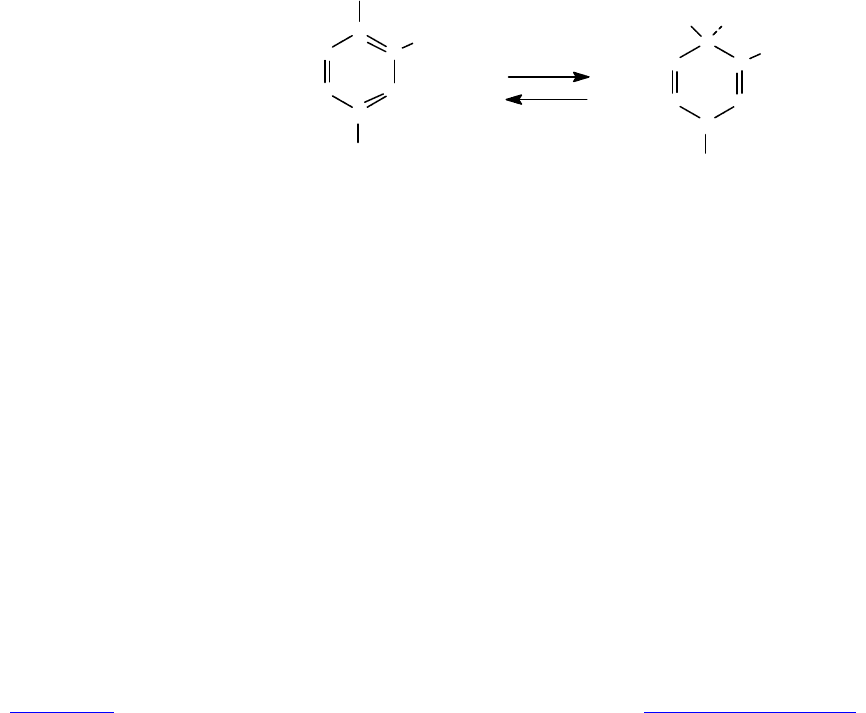
мидадениндинуклеотидфосфат (НАДФ, или NADP). Структурные формулы
NAD и NADP представлены на рис. 7.1, и можно видеть, что два кофермента
очень сходны по строению.
N
N
N
N
NH
2
O
CH
2
O
O R
O
P
O
P
O
O
O
-
-
O
O
O
OH
CH
2
O
H
C
N
O
NH
2
+
В молекуле NAD
+
: R = H
В молекуле NADP
+
: R =
P
O
O
O
-
-
AMP
H
Никотинамид
(витамин)
Рис. 7.1. Структура никотинамидных окислительно-
восстановительных коферментов
При физиологических значениях рН (7,0—7,5) кислотные группы
фосфатных остатков этих коферментов ионизированы и суммарный заряд
молекулы NAD в окисленном состоянии равен (-)1, а молекулы NADP —
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
126
(-)3. Тем не менее окисленные формы этих коферментов принято обозна-
чать как NAD
+
и NADP
+
, желая подчеркнуть присутствие избыточного
положительного заряда на атоме азота никотинамидного кольца.
Функциональной группой никотинамидных переносчиков восстанови-
тельных эквивалентов служит никотинамидное кольцо, входящее в состав
никотинамида — одной из форм витамина В
5
(РР). При ферментативном
окислении субстрата с участием NAD
+
(NADP
+
) никотинамидное кольцо вос-
станавливается в ходе присоединения гидрид-иона, который представляет
собой протон и два электрона (рис. 7.2). При этом дегидрирование субстрата
в большинстве случаев сопровождается отщеплением двух атомов водорода,
в ходе которого протон выделяется в окружающую среду.
Примером работы никотинамидных переносчиков восстановительных эк-
вивалентов может служить окисление этанола в уксусный альдегид, катали-
зируемое алкогольдегидрогеназой (рис. 7.3). Этот фермент осуществляет сте-
реоспецифическое отщепление двух атомов водорода от молекулы этанола,
причем к NAD
+
переносится водород, связанный с углеродом спиртовой
группы, а водород, присоединенный к кислороду гидроксила, высвобождается
в среду в виде протона.
Два пиримидиновых кофермента участвуют в разных окислительно-
восстановительных реакциях при различных окислительно-восста-
новительных потенциалах: NAD
+
чаще выступает в роли окислительного
агента в катаболитных путях, а NADP
+
восстанавливается до NADPH и вы-
полняет функцию восстановителя в биосинтетических процессах.
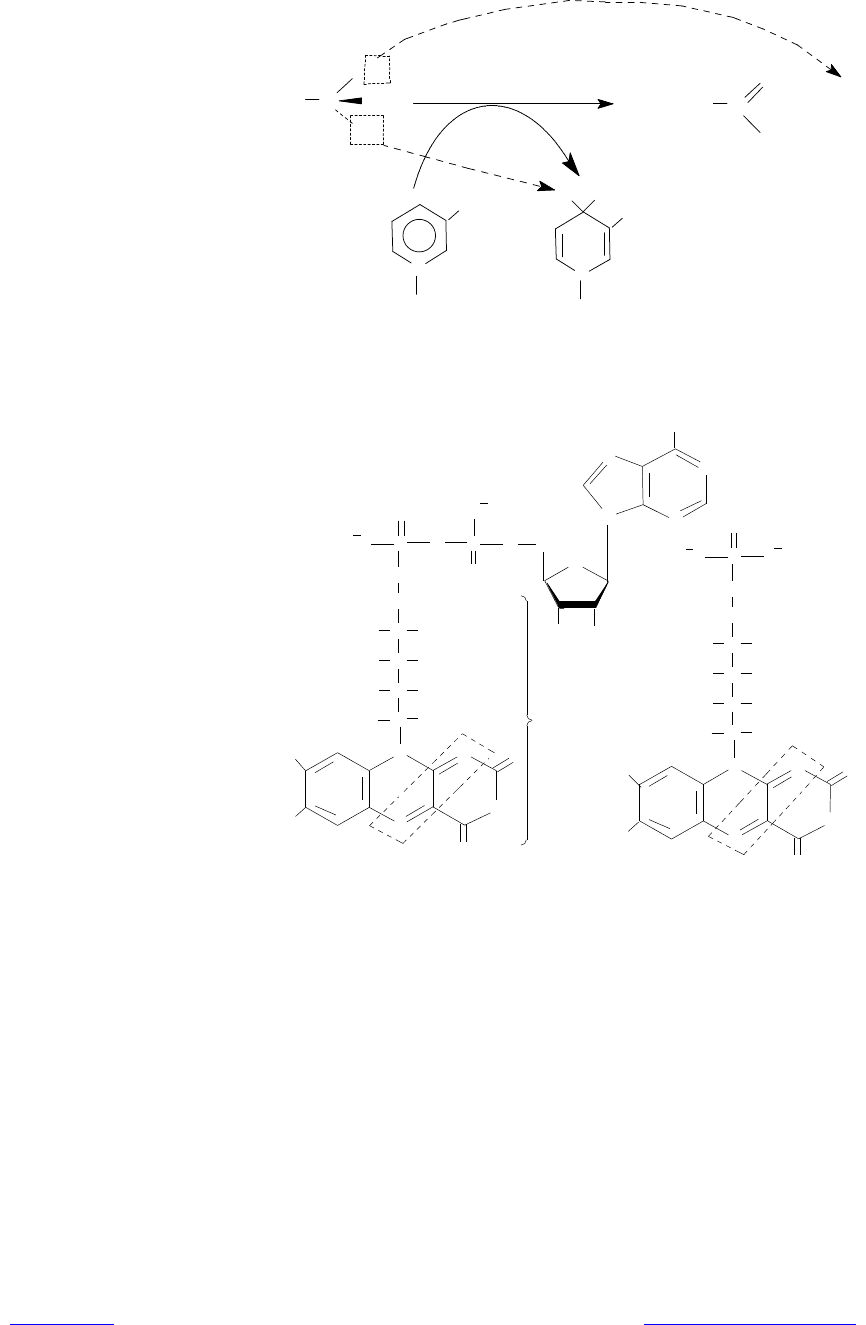
Флавиновые переносчики восстановительных эквивалентов. Сущест-
вует не менее 80 флавинсодержащих ферментов, которые в качестве просте-
тической группы используют либо флавинадениндинуклеотид (ФАД, или
FAD), либо флавинмононуклеотид (ФМН, или FMN). Оба этих кофактора
построены на основе витамина рибофлавина (В
2
) (рис. 7.4).
C
C
N
C
C
C
CONH
2
+
R
H
H H
H
HH
H
R
CONH
2
C
C
N
C
C
C
H
H
+ [H
-
]
- [H
-
]
NAD
+
(NADP
+
)
NADH (NADPH)
Рис. 7.2. Окисление—восстановление никотинамидного кольца
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
127
H
O
H
3
C C
H
R
H
s
OH
H
3
C C
+
H
+
NAD
+
NADH
N
CONH
2
CONH
2
N
H
H
+
Алкогольдегидрогеназа
Этанол
Ацетальдегид
Рис. 7.3. Восстановление никотинамидного кольца в процессе стереоспецифи-
ческого дегидрирования этанола с участием алкогольдегидрогеназы
HO
O
CH
2
O
N
H
2
N
N
N
N
H
OPOPO
O
O
O
O
-
CH
2
HO C H
H
C
HO
HCHO
HCH
NH
N
N
N
O
O
O
O
H
3
C
NH
N
N
N
H C H
HO
C
H
HO C H
H
C
HO
CH
2
-
O
O
OPO
В
и
т
а
м
и
н
В
2
(
р
и
б
о
ф
л
а
в
и
н
)
Флавинадениндинуклеотид (FAD)
Флавинмононуклеотид (FMN)
H
3
C
H
3
C
H
3
C
Рис. 7.4. Структура флавиновых кофакторов: в пунктирную рамку заклю-
чена реакционноспособная часть — изоаллоксазиновая система
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
