Белясова Н.А. Биохимия и молекулярная биология
Подождите немного. Документ загружается.

110
лисахаридом покровов тела насекомых.
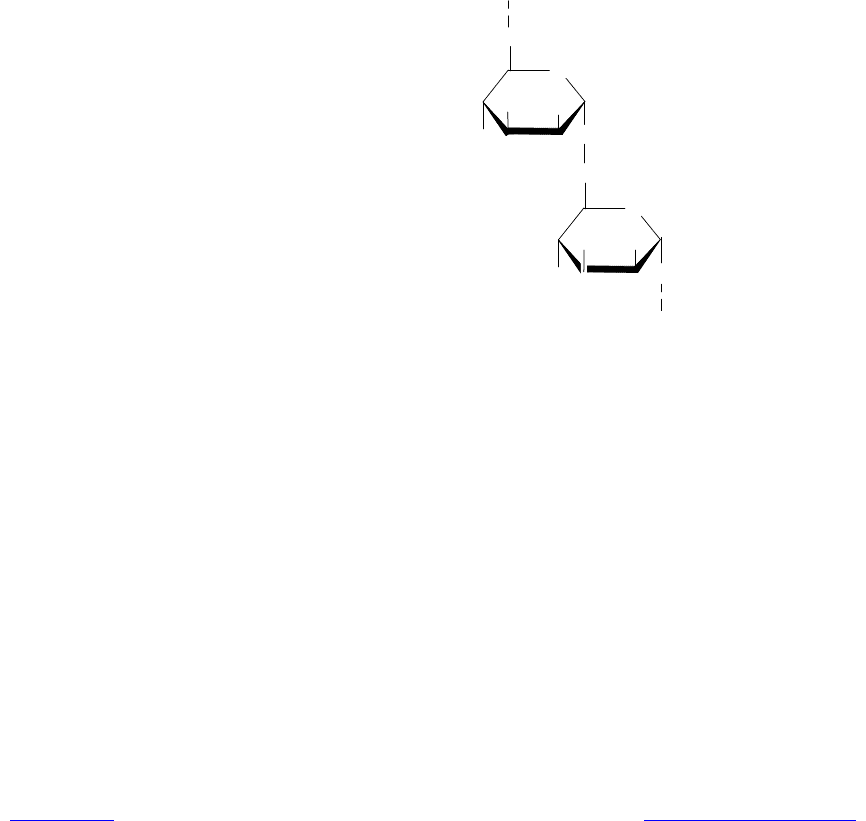
Маннаны являются полимерами маннозы (рис. 5.8). В них от главной a-
1,6-цепи отходят короткие ветви (из 1—3 маннозных звена), присоединенные
через a(1®2)- и a(1®3)-гликозидные связи. Маннаны и глюканы — это ос-
новные полисахариды клеточных стенок дрожжей (составляют в них 60—
80% сухого вещества).
Кроме гемицеллюлоз, в состав клеточных стенок грибов входят белки
(6—13%), липиды (2—9%) и неорганические полифосфаты. Белки богаты
серусодержащими аминокислотами и присутствуют в виде комплексов с по-
лисахаридами. Наиболее часто среди таких комплексов встречаются манна-
нопротеины. Кроме структурной функции, маннанопротеинам принадлежит
рецепторная: они воспринимают сигналы из внешней среды и участвуют в
осуществлении клеточных контактов. Структура маннанопротеинов опреде-
ляет иммунологические свойства дрожжей.
Анализ наиболее распространенных клеточных полисахаридов, охаракте-
ризованных в этой главе, позволяет заключить, что их структура и функции
тесно связаны: полисахариды с рыхлой, разветвленной, легко доступной
ферментам структурой выполняют в клетках резервную функцию. Наоборот,
полисахариды, призванные служить механической опорой и защитой для кле-
ток, имеют сложную, компактную структуру, которая упрочняется при взаи-
модействии полисахаридов с веществами других классов: белками, липида-
ми, тейхоевыми кислотами и др. В этих комплексах практически всегда при-
сутствуют межмолекулярные связи, что делает клеточные стенки жесткими,
прочными, трудно доступными ферментативному расщеплению.
CH
2
O
OH
O
O
OH
HO
HO
H
O
HO
O
CH
2
Рис. 5.8. Структура фрагмента главной маннановой цепи
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
111
Глава 6. БЕЛКИ. ОСОБЕННОСТИ ОРГАНИЗАЦИИ И ФУНКЦИИ
ФЕРМЕНТОВ
Белки представляют собой один из основных классов клеточных макро-
молекул, составляя, например, в микробной клетке до 50% сухого вещества.
Этим удивительным по разнообразию полимерам присущи одни из наиболее
важных и разносторонних клеточных функций.
Мономерными единицами белков служат аминокислоты. Природные
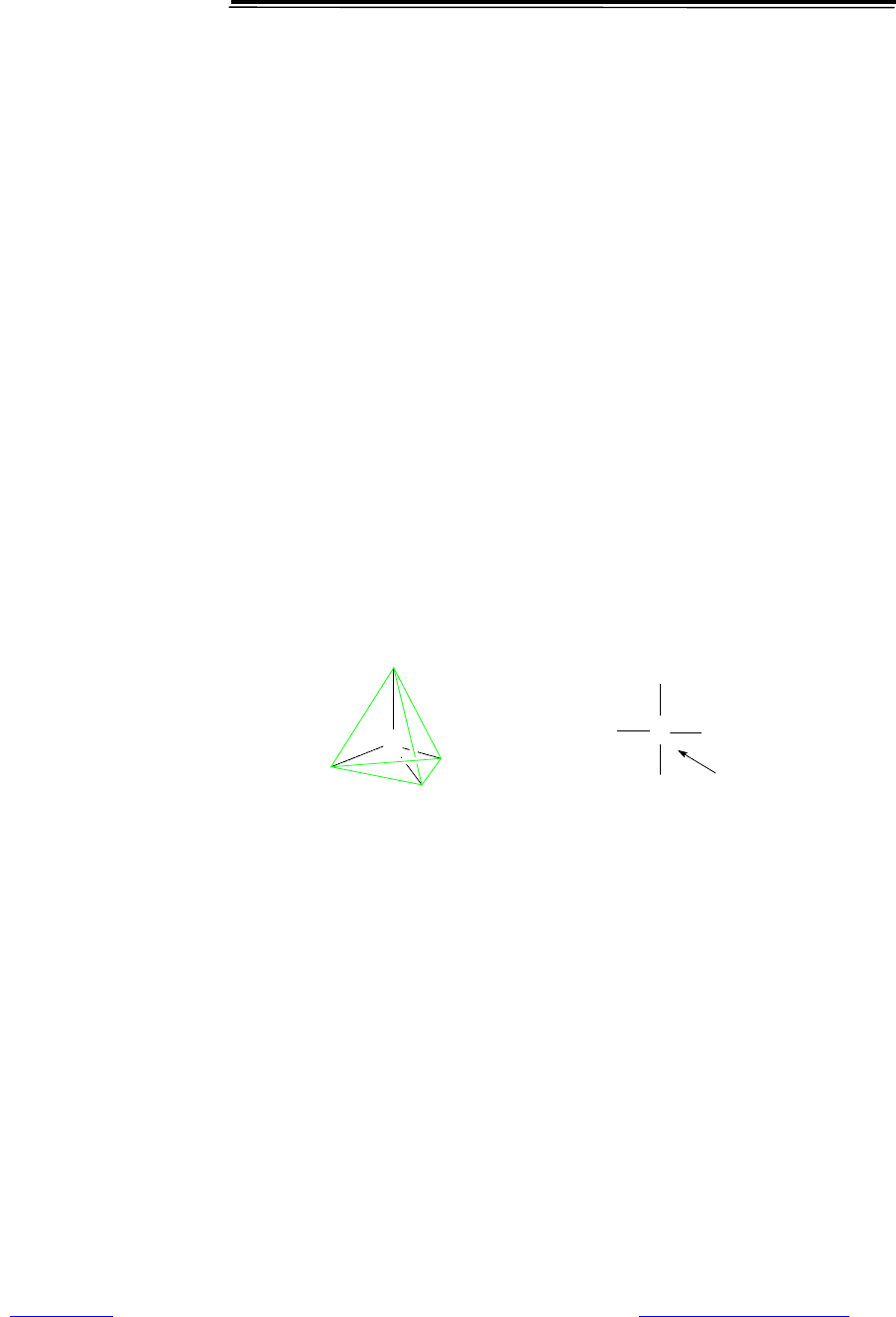
аминокислоты являются 2-аминокарбоновыми кислотами, или a-
аминокислотами. В их молекулах при атоме С-2 (С
a
) имеются 4 различных
заместителя (рис. 6.1). Таким образом, все a-аминокислоты, кроме глицина,
имеют асимметрический (хиральный) a-углеродный атом (рис. 6.1) и сущест-
вуют в виде двух энантиомеров — L- и D-аминокислот. В большинстве при-
родных пептидов содержатся L-аминокислоты.
Аминокислоты различаются структурой боковых цепей и степенью их по-
лярности. На рис. 6.2 изображено строение боковых групп 20-ти протеино-
генных (положение которых в полипептидах кодируется генетическим ко-
дом) аминокислот. Из них выраженными неполярными (гидрофобными)
свойствами характеризуются боковые группы аланина, валина, лейцина, изо-
лейцина, метионина, цистеина, фенилаланина. Заряженные боковые цепи
содержатся в составе кислых аминокислот (аспарагиновой, глутминовой) и
основных аминокислот (лизина, аргинина, гистидина).
a
Аминогруппа
Карбоксильная
группа
Боковая
цепь
a-Углеродный
атом
C
COO
-
R
H
3
N
H
+
C
COO
-
H
3
N
+
H
R
L-аминокислота
(реальное изображение)
Проекционная формула Фишера
Рис. 6.1. Особенности строения L-аминокислот
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
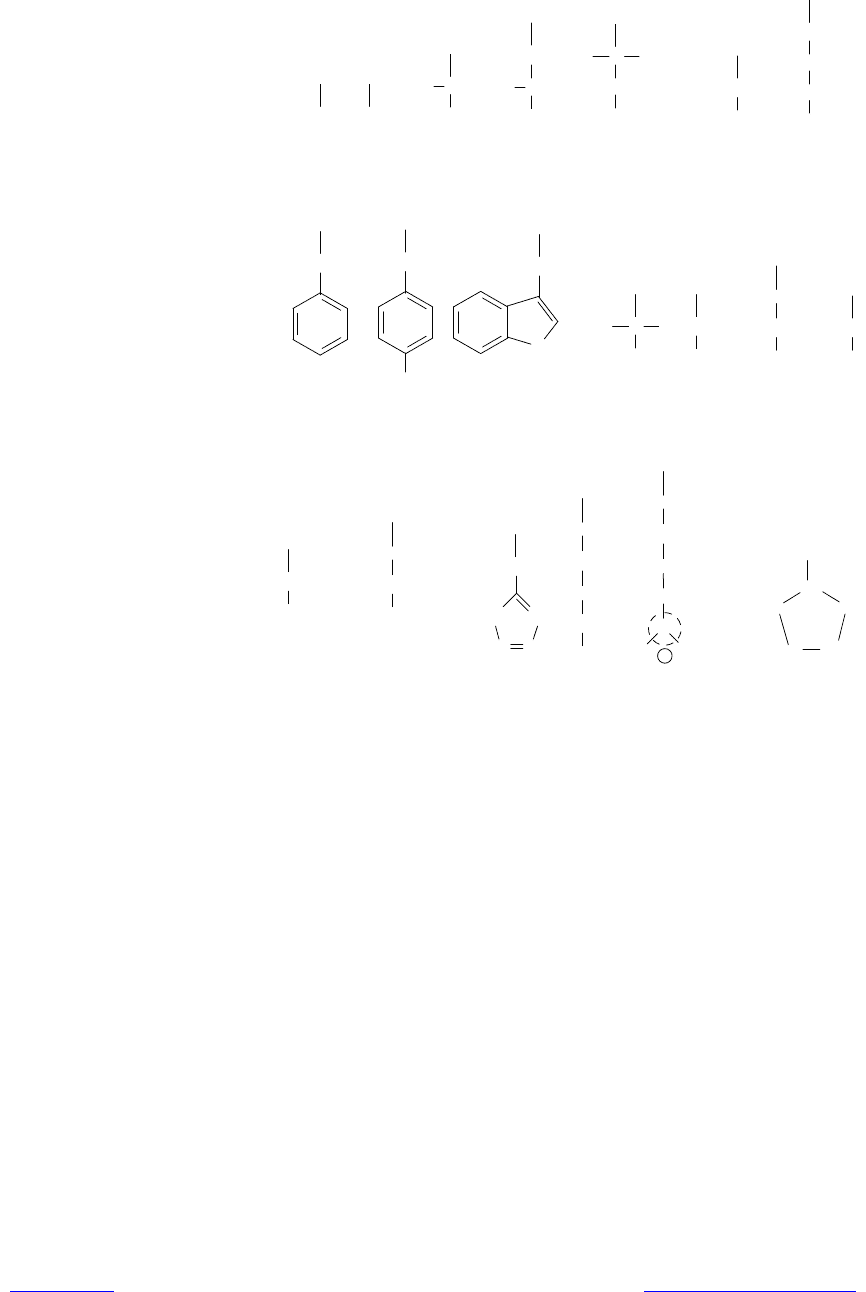
112
H CH
3
CH
CH
2
CH
3
C
H
3
C
H
3
C H
H
3
C
CH
3
CH
CH
2
CH
3
Глицин Аланин Валин
Лейцин Изолейцин
Алифатические
Серосодержащие
CH
2
SH
CH
2
CH
2
S
CH
3
Цистеин Метионин
(Gly, G) (Ala, A) (Val, V)
(Leu, L) (Ile, I)
(Cys, C) (Met, M)
Ароматические
CH
2
CH
2
OH
N
H
CH
2
Фенилаланин Тирозин Триптофан
(Phe, F)
(Tyr, Y) (Trp, W)
OH
CH
2
HH
3
C
C
OH
CONH
2
CH
2
CH
2
CH
2
CONH
2
СеринТреонин Аспарагин Глутамин
Нейтральные
CH
2
COO
-
COO
-
CH
2
CH
2
Аспара-
гиновая
кислота
Глута-
миновая
кислота
(Asp, D)
(Glu, E)
Кислые
CH
2
HN
CH
C N
H H
+
CH
2
CH
2
CH
2
CH
2
NH
3
+
CH
2
CH
2
CH
2
(Thr, T) (Asn, N) (Gln, Q) (Ser, S
)
NH
C
NH
2
H
2
N
+
Гистидин
Лизин
Аргинин
Основные
Иминокислота
HN
H
2
C CH
2
CH
2
CH
COO
-
Пролин
(His, H) (Lys, K) (Arg, R) (Pro, P)
Рис. 6.2. Строение боковых цепей протеиногенных аминокислот
a-Аминокислоты в водных растворах при нейтральных рН существуют пре-
имущественно в виде диполярных ионов (цвиттер-ионов), у которых аминогруппы
протонированы, а карбоксильные группы диссоциированы (рис. 6.1).
Остатки аминокислот в пептидах соединяются друг с другом пептидной
(карбоксамидной) связью, в формировании которой принимают участие a-
карбоксильная группа одной и a-аминогруппа другой аминокислоты. В ходе
этой реакции выделяется вода (рис.6.3).
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

113
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

114
Первичная структура белков характеризует их аминокислотную после-
довательность, которая определяет другие уровни организации этих полиме-
ров — вторичную, третичную и четвертичную структуру. Под вторичной
структурой обычно подразумевают структуру участков полипептидной цепи
с упорядоченной конформацией, стабилизированной водородными связями
между СО- и NH-группами. Подобные участки называют элементами вто-
ричной структуры и различают несколько их типов: правую a-спираль
(наиболее распространенный элемент), левую a-спираль, антипараллельный
и параллельный b-складчатый лист, b-петлю. В фибриллярных белках, кото-
рые обычно выполняют структурную функцию, регулярные вторичные струк-
туры распространяются на достаточно протяженные фрагменты молекулы и
представлены чаще каким-либо одним типом. К тому же для этих белков ха-
рактерно формирование ансамблей взаимодействующих между собой вто-
ричных структур, что обусловливает особую прочность формируемых воло-
кон. Например, коллаген — белок соединительной и костной тканей, сухо-
жилий, хрящей — представляет собой правую тройную спираль, скрученную
из трех первичных левых спиралей.
В глобулярных белках (растворимые, с формой, близкой к сферической),
которые выполняют в клетках специфические функции, в том числе обладают
каталитической активностью, обычно присутствуют одновременно и a-
спирали, и b-складчатые листы. Кроме этого имеются участки с неупорядо-
ченной структурой. В молекуле инсулина (см. разд. 21.3), например, на долю
участков, представленных a-спиралью, приходится 57%, b-складчатой струк-
турой — 6%, b-петлей — 10%. Остальная часть молекулы (27%) не имеет
упорядоченной структуры.
Под третичной структурой понимают расположение в пространстве
атомов и формируемых ими элементов вторичной структуры полипептида,
иными словами, трехмерную функционально активную конформацию бел-
ка. Каждый белок характеризуется своей уникальной пространственной
структурой. Стабилизация конформации белковых молекул обеспечивается
водородными связями, дисульфидными мостиками, электростатическим
взаимодействием, комплексообразованием с ионами металлов, гидрофобны-
ми эффектами.
Многие белковые молекулы образуют симметрично построенные ком-
плексы, стабилизированные за счет нековалентных взаимодействий. Взаим-
ное расположение составных единиц комплексов (субъединиц) определяет
четвертичную структуру белка.
Обычно в белковых молекулах насчитывается несколько десятков амино-
кислотных остатков, однако встречаются полипептиды, содержащие сотни и
даже тысячи мономерных звеньев. При этом число типов мономерных еди-
ниц (различающихся своей боковой цепью аминокислот) в большинстве при-
родных белков составляет 20. Поистине огромная вариабельность структуры
разных белков определяется последовательностью аминокислот, число раз-
личных вариантов которой описывается величиной 20
n
, где n — количество
аминокислотных остатков в белке. Последовательность аминокислот в поли-
пептиде определена генетически. Белковая молекула может состоять из одной
или нескольких полипептидных цепей.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

115
Кроме простых белков, в состав которых входят только аминокислоты,
существуют сложные белки, которые могут содержать ионы металлов (ме-
таллопротеины), молекулы пигментов (хромопротеины), образовывать
комплексы с другими молекулами (липопротеины, нуклеопротеины, гли-
копротеины), ковалентно связывать неорганический фосфат (фосфопротеи-
ны).
Химические свойства белков обусловлены набором и соотношением ами-
нокислот с гидрофильными и гидрофобными боковыми группами. К биоло-
гическим свойствам белков относятся, в первую очередь, каталитическая
(ферментативная), транспортная (транспортировка веществ в организме и
перенос их через биомембраны), структурная (в составе хромосом, цитоске-
лета, соединительных, мышечных, опорных тканей), регуляторная (способ-
ность регулировать скорость химических реакций в клетке и уровень мета-
болизма в целом организме) и рецепторная функции. Кроме этого, белкам
присущи защитные, запасные, токсические, сократительные и некоторые дру-
гие функции. Большинство перечисленных биологических свойств белков уже
охарактеризованы в предыдущих главах. Здесь внимание будет уделено био-
каталитической активности белковых молекул.
6.1. Особенности структуры ферментных молекул
Ферменты (энзимы) представляют собой специфические высокоэффек-
тивные катализаторы химических реакций. Подавляющее большинство кле-
точных реакций осуществляется с участием ферментов, одна клетка может
содержать до 1000 различных ферментов. В настоящее время известны функ-
ции более двух тысяч ферментов, из которых несколько сотен изучены наи-
более полно, для них определена аминокислотная последовательность и про-
странственная структура.
Ферментативный катализ ускоряет протекание химических реакций в
10
6
—10
16
раз! Будучи выделенными из клетки без повреждения нативной
структуры, ферменты сохраняют активность, что делает возможным их ис-
пользование в бесклеточных реакциях.
Молекулы ферментов характеризуются различными молекулярными мас-
сами — от 10 000 до 1 000 000 дальтон (Да) и выше, однако большинство
ферментов представлено глобулярными белками с молекулярной массой в
несколько сотен тысяч дальтон, построенными из субъединиц (протомеров).
Упаковка субъединиц в мультимерном (состоящем из нескольких субъеди-
ниц) белке осуществляется благодаря взаимодействиям того же типа, что и
при образовании третичной структуры белка. Среди ферментов-мультимеров
преобладают димеры и тетрамеры, в меньшей мере распространены гексаме-
ры и октамеры и очень редко встречаются тримеры и пентамеры.
Мультимерные ферментные белки могут содержать протомеры несколь-
ких типов, различающихся некоторыми особенностями первичной и третич-
ной структуры. От соотношения протомеров разного типа в мультимере зави-
сят некоторые его химические и физические свойства, и такие различающие-
ся формы мультимерного фермента называют изоферментами (изозимами).
Например, лактатдегидрогеназа, катализирующая в мышцах обратимую ре-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

116
акцию окисления молочной кислоты, состоит из четырех субъединиц двух
типов (Н и М) и представлена пятью изоферментами (НННН, НННМ,
ННММ, НМММ, ММММ). Эти изоферменты отличаются друг от друга ак-
тивностью, молекулярной массой, электрофоретической подвижностью, ло-
кализацией в органах и тканях, а также чувствительностью к регуляторным
веществам. Существование изоферментов позволяет организму изменять их
соотношение и регулировать, таким образом, метаболическую активность.
Изучение структуры молекул ферментов позволило выявить ряд законо-
мерностей в их организации. Полипептидная цепь, образующая белковую
глобулу, свернута довольно сложным образом. Одни участки этой цепи явля-
ются a-спиралями или же b-структурами, другие принимают нерегулярные,
но вполне определенные конформации. Эти структуры, тесно прилегая друг к
другу и чередуясь, упаковываются в блоки, обладающие функциональной
активностью. На поверхности белковой глобулы сосредоточены в основном
полярные группы и заряженные атомы, причем между противоположно заря-
женными группами (например, между боковыми цепями Glu
-
и Lys
+
) иногда
образуются ионные связи (солевые мостики). Внутренняя часть белковой гло-
булы представляет собой неполярную среду, гидрофобное ядро образовано
неполярными группами, входящими главным образом в состав алифатиче-
ских и ароматических боковых цепей аланина, валина, изолейцина, лейцина,
метионина, фенилаланина и триптофана. Полярные радикалы аминокислот,
имеющие функциональное значение, ориентированы также внутрь глобулы,
при этом они ассоциированы друг с другом.
Важнейшей частью ферментной молекулы является активный центр, ко-
торый обычно имеет форму щели или впадины в глобуле фермента. В актив-
ном центре происходит связывание субстрата и превращение его в продукт.
Активный центр почти всегда построен из небольшого количества аминокис-
лотных остатков, которые, как правило, значительно удалены друг от друга в
полипептидной молекуле. В активном центре можно условно выделить два
участка: связывающий и каталитический.
Остатки аминокислот, образующие связывающий участок, обеспечивают
удержание субстрата в актином центре. Именно «архитектура» связывающего
участка активного центра фермента определяет его комплементарность
структуре субстрата, т. е. специфичность связывания фермента. Часто при-
крепление субстрата осуществляется за счет взаимодействия с e-
аминогруппой радикала лизина, расположенного в субстратном участке. Эту
же роль может выполнять карбоксильная группа глутаминовой кислоты, а
также сульфгидрильная группа цистеина. Однако чаще формирование суб-
страт-ферментного комплекса происходит без образования ковалентных свя-
зей, за счет более слабых сил, таких, как водородные и электростатические
связи, гидрофобные и ван-дер-Ваальсовы взаимодействия.
В каталитический участок фермента входят остатки аминокислот, непо-
средственно участвующие в катализе. Их называют каталитическими груп-
пами, и они чаще всего представлены остатками серина, гистидина, трипто-
фана, аргинина, цистеина, аспарагиновой и глутаминовой кислоты, тирозина.
Окончательное формирование каталитического участка у многих ферментов
может происходить в момент присоединения субстрата.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

117
Кроме активного центра, большинство ферментов содержат аллостери-
ческий центр. Этот участок молекулы предназначен для связывания с регу-
ляторными веществами, в результате чего изменяется третичная структура
белка. Это искажение затрагивает и конфигурацию активного центра, что
сопровождается увеличением или снижением каталитической активности
фермента. Данное явление лежит в основе аллостерической регуляции актив-
ности ферментов.
Некоторые ферменты проявляют полифункциональность —способность
осуществлять несколько энзиматических активностей. Данное явление объяс-
няется тем, что при формировании третичной структуры полипептидные цепи
подобных ферментов образуют несколько функционально и стерически обо-
собленных глобулярных участков — доменов, каждый из которых характе-
ризуется собственной каталитической активностью.
6.2. Специфичность ферментов
Одним из удивительных свойств ферментов является их высокая специ-
фичность. Различают субстратную специфичность (способность связываться с
определенным субстратом или их группой) и специфичность действия, или
реакционную специфичность (способность катализировать реакции опреде-
ленного типа).
Специфичность связывания субстрата у разных ферментов значительно
варьирует — некоторые ферменты могут катализировать реакцию с участием
только одного субстрата, тогда как другие — с несколькими химически род-
ственными веществами. Например, формамидаза гидролизует только фор-
мамид, в то время как амидаза гидролизует любой алифатический амид. В
таком случае говорят соответственно об узкой и широкой специфичности
ферментов.
Ранее было принято объяснять субстратную специфичность ферментов
теорией замка и ключа: к ферменту (замку) подходит лишь свой субстрат
(ключ). Однако в настоящее время эта теория получила развитие в гипотезе
Кошланда об индуцированном соответствии субстрата и фермента, кото-
рая считается общепринятой. Согласно этой гипотезе, пространственное со-
ответствие между структурами активного центра фермента и субстрата созда-
ется в момент их взаимодействия друг с другом. При этом в молекуле фер-
мента индуцируются небольшие конформационные изменения, в результате
чего в каталитическом участке функционально активные группы ориентиру-
ются наиболее благоприятным для протекания соответствующей реакции об-
разом. В субстрате также возникают конформационные превращения (гово-
рят о возникновении напряжения в субстрате), что делает его более реакци-
онноспособным. Данная гипотеза объясняет тот факт, что молекулы, очень
похожие по форме на истинный субстрат, могут связываться с ферментом, но
не превращаются в продукт, т. е. действуют как ингибиторы.
Субстратная специфичность ферментов настолько выражена, что боль-
шинство из них способно распознавать положение заместителей у аномерного
атома углерода, связывая и катализируя превращения лишь одной из групп
аномеров. Например, почечная оксидаза D-аминокислот катализирует окис-
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

118
ление целого ряда D-аминокислот, но не действует на L-аминокислоты. Од-
нако это правило не абсолютно, и существуют ферменты, катализирующие
превращения обоих энантиомеров. Так, субстратами глутаминсинтетазы из
мозга овцы служит как D-, так и L-глутаминовая кислота.
Специфичность действия ферментов также проявляется в высокой степе-
ни и характеризует способность ферментов катализировать одну-
единственную химическую реакцию или несколько реакций одного типа. Час-
то превращения субстрата могут идти по нескольким путям, и в ходе неката-
лизируемой реакции либо при участии неорганического катализатора пре-
вращения органического вещества сопровождаются образованием множества
побочных продуктов. Этого не происходит при ферментативном катализе, и
продукт ферментативной реакции не содержит примесей.
Более того, некоторые ферменты обладают стереохимической специ-
фичностью, т. е. способны различать в субстрате правую и левую стороны, а
также распознавать пространственное положение атомов. Например, фермен-
ты, расщепляющие a- и b-метилглюкозиды, узнают эти пространственные
изомеры и характеризуются специфичностью по отношению к ним. Алко-
гольдегидрогеназа, катализирующая окисление этанола, распознает и отщеп-
ляет один из пары атомов в СН
2
-группе этанола, а именно тот, который нахо-
дится в положении про-R относительно прохирального центра:
H
3
C C
OH
H
s
H
R
H
3
C C
O
H
Этанол
Ацетальдегид
+
[H]
Алкогольдегидрогеназа
6.3. Механизм ферментативного катализа
Последовательность событий в ферментативном катализе можно описать
следующей схемой. Вначале формируется субстрат-ферментный комплекс.
При этом происходит изменение конформаций ферментной молекулы и мо-
лекулы субстрата, последняя фиксируется в активном центре в напряженной
конфигурации. Так формируется активированный комплекс, или переходное
состояние, — высокоэнергетическая промежуточная структура, которая
энергетически менее устойчива, чем исходные соединения и продукты. Важ-
нейший вклад в суммарный каталитический эффект вносит процесс стабили-
зации переходного состояния —взаимодействия между аминокислотными
остатками белка и субстратом, находящимся в напряженной конфигурации.
Разность значений свободной энергии для исходных реагентов и переходного
состояния соответствует свободной энергии активации (DG
#
). Скорость реак-
ции зависит от величины DG
#
: чем она меньше, тем больше скорость реак-
ции, и наоборот. По сути DG
#
представляет собой «энергетический барьер»,
который требуется преодолеть для осуществления реакции. Стабилизация
переходного состояния понижает этот «барьер» или энергию активации. На
следующем этапе происходит сама химическая реакция, после чего образо-
вавшиеся продукты освобождаются из фермент-продуктного комплекса.
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)

119
Можно выделить несколько причин высокой каталитической активности
ферментов, которые обеспечивают снижение энергетического барьера реак-
ции.
1. Фермент может связывать молекулы реагирующих субстратов таким
образом, что их реакционноспособные группы будут располагаться поблизо-
сти друг от друга и от каталитических групп фермента (эффект сближения).
2. При образовании субстрат-ферментного комплекса достигаются фик-
сация субстрата и его оптимальная для разрыва и образования химических
связей ориентация (эффект ориентации).
3. Связывание субстрата приводит к удалению его гидратной оболочки
(существует на растворенных в воде веществах).
4. Эффект индуцированного соответствия субстрата и фермента.
5. Стабилизация переходного состояния.
6. Определенные группы в молекуле фермента могут обеспечивать ки-
слотно-основный катализ (перенос протонов в субстрате) и нуклеофиль-
ный катализ (формирование ковалентных связей с субстратом, что приводит
к образованию более реакционноспособных структур, чем субстрат).
Одним из примеров кислотно-основного катализа является гидролиз гли-
козидных связей в молекуле муреина с помощью лизоцима. Лизоцим пред-
ставляет собой фермент, присутствующий в клетках различных животных и
растений: в слезной жидкости, слюне, курином белке, молоке. Лизоцим из
куриных яиц имеет молекулярную массу 14 600 Да, состоит из одной поли-
пептидной цепи (129 аминокислотных остатков) и имеет 4 дисульфидных
мостика, что обеспечивает высокую стабильность фермента. Рентгенострук-
турный анализ молекулы лизоцима показал, что она состоит из двух доменов,
образующих «щель», в которой находится активный центр. Вдоль этой «ще-
ли» связывается гексосахарид, причем для связывания каждого из шести са-
харных колец муреина на ферменте имеется свой участок (А, В, С, D, E и F)
(рис. 6.4).
субстрат
фермент
F
E
D
C участок
участок
участок участок
участок В
участок А
NAMNAG
NAM
NAG
NAM
NAG
Glu-35
Asp-52
Рис. 6.4. Расположение гексосахаридного звена муреина в активном цен-
тре молекулы лизоцима: NAG — остаток N-ацетилглюкозамина; NAM —
остаток N-ацетилмурамовой кислоты; заштрихованная часть
рисунка — область активного центра лизоцима
Create PDF files without this message by purchasing novaPDF printer (http://www.novapdf.com)
