Автономова Е.Н. и др. Учебно-лабораторный практикум по курсу Химия
Подождите немного. Документ загружается.


MoS
2
+ NaClO + NaOH → Na
2
MoO
4
+ NaCl + Na
2
SO
4
+ ...
1 MoS
2
+ 24 OH
─
– 18 ē = MoO
4
2─
+ 2 SO
4
2─
+ 12 H
2
O
9 ClO
─
+ H
2
O + 2 ē = Cl
─
+ 2 OH
─
MoS
2
+ 9NaClO + 6NaOH = Na
2
MoO
4
+ 9NaCl + 2Na
2
SO
4
+ 3 H
2
O.
Рассмотрим ОВР с участием органических соединений, к примеру
окисление сахарозы кислым раствором перманганата калия:
C
12
H
22
O
11
+ KMnO
4
+ H
2
SO
4
→ MnSO
4
+ CO
2
+ H
2
O + ...
5 C
12
H
22
O
11
+ 13 H
2
O – 48 ē = 12 CO
2
+ 48 H
+
48 MnO
4
─
+ 8 H
+
+ 5 ē = Mn
2+
+ 4 H
2
O,
5C
12
H
22
O
11
+ 48KMnO
4
+ 72H
2
SO
4
= 48MnSO
4
+ 60CO
2
+ 127H
2
O + 24K
2
SO
4
.
7.5. Экспериментальная часть
7.5.1. Окислительные и восстановительные свойства соединений
серы (IV) (опыт 7.1)
Выполнение опыта
В первую пробирку с раствором дихромата калия К
2
Сr
2
O
7
и во вто-
рую с раствором сульфида натрия Na
2
S внести по нескольку капель 2 н.
раствора серной кислоты и по 2–3 микрошпателя сульфита натрия Na
2
SO
3.
.
Запись данных опыта
Написать уравнения протекающих реакций. Составить баланс для
подбора коэффициентов.
Как изменилась окраска в первой пробирке? Почему помутнел
раствор во второй пробирке? Окислителем или восстановителем может яв-
ляться в химических реакциях К
2
Сr
2
O
7
? Окислителем или восстановителем
может являться в химических реакциях Na
2
S? Окислительные или восста-
новительные свойства проявляет Na
2
SO
3
?
7.5.2. Окислительные и восстановительные свойства соединений
олова (II) (опыт 7.2)
Выполнение опыта
Внести в пробирку по 2–3 капли растворов хлорида железа (III) и
гексацианоферрата (III) калия K
3
[Fe(CN)
6
]. Отметить окраску раствора и
добавить к нему несколько капель раствора хлорида олова (II). Окрашива-
ние раствора в интенсивно синий цвет обусловлено появлением ионов Fe
2+
,
образующих с K
3
[Fe(CN)
6
] синий осадок. Хлорид олова (II) при этом пере-
ходит в хлорид олова (IV).
В другую пробирку внести 5–6 капель хлорида олова (II) и кусочек
цинка, наблюдать на поверхности цинка образование блестящих кристал-
ликов олова.
61

Запись данных опыта
Написать уравнения реакций взаимодействия хлорида олова (II) с
хлоридом железа (III) и с цинком. Окислителем или восстановителем яв-
ляется ион Sn
2+
в этих реакциях?
7.5.3. Влияние рН среды на характер восстановления
перманганата калия (опыт 7.3)
Выполнение опыта
В три пробирки внести по 3–4 капли раствора перманганата калия. В
одну пробирку добавить 2–3 капли 2 н. раствора серной кислоты, во вто-
рую – столько же воды, в третью – такое же количество раствора щелочи.
Во все три пробирки внести по два микрошпателя кристаллического суль-
фита натрия и перемешать растворы до полного растворения кристаллов.
Отметить изменение окраски раствора во всех трех случаях.
Запись данных опыта
Написать уравнения реакций восстановления перманганата калия
сульфитом натрия в кислой, нейтральной и щелочной средах. Учесть, что
соединения марганца в различных степенях его окисления имеют харак-
терные окраски: ион МnО
4
–
имеет фиолетовую окраску, ион МnО
4
2–
– зеле-
ную, ион Mn
2+
– слабо-розовую, а при малой концентрации практически
бесцветен. Диоксид марганца и его гидроксид являются труднораствори-
мыми веществами бурого цвета. В кислой среде может выделяться серни-
стый газ (оксид серы (IV)), который является продуктом побочно проте-
кающей реакции взаимодействия сульфита натрия с серной кислотой.
До какой степени окисления восстанавливается перманганат калия в
растворах, имеющих рН > 7, рН = 7, рН < 7? Чему равен эквивалент
КМnО
4
в каждом из этих случаев?
7.5.4. Окислительные и восстановительные свойства пероксидов
(опыт 7.4)
• Диспропорционирование пероксида водорода
Выполнение опыта
В пробирку с несколькими каплями пероксида водорода прибавить
2 н. раствора серной кислоты. Какой газ выделяется?
Запись данных опыта
Составить схему реакции диспропорционирования пероксида водо-
рода с образованием кислорода и воды. Подобрать коэффициенты методом
полуреакций:
для реакции восстановления пероксида водорода (Н
2
О
2
– окислитель):
Н
2
О
2
+ 2Н
+
+ 2ē = 2Н
2
О,
для реакции окисления пероксида водорода (Н
2
О
2
– восстановитель):
Н
2
О
2
– 2ē = О
2
+ 2Н
+
.
62

• Взаимодействие пероксида водорода с иодидом калия
Выполнение опыта
К раствору иодида калия, подкисленному серной кислотой, приба-
вить 1–2 капли раствора пероксида водорода. Для какого вещества харак-
терна появившаяся окраска раствора?
Запись данных опыта
Написать уравнение реакции. Окислителем или восстановителем яв-
лялся в ней пероксид водорода?
7.5.5. ОВР с участием органических соединений (опыт 7.5)
• Восстановление дихромата калия спиртом
Выполнение работы
В пробирку с раствором дихромата калия К
2
Сr
2
O
7
(5–6 капель) вне-
сти 2–3 капли концентрированной серной кислоты плотностью 1,84 г/см
3
и
4–5 капель этилового спирта С
2
H
5
ОH. Отметить изменение цвета раствора
и появление специфического «яблочного» запаха, присущего уксусному
альдегиду (ацетальдегиду) СН
3
СНО.
Запись данных опыта
Написать уравнение реакции, учитывая, что хром (VI) перешел в
хром (III).
• Восстановление перманганата калия щавелевой кислотой
Выполнение опыта
Внести в пробирку по 5–6 капель раствора щавелевой кислоты
Н
2
С
2
О
4
и 2 н. раствора хлороводородной кислоты. Подогреть раствор до
70–80 °С, опустив пробирку на 4–5 мин в стакан с горячей водой. Вынуть
пробирку и прибавить несколько капель раствора перманганата калия, вс-
тряхивая раствор после добавления каждой капли. Наблюдать обесцвечи-
вание перманганата калия, обусловленное восстановлением его до марган-
ца (II), а также выделение диоксида углерода, до которого окисляется ща-
велевая кислота.
Запись данных опыта
Составить баланс и написать уравнение реакции. Сколько электро-
нов отдает при окислении одна молекула щавелевой кислоты?
7.6. Контрольные вопросы
1. Что такое степень окисления элемента? Как рассчитать эту ве-
личину в конкретном соединении? Приведите пример.
2. Что называют окислением и восстановлением? Приведите приме-
ры типичных окислителей и восстановителей.
3. Дайте примеры ОВР различных типов.
4. Как сравнить силу окислителей или восстановителей?
5. Какие продукты восстановления может дать азотная кислота?
63
6. До каких продуктов восстанавливаются перманганат калия KMnO
4
и дихромат калия K
2
Cr
2
O
7
(или хромат K
2
CrO
4
) в кислой, нейтральной и
щелочной средах?
7. Изложите сущность метода полуреакций (ионно-электронного ба-
ланса) при поиске коэффициентов ОВР.
8. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электрохимия занимается изучением закономерностей, связанных с
взаимным превращением химической и электрической форм энергии. При
электрохимической реакции прямой контакт между реагирующими части-
цами заменяется контактом каждого из ее участников с электродом (метал-
лом), принимающим или отдающим электроны.
В электрохимии изучаются реакции, протекающие за счет подведен-
ной извне электрической энергии или служащие источником ее получения.
8.1. Электродные потенциалы и гальванические элементы
Система, состоящая из металла, погруженного в раствор электроли-
та, называется электродом. Рассмотрим равновесие, устанавливающееся
после погружения металлической пластинки в раствор соли этого металла.
С участием молекул воды протекает обратимый процесс:
Me + mH
2
O ↔ Me
n+
·
mH
2
O + nē.
Если концентрация ионов металла в растворе меньше равновесной,
то при погружении металла в раствор равновесие смещается вправо, что
приводит к отрицательному заряду на металле по отношению к раствору.
Если малоактивный металл погружен в раствор соли с концентрацией
больше равновесной, то происходит переход ионов из раствора на металл,
который заряжается положительно. В любом случае возникает двойной
электрический слой и появляется разность электрических потенциалов.
Абсолютное значение разности потенциалов на границе двух фаз разной
природы «металл – электролит» измерить нельзя, однако можно измерить
разность потенциалов двух различных электродов. Для этого необходимо
собрать электрохимическую ячейку, или гальванический элемент.
Гальваническим элементом называется многофазная система, со-
стоящая по меньшей мере из двух электродов (полуэлементов). В качестве
примера рассмотрим цинк-серебряный гальванический элемент (рис. 8.1),
состоящий из цинкового и серебряного полуэлементов.
Этот гальванический элемент состоит из растворов, содержащих
ионы Zn
2+
и Ag
+
и разделенных пористой диафрагмой для того, чтобы
обеспечить протекание тока без смешения растворов. В каждый из раство-
ров опущен электрод из соответствующего металла. Границу раздела фаз
64
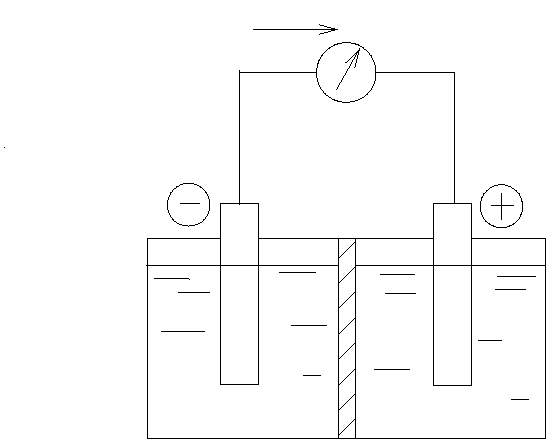
металл – раствор обозначают символом «/», а электролитический контакт
растворов – «//». Схему рассматриваемого элемента представляют в виде
Ag/AgNO//)NO(Zn/Zn
323
.
В цинковом полуэлементе протекает реакция окисления, электрод
является анодом. При протекании тока масса анода уменьшается за счет
его растворения: Zn ↔ Zn
2+
+ 2ē.
В серебряном полуэлементе протекает реакция восстановления:
Ag
+
+ ē ↔ Ag,
электрод является катодом. При протекании тока масса катода увеличива-
ется за счет осаждения на его поверхности металла.
Рис. 8.1. Схема цинк-серебряного гальванического элемента
Суммарное уравнение реакции получается сложением полуреакций:
Zn + 2 Ag
+
↔ Zn
2+
+ 2 Ag.
Направление протекания самопроизвольного процесса можно опре-
делить из величин электродных потенциалов полуэлементов.
Электродный потенциал – это разность потенциалов гальваническо-
го элемента, состоящего из исследуемого электрода и электрода сравнения,
при условии, что ток во внешней цепи равен нулю. Измеренную в таких
условиях разность потенциалов называют электродвижущей силой (ко-
ротко – эдс).
Стандартным электродом сравнения служит стандартный водород-
ный электрод. Это газовый электрод, состоящий из платиновой проволоки,
покрытой слоем платиновой черни, находящийся в атмосфере водорода
под давлением 1,013⋅10
5
Па (1 атм) и погруженный в раствор с активно-
стью ионов Н
+
, равной 1,0 моль/дм
3
. В соответствии с международным со-
Zn(NO
3
)
2
AgNO
3
Zn
Ag
Движение
электронов
65

глашением, потенциал такого электрода условно принят за нуль при лю-
бых температурах:
В00,0
0
)H2/1H(
2
=ϕ
+
.
Для измерения электродного потенциала необходимо собрать гальва-
нический элемент, состоящий из исследуемого электрода (всегда записы-
вают справа) и стандартного водородного электрода (всегда записывают
слева). Например, для цинкового электрода
Zn/)0,1a(Zn//)0,1a(H/H/Pt
2
Zn
2
H
2
==
++
++
Эдс такого гальванического элемента называют стандартным элек-
тродным потенциалом, если измерения проводят при стандартных усло-
виях (активности всех компонентов равны 1,0 моль/дм
3
; Т = 298 К)
0
Zn/Zn
0
Zn/Zn
0
H/H
0
Zn/Zn
0
22
2
2
0E
++++
ϕ=−ϕ=ϕ−ϕ=
.
Потенциал электрода зависит от состава электролита и температуры
в соответствии с уравнением Нернста:
вос
ок
0
a
a
ln
nF
RT
+ϕ=ϕ
,
где φ – потенциал в вольтах, φ
о
– стандартный электродный потенциал;
a
ок
, a
вос
– активности потенциалопределяющих ионов в окисленном и
восстановленном состоянии; n – число электронов, принимающих участие
в данной электродной реакции; F = 96485 Кл/моль – постоянная Фарадея);
R – универсальная газовая постоянная; Т – температура, К.
При Т = 298 К для металлических электродов уравнение Нернста
имеет вид
]Melg[
n
059,0
n0
+
+ϕ=ϕ
.
Таблица стандартных электродных потенциалов
Стандартные электродные потенциалы для различных электродных
реакций приведены в справочных таблицах (табл. П.5, П.6). Величина
стандартного электродного потенциала характеризует стремление элек-
тродной реакции протекать в направлении восстановления иона. Чем
больше величина электродного потенциала, тем вероятней протекание ре-
акции восстановления. Восстановленная форма любого элемента (иона),
имеющая меньшее значение электродного потенциала, будет восстанавли-
вать окисленную форму элемента (иона), имеющего более положительный
потенциал.
Ряд напряжения металлов
66
Стандартные электродные потенциалы для различных металлов, рас-
положенные в порядке возрастания, называют рядом напряжения метал-
лов, который совпадает с рядом активностей металлов (табл. П.5). Этот
ряд позволяет делать практически важные выводы об относительной окис-
лительно-восстановительной способности металлов:
металлы с более отрицательным потенциалом способны вытеснить
(восстановить) из водных растворов солей металлы с более положитель-
ным потенциалом;
металлы с отрицательными электродными потенциалами могут вы-
теснять водород из кислот, металлы с ϕ
0
> 0 этим свойством не обладают.
8.2. Электрохимическая коррозия металлов
Коррозия – это самопроизвольное разрушение металлов в результа-
те физико-химического взаимодействия их с компонентами окружающей
среды. Электрохимическая коррозия наблюдается в случае электрическо-
го контакта двух различных металлов с раствором электролита (рис.
8.2). При этом возникают микроскопические гальванические элементы
(гальванические пары). Как и в любом гальваническом элементе, появ-
ляются анодные и катодные участки поверхности, на которых протекают
процессы окисления и восстановления. Наличие двух металлов не является
необходимым: микроскопические гальванические элементы могут возни-
кать за счет энергетической неоднородности поверхности (дефекты, напря-
жения) или за счет различной концентрации электролита.
Анодный процесс
При электрохимической коррозии анодным процессом всегда являет-
ся окисление металла с меньшим стандартным потенциалом:
Me ↔ Me
n+
+ nē.
В результате происходит растворение металла и переход его в
раствор, анод приобретает отрицательный заряд.
Катодный процесс
Электроны, освободившиеся на аноде, перемещаются к катодному
участку, имеющему больший потенциал. Электроны расходуются в про-
цессе восстановления каких-либо ионов или молекул (деполяризация). В
зависимости от состава электролита различают водородную деполяризацию
при рН < 7
2H
+
+ 2ē = H
2
(8.1)
и кислородную деполяризацию при рН ≥ 7
O
2
+ 2H
2
O + 4ē = 4OH
–
. (8.2)
67
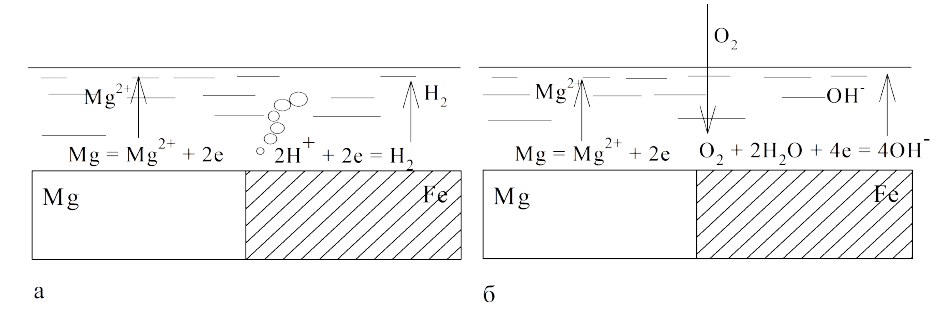
В качестве примера рассмотрим электрохимическую коррозию маг-
ния при контакте с железом (рис. 8.2). Определим по табл. П.5 стандарт-
ные потенциалы магния и железа:
В36,2
0
Mg/Mg
2
−=ϕ
+
;
В44,0
0
Fe/Fe
2
−=ϕ
+
.
Так как стандартный потенциал магния меньше, в паре с железом он
будет анодом. Таким образом, магний окисляется, ионы магния переходят
в раствор. Поверхность железа является катодом, в кислой среде (рН < 7)
протекает реакция (8.1), и выделяется газообразный водород. В нейтраль-
ной и щелочной среде (рН ≥ 7) восстанавливается кислород согласно схеме
(8.2).
Рис. 8.2. Электрохимическая коррозия магния при контакте
с железом: а – в растворе с рН < 7; б – в растворе с рН ≥ 7
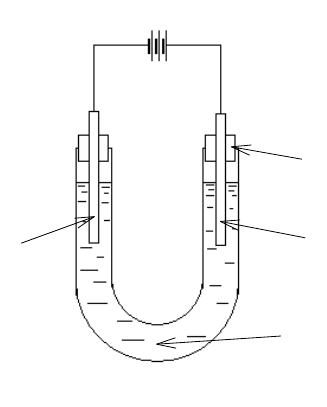
8.3. Электролиз водных растворов электролитов
Электролизом называют совокупность процессов, протекающих
при прохождении постоянного тока через расплав или раствор электро-
лита. Схема электролизера приведена на рис. 8.3.
В процессе электролиза при приложении к ячейке постоянного
напряжения от внешнего источника химическая реакция протекает в
направлении, противоположном самопроизвольному. На отрицательном
электроде протекает реакция восстановления, электрод называют катодом.
На положительном электроде протекает реакция окисления, электрод на-
зывают анодом.
Количественные соотношения электролиза установлены М. Фара-
деем (1827 г.). Согласно его закону, масса прореагировавшего на электроде
вещества пропорциональна затраченному количеству электричества:
m = k · Q = k · I · t,
где Q – количество электричества, Кл; k – электрохимический эквивалент,
г/Кл; I – сила тока, А; t – продолжительность электролиза, с.
68
Электрохимический эквивалент рассчитывают из соотношения
k = M / (n · F),
где М – молярная масса окислителя или восстановителя; n – число элек-
тронов, участвующих в полуреакции на данном электроде; F – постоян-
ная Фарадея.
(-)Катод(+)Анод
1
2
3
2
Рис. 8.3. Схема лабораторного электролизера:
1 – пробки; 2 – графитовые электроды; 3 – электролит
Последовательность разряда ионов при электролизе
Электродные реакции, протекающие в электролитической ячейке,
требуют приложения минимального внешнего напряжения. При электро-
лизе водных растворов необходимо учитывать возможность окисления и
восстановления молекул H
2
O.
Если на электроде возможно протекание нескольких конкурирую-
щих процессов, то для определения их последовательности необходимо
руководствоваться следующими правилами, определяющими последова-
тельность разряда ионов на электродах.
На аноде в первую очередь окисляется наиболее сильный восстано-
витель (восстановленная форма той полуреакции, потенциал которой мень-
ше), поэтому с учетом перенапряжения на аноде в первую очередь окисля-
ются анионы бескислородных кислот (Cl
–
, Br
–
, I
–
, CN
–
, S
2–
, NCS
–
); вода
при этом не окисляется. Анионы кислородсодержащих кислот (SO
4
2–
, NO
3
–
,
CO
3
2–
и др.), а также анион F
–
на аноде не окисляются, происходит окисле-
ние воды до кислорода.
На катоде в первую очередь восстанавливается наиболее сильный
окислитель (окисленная форма той полуреакции, потенциал которой
больше). Катионы металлов с положительным значением стандартного
электродного потенциала восстанавливаются на катоде с образованием
свободного металла. Катионы, которым соответствует потенциал меньше
69

нуля в кислой среде или меньше –0,41 В в нейтральной, на катоде не
восстанавливаются (в этом случае восстанавливаются ионы Н
+
или молеку-
лы воды с образованием водорода). При использовании в качестве анода
активного металла (большинство металлов, за исключением благородных
и некоторых, подверженных пассивации) происходит окисление материала
анода (его растворение).
8.4. Химические источники тока
Химические источники тока – это устройства, вырабатывающие
электрическую энергию за счет протекания окислительно-восстанови-
тельных реакций. Основой конструкции химического источника тока яв-
ляется гальванический элемент с двумя электродами (на одном протекает
окисление, на другом – восстановление), находящимися в контакте с элек-
тролитом (жидким или твердым).
Все химические источники тока делят на гальванические элементы
(первичные элементы), аккумуляторы (вторичные элементы) и топлив-
ные элементы.
Гальванический элемент содержит запас реагентов, после расходова-
ния которых становится неработоспособным. Например, медно-цинковый
гальванический элемент (элемент Даниэля) Zn/ZnSO
4
//CuSO
4
/Cu. Суммар-
ное уравнение реакции
Zn + Cu
2+
= Zn
2+
+ Cu.
Аккумулятор рассчитан на многократное использование. При про-
пускании тока от внешнего источника в обратном направлении происходит
регенерация реагентов гальванического элемента (зарядка). Например,
свинцовый аккумулятор PbO
2(тв)
/H
2
SO
4(р-р)
/Pb
(тв)
. Электроды (пластины)
свинцового аккумулятора изготовлены из свинцовой сетки, ячейки кото-
рой заполнены пастой из оксида свинца (IV). Электролитом служит
30%-ный раствор серной кислоты. Погружение пластин в серную кислоту
приводит к образованию на поверхности труднорастворимого сульфата
свинца PbSO
4
. Суммарная реакция, протекающая в аккумуляторе:
PbO
2(тв)
+ 2H
2
SO
4(р-р)
+ Pb
(тв)
Разряд
Заряд
2PbSO
4(тв)
+ 2H
2
O
(ж)
Топливные элементы (электрохимические генераторы) могут рабо-
тать длительное время за счет постоянного подвода реагентов и отвода
продуктов реакции.
70
