Автономова Е.Н. и др. Учебно-лабораторный практикум по курсу Химия
Подождите немного. Документ загружается.

Условия и результаты опыта записать по форме табл. 3.3.
Таблица 3.3
Влияние температуры на скорость реакции
T,
o
C τ, с W, с
–1
20
30
40
По данным табл. 3.3 построить график в координатах «W – T». Сде-
лать вывод о соответствии зависимости скорости реакции от температуры
правилу Вант-Гоффа.
3.3.4. Смещение равновесия обратимой реакции (опыт 3.4)
О состоянии равновесия обратимой реакции
[Fe(H
2
O)
6
]Cl
3
+ KSCN ↔ [Fe(H
2
O)
5
SCN]Cl
2
+ KCl
судят по интенсивности красной окраски раствора, обусловленной присут-
ствием продукта взаимодействия – [Fe(H
2
O)
5
SCN]Cl
2
.
Выполнение опыта
В 4 пробирки вносят по 10 капель разбавленных растворов FeCl
3
и
KSCN. Получают растворы с одинаковой интенсивностью окраски, свиде-
тельствующей о равной концентрации [Fe(H
2
O)
5
SCN]Cl
2.
Одну пробирку
оставляют в качестве контрольной, а в другие добавляют соответственно
каплю насыщенного раствора FeCl
3
, каплю насыщенного раствора KSCN и
один микрошпатель кристаллического KCl. Результат исследования зано-
сят в табл. 3.4.
Таблица 3.4
Смещение равновесия при изменении концентрации вещества в растворе
Про-
бир-
ка
Оказанное воздействие
Наблюдаемое
изменение окраски
Направление
смещения
равновесия
1
Добавлена капля насыщенного
раствора FeCl
3
2
Добавлена капля насыщенного
раствора KSCN
3 Добавлен кристаллический KCl
Составить выражение для константы равновесия исследуемой реак-
ции. Сделать вывод о соответствии наблюдаемых явлений принципу Ле
Шателье.
31
3.4. Контрольные вопросы
1. Что называют термодинамической системой?
2. Назовите главное свойство функции состояния системы.
3. Сформулируйте закон Гесса.
4. Что называют энтальпией образования соединения?
5. Какое следствие из закона Гесса используют в термодинамических
расчетах?
6. Что называют скоростью химической реакции?
7. От каких факторов зависит скорость химической реакции?
8. Сформулируйте основной постулат химической кинетики.
9. Какой физический смысл имеет константа скорости реакции?
10. Как правило Вант-Гоффа и уравнение Аррениуса описывают
влияние температуры на скорость реакции?
11. На основании принципа Ле Шателье объясните направления сме-
щения равновесия обратимой реакции в опыте 3.4.
4. ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ. ДИСПЕРСНЫЕ СИСТЕМЫ
Дисперсные системы (ДС) – это микрогетерогенные системы, состо-
ящие из двух и более фаз. Одна из фаз – сплошная (дисперсионная среда),
а другие распределены в ней в виде микровключений (дисперсные фазы).
Дисперсные системы чрезвычайно распространены в живой и нежи-
вой природе и технологиях (почвы, сплавы, пищевые продукты, волокна,
растительного и животного происхождения, краска и т.д.). Они образуются
в основном двумя путями: измельчение (дробление, размалывание, распы-
ление) или конденсация (образование осадков при химических реакциях).
4.1. Классификация дисперсных систем
В качестве классификационных признаков используют дисперсность,
агрегатное состояние, энергию межфазного взаимодействия и др.
Дисперсную фазу характеризуют дисперсностью – обратной величи-
ной среднего размера частиц (D = 1/d).
Дисперсностью, например, характеризуют качество (степень) помола
различных материалов, извести (СаО) и кварцевого песка (SiO
2
) на пред-
приятиях строительных материалов. Для производства силикатного кирпи-
ча дисперсность исходных минералов доводят до 3∙10
6
– 5∙10
6
м
–1
.
По размеру частиц системы разделяют на грубодисперсные
(d >10
–5
м), системы промежуточной дисперсности (10
–5
> d >10
–7
м) и вы-
сокодисперсные, или коллоидные (10
–7
> d > 10
–9
м). Последние могут
иметь удельную поверхность до сотен м
2
/г.
32
Механические смеси (d > 10
–4
м) к ДС не относят. Их частицы видны
невооруженным глазом. Такие смеси легко разрушаются под действием
гравитационного поля или при фильтрации на крупнопористых фильтрах.
Размеры дисперсных частиц неодинаковы. Это свойство ДС называ-
ется полидисперсностью.
При классификации по агрегатному состоянию дисперсионной
среды выделяют три группы ДС, в которых дисперсионная среда является
твердой, жидкой и газообразной (табл. 4.1).
Таблица 4.1
Классификация ДС по агрегатному состоянию (Д.А. Фридрихсберг)
Диспер-
сионная
среда
Диспер-
сная
фаза
Тип системы Примеры
Т
Т
Твердые коллоидные раство-
ры
Минералы, сплавы
(самоцветы, сталь)
Ж
Пористые тела, капиллярные
системы, гели
Влажные грунты,
жемчуг, древесина
Г
Пористые тела, капиллярные
системы, ксерогели
Пемза,
ячеистый бетон
Ж
Т Золи, суспензии Меловая побелка
Ж Эмульсии Молоко, смазки
Г Газовые эмульсии, пена Мыльная пена
Г
Т Аэрозоль, дым
Табачный дым,
угольная пыль
Ж Аэрозоль, туман Туман, облака
Г
Системы с флуктуациями
плотности
Атмосфера Земли
Если дисперсионной средой является вода, то ДС называют гидрозо-
лями, если органический растворитель – органозолями. Если дисперсион-
ной средой является воздух (дым, туман), такие ДС называют аэрозолями.
Дисперсные системы по структурным свойствам разделяют с уче-
том их структурных свойств на два основных типа:
свободнодисперсные системы, в которых частицы дисперсной фазы
существуют отдельно друг от друга, не образуя агрегатов;
связнодисперсные системы – гели, в которых отдельные частицы за
счет сил межмолекулярного взаимодействия образуют агрегаты, объединя-
ются в цепные, сетчатые, кольчатые структурные ассоциаты. Гели, в от-
личие от золей, не обладают текучестью. В качестве примеров могут слу-
жить гели кремниевых кислот (силикагели), гель гидроксида алюминия
(обезвоженный алюмогель), желатиновый студень и др.
33
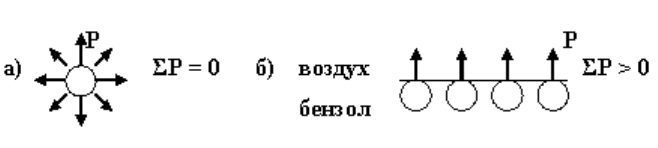
Дисперсные частицы могут иметь самую разную форму, чаще – не-
правильную. По форме частиц дисперсной фазы различают ДС пластин-
чато-дисперсные (слюда), капиллярно-дисперсные (волокна) и корпуску-
лярно-дисперсные (суспензия мела в воде).
4.2. Образование и свойства дисперсных систем
Получают ДС двумя противоположными путями – диспергировани-
ем грубых частиц на более мелкие и агрегацией молекул или ионов в более
крупные частицы. Диспергирование осуществляется при механическом из-
мельчении, распылении или переходе во взвешенное состояние уже суще-
ствующей, но осажденной дисперсной фазы (пептизация). Агрегация мо-
жет быть осуществлена физическим методом (конденсация пара с образо-
ванием тумана) или химическим (при протекании реакции осаждения, при-
водящей к образованию золя или геля).
4.2.1. Удельная поверхность дисперсных систем
Дисперсные системы обладают колоссальной удельной площадью
поверхности раздела фаз. Это обусловлено увеличением площади поверх-
ности частиц при измельчении. Так, если частицу в 1 см
3
раздробить до ча-
стиц с длиной ребра 10
–7
м, то поверхность раздела фаз увеличится от 6
см
2
до 600 м
2
. Известно, что 1 г активированного угля обладает суммарной
поверхностью до 1000 м
2
.
На поверхности частицы дисперсной фазы и внутри нее молекулы
неравноценны по запасу сил межмолекулярного взаимодействия. Молеку-
лы внутри частицы испытывают взаимодействие соседних молекул по
всем направлениям, для них силы межмолекулярного притяжения (Р)
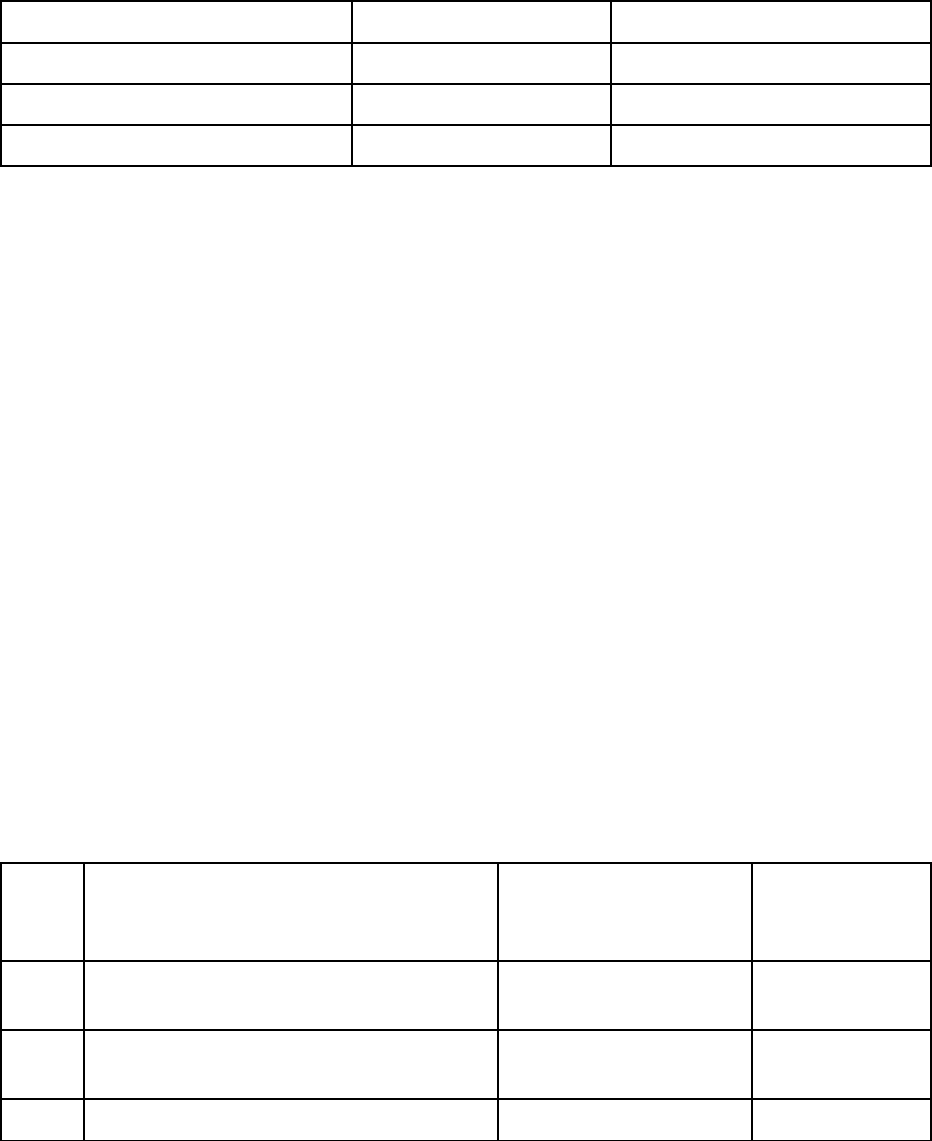
компенсированы и их сумма равна нулю (рис. 4.1а).
Рис. 4.1. Силы межмолекулярного взаимодействия молекулы:
а – внутри дисперсной частицы; б – на поверхности раздела фаз
Молекулы на границе раздела фаз (например, масло – вода, вода –
воздух, бензол – воздух) обладают некомпенсированными силами межмо-
лекулярного взаимодействия, для них ΣР > 0. Эти силы в совокупности со-
здают свободную поверхностную энергию (F), прямо пропорциональную
удельной площади поверхности раздела фаз S
уд
:
F = σ S
уд
, (4.1)
34
где σ, Дж/м
2
, – удельная поверхностная энергия, называемая поверхност-
ным натяжением. Величину σ можно интерпретировать как работу по со-
зданию единицы площади поверхности раздела фаз.
Удельная площадь поверхности раздела фаз S
уд
определяется отно-
шением площади поверхности к объему частиц дисперсной фазы:
S
уд
= S / V. (4.2)
Согласно второму закону термодинамики, система самопроизвольно
стремится перейти в состояние с меньшим запасом свободной поверхност-
ной энергии (F → F
min
). Следовательно, ДС являются термодинамически
неустойчивыми. Это проявляется в стремлении системы к снижению запа-
са поверхностной энергии F, которое делает дисперсную систему агрега-
тивно неустойчивой.
4.2.2. Факторы, влияющие на устойчивость дисперсных систем
Стремление F → F
min
может быть реализовано путем уменьшения
площади удельной поверхности S
уд
→ S
уд
min
или снижения величины по-
верхностного натяжения σ.
Коагуляция (укрупнение частиц суспензии) и коалесценция (слияние
капель эмульсии) приводят к уменьшению величины S
уд
, а значит, и F.
Слипание частиц обусловлено силами межмолекулярного притяжения.
Коагуляция и коалесценция могут завершаться разрушением дисперсной
системы, когда под действием сил гравитации крупные тяжелые частицы
самопроизвольно оседают на дно. Это явление называется седиментацией.
Укрупненные капли легкой фазы в эмульсиях всплывают на поверхность,
образуя два слоя с четкой или размытой поверхностью раздела фаз. Систе-
ма из микрогетерогенной превращается в гетерогенную. Таким образом,
ДС являются агрегативно неустойчивыми системами.
Удельная площадь поверхности дисперсной фазы S
уд
может не
уменьшаться, если будут компенсированы силы свободной поверхностной
энергии. Это явление имеет место тогда, когда на поверхности частиц дис-
персной фазы адсорбируются молекулы другого вещества (адсорбтива),
имеющего физико-химическое сродство к веществу дисперсной фазы.
Адсорбцией называют самопроизвольное концентрирование веще-
ства на границе раздела фаз. Она происходит на любых межфазных по-
верхностях, причем адсорбироваться могут любые вещества. Часто взаи-
модействие, приводящее к адсорбции, имеет физическую природу. Воз-
можно также образование химических связей между молекулами адсорби-
рованного соединения и вещества на границе раздела фаз. Этот вариант ад-
сорбции называется хемосорбцией. В ряде случаев поглощение одного ве-
щества другим не ограничивается поверхностным слоем, а происходит во
всем объеме сорбента. Такое поглощение называют абсорбцией.
35
Адсорбция газов и паров на поверхности твердых тел сопровождает-
ся уменьшением свободной поверхностной энергии системы F, что приво-
дит к ее стабилизации. В результате адсорбции происходит перераспреде-
ление компонентов между объемными фазами и поверхностными слоями.
Важнейшей адсорбционной характеристикой вещества является по-
верхностная активность, выражаемая в Дж∙м
2
/моль или Н∙м/моль. Если с
увеличением концентрации некоторого вещества на границе раздела фаз
величина σ понижается, то его называют поверхностно-активным веще-
ством (ПАВ). Большинство органических веществ имеют значение σ,
меньшее, чем вода (для воды σ = 72∙10
–3
Дж/м
2
), поэтому по отношению к
воде они поверхностно активны. Например, для масляной кислоты
σ = 26,5∙10
–3
Дж/м
2
,
следовательно, это ПАВ.
Молекулы ПАВ имеют особое строение (рис. 4.2): неполярную угле-
водородную цепь и полярную часть, представленную функциональными
группами –COOH, –NH
2
, –OH, –O–, –SO
2
OH и др.
Рис. 4.2. Схематическое строение молекулы ПАВ
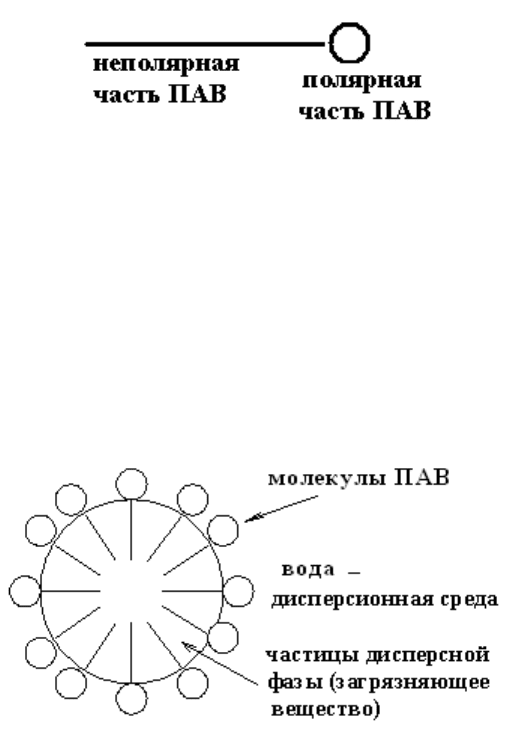
Молекулы ПАВ неполярной частью обращаются к неполярному ве-
ществу дисперсных частиц (бензол, частицы загрязняющих веществ), а по-
лярной группой связываются с полярными молекулами вещества диспер-
сионной среды (например, воды). На частице загрязняющего вещества мо-
лекулы ПАВ располагаются, как частокол, образуя моно- или полимолеку-
лярные слои (рис. 4.3). Таким образом, ПАВ концентрируются на поверх-
ности раздела фаз – адсорбируются.
Рис. 4.3. Схема распределения молекул ПАВ на границе раздела фаз
Частицы дисперсной фазы, окруженные ПАВ, увлекаются в объем
дисперсионной среды (моющего раствора), отрываясь от загрязненной по-
36
верхности. Например, ПАВ типа обычного мыла (олеат натрия) при кон-
центрации 10
–6
моль/см
3
снижают σ воды при 298 К с 72∙10
–3
до
32∙10
–3
Дж/м
2
. В результате вода с добавкой ПАВ стекает, не оставляя
«жирных» капель, а бензин смывается с рук.
4.3. Высокодисперсные системы – золи (коллоидные растворы)
Золи обладают повышенной агрегативной устойчивостью и могут су-
ществовать долгое время без изменения степени дисперсности. Это объяс-
няется особым строением коллоидных частиц. В качестве примера
рассмотрим строение золя иодида серебра, образующегося в результате
реакции ионного обмена нитрата серебра с иодидом калия:
AgNO
3
+ KI = AgI↓ + KNO
3
.
В начале осаждения образуются мельчайшие кристаллы AgI – заро-
дыши микрокристаллического ядра, на поверхности которых адсорбиру-
ются ионы Ag
+
, входящие в состав кристаллов и в избытке присутствую-
щие в растворе. Эти ионы (Ag
+
) называют потенциалопределяющими. Они
притягивают к себе ионы противоположного знака (NO
3
–
). Так, на поверх-
ности ядра AgI формируется двойной электрический слой из адсорбирован-
ных потенциалопределяющих ионов (Ag
+
) и противоионов (NO
3
–
). Ад-
сорбированные ионы достаточно прочно связаны с ядром силами межмо-
лекулярного притяжения. Ядро с адсорбционным слоем образует гранулу.
Каждая гранула несет заряд (в рассматриваемом примере – положитель-
ный). Одноименно заряженные гранулы взаимно отталкиваются. Это пре-
пятствует коагуляции ДС и обеспечивает кинетическую устойчивость кол-
лоидных растворов. Часть ионов NO
3
–
, компенсирующих заряд гранулы, не
адсорбированы, а удалены от ядра и образуют диффузионный слой колло-
идной частицы, которая в целом называется мицеллой. Таким образом, ми-
целлы нейтральны.
Образование золя иодида серебра при избытке нитрата серебра при-
водит к такому строению коллоидных мицелл, при котором гранулы име-
ют положительный заряд (рис. 4.4):
{[AgI]
m
· nAg
+
· (n-x)NO
3
–
}
x+
· x NO
3
–
. (4.3)
Строение мицеллы золя иодида серебра, образовавшегося при избыт-
ке иодида калия, может быть выражено формулой
{[AgI]
m
· nI
–
· (n-x)K
+
}
x–
· x K
+
. (4.4)
Наличие заряженных гранул в составе коллоидных мицелл подтвер-
ждает явление электрофореза, заключающееся в том, что при пропуска-
нии постоянного электрического тока происходит перемещение гранул и
противоионов к электродам противоположного по знаку заряда.
37
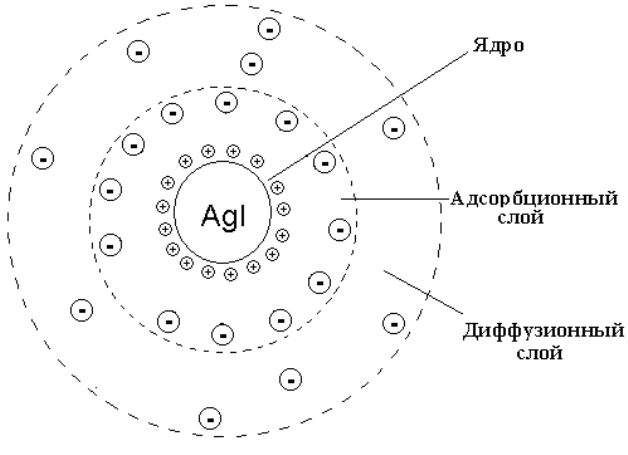
Рис. 4.4. Строение коллоидной мицеллы золя иодида серебра
при избытке нитрата серебра
4.4. Связнодисперсные системы – гели
Дисперсные системы с жидкой или газообразной дисперсионной
средой обладают некоторыми свойствами твердых тел: способностью
сохранять форму, прочностью, упругостью, пластичностью. Эти свойства
гелей обусловлены существованием у них структурной сетки (каркаса), об-
разованной частицами дисперсной фазы, которые связаны между собой си-
лами межмолекулярного взаимодействия различной природы.
Гели в виде студенистых осадков (коагелей) образуются из золей
при их коагуляции или в процессах выделения новой фазы из пересыщен-
ных растворов как низко-, так и высокомолекулярных веществ. Гели с вод-
ной дисперсионной средой называют гидрогелями, с жидкой углеводород-
ной средой – органогелями. Отвердение золей во всем объеме без выделе-
ния осадка и нарушения их однородности дает так называемые лиогели.
Вся дисперсионная среда в таких гелях лишена подвижности (иммобилизо-
вана) вследствие изолирования в ячейках структурной сетки. Чем больше
асимметрия частиц, тем при более низком содержании дисперсной фазы
образуется гель. Например, при образовании гидрогеля из гидрозоля пен-
токсида ванадия для отвердения системы достаточно 0,05%, в других слу-
чаях – нескольких объемных процентов дисперсной фазы. Лиогели облада-
ют малой прочностью, пластичностью, некоторой эластичностью и тиксо-
тропией, то есть способностью обратимо восстанавливать структуру, раз-
рушенную механическим воздействием. Таковы, например, гели мыл и
мылоподобных поверхностно-активных веществ, гели гидроксидов многих
поливалентных металлов. Высушиванием лиогелей можно получить аэро-
38

гели, или ксерогели, – микропористые системы, лишенные пластичности,
имеющие хрупкую, необратимо разрушаемую структуру. Так получают
распространенные сорбенты: алюмогель из геля гидроксида алюминия и
силикагель из студней кремниевой кислоты.
4.5. Экспериментальная часть
4.5.1. Получение суспензии мыла в воде и исследование ее свойств
(опыт 4.1)
Налейте в две цилиндрические пробирки до ½ объема каждой ди-
стиллированной воды и внесите по 1 микрошпателю порошка мела. В одну
из пробирок добавьте 1 мл 1%-ного раствора мыла. Пробирки закройте
пробками и сильно встряхните.
Включив секундомер, наблюдайте расслоение полученной сус-
пензии. Отметьте время до осветления верхней водной фазы в каждой из
пробирок. Наблюдайте седиментацию крупных тяжелых частиц.
Как влияет добавка мыла на скорость разрушения суспензии?
Перенесите стеклянной палочкой 2–3 капли мутной жидкости (без
мыла) на зеркало и рассмотрите суспензию через лупу. Охарактеризуйте
полученную суспензию.
Ответьте на вопросы:
1. Что является дисперсионной средой?
2. Каков химический состав дисперсной фазы?
3. Моно- или полидисперсной системой является данная суспензия?
4. Повышает ли агрегативную устойчивость добавка мыла?
Сравните размеры частиц дисперсной фазы в полученной суспензии.
Обсудите роль молекул мыла С
17
Н
35
СООNa.
4.5.2. Получение эмульсии бензола в воде (опыт 4.2)
В две пробирки налить до ½ дистиллированной воды и в каждую до-
бавить 8–10 капель бензола. В одну из пробирок добавить 10 капель 1%-
ного раствора мыла. Обе пробирки плотно закрыть резиновыми пробками
и сильно встряхнуть. По секундомеру наблюдать от момента встряхивания
расслоение эмульсии. Убедитесь в том, что в присутствии мыла эмульсия
более стабильна во времени. Наблюдайте быстрое расслоение эмульсии в
пробирке без добавок мыла.
Как объяснить повышение агрегативной устойчивости эмульсии до-
бавками мыла?
Изобразите схематически адсорбцию молекул мыла на поверхности
капель бензола.
Объясните причину адсорбции ПАВ на поверхности капелек бензола.
39
4.5.3. Испытание действия моющего средства (опыт 4.3)
Каплю растительного масла нанесите на ладонь и попытайтесь
смыть водой. В случае неудачи смойте каплю при помощи мыла. Вместо
мыла в качестве ПАВ можно использовать другое вещество, например сти-
ральный порошок.
Какова роль мыла в процессе смывания растительного масла с кожи
рук?
Как ориентированы ионы стеариновой кислоты (С
17
Н
35
СОО
–
) в этой
системе?
4.5.4. Образование геля кремниевой кислоты (опыт 4.4)
В пробирку внести 6 капель 2 М раствора хлороводородной кислоты
и добавить, встряхивая пробирку, 15 капель 10%-ного раствора силиката
натрия. Отметить образование золя кремниевой кислоты и наблюдать
превращение в гель.
Чем объясняется образование гелей? Почему гели теряют текучесть?
В каких случаях возможно превращение золя в гель?
4.5.5. Получение геля кремниевой кислоты из золя (опыт 4.5)
В цилиндрическую пробирку налить 3 – 5 капель концентрирован-
ной хлороводородной кислоты (ρ = 1,19 г/см
3
), внести 1 – 2 капли насы-
щенного раствора силиката натрия (силикатный клей) и смесь встряхнуть.
Полученный золь кремниевой кислоты нагреть на водяной бане до перехо-
да золя в гель.
Объясните роль нагревания. Чем отличается золь от геля? Какие
золи можно превратить в гель и наоборот?
4.5.6. Получение коллоидного раствора гидроксида железа (III)
при гидролизе соли железа (опыт 4.6)
В стакан емкостью 50 см
3
налить 20 см
3
дистиллированной воды и
нагреть на плитке до кипения. Снять стакан с плитки и в горячую воду при
помешивании стеклянной палочкой внести 30 капель раствора хлорида же-
леза (III). Полученный раствор снова нагреть и кипятить в течение 1 –
2 минут. Отметить красный цвет золя гидроксида железа. Оставить стакан-
чик с полученным золем до следующего опыта.
Составьте ионное и молекулярное уравнение гидролиза хлорида же-
леза (III), который при нагревании и высокой степени разбавления проте-
кает до конца, т.е. до образования гидроксида железа (III). Изобразите гра-
фически строение коллоидной мицеллы. В центре находится ядро из моле-
40
