Автономова Е.Н. и др. Учебно-лабораторный практикум по курсу Химия
Подождите немного. Документ загружается.


[HCN]
]].[CN[H
-
+
=
K
. (6.1)
Диссоциируют ионные и полярные ковалентные соединения. Чем
выше диэлектрическая постоянная растворителя (ε
0
), тем сильнее его
ионизирующее действие [α = f(ε
0
) ]. Ассоциации ионов препятствует их
сольватная (гидратная) оболочка.
Изотонический коэффициент Вант-Гоффа
(i)
показывает, во сколь-
ко раз число частиц в растворе превышает число растворенных молекул.
Коэффициент
i
можно рассчитать по величине α, которая, в свою очередь,
может быть найдена из значения константы диссоциации электролита К
Д
:
)1(1
−⋅+=
ni
α
, (6.2)
где n – количество ионов, на которые распадается молекула при диссоциа-
ции.
Законы Рауля и Вант-Гоффа для разбавленных растворов электро-
литов имеют вид
);(
0
0
вовNi
P
PP
−⋅=
−
(6.3)
ΔТ
кр
= i
· К
кр
· С
m
; (6.4)
ΔТ
кип
= i
· Е · С
m
; (6.5)
Р
осм
= i
· С
M
· R · T. (6.6)
Электролиты называют сильными, если при С
н
= 1 моль/дм
3
α >
0,5
(к ним относятся практически все растворимые соли, HCl, H
2
SO
4
, HNO
3
,
NaOH, Ba(OH)
2
и др.), и слабыми, если при С
н
= 1 моль/дм
3
α < 0,5
(CH
3
COOH, HCN, H
2
S, HNO
2
, H
2
CO
3
, H
2
SO
3
, Сu(OH)
2
, Zn(OH)
2
, Fe(OH)
2
,
Fe(OH)
3
и др.; см. табл. П.1 приложений).
Закон разбавления Оствальда связывает константу равновесия
диссоциации слабого электролита К
Д
с величиной степени диссоциации α
при данной молярной концентрации С:
α−
⋅α
=
1
2
С
K
Д
,
а при α << 1
C
K
Д
=
α
. (6.7)
Электролиты, проявляющие свойства и кислот, и оснований, назы-
вают амфотерными. Пример амфотерного соединения – гидроксид цинка
Zn(OH)
2
:
Zn(OH)
2
+ 2 H
+
= Zn
2+
+ 2 H
2
O;
51

Zn(OH)
2
+ 2 ОH
–
= ZnО
2
2–
+ 2 H
2
O (при плавлении);
Zn(OH)
2
+ 2 OH
–
= [Zn(OH)
4
]
2–
(в растворе).
Ионные равновесия и реакции
Реакции ионного обмена протекают в том случае, когда возможно
образование менее диссоциированных продуктов, чем исходные вещества.
При составлении ионных уравнений принято сильные электролиты запи-
сывать в ионной форме, а слабые – в молекулярной. Например, для реак-
ции нейтрализации сильной кислоты сильным основанием ионное уравне-
ние имеет вид
Н
+
+ ОН
–
= H
2
O
.
Равновесие диссоциации воды
Для водных растворов ионное произведение
К
W
– величина, постоян-
ная при данной температуре:
К
W
= [H
+
] · [OH
–
] = 1
· 10
–14
(при t
=
25
o
C). (6.8)
Водородный показатель – логарифмическая форма выражения мо-
лярной концентрации свободных ионов Н
+
:
рН = –lg[H
+
]
.
(6.9)
Шкала рН
←усиление кислотности усиление щелочности→
--0---1---2---3---4---5---6-- -7- --8---9---10---11---12---13---14--
Малорастворимые электролиты в растворе ионизированы. Величина
ионного произведения при данной температуре постоянна, ее называют
произведением растворимости (ПР). В общем виде для электролита со-
става A
x
B
y
ПР = [A
y+
]
x
· [B
x–
]
y
. (6.10)
Соотношение между ПР и растворимостью (С, моль/дм
3
) представим
на примере сульфида висмута (III):
Bi
2
S
3
(тв)
↔ 2 Bi
3+
(р–р) + 3 S
2–
(р–р) ,
ПР(Bi
2
S
3
) = [Bi
3+
]
2
· [S
2–
]
3
= (2С)
2
· (3С)
3
= 108 С
5
.
По справочным данным (табл. П.2), ПР(Bi
2
S
3
) = 1,0 · 10
–97
.
Гидролиз солей – процесс их ионного обмена с молекулами воды,
при котором образуются малодиссоциированные соединения:
CH
3
COONa + H
2
O ↔ CH
3
COOH + NaOH
,
CH
3
COO
–
+ H
2
O ↔ CH
3
COOH + OH
–
, pH >
7.
52
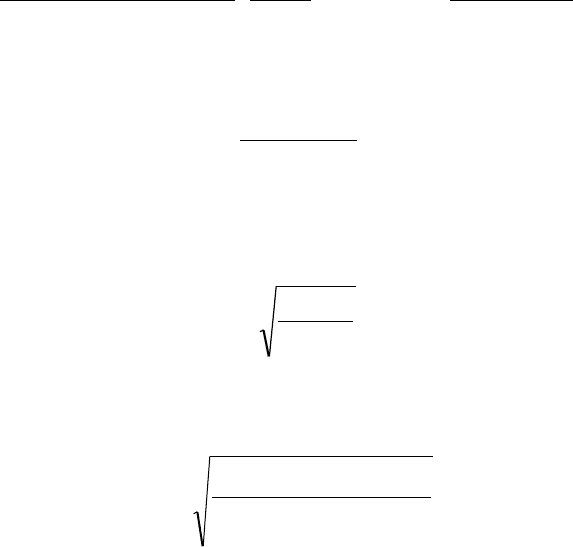
NH
4
Cl + H
2
O ↔ NH
4
OH + HCl
,
NH
4
+
+ H
2
O ↔ NH
4
OH + H
+
, pH <
7.
Доля подвергшихся гидролизу молекул называется степенью гидро-
лиза h; 0 < h ≤ 1. Гидролитическое равновесие подчиняется закону дей-
ствующих масс. Константа гидролиза К
г
представляет собой константу
равновесия гидролиза, умноженную на постоянную 55,56 моль/дм
3
(моляр-
ная концентрация Н
2
О). Для гидролиза ацетата
.)(
][
][
][
][][
3
3
кисл
Д
K
K
г
K
H
H
COOCH
OHCOOHCH
г
K
W
=⇒
+
+
⋅
−
−
⋅
=
. (6.11)
Аналогично для гидролиза соли слабого основания
.)(осн
Д
K
K
г
K
W
=
. (6.12)
Для равновесия гидролиза справедливо соотношение, аналогичное
закону Оствальда для диссоциации:
соли
C
г
K
h
=
.
(6.13)
Уравнение (6.13) применяют для расчета величины рН растворов
гидролизующихся солей. Например, для соли слабой кислоты
соли
С
кислД
K
W
K
h
⋅
=
.)(
. (6.14)
Многозарядные ионы подвергаются гидролизу ступенчато:
Cr
3+
+ H
2
O ↔ CrOH
2+
+ H
+
,
CrOH
2+
+ H
2
O ↔ Cr(OH)
2
+
+ H
+
,
Cr(OH)
2
+
+ H
2
O ↔ Cr(OH)
3
+ H
+
;
CO
3
2–
+ H
2
O ↔ HCO
3
–
+ OH
–
,
HCO
3
–
+ H
2
O ↔ H
2
CO
3
+ OH
–
.
Обычно равновесие устанавливается после протекания гидролиза по
первой ступени. Для протекания последующих стадий необходимо кипяче-
ние или нейтрализация раствора.
При совместном гидролизе катионов и анионов процесс взаимно
усиливается и протекает необратимо до образования конечных продуктов
2 Cr
3+
+ 3 CO
3
2–
+ 3 H
2
O = 2 Cr(OH)
3
↓ + 3 СО
2
↑
.
53
6.2. Экспериментальная часть
Исследуем равновесия диссоциации слабых электролитов.
6.2.1. Влияние соли слабой кислоты на диссоциацию этой кислоты
(опыт 6.1)
Выполнение опыта
В две пробирки внести по 5-7 капель 0,1 н. раствора уксусной кисло-
ты. В каждую пробирку прибавить одну каплю метилового оранжевого.
Под влиянием каких ионов метиловый оранжевый принимает розовую
окраску? Одну пробирку с уксусной кислотой оставить в качестве
контрольной, а в другую внести 3-4 микрошпателя ацетата натрия и пере-
мешать раствор стеклянной палочкой. Сравнить окраску полученного
раствора с окраской раствора в контрольной пробирке. На изменение кон-
центрации каких ионов указывает изменение окраски метилового оранже-
вого?
Запись результатов опыта
Написать уравнение диссоциации уксусной кислоты и выражение
константы ее диссоциации. Объяснить, как смещается равновесие диссоци-
ации кислоты при добавлении к ней ацетата натрия. Как меняются при
этом степень диссоциации уксусной кислоты и концентрация ионов Н
+
?
6.2.2. Влияние соли слабого основания на диссоциацию этого
основания (опыт 6.2)
Выполнение опыта
В две пробирки внести по 5–7 капель 0,1 н. раствора аммиака. В каж-
дую пробирку прибавить одну каплю раствора фенолфталеина. Под влия-
нием каких ионов фенолфталеин принимает красную окраску?
Одну пробирку с раствором аммиака оставить в качестве контроль-
ной, в другую добавить 3–4 микрошпателя хлорида аммония и перемешать
раствор стеклянной палочкой. Сравнить окраску полученного раствора с
окраской раствора в контрольной пробирке.
Запись результатов опыта
Написать схему равновесия в растворе аммиака. Как смещается рав-
новесие в этом растворе при добавлении к нему хлорида аммония? Почему
при этом окраска фенолфталеина бледнеет?
6.2.3. Характер диссоциации гидроксидов элементов (опыт 6.3)
Выполнение опыта
Пронумеровать 5 пробирок и внести по 4–5 капель 0,5 н. растворов: в
первую – MgCl
2
, во вторую – AlCl
3
, в третью – Na
2
SiO
3
, в четвертую –
54

NiSO
4
, в пятую – ZnSO
4
. Прибавить в пробирки 1, 2, 4, 5 по нескольку
капель (до начала выпадения осадков гидроксидов) 0,5 н. раствора NaOH, в
3-ю пробирку – 2 н. раствора HCl. Определить кислотно-основной харак-
тер выпавших гидроксидов. Для этого половину суспензии гидроксида
магния отлить в чистую пробирку и прибавить к ней 4–5 капель 0,5 н.
раствора HCl, к оставшейся части в первой пробирке добавить дополни-
тельно 6-8 капель 0,5 н. раствора NaOH. В обоих ли случаях растворился
осадок? Кислотными, основными или амфотерными свойствами обладает
Mg(OH)
2
?
Аналогичным образом исследовать свойства гидроксидов алюминия,
кремния, никеля (II) и цинка. В чем они растворяются? Каковы их кислот-
но-основные свойства?
Запись результатов опыта и сведения об особенностях диссоциа-
ции гидроксидов представьте по форме табл. 6.1.
Таблица 6.1
Поведение гидроксидов в водном растворе
Сколько электронов находится на внешнем электронном уровне
ионов Mg
2+
, Аl
3+
и атома кремния в степени окисления +IV? В прямой или
обратной зависимости находится усиление кислотных свойств гидрокси-
дов от увеличения заряда ионов (степени окисления атомов), гидроксиды
которых рассматриваются?
Радиусы ионов Mg
2+
, Аl
3+
и атома кремния в степени окисления +IV
соответственно равны (по Полингу) 0,065; 0,050 и 0,041 нм. Как влияет из-
менение радиусов ионов и их эффективный заряд на характер химических
свойств гидроксидов?
Почему Mg(OH)
2
– более сильное основание, чем Ni(OH)
2
?
Гидроксид
Схема полной диссоциации
Кислотно-
основные
свойства
Название Формула
Гидроксид
натрия
Гидроксид
алюминия
Гидроксид
магния
Гидроксид
никеля
Гидроксид
цинка
Гидроксид
кремния
55
Сделать общий вывод о влиянии радиуса, заряда и внешней элек-
тронной оболочки ионов на характер диссоциации гидроксидов.
При написании схем диссоциации амфотерных гидроксидов учесть,
что в щелочных водных растворах они переходят в комплексные гидроксо-
ионы. Например, схема диссоциации амфотерного гидроксида цинка запи-
сывается следующим образом:
2ОН
-
+ [Zn(H
2
O)
4
]
2+
↔ Zn (ОН)
2
+ 4H
2
O ↔ [Zn (ОН)
4
]
2–
+ 2Н
3
O
+
+ 2H
2
O
в кислой в щелочной
среде среде
Написать молекулярные и ионно-молекулярные уравнения реакций
Zn(ОН)
2
и Аl(ОН)
3
с кислотой и щелочью.
Исследуем теперь реакции ионного обмена.
6.2.4. Получение сульфида свинца из сульфата свинца (опыт 6.4)
Выполнение опыта
В пробирку внести 2 капли раствора нитрата свинца и прибавить
туда же 3 капли раствора сульфата натрия.
Какой цвет имеет образовавшийся осадок? Написать в молекулярной
и ионно-молекулярной форме уравнение реакции.
Дать осадку отстояться и кусочком фильтровальной бумаги, сверну-
тым трубочкой, отобрать жидкую фазу. К осадку добавить 3-4 капли суль-
фида аммония и перемешать осадок стеклянной палочкой.
Как изменился цвет осадка? Какое вещество образовалось?
Запись результатов опыта
Описать наблюдаемые явления. Ответить на поставленные вопросы.
Написать выражения произведений растворимости полученных мало-
растворимых солей и их числовые значения (см. табл. П.2). Объяснить
переход одного осадка в другой.
6.2.5. Гидролиз солей (опыт 6.5)
Определим реакцию среды в растворах различных солей.
Выполнение опыта
В шесть пробирок налить на 1/3 объема дистиллированной воды, до-
бавить 2-3 капли раствора лакмуса. Одну пробирку оставить в качестве
контрольной. В остальные внести по одному микрошпателю кристаллов
следующих солей: в первую – ацетата натрия, во вторую – хлорида алю-
миния, в третью – карбоната натрия, в четвертую – сульфита натрия, в пя-
тую – хлорида калия. Растворы перемешать стеклянной палочкой, которую
надо промывать дистиллированной водой при смене одной пробирки на
другую.
56

По окраске лакмуса сделать вывод о реакции среды в растворе каж-
дой соли.
Запись результатов опыта
Данные опыта зафиксировать по форме табл. 6.2.
Таблица 6.2
Наблюдения гидролиза солей
Написать ионные и ионно-молекулярные уравнения протекающих
реакций гидролиза.
6.3. Контрольные вопросы
1. Сформулируйте основные положения теории диссоциации элек-
тролитов С. Аррениуса.
2. От каких факторов зависит степень диссоциации электролита?
3. Какие электролиты относят к сильным, какие – к слабым? Почему?
4. Запишите выражения для констант трех ступеней диссоциации ор-
тофосфорной кислоты. Как и почему изменяется величина константы дис-
социации от ступени к ступени?
5. Что такое произведение растворимости (ПР)? От каких факторов
зависит эта характеристика?
6. Что называют ионным произведением воды?
7. Что характеризует величина водородного показателя (рН)? Чему
равна величина рН раствора щелочи с эквивалентной концентрацией
0,01 моль·дм
–3
?
8. Почему гидролиз многозарядных ионов обычно прекращается на
первой ступени? При каких условиях процесс гидролиза многозарядных
ионов протекает до конца?
7. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
В соединениях элементы характеризуются степенью окисления.
Это условный заряд, который имели бы атомы элемента при полном сме-
щении электронов химических связей к более электроотрицательным из
соседних атомов: H
2
SO
4
(S
+6
), KMnO
4
(Mn
+7
), K
2
Cr
2
O
7
(Cr
+6
).
7.1. Окислительно-восстановительные системы
№ про-
бирки
Формула
соли
Цвет
раствора
Реакция
среды
рН (≈7, >7, <7)
57
Реакции, протекающие с изменением степени окисления элементов,
называют окислительно-восстановительными:
2 Fe + 6 H
2
SO
4
= Fe
2
(SO
4
)
3
+ 3 SO
2
+ 6 H
2
O,
Fe - 3 ē = Fe
+3
окисление – увеличение степени окисления;
S
+6
+ 2 ē = S
+4
восстановление – снижение степени окисления.
Типичные окислители – активные неметаллы (F
2
, O
2
, Cl
2
) и эле-
менты в максимальной степени окисления в составе соединений (KMnO
4
,
K
2
Cr
2
O
7
, KCrO
4
, KClO
4
, PbO
2
, H
2
SO
4
, HNO
3
). Типичные восстановители
– металлы и элементы в минимальной степени окисления в составе соеди-
нений (H
2
S, KI). Соединения, содержащие атомы элементов в промежу-
точных степенях окисления (H
2
O
2
, MnO
2
), проявляют окислительно-
восстановительную двойственность, т.е. могут быть как окислителями,
так и восстановителями в зависимости от второго реагента.
Типы ОВР:
межмолекулярные – Zn + CuSO
4
= ZnSO
4
+ Cu;
внутримолекулярные – (NH
4
)
2
Cr
2
O
7
= Cr
2
O
3
+ N
2
+ 4 H
2
O;
диспропорционирования – Cl
2
+ 2 KOH = KCl + KClO + H
2
O.
7.2. Методы подбора коэффициентов в уравнениях ОВР
Метод ионно-электронного баланса (метод полуреакций)
Изменение степени окисления приводит к изменению состава соеди-
нений. В перестройке ионов и молекул в растворах принимают участие
ионы Н
+
, ОН
─
и молекулы Н
2
О. Метод отражает роль среды в протекании
ОВР. При его использовании нет необходимости рассчитывать степень
окисления элемента, что существенно облегчает подбор коэффициентов
для реакций с участием сложных органических соединений (например, са-
харозы C
12
H
22
O
11
) и в тех случаях, когда расчет степени окисления связан с
определенными трудностями (например, в сульфидах одинакового состава
FeS
2
и MoS
2
степени окисления и металлов, и серы различны).
Для обеспечения баланса ионного состава в полуреакциях окисления
и восстановления используют вспомогательные соотношения:
(О
─2
) + 2Н
+
↔ Н
2
О при рН<7 и (О
─2
) + Н
2
O ↔ 2ОH
─
при рН≥7.
Воспользуемся этим методом для составления уравнений ОВР между
KMnO
4
и KNO
2
, протекающих в различных средах. Окислитель MnO
4
–
восстанавливается до различных форм в зависимости от кислотности сре-
ды: Mn
2+
при рН < 7; MnO
2
при рН = 7 и MnO
4
2–
при рН > 7.
Кислая среда: KMnO
4
+ KNO
2
+ H
2
SO
4
→ KNO
3
+ MnSO
4
+ ...
Находим окислитель и восстановитель и записываем для них ионные
состояния до и после реакции, используя ионы и молекулы среды:
58

2 MnO
4
─
+ 8 H
+
+ 5 ē = Mn
2+
+ 4 H
2
O – восстановление
5 NO
2
–
+ H
2
O – 2 ē = NO
3
–
+ 2 H
+
– окисление
Суммируем уравнения:
2 MnO
4
─
+ 16H
+
+ 5 NO
2
–
+ 5H
2
O = 2Mn
2+
+ 8H
2
O + 5 NO
3
–
+ 10H
+
.
Окончательно в молекулярной форме
2 KMnO
4
+ 5 KNO
2
+ 3 H
2
SO
4
= 5 KNO
3
+ 2 MnSO
4
+ 3 H
2
O + K
2
SO
4
.
Нейтральная среда: KMnO
4
+ KNO
2
+ H
2
O → KNO
3
+ MnO
2
+ ...
2 MnO
4
─
+ 2 H
2
O + 3 ē = MnO
2
+ 4 ОН
─
– восстановление
3 NO
2
–
+ 2 ОН
─
– 2 ē = NO
3
–
+ H
2
O – окисление
2 KMnO
4
+ 3 KNO
2
+ H
2
O = 3 KNO
3
+ 2 MnO
2
+ 2 KOH.
Щелочная среда: KMnO
4
+ Na
2
SO
3
+ КОН → Na
2
SO
4
+ К
2
MnO
4
+ ...
2 MnO
4
–
+ ē = MnO
4
2–
– восстановление
1 NO
2
–
+ 2 ОН
─
– 2 ē = NO
3
–
+ H
2
O – окисление
2 KMnO
4
+ KNO
2
+ 2 КОН = KNO
3
+ 2 К
2
MnO
4
+ Н
2
О.
7.3. Влияние среды на характер ОВР
Приведенные выше три уравнения позволяют отметить некоторые
закономерности ОВР и влияние среды на их протекание:
уменьшение кислотности и увеличение щелочности приводит к
ослаблению окислительной активности KMnO
4
;
в кислой среде облегчается полуреакция, связанная с уменьшением
количества атомов кислорода в составе иона, например:
Cr
2
O
7
2─
+ 14 H
+
+ 6 ē = 2 Cr
3+
+ 7 H
2
O;
в щелочной среде облегчается полуреакция, связанная с увеличени-
ем числа атомов кислорода в составе иона, например:
SO
3
2─
+ 2 OH
─
– 2 ē = SO
4
2─
+ H
2
O.
Кислая среда способствует процессам, в которых расход ионов Н
+
на
восстановление окислителя больше расхода ионов ОН
─
на окисление
восстановителя.
Составим уравнения для ОВР с участием Н
2
О
2
при различных значе-
ниях рН.
Пероксид в роли Н
2
О
2
+ 2 Н
+
+ 2 ē = 2 Н
2
О, рН < 7;
окислителя:
Н
2
О
2
+ 2 ē = 2 ОН
─
, pH ≥ 7.
Пероксид в роли Н
2
О
2
– 2 ē = O
2
+ 2 H
+
, рН < 7;
восстановителя:
Н
2
О
2
+ 2 OH
─
– 2 ē = O
2
+ 2 Н
2
О, pH ≥ 7.
59
7.4. Направление протекания ОВР
Активность окислителя или восстановителя оценивают при помощи
величины электродного потенциала полуреакции φ, который можно изме-
рить или рассчитать. В справочниках приводят величины стандартных
электродных потенциалов полуреакций (при 298 К и активности окислен-
ной и восстановленной формы 1 моль/дм
з
). Сравним два типичных окисли-
теля MnO
4
─
и Cr
2
O
7
2─
по величинам их стандартных потенциалов (см.
табл. П.5 и П.6):
MnO
4
─
+ 8 H
+
+ 5 ē = Mn
2+
+ 4 H
2
O, φ
о
= +1,51 В;
Cr
2
O
7
2─
+ 14 H
+
+ 6 ē = 2 Cr
3+
+ 7 H
2
O; φ
о
= +1,33 В.
Поскольку потенциал первой полуреакции выше, то MnO
4
─
является
более сильным окислителем, чем Cr
2
O
7
2─
.
ОВР может протекать самопроизвольно, если ее ЭДС, т.е. разность
потенциалов полуреакций восстановления и окисления, положительна:
Е = φ
вос
– φ
ок
> 0.
Величина эдс связана с термодинамическими функциями:
ΔG = – nFE; nFE = RT lnK,
где n – число электронов, принимаемых окислителем; К – константа рав-
новесия обратимой ОВР; F = 96485 Кл/моль – постоянная Фарадея.
Для участника ОВР окислительно-восстановительный эквивалент
рассчитывают по формуле Э(X) = (1/n) X, тогда M
Э
(Х) = (1/n) М(X).
Задача
Возможно ли окисление ионов Cl
–
и I
–
при помощи ионов Fe
3+
?
Решение
В справочнике находим потенциалы полуреакций:
Fe
3+
+ ē = Fe
2+
, φ
о
= 0,77 В;
2 Cl
─
– 2 ē = Cl
2
, φ
о
= 1,36 В;
2 I
─
– 2 ē = I
2
, φ
о
= 0,54 В.
Составляем уравнения предполагаемых ОВР и рассчитываем их эдс:
1) 2 Cl
─
+ 2 Fe
3+
= Cl
2
+ 2 Fe
2+
, Е
1
= 0,77 – 1,36 = – 0,59 В < 0;
2) 2 I
─
+ 2 Fe
3+
= I
2
+ 2 Fe
2+
, Е
2
= 0,77 – 0,54 = + 0,24 В > 0.
Первая реакция невозможна, а вторая протекает самопроизвольно.
При выборе продуктов восстановления для ОВР с участием HNO
3
полезно руководствоваться схемой
HNO
3
→ NO
2
→ НNO
2
→ NO → N
2
O → N
2
→ NH
3
(NH
4
NO
3
)
рост активности восстановителя, уменьшение [HNO
3
] и Т → .
Рассмотрим окисление сульфида поливалентного металла в щелоч-
ной среде. Взаимодействие MoS
2
со щелочным раствором NaClO:
60
