Автономова Е.Н. и др. Учебно-лабораторный практикум по курсу Химия
Подождите немного. Документ загружается.

Плотность исходного раствора ρ = …
Заданная молярная концентрация эквивалента NaOH в растворе
С(1/1 NaOH) = …
Объем мерной колбы V = …
Расчет объема исходного раствора: …
Объем исходного раствора V(р-р) = …
2.2.2. Определение концентрации гидроксида натрия (опыт 2.2)
Определение проводят методом кислотно-основного титрования, в
котором используются реакции кислотно-основного взаимодействия обще-
го вида:
−+
+↔+
AHBBHA
,
где НА – кислота; В – основание; НВ
+
– сопряженная кислота; А
–
– сопря-
женное основание.
В результате взаимодействия растворов сильных кислот и оснований
раствор становится нейтральным, поэтому метод кислотно-основного тит-
рования иногда называют методом нейтрализации. В данной лабораторной
работе используем титрование сильного основания сильной кислотой в со-
ответствии с уравнением реакции
2NaOH + H
2
SO
4
= Na
2
SO
4
+ 2Н
2
О
Реактивы и оборудование: титрант – стандартный раствор H
2
SO
4
c
концентрацией C[1/2(H
2
SO
4
)] = 0,10 моль/ дм
3
; коническая колба для тит-
рования объемом 250 см
3
; пипетка на 10,0 см
3
; бюретка объемом 25 см
3
;
кислотно-основной индикатор (фенолфталеин или метиловый оранжевый).
Выполнение работы
Определяют концентрацию раствора гидроксида натрия, приготов-
ленного в опыте 2.1. Техника отбора проб и титрования описана в разделе
2.1.3. Готовят бюретку для титрования и заполняют ее стандартным
раствором кислоты. Раствор NaOH из мерной колбы переливают в чистый
сухой химический стакан, пипеткой объемом 10,0 см
3
отбирают аликвот-
ный объем раствора гидроксида натрия и переносят его в коническую кол-
бу для титрования. Стенки колбы обмывают небольшим количеством ди-
стиллированной воды, добавляют 2 капли индикатора метилового оранже-
вого и начинают титрование. Последние порции кислоты следует прили-
вать по каплям. Титрование останавливают в тот момент, когда произойдет
резкий переход окраски от желтой к оранжево-красной. Записывают объем
раствора кислоты, пошедший на титрование. Повторяют титрование еще
три раза. Перед каждым титрованием коническую колбу моют и ополаски-
вают дистиллированной водой.
21

Запись данных опыта и расчеты
Данные записать по приведенной ниже форме.
Объем мерной колбы V = 100,0 см
3
.
Концентрация титранта C(½H
2
SO
4
) = 0,10 моль/дм
3
.
Индикатор – …
Таблица 2.1
Результаты титрования раствора гидроксида натрия
№ п/п
Объем аликвоты V(NaOH), см
3
Эквивалентный объем
титранта V(H
2
SO
4
), см
3
1
2
3
4
По результатам титрования найти средний объем титранта
)SOH(V
42
и рассчитать эквивалентную концентрацию NaOH.
На основании закона эквивалентов
n(1/1 NaOH) = n(½H
2
SO
4
)
рассчитать эквивалентную концентрацию гидроксида натрия:
С(NaOH) = C(½H
2
SO
4
) ·
)SOH(V
42
/ V(NaOH).
2.2.3. Определение общей жесткости воды (опыт 2.3)
Определение проводится методом комплексонометрического титро-
вания. Он основан на аналитическом использовании реакций комплексооб-
разования ионов металла с полидентантными хелатообразующими органи-
ческими реагентами – комплексонами. Наиболее часто применяют
комплексон (III) – двунатриевую соль этилендиаминтетрауксусной кисло-
ты (ЭДТА) Na
2
H
2
Y. Для краткости обозначим анион ЭДТА как Y
4–
, тогда
уравнение реакции комплексообразования, например с двухзарядными
ионами металлов, будет иметь вид
+−−+
+=+
H2]MY[YHM
22
2
2
.
Вне зависимости от заряда иона металла комплексообразователя все-
гда образуются комплексы состава 1:1.
Жесткость воды – это совокупность свойств, обусловленная на-
личием в ней катионов кальция Са
2+
и магния Mg
2+
. Сумму концентраций
Са
2+
и Mg
2+
называют общей жесткостью (Н
общ
, ммоль экв/дм
3
или моль
экв/м
3
).
Обычно общую жесткость определяют титрованием стандартным
раствором ЭДТА. В этом случае жесткость рассчитывают по уравнению
22
1000
)(
)(2)(
2
⋅
⋅⋅
=
OHV
ЭДТАCЭДТАV
H
М
общ
моль-экв/м
3
.
Реактивы и оборудование: титрант – стандартный раствор ЭДТА c
концентрацией 0,025 моль/дм
3
; коническая колба для титрования объемом
250 см
3
; пипетка на 10,00 см
3
; бюретка объемом 25 см
3
; индикатор эрио-
хромовый черный Т; аммиачный буфер рН = 10.
Выполнение работы
Определяют общую жесткость водопроводной воды. Техника титро-
вания описана в разделе 2.1.3. Готовят бюретку для титрования и заполня-
ют ее стандартным раствором ЭДТА. Мерным цилиндром отбирают
50,0 см
3
водопроводной воды, переносят ее в колбу для титрования и при-
ливают 1 см
3
аммиачного буфера рН = 10. Добавляют на кончике шпателя
кристаллы индикатора и начинают титрование. Последние порции ЭДТА
приливают по каплям. Титрование останавливают в тот момент, когда
произойдет резкий переход окраски от фиолетовой к синей. Записывают
объем раствора ЭДТА, пошедший на титрование. Повторяют титрование
еще три раза. Перед каждым титрованием коническую колбу моют и опо-
ласкивают дистиллированной водой.
Примечания: 1) буферный раствор приливают обязательно перед
добавлением индикатора; 2) индикатора не следует добавлять слишком
много, иначе окраска изменяется медленно и раствор оказывается перетит-
рованным.
Запись данных опыта и расчеты
Данные записать по приведенной ниже форме.
Концентрация титранта C
М
(ЭДТА) = 0,025 моль/дм
3
.
Индикатор – эриохромовый черный Т.
По результатам титрования найти средний объем титранта
)ЭДТА(V
и рассчитать общую жесткость воды по приведенной выше формуле.
Таблица 2.2
Результаты титрования питьевой воды
№ п/п Объем воды V(Н
2
О), см
3
Эквивалентный объем
титранта V(ЭДТА), см
3
1
2
3
4
23
2.3. Контрольные вопросы
1. Дайте определение понятию «массовая доля растворенного веще-
ства».
2. Дайте определение молярной концентрации и молярной концен-
трации эквивалента.
3. Вычислите факторы эквивалентности и молярные массы эквива-
лентов в реакциях нейтрализации следующих веществ: HNO
3
; NH
3
; H
2
SO
4
;
KHSO
4
.
4. Рассчитайте количество вещества HNO
3
, необходимое для полного
взаимодействия с 5,3 г Na
2
CO
3
.
5. Что такое жесткость воды, как ее определить?
6. Изложите сущность метода определения общей жесткости воды
методом комплексонометрического титрования.
7. Рассчитайте общую жесткость воды, если в 100 дм
3
содержится 4 г
ионов Са
2+
и 2,4 г ионов Mg
2+
.
3. ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
Химические процессы протекают с изменением энергетического со-
стояния веществ (сопровождаются выделением или поглощением теплоты)
и упорядоченности их строения. Для анализа этого аспекта химического
взаимодействия используют понятие «термодинамическая система». Под
ней подразумевается совокупность тел, выделенных из пространства, в ко-
торой возможен тепло- и массообмен. Если система не обменивается с
окружающей средой энергией и массой, то её называют изолированной.
Незамкнутая, или открытая, система обменивается с окружающими тела-
ми массой и энергией. Система, обменивающаяся с окружением только
энергией, но не обменивающаяся массой, называется замкнутой.
Термодинамика изучает свойства макроскопических систем на
основе возможных превращений энергии без рассмотрения их микрососто-
яний. Важнейшим результатом термодинамического исследования предпо-
лагаемых изменений в системе является вывод о возможности или невоз-
можности самопроизвольного протекания процесса в выбранных условиях.
Если вопрос о возможности протекания реакции решен, возникает
проблема оценки скорости реакции и возможности управления ею. Этот
аспект химического взаимодействия изучает химическая кинетика – уче-
ние о скоростях и механизме реакций.
Ниже обсуждены важнейшие термодинамические и кинетические ха-
рактеристики и закономерности протекания химических процессов и дано
описание опытов, позволяющих исследовать их экспериментально.
24
3.1. Термодинамические закономерности химических процессов
Параметр состояния системы, изменение которого в ходе процесса
не зависит от пути его протекания, называют функцией состояния систе-
мы. Таким свойством обладает внутренняя энергия системы (U).
Первый закон термодинамики соответствует закону сохранения
энергии: изменение внутренней энергии термодинамической системы
(
∆
U) равно количеству теплоты, сообщенной ей (Q), за вычетом работы
(А), совершенной системой. Закон справедлив для замкнутых систем. В
химических процессах работа против внешних сил представляет собой ра-
боту расширения А = P
∆
V. Тогда 1-й закон термодинамики имеет вид
∆
U = Q – P
∆
V. (3.1)
Тепловой эффект процесса, протекающего при постоянном объеме
(Q
v
), равен изменению внутренней энергии системы, следовательно, обла-
дает свойствами функции состояния:
Q
v
=
∆
U. (3.2)
Если процесс протекает при постоянном давлении, из (3.1) следует
Q = (U
2
+ PV
2
) – (U
1
+ PV
1
) = H
2
– H
1
=
∆
H. (3.3)
Функция Н называется энтальпией (теплосодержанием) системы и
по определению является функцией состояния. Таким образом, тепловой
эффект реакции, протекающей при постоянном давлении, равен измене-
нию энтальпии системы и обладает свойствами функции состояния:
Q
p
=
∆
H. (3.4)
Соотношения (3.3) и (3.4) являются обоснованием закона Гесса:
тепловой эффект реакции не зависит от пути ее протекания.
Экзотермические реакции протекают с выделением теплоты. Для
них ∆Н < 0. Соответственно, для эндотермических реакций, протекающих
с поглощением теплоты,
∆
Н > 0.
В термодинамических расчетах широко применяется понятие
«энтальпия образования» соединения
∆
Н
o
298
– это тепловой эффект полу-
чения одного моля сложного вещества из простых. Для простых веществ
энтальпия образования равна нулю. Обсуждаемая величина зависит от
условий протекания процесса, поэтому в справочниках она приводится для
стандартного состояния (P
о
= 101325 Па и Т
о
= 298 К).
Второй закон термодинамики справедлив для изолированных си-
стем. Он утверждает, что невозможно всю внутреннюю энергию системы
превратить в полезную работу. Закон учитывает не только изменение эн-
тальпии в ходе процесса, но и общее изменение ее структурной упорядо-
ченности (уровня хаотичности). Мерой хаотичности строения системы яв-
ляется функция состояния энтропия (S, Дж/К). Больцман показал, что
S = k · lnW, (3.5)
25
где k = R/N
A
– постоянная Больцмана; W – термодинамическая вероят-
ность системы (число микросостояний, через которые реализуется данное
макросостояние).
Критерием возможности самопроизвольного протекания процесса в
замкнутой системе является изменение функции состояния системы –
энергии Гиббса (
∆
G):
∆
G =
∆
H – T
∆
S. (3.6)
Для самопроизвольных процессов
∆
Н – Т
∆
S ≤ 0. (3.7)
Уравнение (3.7) является формальным выражением второго закона
термодинамики: невозможен процесс, единственным результатом кото-
рого является передача теплоты от менее нагретого тела к более нагре-
тому телу (формулировка Клаузиуса).
В термодинамических расчетах наряду со значениями энтальпии об-
разования соединений
∆
Н
o
298
широко применяются стандартные величины
энтропии S
o
298
и энергии Гиббса
∆
G
o
298
. Многие расчеты основаны на при-
менении следствия из закона Гесса: для функций состояния системы их из-
менение в ходе процесса можно рассчитать следующим образом:
∑∑
∆−∆=∆
i
ii
j
jjпроц
HHH )()(
νν
, (3.8)
где i, j – соответственно индексы исходных веществ и продуктов, а ν
i
, ν
j
–
соответствующие коэффициенты из уравнения реакции. Таким образом,
изменение энтальпии в ходе реакции равно разности между суммой эн-
тальпий образования продуктов и суммой энтальпий образования исход-
ных веществ. Аналогичные уравнения справедливы для изменения энтро-
пии и энергии Гиббса в ходе процесса:
∑∑
−=∆
i
ii
j
jjпроц
SSS )()(
νν
,
(3.9)
∑∑
∆−∆=∆
i
ii
j
jjпроц
GGG )()(
νν
.
(3.10)
3.2. Кинетические закономерности химических реакций
Средняя скорость реакции соответствует изменению количества ве-
щества ∆n за промежуток времени ∆τ в единице объема или на единице
площади поверхности:
W = ∆n/(V · ∆τ) = ∆C
M
/
∆τ (для гомогенных реакций);
W = ∆n/(S · ∆τ) = ∆C
S
/
∆τ (для гетерогенных реакций).
26

Влияние концентрации реагентов на скорость реакции. Основной
постулат химической кинетики (закон действующих масс для скорости
реакции) гласит: скорость реакции пропорциональна произведению моляр-
ных концентраций реагентов.
Для реакции aА + bВ → продукты
W = k · [A]
a
· [B]
b
, (3.11)
где k – константа скорости реакции; [А], [В] – молярные концентрации
реагентов; a, b – порядок реакции по реагентам А и B. Физический смысл
константы скорости: k = W, если [А] = [В] = 1 моль/дм
3
. Величина k за-
висит от природы реагентов и температуры.
Влияние температуры. Согласно правилу Вант-Гоффа, увеличение
температуры на 10 градусов приводит к возрастанию скорости в γ раз:
W
2
/
W
1
= k
2
/
k
1
= γ
(
∆
Т / 10)
, (3.12)
где γ = 2÷4 – температурный коэффициент скорости реакции.
Более корректно влияние температуры на величину k выражает урав-
нение Аррениуса:
lnk = B – A/T,
(3.13)
где B и A – константы. Уравнению Аррениуса отвечает зависимость
k = k
0
· e
–E / RT
,
(3.14)
где Е – энергия активации реакции – энергия, избыточная по сравнению с
имеющимся запасом, которая нужна для того, чтобы перевести молеку-
лы исходных веществ в реакционноспособное состояние.
Равновесие обратимых химических процессов. Обратимые химиче-
ские реакции протекают в прямом и обратном направлениях:
aА + bВ ↔ сС + dD.
Для равновесия обратимой реакции справедлив закон действующих
масс:
ba
dc
p
BA
DC
K
][][
][][
=
,
(3.15)
где K
р
– константа равновесия обратимой химической реакции.
Из уравнения (3.15) следует формулировка закона действующих
масс: для обратимых реакций в состоянии равновесия отношение произве-
дений концентраций продуктов к произведению концентраций реагентов
– величина постоянная. Это заключение называют законом действующих
масс для равновесия. Величина K
р
связана с изменением энергии Гиббса в
ходе реакции:
∆G = –RT · lnK
р
. (3.16)
27
Равновесие обратимых процессов подчиняется принципу Ле Шате-
лье: если на обратимую систему, находящуюся в состоянии динамического
равновесия, оказать воздействие (изменить параметр), то равновесие сме-
стится так, чтобы воздействие ослабить.
3.3. Экспериментальная часть
3.3.1. Определение изменения энтальпии при протекании хи-
мической реакции (опыт 3.1)
Тепловой эффект процесса (q) можно рассчитать по формуле
q = C
.
m
.
ΔT, (3.17)
где ΔT – разность между конечной и начальной температурой системы, К;
m – масса исследуемой системы, кг; C – удельная теплоемкость системы,
кДж/(кг·К).
Для данной системы
С · m = С
1
m
1
+ C
2
m
2
, (3.18)
где C
1
и m
1
–
удельная теплоемкость и масса реакционного сосуда;
C
2
и m
2
– удельная теплоемкость и масса исследуемого раствора. Ввиду
низкой теплопроводности стеклянного сосуда первой составляющей в
упрощенных опытах пренебрегают.
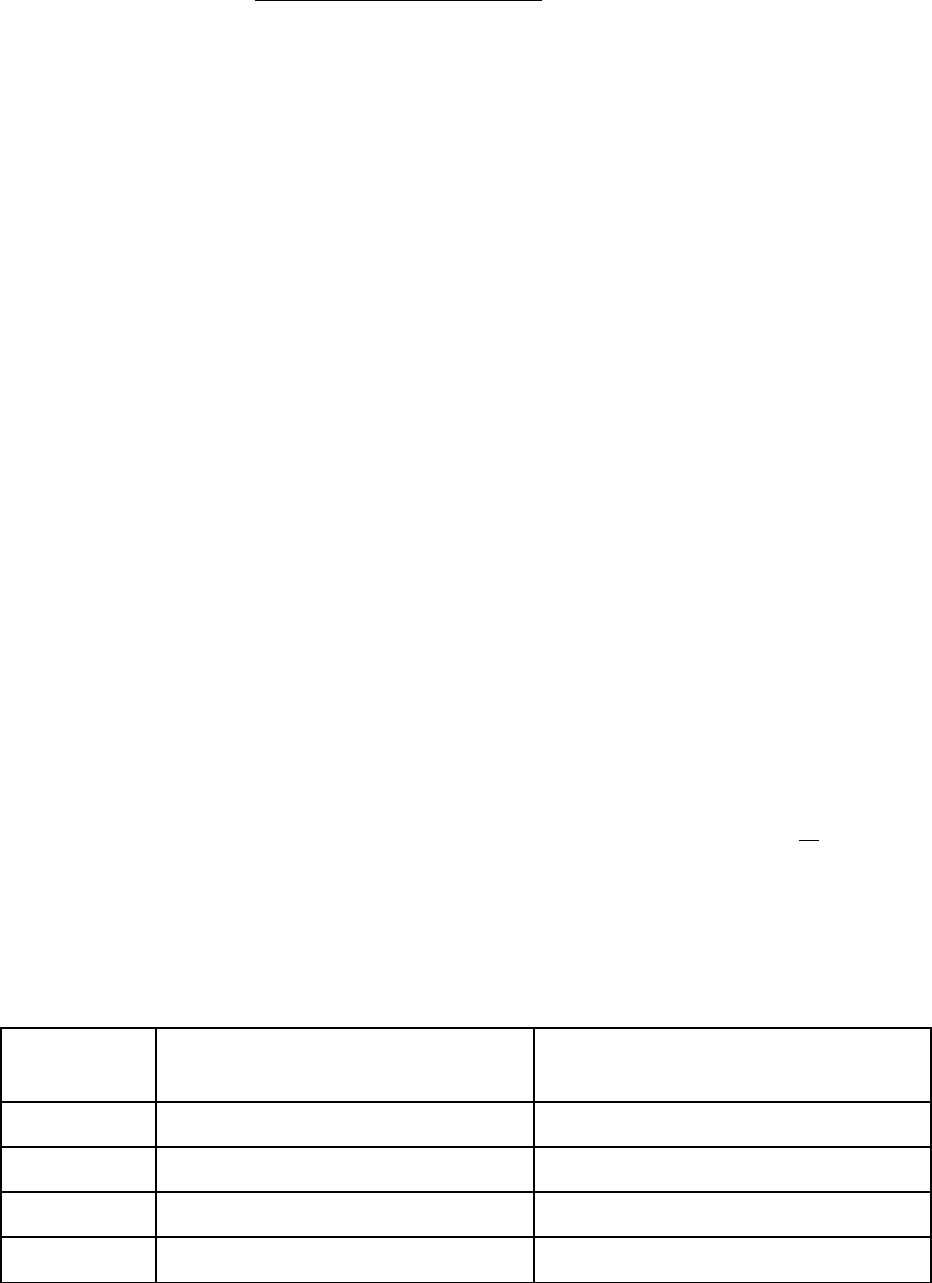
Для определения ΔT используют калориметры – лабораторные при-
боры, в которых сведен к минимуму обмен системы теплотой с окружаю-
щей средой (рис. 3.1).
Рис. 3.1. Схема устройства калориметра: 1 – корпус; 2 – реактор;
3 – воронка; 4 – мешалка; 5 – термометр
28
Выполнение опыта
Отмерить цилиндром и вылить в реактор 50 см
3
1 н. раствора NaOH.
Перемешивая раствор с постоянной интенсивностью, регистрировать тем-
пературу каждые 2 секунды в течение всего опыта. Температуру измерять
с точностью до 0,5 °С. Через 10-12 с добавить в реактор 50 см
3
1 н. раство-
ра H
2
SO
4
. Регистрацию температуры продолжать еще 16-20 с. Данные на-
блюдений записать по форме табл. 3.1.
Таблица 3.1
Зависимость температуры раствора от времени
τ, с 2 4 6 8 10 12 14 16 18 …
T,
o
С
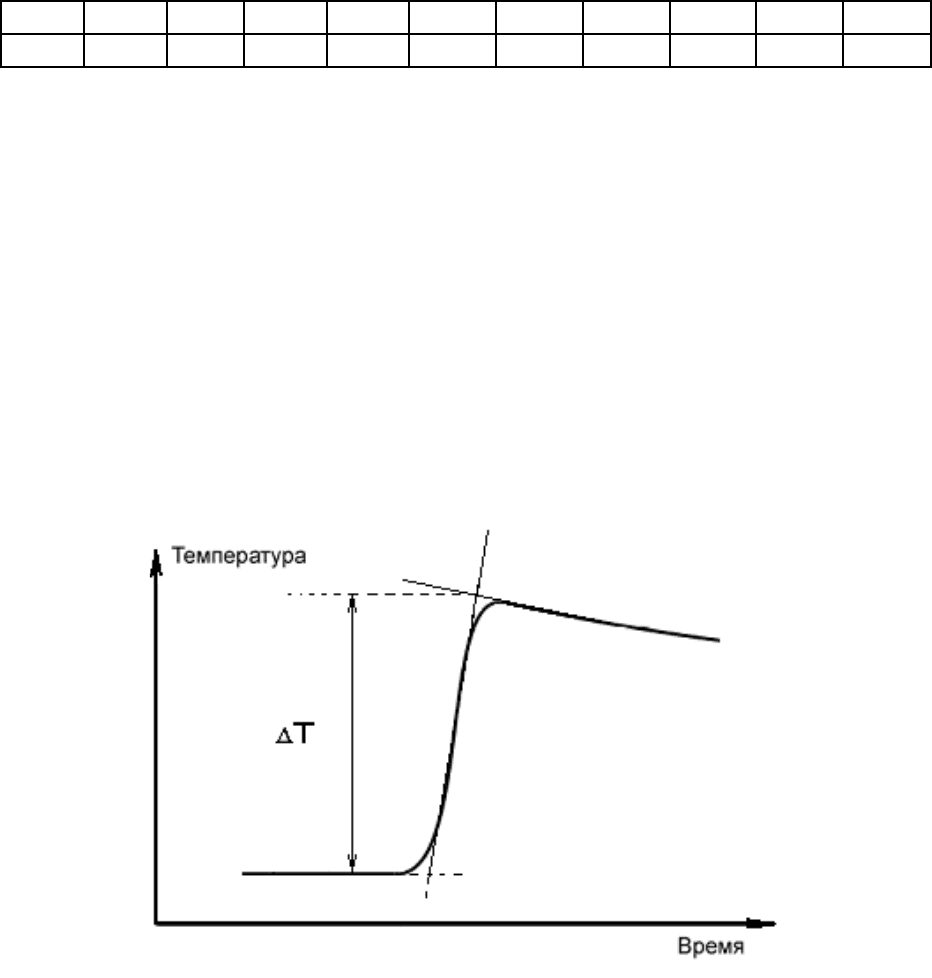
По данным табл. 3.1 построить график в координатах «T – τ». Вид
ожидаемой кривой и метод графического определения ΔT представлены на
рис. 3.2.
Зная ΔT, рассчитать величину q по формуле (3.17), приняв теплоем-
кость раствора равной удельной теплоемкости воды (4,2 кДж/кг).
Рассчитать молярный тепловой эффект реакции нейтрализации (Q
м
)
H
+
+ OH
–
= H
2
O
по формуле
Q
м
= q · M / m, (3.19)
где М – молярная масса воды; m – масса воды, полученной в ходе опыта.
Записать результат
ΔН
298
(Н
2
О) = – Q
м
.
Рис. 3.2. Изменение температуры раствора при протекании
экзотермической реакции в ячейке, теряющей теплоту
в окружающую среду
29

Рассчитать погрешность определения, сравнив полученную величи-
ну с табличным значением ΔН
298
(Н
2
О) = – 57,22 кДж/моль.
3.3.2. Исследование зависимости скорости протекания химической
реакции от концентрации реагента (опыт 3.2)
О скорости протекания исследуемой реакции (W = k·τ
–1
)
Na
2
S
2
O
3
+ H
2
SO
4
= S↓ + SO
2
+ Na
2
SO
4
+ H
2
O
судят по промежутку времени (τ, с) с момента сливания растворов до пер-
вых признаков появления в растворе осадка серы (секундомер останавли-
вают в момент появления голубой окраски раствора, обусловленной рассе-
янием света образовавшимися в растворе частицами серы).
Выполнение опыта
Готовят в пробирках растворы тиосульфата натрия Na
2
S
2
O
3
различ-
ной концентрации. Добавляют в приготовленный раствор одну каплю 2 н.
раствора серной кислоты H
2
SO
4
, одновременно включают отсчет времени
по секундомеру и измеряют продолжительность взаимодействия до появ-
ления признаков образования осадка (τ, с). Условия и результаты опыта за-
носят в табл. 3.2. По данным табл. 3.2 построить график в координатах «W
– концентрация Na
2
S
2
O
3
». Сделать вывод о соответствии полученной зави-
симости основному постулату химической кинетики.
Таблица 3.2
Влияние концентрации тиосульфата натрия на скорость реакции
Про-бир-
ка
Число капель
раствора
Na
2
S
2
O
3
Число
капель
Н
2
О
Концентрация
Na
2
S
2
O
3
τ, с
Оценка
скорости
W = 1/τ,
с
–1
1 4 8 С
2 8 4 2С
3 12 0 3С
3.3.3. Исследование зависимости скорости химической реакции
от температуры (опыт 3.3)
В условиях, соответствующих первой строке табл. 3.2, оценить ско-
рость при температуре на 10
о
С и 20
о
С выше комнатной.
Выполнение опыта
Пробирку с раствором перед добавлением кислоты выдерживают
1-2 мин в стакане с водой, температура которой соответствует выбранной.
Водяную баню нужной температуры готовят, смешивая горячую и холод-
ную воду.
30
