Автономова Е.Н. и др. Учебно-лабораторный практикум по курсу Химия
Подождите немного. Документ загружается.

кул гидроксида железа (III), на его поверхности адсорбируются ионы FeО
+
и противоионы. Укажите знак заряда коллоидной гранулы.
Добавкой каких ионов (в составе соли) можно нейтрализовать заряд
гранул и вызвать их коагуляцию?
4.5.7. Коагуляция золя гидроксида железа (III) электролитами
(опыт 4.7)
Раствор, приготовленный в опыте 4.6, налейте в 4 пробирки до поло-
вины их объема. В одну пробирку добавьте 1–2 капли 0,5 M раствора хло-
рида натрия; во вторую – 1–2 капли 0,5 М раствора сульфата натрия.
В какой пробирке наблюдается помутнение, т.е. коагуляция коллоид-
ных частиц и образование суспензии?
В третью пробирку добавьте насыщенный раствор хлорида натрия до
появления мути.
Обсудите явление устойчивости коллоидных растворов и их коагуля-
цию под действием электролитов.
4.5.8. Адсорбция активированным углем красителя из растворов
(опыт 4.8)
В стеклянную воронку вложить бумажный фильтр, плотно пригнать
его к стенкам воронки, слегка смочить водой. Закрепить воронку в штати-
ве; внести на фильтр 5 – 6 микрошпателей активированного угля (можно
использовать толченый древесный уголь). Взять ½ пробирки интенсивно
окрашенного раствора лакмуса, фуксина или другого раствора и про-
фильтровать его через слой угля.
Сравните окраску раствора до и после фильтрации.
Чем объясняются адсорбционные свойства угля?
4.5.9. Адсорбция активированным углем ионов тяжелых
металлов из растворов (опыт 4.9)
В одну пробирку внести 3–4 капли 0,01 н. раствора соли свинца и до-
бавить 1 каплю 0,01 н. раствора иодида калия. Отметить выпадение обиль-
ного желтого осадка иодида свинца. Составить уравнение протекающей
реакции ионного обмена.
В другую пробирку внести 10–15 капель 0,01 н. раствора нитрата
свинца и добавить 2 микрошпателя активированного угля, закрыть проб-
кой пробирку, встряхивать в течение 2–3 минут. Затем капельной пипет-
кой, обернутой ватой, отобрать 3–4 капли прозрачного раствора соли свин-
ца и перенести в другую чистую пробирку. Внести в нее 1 каплю 0,01 н.
раствора иодида калия и наблюдать результат.
41
Какое явление называют адсорбцией?
Обсудите адсорбционные свойства активированного угля.
При каких условиях выпадает осадок?
5. РАСТВОРЫ НЕЭЛЕКТРОЛИТОВ. ОПРЕДЕ-
ЛЕНИЕ МОЛЯРНОЙ МАССЫ РАСТВОРЕН-
НОГО ВЕЩЕСТВА МЕТОДОМ КРИОСКОПИИ
Свойства растворов, которые зависят только от концентрации частиц
в растворе, но не зависят от их природы, называются коллигативными. К
таким свойствам относятся понижение давления пара растворителя над
раствором, повышение температуры кипения и понижение температуры
кристаллизации раствора в сравнении с чистым растворителем, осмотиче-
ское давление.
В данной лабораторной работе понижение температуры кристаллиза-
ции раствора по сравнению с температурой кристаллизации чистого
растворителя используется для определения молярной массы неизвестного
растворенного вещества.
5.1. Теоретическое обоснование работы
Из всех растворителей наибольшее значение имеет вода. Рассмотрим
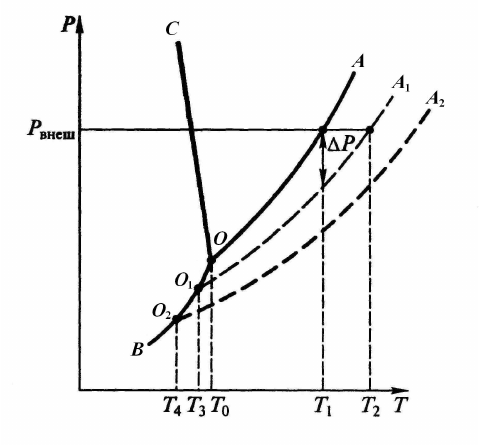
фазовую диаграмму «P – T» воды (рис. 5.1).
Рис. 5.1. Фазовая диаграмма «P – T» воды и водного раствора
При любом сочетании значений давления и температуры вода суще-
ствует в том или ином агрегатном состоянии – в виде льда (область ВОС),
42

жидкости (область СОА) или пара (область АОВ). На границах этих обла-
стей одновременно в равновесии существуют две фазы. Так, линия ОА
представляет собой кривую равновесия «пар – жидкость», или кривую ки-
пения. Линия ОС характеризует равновесие «жидкость – твердое вещество
(лед)», это кривая плавления. Линия ОВ является кривой сублимации (воз-
гонки), она характеризует равновесие «лед – пар». Точку О называют
тройной точкой воды. Это такая комбинация давления и температуры, при
которой одновременно в равновесии сосуществует все три фазы: лед,
жидкость и пар.
Температурой кипения называют температуру, при которой давление
пара над жидкостью становится равным внешнему атмосферному давле-
нию. Из рис. 5.1 следует, что при давлении Р
внеш
вода будет кипеть при
температуре Т
1
. Если Р
внеш
= P
атм
= 101 325 Па, то Т
1
= 100
о
С. Увеличение
внешнего давления приводит к повышению температуры кипения воды,
тогда как его уменьшение вызывает понижение температуры кипения это-
го растворителя.
Температурой кристаллизации называют температуру, при которой
давление пара над жидкостью становится равным давлению пара надо
льдом (точка Т
0
на рис. 5.1). Для воды Т
0
= 0
о
С.
При каждой температуре давление насыщенного пара над жидко-
стью есть величина постоянная. Экспериментально установлено, что при
растворении в жидкости любого вещества давление насыщенного пара
этой жидкости понижается. Таким образом, давление насыщенного пара
растворителя над раствором всегда ниже, чем над чистым раствори-
телем при той же температуре.
Это явление вытекает из принципа Ле Шателье. Равновесию между
жидкостью и паром
(Н
2
О)
жидк
↔ (Н
2
О)
пар
отвечает определенное давление пара. Если растворить в воде некоторое
количество какого-либо вещества, концентрация молекул воды в жидкости
понизится и, в соответствии с принципом Ле Шателье, начнется процесс,
увеличивающий ее, – конденсация водяных паров. В результате новое рав-
новесие установится при более низком давлении пара.
Равновесное давление насыщенного пара растворителя над разбав-
ленными растворами неэлектролитов определяется законом Рауля: отно-
сительное понижение давления пара растворителя над раствором равно
мольной доле растворенного вещества. Математическим выражением это-
го закона является уравнение
),(
0
0
0
вавN
P
PP
P
P
−=
−
=
∆
(5.1)
43
где Р
0
и Р – давление пара соответственно над чистым растворителем и
раствором; ∆Р = Р
0
– Р – абсолютное понижение давления пара раствори-
теля над раствором; N(в-ва) – мольная доля растворенного вещества.
Это уравнение справедливо для идеальных растворов, т.е. растворов,
в которых отсутствует взаимодействие частиц растворителя и растворен-
ного вещества. Строго говоря, ни один реальный раствор не удовлетворяет
критерию идеальности, однако с достаточной степенью достоверности за-
кон Рауля можно применять к разбавленным растворам неэлектролитов.
Понижение давления пара над раствором находит отражение на фа-
зовой диаграмме «P – T». На рис. 5.1 приведены линии зависимости давле-
ния пара воды над растворами различной концентрации (О
1
А
1
и О
2
А
2
). Со-
гласно закону Рауля, давление водяного пара над раствором на величину
∆Р меньше, чем над водой, поэтому кривая кипения для раствора О
1
А
1
рас-
положена ниже, чем кривая кипения для воды ОА. Из графиков следует,
что равенство давления паров внешнему давлению для растворов достига-
ется при более высокой температуре, чем для чистого растворителя.
Поэтому температура кипения раствора Т
2
оказывается больше температу-
ры кипения чистого растворителя Т
1
. При дальнейшем увеличении концен-
трации растворенного вещества (N(в-ва)
2
> N(в-ва)
1
) давление пара продол-
жает понижаться. В результате линия О
2
А
2
оказывается ниже линии О
1
А
1
,
а температура кипения такого раствора – выше температуры Т
2
.
При переходе от воды к раствору уменьшается температура кристал-
лизации. Из рис. 5.1 видно, что раствор состава N(в-ва)
1
кристаллизуется
при температуре Т
3
<
T
0
, тогда как раствор состава N(в-ва)
2
– при Т
4
< T
3
.
Таким образом, растворы кипят при более высоких температурах,
чем чистый растворитель, а замерзают при более низких. Эти отклонения
тем больше, чем больше концентрация растворенного вещества в растворе.
Повышение температуры кипения раствора ∆Т
кип
и понижение темпера-
туры его кристаллизации по сравнению с чистым растворителем ∆Т
кр
ока-
зываются прямо пропорциональными моляльной концентрации растворен-
ного вещества C
m
(моль / 1 кг растворителя):
∆Т
кип
= Е · С
m
, (5.2)
∆Т
кр
= К · С
m
, (5.3)
где ∆Т
кип
= t
кип(р-р)
– t
кип(р-тель);
∆Т
кр
= t
кр(р-тель)
– t
кр(р-р)
; Е – эбуллиоскопичес-
кая постоянная растворителя; К – криоскопическая постоянная растворите-
ля.
Эти константы зависят от природы растворителя, не зависят от при-
роды растворенного вещества и формально равны соответственно повыше-
нию температуры кипения и понижению температуры кристаллизации од-
номоляльных растворов неэлектролитов. Константы К и Е для наиболее
часто используемых растворителей приведены в табл. 5.1.
44
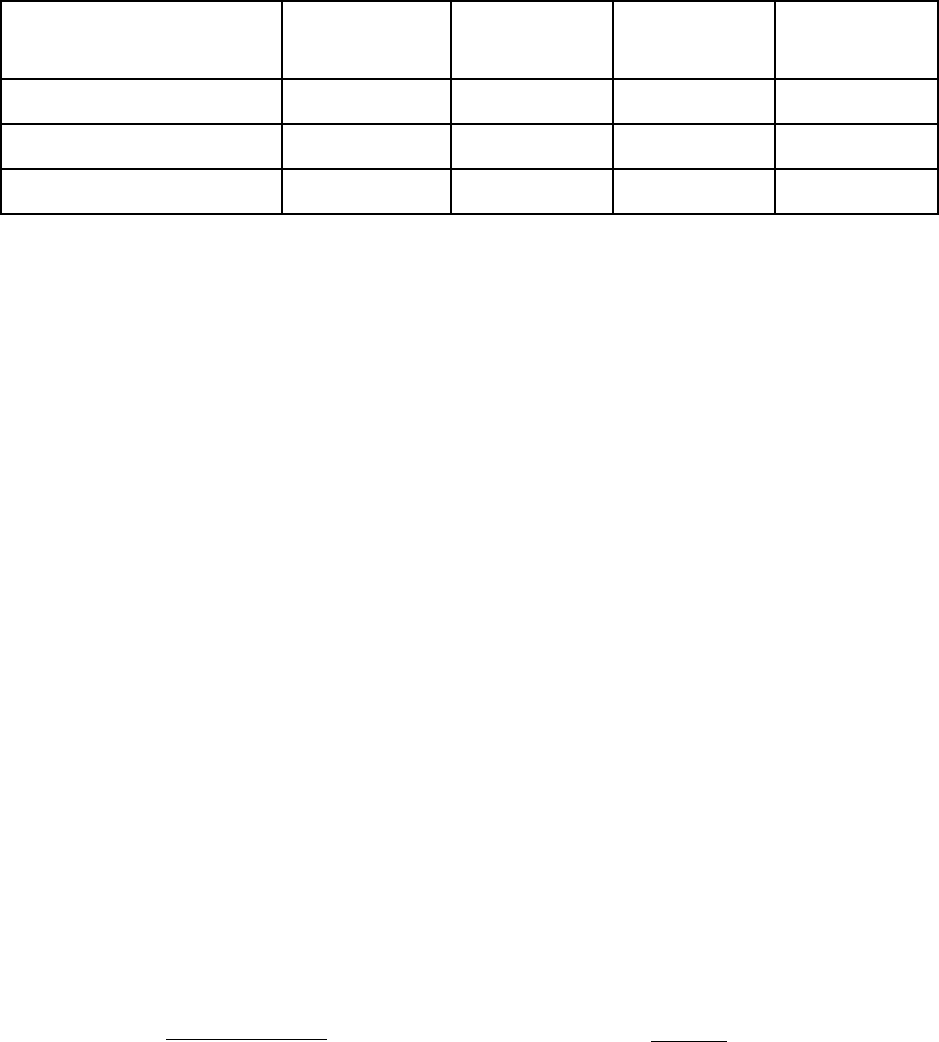
Таблица 5.1
Криоскопические и эбуллиоскопические постоянные некоторых жидкостей
Растворитель
t
кр,
о
С
К,
К·кг/моль
t
кип,
о
С
Е,
К·кг/моль
Вода H
2
O 0 1,86 100 0,52
Бензол С
6
Н
6
5,5 5,12 80,1 2,53
Тетрахлорметан CCl
4
–23 30 76,5 5,03
Еще одним коллигативным свойством раствора, как указывалось
выше, является осмотическое давление.
Осмос – это явление одностороннего самопроизвольного проникно-
вения молекул растворителя в раствор через полупроницаемую мембрану.
Эта мембрана проходима для молекул растворителя и непроходима для
растворенного вещества. Если в чистый растворитель опустить трубку с
раствором, нижнее отверстие которой закрыто такой мембраной, то через
некоторое время объем жидкости в трубке увеличится – раствор поднимет-
ся над уровнем растворителя. Гидростатическое избыточное давление,
создаваемое раствором, препятствующим диффузии растворителя через
полупроницаемую мембрану в раствор, называется осмотическим давле-
нием. Оно численно равно тому давлению, которое необходимо прило-
жить к поверхности раствора в трубке, чтобы вернуть его уровень в исход-
ное положение и тем самым предотвратить осмос. Такой процесс сопрово-
ждается выходом («выдавливанием») растворителя из раствора и называет-
ся обратным осмосом.
Зависимость осмотического давления раствора неэлектролита от его
молярной концентрации выражается законом Вант-Гоффа:
P
осм
= С
М
· R ·T. (5.4)
Из формулы (5.4) следует, что осмотическое давление раствора не-
электролита прямо пропорционально его молярной концентрации и абсо-
лютной температуре. С учетом выражения (2.3)
RT
VM
m
P
рарвав
вав
осм
⋅
⋅
=
−−
−
, или
.RT
M
m
VP
вав
вав
раросм
⋅=⋅
−
−
−
(5.5)
Аналогия выражения (5.5) с уравнением Клапейрона – Менделеева
(формула (1.5)) позволяет дать следующую формулировку закона Вант-
Гоффа: осмотическое давление равно тому давлению, которое имело бы
растворенное вещество, если бы оно было газом и занимало бы при дан-
ной температуре объем раствора.
45

Осмотические явления широко распространены в природе. В технике
для очистки сточных вод и опреснения морской воды используют обрат-
ный осмос.
Основанный на применении закона Вант-Гоффа метод определения
молярной массы растворенного вещества по измерению осмотического
давления раствора называется осмометрией.
Для растворов электролитов изменение коллигативных свойств ока-
зывается больше теоретически вычисленного по формулам (5.1) – (5.5) в
результате увеличения числа частиц в растворе за счет диссоциации.
В настоящей работе для определения молярных масс растворенных
веществ используется метод криоскопии, в основе которого лежит измере-
ние температуры кристаллизации раствора.
Поскольку моляльная концентрация раствора связана с массой раство-
ренного вещества m
(в-ва)
и массой растворителя в граммах m
(р-тель)
соотноше-
нием (2.5)
,
1000
телярвав
вав
m
mМ
m
С
−−
−
⋅
⋅
=
то, подставив это выражение в уравнение (5.3), получим
.
)()(
1000)(
тельрmвовM
вовm
KCKT
mкр
−⋅−
⋅−
⋅=⋅=∆
(5.6)
Отсюда
.
)(
1000)(
)(
тельрmT
вовm
KвовM
кр
−⋅∆
⋅−
⋅=−
(5.7)
В данной работе экспериментально определяют температуру кри-
сталлизации водного раствора, затем по формуле (5.7) рассчитывают мо-
лярную массу растворенного вещества.
Значение температуры кристаллизации раствора под воздействием
охлаждающей среды определяют из кривой охлаждения (t,
o
C – τ). Пример-
ный вид кривых охлаждения растворителя (воды) и водного раствора пока-
зан соответственно на рис. 5.2 и 5.3.
Как видно из рис. 5.2, кривая охлаждения воды содержит участок,
соответствующий ее охлаждению ниже 0
о
С (отрезок В’Б). После появле-
ния первых кристаллов льда (точка Б) температура воды повышается (от-
резок БВ), а затем остается постоянной до тех пор, пока вся вода во вну-
тренней пробирке прибора не замерзнет полностью (участок ВГ). Далее
происходит постепенное охлаждение кристаллов льда до температуры
охлаждающей смеси (участок ГД). Температуре кристаллизации раствори-
теля соответствует точка В на кривой охлаждения.
46
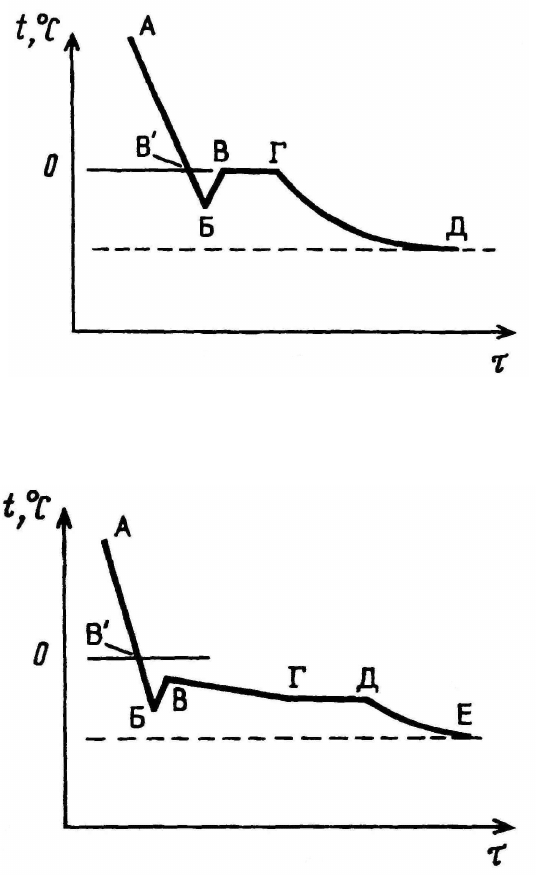
Рис. 5.2. Кривая охлаждения растворителя (воды)
Рис. 5.3. Кривая охлаждения раствора
При охлаждении раствора неэлектролита (рис. 5.3) сначала также на-
блюдается его переохлаждение (участок В’Б), выпадение первых кристал-
лов льда (точка Б) и повышение температуры раствора (участок БВ). От-
личие кривых замерзания растворителя и раствора заключается в том, что
последний замерзает в некотором температурном интервале, так как в про-
цессе замерзания из раствора частично удаляется растворитель и повыша-
ется концентрация растворенного вещества. Это вызывает дальнейшее по-
нижение температуры замерзания раствора (участок ВГ). Затем начинают
одновременно кристаллизоваться вода и растворенное вещество, и темпе-
ратура раствора остается постоянной (участок ГД). Далее температура по-
нижается до температуры охлаждающей смеси (участок ДЕ). Температуре
кристаллизации раствора соответствует точка В.
47

5.2. Экспериментальная часть
Реактивы: водный раствор неизвестного неэлектролита А с массо-
вой долей растворенного вещества 30% (плотность раствора – 1,08 г/см
3
),
дистиллированная вода, лед, поваренная соль.
Оборудование: криостат – прибор для криоскопических исследова-
ний (рис. 5.4); химический стакан для приготовления исследуемого раство-
ра; кристаллизатор для приготовления охлаждающей смеси; две бюретки
(с 30%-ным раствором вещества А и дистиллированной водой); шпатель;
секундомер.
Рис. 5.4. Прибор для криоскопических исследований (криостат):
1 – внутренняя пробирка; 2 – пробка внутренней пробирки;
3 – термометр с ценой деления 0,1
о
С; 4 – крышка;
5 – стеклянный сосуд с охлаждающей смесью
Ход работы
1. Приготовьте раствор для исследования. Для этого в химический
стакан с помощью бюретки сначала налейте a см
3
30%-ного раствора веще-
ства А. Затем с помощью другой бюретки внесите в этот же стакан b см
3
дистиллированной воды. (Значения объемов a и b указывает преподава-
тель.) Полученный раствор тщательно перемешайте.
2. В кристаллизаторе приготовьте охлаждающую смесь из льда и
соли. Заполните ею стеклянный сосуд криостата.
48

3. Внутреннюю пробирку криостата приблизительно до ½ ее объема
заполните приготовленным раствором вещества А. Не пытайтесь залить в
пробирку весь приготовленный раствор! Убедитесь, что при погружении
пробирки в криостат раствор в ней будет полностью окружен охлаждаю-
щей смесью.
4. Поместите пробирку с раствором в охлаждающую смесь и изме-
ряйте температуру в пробирке через каждые 15 с. Осторожно перемеши-
вайте раствор в пробирке термометром, стараясь не повредить его.
5. Полученные экспериментальные данные запишите по форме
табл. 5.2.
6. Продолжайте измерение температуры до тех пор, пока она не до-
стигнет значения –10
о
С. По окончании опыта выньте внутреннюю пробир-
ку из криостата, поместите ее под струю теплой водопроводной воды и до-
ждитесь, пока кристаллы расплавятся. Затем раствор из пробирки можно
вылить.
Таблица 5.2
Зависимость температуры раствора от продолжительности охлаждения
τ, с 15 30 45 60 75 90 105 120 …
t,
o
С
7. По данным таблицы постройте график зависимости температуры
раствора от времени его охлаждения t = f(τ) в пределах изменения темпера-
тур от +5 до –10
о
С (точки, выходящие за эти границы, на график не нано-
сите). Вид полученного графика должен соответствовать рис. 5.3.
8. По графику определите температуру кристаллизации раствора
t
кр(р-ра)
. Вычислите понижение температуры кристаллизации раствора в
сравнении с чистым растворителем ∆Т
кр
.
9. Вычислите массу растворенного вещества и массу растворителя в
приготовленном растворе:
m
в-ва
= V
р-ра А
· ρ
р-ра
· С(А); m
в-ва
= a · 1,08 · 0,3 = … г;
m
воды
= V
р-ра А
· ρ
р-ра
· (1 – С(А)) + V
воды
· ρ
воды
;
m
воды
= а · 1,08 · (1 – 0,3) + b · 1 = … г.
10. По формуле (5.7) рассчитайте молярную массу неизвестного не-
электролита А.
11. Узнайте у преподавателя справочное значение М(А) и вычислите
относительную ошибку определения молярной массы вещества А:
49

%.100
⋅
−
=δ
справ
экспсправ
M
MM
(5.8)
5.3. Контрольные вопросы
1. От чего зависят температуры кипения и кристаллизации раствора?
2. Что характеризуют криоскопическая и эбуллиоскопическая посто-
янные?
3. Как можно использовать данные по определению температуры
кристаллизации раствора для определения молярной массы растворенного
вещества?
4. Каким образом можно использовать данные по определению тем-
пературы кристаллизации раствора для обнаружения диссоциации элек-
тролитов в водных растворах?
5. В каком из следующих 0,1-моляльных растворов: а) HNO
3
;
б) NaCl; в) C
6
H
12
O
6
; г) CuSO
4
; д) BaCl
2
– изменение температуры кристал-
лизации будет наибольшим?
5.4. Примеры контрольных задач по теме лабораторной работы
1. Раствор, содержащий 2,5 г C
6
H
5
OH в 91 г бензола, начинает кри-
сталлизоваться при 3,8
о
С. Вычислите криоскопическую постоянную бен-
зола, зная, что чистый бензол кристаллизуется при 5,5
о
С.
2. Определите молярную массу спирта, если известно, что раствор,
содержащий 0,874 г спирта в 100 г воды, начинает кристаллизоваться при
температуре –0,354
о
С.
3. При какой температуре замерзает антифриз, состоящий из 9 л
воды и 2 л метилового спирта СН
3
ОН (плотность 0,8 г/см
3
)?
6. ДИССОЦИАЦИЯ ЭЛЕКТРОЛИТОВ
6.1. Основные понятия и закономерности
Соединения, растворы и расплавы которых проводят электрический
ток, называют электролитами.
Согласно теории электролитической диссоциации С. Аррениуса
(1887 г.):
при растворении кислоты, основания и соли диссоциируют на ионы;
диссоциация протекает лишь частично; доля диссоциированных мо-
лекул называется степенью диссоциации (0 <α< 1); разбавление и рост
температуры приводит к увеличению α;
к равновесию диссоциации применим закон действующих масс.
Для равновесия НСN ↔ H
+
+ CN
–
50
