Аскирка В.Ф. Механика, молекулярная физика, термодинамика
Подождите немного. Документ загружается.


101
M
m
N
N
A
==n
, (9.1)
где N – количество молекул,
A
N – постоянная Авогадро,
m
–
масса вещества,
M
– молярная масса.
Относительная атомная масса (
r
A ) некоторого элемента –
это отношение массы атома элемента к 121 массы атома угле-
рода C
12
.
Масса, равная 121 массы атома углерода C
12
, называется атом-
ной единицей массы ( 0,1 а.е.м.=
27
106,1
-
× кг).
Единицей измерения количества вещества является один моль.
1 Моль – это такое количество вещества, в котором содержится
столько структурных единиц (атомов, молекул или ионов), сколь-
ко их содержится в 0,012 кг углерода C
12
.
Молярная масса – масса одного моля вещества, которая может
быть определена по таблице Менделеева. Для этого необходимо из
таблицы взять значение
r
A для каждого из атомов, входящих в
состав молекулы данного вещества, умножить на число таких ато-
мов в молекуле и сложить. Умножив полученное значение на 10
-3
,
получим молярную массу вещества, измеряемую в единицах
кг/моль. К примеру, молярная масса воды:
(
)
(
)
33
2
1018100,12161
--
×=××+×=OHM кг/моль.
Постоянная Авогадро (
A
N ) – количество частиц, содержащих-
ся в 1 моле вещества:
23
10023,6 ×=
A
N моль
-1
.
Соотношение, определяющее связь между параметрами состояния
какого-либо тела (системы), называется уравнением состояния
этого тела (системы). В общем случае уравнение состояния тела
(системы) можно записать в виде:
(
)
0,, =TVpF . (9.2)
102
Состояние идеального газа описывается уравнением Менде-
леева-Клапейрона:
RT
M
m
pV = nkTp
=
Þ
, (9.3)
где
p
– давление газа, V – объем газа,
R
– универсальная газовая
постоянная,
T
– абсолютная температура.
Закон Дальтона: давление смеси идеальных газов равно сумме
парциальных давлений входящих в ее состав газов:
n
pppp +++= ...
21
, (9.4)
где
1
p ,
2
p , …
n
p – парциальные давления газов смеси.
Парциальное давление – давление, которое оказывал бы газ из
состава смеси при отсутствии других газов при той же темпера-
туре.
Концентрация молекул – число молекул в единице объема:
M
N
V
N
n
A
r
== , (9.5)
где
r
– плотность газа.
Изопроцесс – процесс, при котором хотя бы один из термодина-
мических параметров
(
)
TVp ,, системы остается неизменным.
Для идеального газа справедливы экспериментально установлен-
ные три следующих газовых закона.
Закон Бойля-Мариотта (для изотермического процесса):
для данной массы газа при неизменной температуре произведение
давления на объем является величиной постоянной:
constpV
=
. (9.6)
Закон Гей-Люссака (для изобарного процесса): для данной
массы газа при неизменном давлении отношение объема к абсо-
лютной температуре является величиной постоянной:
const
T
V
= . (9.7)
103
Закон Шарля (для изохорного процесса): для данной массы
газа при неизменном объеме отношение давления к абсолютной
температуре является величиной постоянной:
const
T
p
= . (9.8)
10. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ (МКТ)
Основное уравнение МКТ связывает давление с кинетической
энергией молекул:
ñeá=ñuá=
посткв
nnmp
3
2
3
1
2
0
, (10.1)
где
0
m – масса одной молекулы, ñuá
кв
– средняя квадратичная
скорость движения молекул, ñeá
пост
– средняя кинетическая энер-
гия поступательного движения одной молекулы.
Средняя квадратичная скорость молекул:
å
=
u=ñuá
N
i
iкв
N
1
2
1
, (10.2)
где
i
u – скорости отдельных молекул в некоторый момент време-
ни. Исходя из уравнений МКТ, средняя квадратичная скорость оп-
ределяется также выражениями:
M
RT
m
kT
кв
33
0
==ñuá . (10.3)
Средняя арифметическая скорость молекул:
å
=
u=ñuá
N
i
i
N
1
1
. (10.4)
Выражение для средней арифметической скорости молекул можно
представить и в виде:
M
RT
m
kT
p
=
p
=ñuá
88
0
. (10.5)

104
Средняя кинетическая энергия молекулы:
kT
i
2
=ñeá , (10.6)
где
i
– число степеней свободы. Под степенью свободы понимают
число независимых координат, которыми может быть описано
движение молекулы.
11. РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА И БОЛЬЦМАНА
Основу статистического описания систем, состоящих из множест-
ва молекул, составляют следующие предположения Мак-
свелла.
1. Газ состоит из большого числа N одинаковых молекул.
2. Температура газа постоянна.
3. Молекулы совершают тепловое хаотическое движение (с раз-
ными скоростями).
4. На газ не действуют внешние силы.
Функция распределения молекул по скоростям
()
(
)
u
u
=u
Nd
dN
f
определяет относительное число молекул
(
)
N
dN u
, модули скоро-
стей которых лежат в интервале от
u
до
u
+
u
d .
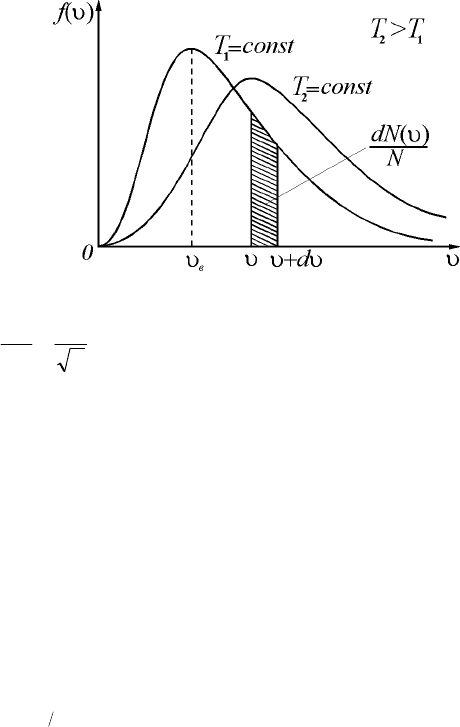
Распределение Максвелла молекул по скоростям уста-
навливает зависимость функции )(f
u
от массы одной молекулы и
температуры газа (рис. 2.1):
()
()
()
kTm
e
kT
m
Nd
dN
f
2
2
23
0
2
0
2
4
u-
u
÷
ø
ö
ç
è
æ
p
p=
u
u
=u . (11.1)
Наивероятнейшая скорость молекул – скорость, соответст-
вующая максимуму функции распределения Максвелла (рис. 2.1):
M
RT
m
kT
в
22
0
==u . (11.2)
Если ввести обозначение
в
z uu= , то распределение Мак-
свелла по относительным скоростям записывается в виде:
105
()
dzez
N
dN
zy
z
2
2
4
-
p
==
. (11.3)
Благодаря хаотическому тепловому движению молекулы газа рав-
номерно распределяются по всему предоставленному ему объему
только в том случае, если на молекулы не действуют внешние
силы.
Если на тело (систему) действуют консервативные (потенциаль-
ные) силы, то говорят, что тело (система) находится в по-
тенциальном поле сил.
В поле силы тяжести у поверхности Земли устанавливается дина-
мическое равновесие, при котором концентрация молекул газов,
составляющих воздух, у поверхности максимальна и экспоненци-
ально убывает с высотой:
(
)
kTghm
enn
0
0
-
= , (11.4)
где
0
m – масса молекулы. Эта зависимость справедлива при усло-
вии постоянства температуры газа, а также ускорения свободного
падения по всей высоте и называется распределением
Больцмана в поле сил тяжести.
Аналогичная зависимость для давления газа в поле силы тяжести
носит название барометрической формулы:
Рис. 2.1
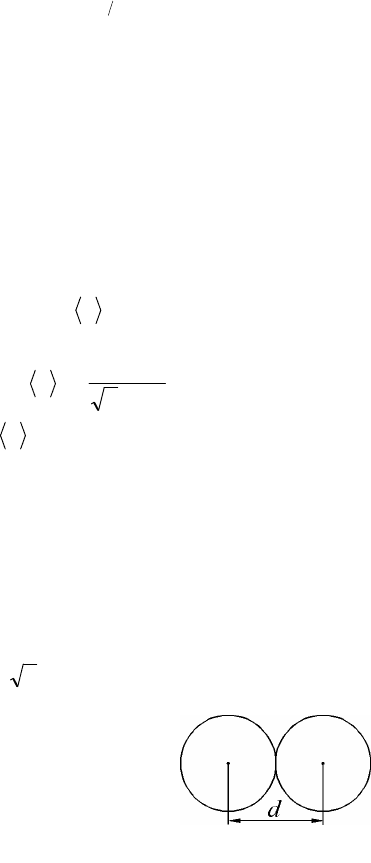
106
Рис. 2.2
(
)
kThhgm
epp
)(
0
00
--
= , (11.5)
где
0
hh - – разность высот, соответствующих давлениям
p
и
0
p .
12. ЯВЛЕНИЯ ПЕРЕНОСА
Молекулы газа, находясь в тепловом движении, непрерывно
«сталкиваются» друг с другом. Столкновение в данном случае –
процесс взаимодействия между молекулами, в результате которого
они изменяют направление своего движения.
Средняя длина свободного пробега молекулы – среднее
расстояние l , проходимое молекулой между двумя последова-
тельными столкновениями:
nd
2
2
1
p
=tu=ñlá
, (12.1)
где u – средняя арифметическая скорость молекулы,
t
– сред-
нее время свободного пробега, d – эффективный диаметр молеку-
лы,
n
– концентрация молекул.
Эффективный диаметр молекулы – минимальное расстоя-
ние d между центрами сближающихся при столкновении молекул
(рис. 2.2), табличная величина.
Среднее число соударений молекулы за 1 секунду:
ñuáp=ñá ndz
2
2. (12.2)
Явления переноса – необратимые процессы в термодинамиче-
ски неравновесных системах, при которых происходит простран-
ственный перенос энергии, массы или импульса.
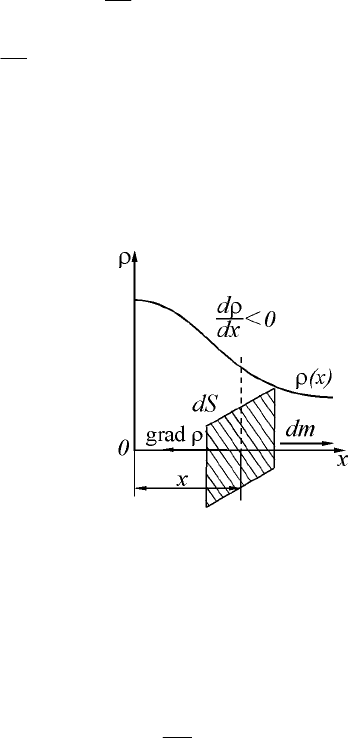
107
Рис. 2.3
Диффузия – самопроизвольное проникновение и перемешивание
частиц двух соприкасающихся веществ (перенос массы).
Явление диффузии описывается законом Фика: масса молекул,
диффундирующих через площадку dS за время dt в направлении,
перпендикулярном площадке, прямо пропорциональна градиенту
плотности частиц
dx
dr
:
dSdt
dx
d
Ddm
r
-= , (12.3)
где
D
– коэффициент диффузии.
Равенство (12.3) называется уравнением диффузии.
Диффузия приводит к перераспределению массы веществ по всему
объему. Этот процесс продолжается до тех пор, пока градиент
плотности не равен нулю (рис. 2.3).
Теплопроводность – перенос энергии в сторону убывания тем-
пературы.
Явление теплопроводности описывается законом Фурье: коли-
чество теплоты, переносимое через площадку dS за время dt в
направлении, перпендикулярном площадке, прямо пропорционально
градиенту температуры
dx
dT
:

108
dSdt
dx
dT
dQ c-= , (12.4)
где
c
– коэффициент теплопроводности.
Уравнение (12.4) называется уравнением теплопроводности.
Процесс теплопроводности происходит до тех пор, пока существу-
ет градиент температуры.
В результате теплопроводности происходит выравнивание темпе-
ратуры по всему объему замкнутой системы (тела). Система пере-
ходит в состояние термодинамического равновесия.
Внутреннее трение (вязкость) – перенос импульса молекул из
одного слоя жидкости или газа в другой. В результате слои вязкой
среды с большей скоростью замедляются, а с меньшей ско-
ростью – ускоряются.
Закон Ньютона: сила вязкого (внутреннего) трения, возникаю-
щего при макроскопических движениях в газе или жидкости, пря-
мо пропорциональна градиенту скорости
dx
du
и величине площади
соприкасающихся слоев S :
S
dx
d
F
u
h= , (12.5)
где
h
– коэффициент внутреннего трения (динамическая вяз-
кость).
Выражение (12.5) носит название уравнения вязкости или
уравнения Ньютона.
Используя связь силы с импульсом, закон Ньютона для вязкого
трения можно записать в виде:
dSdt
dx
d
dp
u
h-= , (12.6)
где dp – изменение импульса слоя, dt – промежуток времени, за
который произошло изменение импульса слоя.
Коэффициенты
D
,
c
и
h
, входящие в законы, описывающие яв-
ления переноса, определяются параметрами системы.

109
Коэффициент диффузии:
ñlñáuá=
3
1
D . (12.7)
Коэффициент теплопроводности:
h=ñlñáuár=c
VV
cc
3
1
, (12.8)
где
V
c – удельная теплоемкость среды при постоянном объеме.
Коэффициент внутреннего трения
(динамическая вязкость):
r=ñlñáuár=h D
3
1
. (12.9)
13. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
Внутренняя энергия термодинамической системы – энер-
гия теплового движения и взаимодействия микрочастиц, состав-
ляющих систему. Внутренняя энергия – однозначная функция
термодинамического состояния системы. Изменение внутренней
энергии системы не зависит от способа перевода системы из одно-
го состояния в другое, а зависит лишь от первоначального и ко-
нечного состояний термодинамической системы.
Внутренняя энергия идеального газа:
RT
M
mi
U
2
= , (13.1)
где
i
– число степеней свободы молекулы.
Опыт показывает, что изменять внутреннюю энергию термодина-
мической системы можно двумя способами: совершением над сис-
темой работы или передачей ей количества теплоты.
Первое начало термодинамики – закон сохранения и превра-
щения энергии применительно к термодинамическим процессам –
количество теплоты Q
d
, переданное системе, идет на изменение
внутренней энергии dU и совершение работы A
d
против внеш-
них сил:
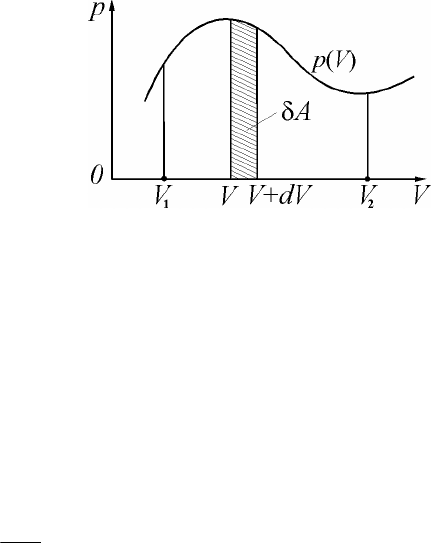
110
Рис. 2.4
AdUQ
d
+
=
d
. (13.2)
Если же работа совершается внешними силами над системой A
¢
d ,
то она принимается отрицательной: AA
¢
d-=d . В этом случае пер-
вое начало термодинамики можно представить в виде:
AdUQ
¢
d-=d . (13.3)
Работа в термодинамике:
pdVA
=
d
, (13.4)
где dV – изменение объема (рис. 2.4). В координатах Vp
-
эле-
ментарная работа газа A
d
представляет собой площадь соответст-
вующей криволинейной трапеции.
Работа, совершенная в течение термодинамического процесса, вы-
ражается соответствующим интегралом (рис. 2.4):
ò
=
2
1
V
V
pdVA , (13.5)
где
1
V и
2
V – начальный и конечный объемы газа.
Молярная теплоемкость – физическая величина, определяемая
количеством теплоты, необходимым для нагревания 1 моль веще-
ства на 1 К:
dT
Q
C
M
n
d
= . (13.6)
