Албертс Б., Брей Д. и др. Молекулярная биология клетки. Том 1
Подождите немного. Документ загружается.

231
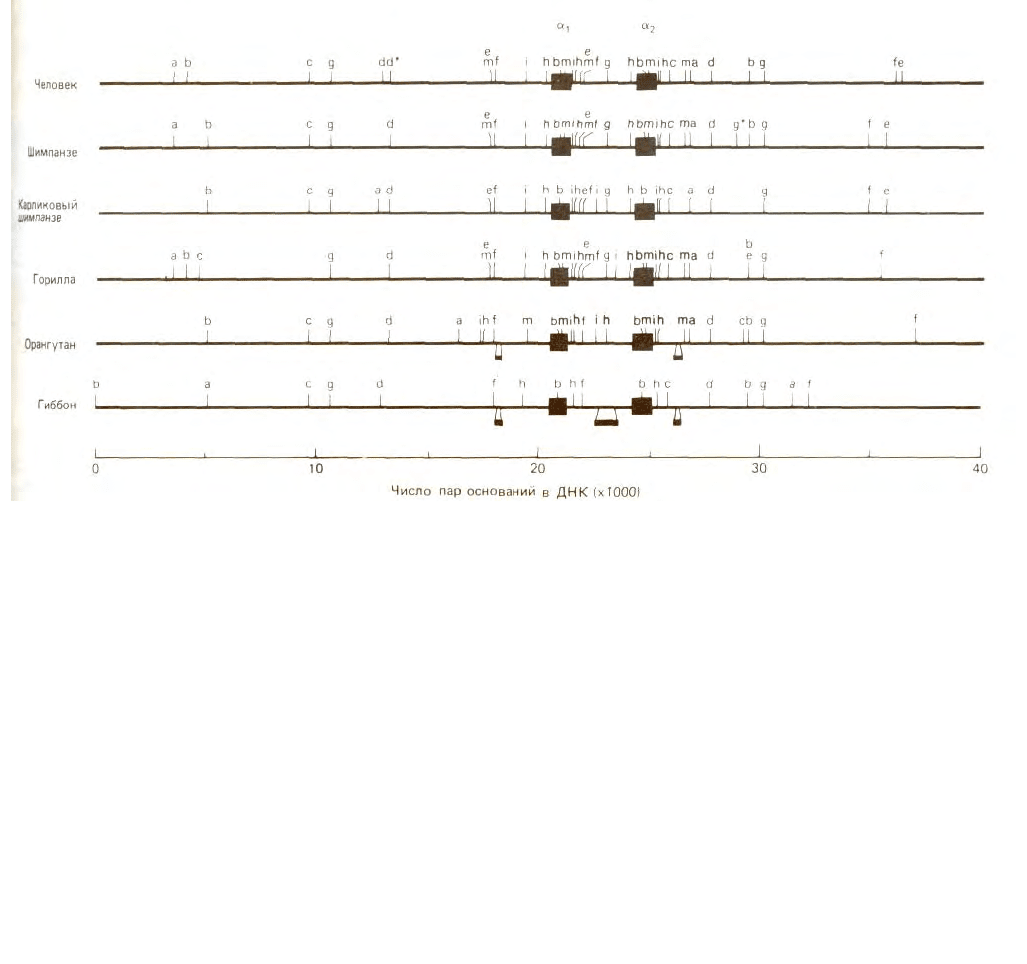
Рис. 4-62. Рестрикционная карта в кластере генов, кодирующих гемоглобин человека и различных приматов. Два окрашенных квадрата в
каждой карте показывают положение участка, соответствующего гену глобина. Каждая буква указывает участок, расщепляемый различными
рестрицирующими нуклеазами. Положение сайтов разреза определяли сравнением размеров фрагментов ДНК, образующихся при обработке ДНК
различными рестрицирующими нуклеазами в отдельности и в различных сочетаниях. (С любезного разрешения Elisabeth Zimmer, Alan Wilson.)
карты) без определения их нуклеотидной последовательности. Например, сравнение рестрикционных карт, указанных на рис. 4-62, привело к
выводу, что хромосомные участки, кодирующие цепи глобина у человека, орангутана и шимпанзе, сохранились практически в неизменном виде в
течение последних 5-10 млн. лет, т.е. с тех пор, как эти виды дивергировали. Рестрикционные карты также важны для клонирования ДНК и генной
инженерии; они позволяют локализовать ген на данном рестрикционном фрагменте. Объяснение этому вы найдете ниже.
4.6.3. Клонирование ДНК позволяет получать любые последовательности ДНК в большом количестве [39]
Многие рестрицирующие нуклеазы вносят разрывы в две цепи ДНК со смещением на несколько нуклеотидов, так что на концах
фрагментов образуются короткие одноцепочечные участки. Эти одноцепочечные концевые участки обладают способностью образовывать
комплементарные пары оснований с любым другим одноцепочечным участком, полученным с помощью того же фермента, и потому их называют
липкими концами (рис. 4-63). Липкие концы, образованные рестрикционными ферментами, позволяют легко соединить два любых фрагмента ДНК
воедино при условии, что эти фрагменты образовались после действия одной и той же рестрицирующей нуклеазы (рестриктазы) (либо иной
нуклеазы, которая создает такие же липкие концы). Таким образом, фрагмент ДНК любого происхождения можно встроить в очищенную ДНК
автореплицирующегося генетического элемента, которым, как правило, является плазмида или бактериальный вирус. Бактериальный клон,
содержащий такую плазмиду или вирус, можно сравнить с фабрикой по производству этого фрагмента ДНК. Исходный фрагмент может
происходить прямо из геномной ДНК, или из кДНК (комплементарной ДНК), т. е. из ДНК, полученной копированием матричной РНК. Эти методы
детально обсуждаются в гл. 5.
Первый этап получения клонов геномной ДНК обычно включает выделение ДНК и ее расщепление рестриктазой. При этом возникает
громадное количество различных фрагментов ДНК, например, в случае

232
Рис. 4-63. Многие виды рестрицирующих нуклеаз позволяют получать фрагменты ДНК с липкими (одноцепочечными) концами. Фрагменты ДНК,
обладающие такими концами, соединяются с помощью комплементарного взаимодействия пар оснований в области липких концов, как показано на
схеме. Два фрагмента ДНК, объединяющиеся здесь, были получены с помощью рестрицирующей нуклеазы Eco R1 (см. рис. 4-60).
генома млекопитающих образуется от 10
5
до 10
7
фрагментов. В процессе клонирования исследователь получает миллионы клеточных колоний
(клонов), большая часть которых содержит различные фрагменты ДНК. Наиболее сложным этапом клонирования является выявление именно того
клона, который содержит нужный фрагмент ДНК.
Получение клонов кДНК начинается с выделения мРНК из клеток, Эта мРНК затем используется в качестве матрицы для обратной
транскриптазы, фермента, синтезируемого определенными вирусами, ДНК которых возникает в процессе копирования последовательности РНК
(процесс обратный по сравнению с обычным процессом копирования, в котором РНК синтезируется с ДНК-матрицы). Фермент создает ДНК-копию
(кДНК) каждой из представленных молекул РНК. Эти одноцепочечные молекулы ДНК затем превращаются в двухцепочечные (см. разд. 5.6.3). Их
клонируют с помощью методов, подобных тем, что были использованы для клонирования фрагментов геномной ДНК.
Следует иметь в виду, что существует принципиальное различие между геномными и кДНК-клонами, которое объясняется, в частности,
характерным для высших эукариот процессом сплайсинга (см. разд. 9.4.8). По всей вероятности, именно клоны кДНК содержат непрерывные
участки нуклеотидной последовательности, кодирующей белки.
4.6.4. Метод гель-электрофореза позволяет быстро фракционировать молекулы ДНК разного размера [40]
В начале 70-х годов было показано, что с помощью методов гель-электрофореза, которые оказались столь полезными для анализа
белковых цепей, можно точно определить длину и чистоту молекул ДНК. Этот метод гораздо проще, чем модификация, используемая для белков;
Рис. 4-64. Гель-электрофорез является мощным методом разделения молекул ДНК по их размерам. В трех указанных примерах
электрофорез проводили сверху вниз, так что более крупные молекулы ДНК находятся в верхней части геля. А. Мелкопористый
полиакриламидный гель был использован для фракционирования отдельных цепей ДНК. В диапазоне размеров от 10 до 500
нуклеотидов можно делить молекулы ДНК, отличающиеся лишь одним нуклеотидом. В этом случае на дорожки 1-4 нанесены
продукты четырех независимых реакций секвенирования ДНК, где на концах цепи присутствуют дидезоксирибонуклеотиды G, А, Т
и С (в скобках см. рис. 4-68); так как в этих реакциях используют молекулы ДНК, предварительно меченные радиоизотопами,
расположение этих радиоизотопов можно выявить радиоавтографически, как указано на рисунке. Б. Среднепористый агарозный
гель используется для разделения двухцепочечных молекул ДНК. Этот метод наиболее удобен для разделения молекул длиной от
300 до 5000 пар нуклеотидов. Именно такую длину имеет рестрикционные фрагменты бактериофага, выявляемые по
флуоресценции после окраски бромистым этидием. В. Метод пульс-электрофореза в агарозном геле использован для разделения 16
различных хромосом дрожжей (Saccharomyces cerevisiae), размеры которых варьируют от 220000 до 2500000 пар нуклеотидов. В
этих гелях можно разделять молекулы длиной до 107 пар нуклеотидов. (А - с разрешения Linder Laufer, Peter Walter; Б - с
разрешения Ken Kreutzer, В - с разрешения D. Wolrath, A.W. Davies - Nucl. Acid Res., 15, 7876, 1988.)

233
каждый нуклеотид в молекуле нуклеиновой кислоты уже обладает отрицательным зарядом, и поэтому нет необходимости добавлять отрицательно
заряженный детергент ДСН, который «заставляет» белковые молекулы двигаться к положительному электроду. Были разработаны специальные
полиакриламидные гели, с помощью которых удается разделить фрагменты ДНК длиной до 500 нуклеотидов, отличающиеся даже на один
нуклеотид (рис. 4-64, А). К сожалению, поры в полиакриламидном геле для больших ДНК слишком малы, для их разделения по размеру были
разработаны специальные гели на основе агарозы (полисахарид, выделяемый из морских водорослей) (рис. 4-64, Б). Оба этих метода разделения
ДНК широко используются для аналитических и препаративных целей.
Недавно была предложена модификация гель-электрофореза в агарозном геле, названная электрофорез в пульсирующем электрическом
поле или пульс-электрофорез. С ее помощью удается разделять очень большие, можно сказать громадные молекулы ДНК. Обычный гель-
электрофорез не позволяет разделить такие молекулы ввиду постоянства электрического поля, которое придает молекулам змеевидную
конфигурацию. Обладающие такой конфигурацией молекулы движутся в гелях с постоянной скоростью вне зависимости от длины молекул. Если
же направление электрического поля будет часто меняться, скорость движения молекул будет определяться их способностью переориентироваться
согласно этому изменению. Такой процесс у больших молекул занимает значительно больше времени, вследствие чего они будут отставать. На
гелях после пульс-электрофореза целые хромосомы бактерий или дрожжей выявляются в виде отдельных полос (рис. 4-64, В), и поэтому можно
легко определить хромосомные перестройки. Более того, используя гибридизацию молекул клонированной ДНК данного геля для поиска
комплементарных последовательностей в геле, удалось картировать множество генов у дрожжей (см. разд. 4.6.8).
Если не произвести мечение или окраску ДНК, полосы в агарозных или полиакриламидных гелях останутся невидимыми. Один из самых
эффективных методов окраски ДНК состоит в выдерживании геля после электрофореза в растворе красителя бромистого этидия, который
флуоресцирует под ультрафиолетовым светом после связывания с ДНК (рис. 4-64, Б и В). Еще более чувствительный метод детекции основан на
включении радиоизотопов в молекулы ДНК до электрофореза; для этого обычно используют
32
Р, который включается в фосфаты ДНК и испускает
β-частицу достаточно высокой энергии, чтобы её можно было выявить с помощью метода радиоавтографии (рис. 4-64, A).
4.6.5. Очищенные молекулы ДНК можно метить радиоизотопами in vitro [41]
Для мечения очищенных молекул ДНК радиоизотопами широко используются два метода. В первом случае в молекулу ДНК с помощью
ДНК-полимеразы I E coli вводят радиоактивно меченные нуклеотиды (рис. 4-65, А). При этом получают радиоактивные «ДНК-зонды»,
используемые в реакциях гибридизации нуклеиновых кислот (см. ниже). Во втором методе фермент полинуклеотидкиназа из бактериофага
используется для переноса отдельных фосфатов, меченных
32
Р, с АТР на 5 '-конец каждой из цепей ДНК (рис. 4-65, Б). Поскольку каждая из цепей
ДНК метится с помощью киназы только одним атомом
32
Р, молекулы ДНК обычно недостаточно радиоактивны, чтобы использоваться в качестве
зондов ДНК; однако то, что помеченными цепи ДНК оказываются только по одному концу, делает их очень удобными для секвенирования и
«футпринтирования», что будет обсуждаться ниже.

234
4.6.6. Выделенные фрагменты ДНК можно легко секвенировать [42]
В конце 70-х годов были разработаны методы для простого и быстрого определения последовательности нуклеотидов (секвенирования)
любых очищенных фрагментов ДНК. Вслед за этим были определены полные последовательности нуклеотидов многих генов млекопитающих,
включая гены, кодирующие гемоглобин, инсулин и цитохром с. Объем информации о последовательностях ДНК столь велик (многие миллионы
нуклеотидов), что для хранения и анализа имеющихся данных необходимо использовать компьютеры. Секвенировано несколько протяженных
последовательностей ДНК, содержащих более 10
5
пар нуклеотидов; среди них полный геном вируса Эпштейна-Барр (вызывающего у человека
инфекционный мононуклеоз), а также полный геном хлоропластов растений. В настоящее время широко используются два различных метода
секвенирования ДНК; принципы, лежащие в основе химического метода иллюстрированы рис. 4-66 и 4-67, ферментативный метод объясняется
на рис. 4-68.
Эти методы настолько быстры и надежны, что, когда перед исследователем стоит задача выяснения последовательности аминокислот в
белке, оказывается целесообразным провести секвенирование соответствующего гена и реконструировать последовательность аминокислот на
основании генетического кода. Хотя считывание любой ДНК может происходить в принципе с шестью различными рамками считывания (по три в
каждой цепи), истинную рамку считывания определяют по следующему свойству: обычно это единственная рамка считывания, в которой стоп-
кодоны встречаются редко (см. разд. 5.1.6). Чтобы убедиться в том, что выводя последовательность аминокислот в белке из последовательности
нуклеотидов в соответствующем гене, мы не ошиблись.
Рис. 4-65. Два ферментативных метода, используемые обычно для получения радиоактивных молекул ДНК. А, ДНК-полимеразой I метят все
нуклеотиды в молекуле ДНК, что позволяет получить высокорадиоактивные ДНК-зонды. Б. Полинуклеотид-киназа метит только 5'-концы ДНК.
Если мечение ДНК сочетают с обработкой рестрикционной нуклеазой, как указано на рисунке, фракция молекул ДНК, содержащих меченные по 5'-
концу отдельные цепи, может быть довольно легко зарегистрирована.
235
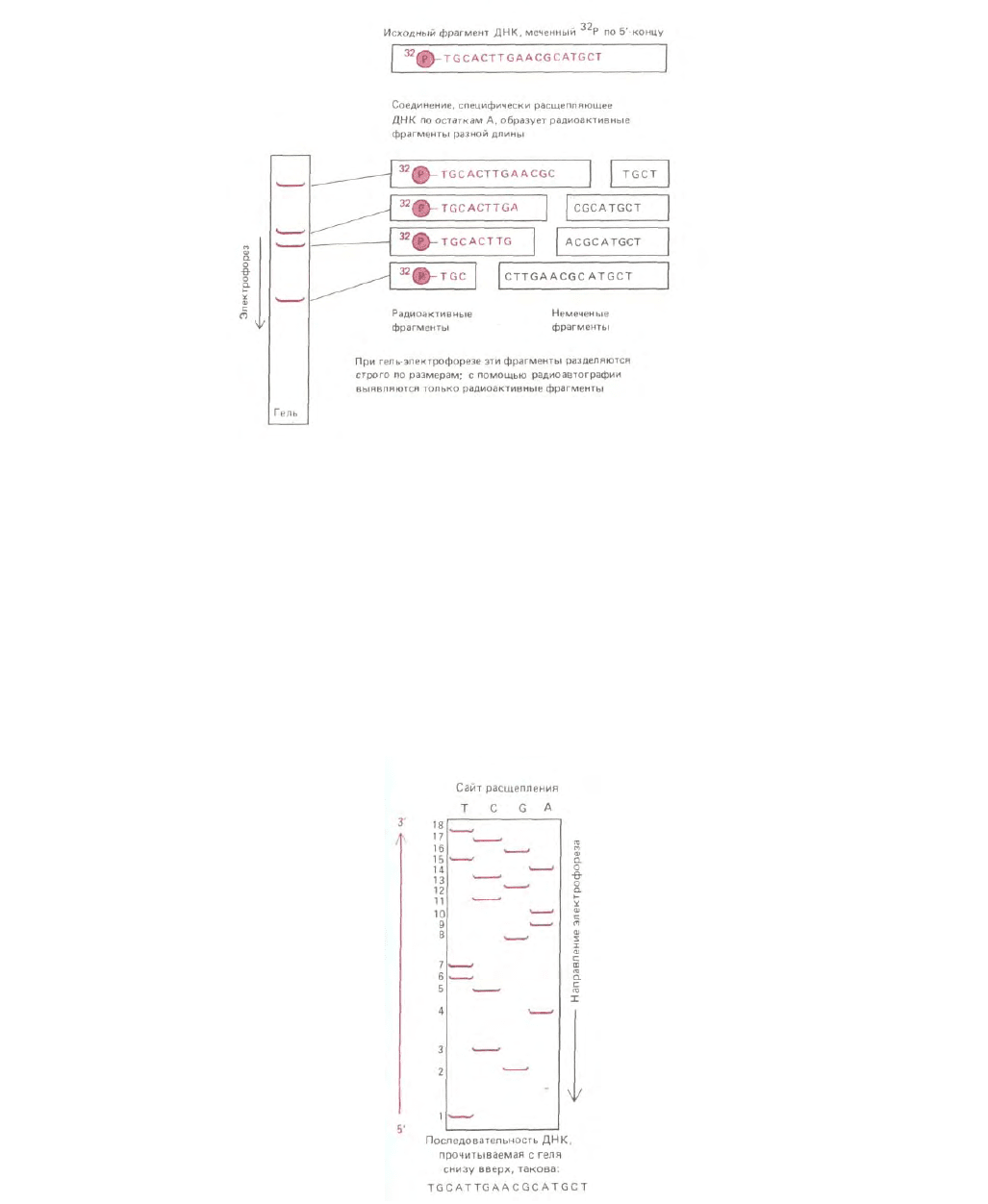
Рис. 4-66. Семейство меченных по 5'-концу фрагментов ДНК, полученных в результате рестрикции по определенному нуклеотиду (в данном случае
основание А). Анализируемая цепь ДНК - продукт денатурации двухцепочечной молекулы, выделенной с помощью метода, описанного на рис. 4-
65, Б. Эту цепь подвергли мягкой химической обработке, удаляющей из цепи некоторое количество одного из четырех нуклеотидов; при этом
большинство таких нуклеотидов остаются в цепи. Поскольку только фрагменты, указанные на рисунке слева, содержат 5'-конец и
32
Р-фосфатную
группу на ней, именно эти фрагменты регистрируются после радиоавтографии геля. Данная процедура лежит в основе химического метода
секвенирования ДНК, описанного на рис. 4-67.
следует прямо секвенировать небольшой участок аминокислотной последовательности в очищенном белке.
Модификация метода секвенирования ДНК, представленная на рис. 4-66 и 4-67, может быть использована для выявления в ДНК
последовательностей, опознаваемых ДНК-связывающими белками. Связывание этих белков с регуляторными участками ДНК (которые обычно
локализованы вне кодирующих участков генов), по-видимому, играет важную роль в определении того - какие именно гены активны в данном типе
клеток. Понимание функции этих белков чрезвычайно важно для идентификации специфических последовательностей, с которыми они
связываются. Для выявления таких последовательностей обычно используют метод, именуемый ДНК-футпринтинг. Сперва очищенный фрагмент
ДНК метят по одному концу
32
Р и затем расщепляют с помощью нуклеазы или химического соединения, делающего случайные разрезы в двойной
спирали ДНК. Фрагменты, которые образуются из меченой цепи, разделяют на геле и выявляют на радиоавтографе; после этого сравнивают
расположение полос ДНК, образуемых в присутствии и в отсутствие ДНК-связывающих белков. Если связывание произошло, нуклеотиды в сайте
расщепления оказываются защищен-
Рис. 4-67. Химический метод секвенирования ДНК. Процедура, описанная на рис. 4-66, выполняется одновременно для четырех одинаковых проб
ДНК. При этом используют химические агенты, расщепляющие ДНК в первом случае по Т, во втором по С, в третьем по G и четвертом по А.
Полученные образцы подвергают электрофорезу на параллельных дорожках одного геля, как это указано на рис. 4-64,
А. Анализируя результаты
электрофореза, можно определить последовательность ДНК. Так, первая снизу полоса соответствует нуклеотиду, расположенному на 5'-конце. При
этом определяют, на какой из дорожек расположена полоса, - в данном случае это Т. Для определения полной последовательности эту же
процедуру выполняют на уровне второй, затем третьей полосы и так далее. В данном случае метод идеализирован; на самом деле химическая
обработка менее специфична, чем указано здесь.

236
Молекулы, оканчивающиеся каждым из дидезоксирибонуклеотидов, выявляют в виде окрашенных полос по соответствующим окрашенным
затравкам. Таким образом можно прямо прочесть последовательность цепи комплементарной ДНК по мере прохождения детектором полос А
Рис. 4-68. Метод секвенирования нуклеиновых кислот, основанный на энзиматическом введении нуклеотида, терминирующего цепь. Ключевым
для этого метода является использование дидезоксирибонуклеозидтрифосфатов, в которых дезоксирибоза-3'-ОН, представленная в нормальных
нуклеотидах, в данном случае отсутствует; внедряясь в цепь ДНК, такой модифицированный нуклеозид блокирует присоединение следующего
нуклеозида. А. Синтез in vitro молекулы ДНК в присутствии затравки, а также небольшого количества одного из таких модифицированных
нуклеозидов приводит к образованию «лесенки» фрагментов ДНК, представленных на рис. 4-66. Если для получения таких фрагментов применяют
радиоактивную ДНК, проводят четыре различные реакции синтеза, каждая из которых использует различные нуклеозиды, терминирующие цепь, а
электрофоретический анализ проводят на четырех параллельных дорожках геля, можно определить последовательность нуклеотидов в ДНК (см.
рис. 4-67, а также рис. 4-64, А). Б. Более современная модификация метода, в которой четыре набора фрагментов, меченные различным образом,
автоматически анализируются по флуоресценции в процессе движения по одной дорожке геля.

237
Рис. 4-69. Метод футпринтирования ДНК. А. Белок плотно связывается со специфическим участком ДНК из восьми нуклеотидов и защищает его от
расщепляющего агента. Если реакция выполняется без белка, связывающегося с ДНК, на геле проявится полный набор полос (не указано). Б.
Реальный футпринт, использованный для определения участка связывания для белка человека, стимулирующего транскрипцию некоторых генов
эукариот. Из результатов следует, что данный сайт расположен за 60 нуклеотидов до сайта инициации синтеза РНК. В качестве расщепляющего
агента использовали низкомолекулярное железосодержащее органическое вещество. Это вещество в норме расщепляет каждую из
фосфодиэфирных связей практически с равной частотой. (Б - с разрешения Michelle Savadogo, Robert Roeder.)
ными от действия нуклеазы. В результате меченые фрагменты, содержащие участок нуклеазы. В результате меченые фрагменты, содержащие
участок связывания, отсутствуют, и на геле возникает промежуток, не содержащий фрагментов ДНК, именуемый «футпринт», или «отпечаток
ноги» (рис. 4-69, А). На рис. 4-69, Б представлен футпринт белков, активируют их транскрипцию эукариот.
4.6.7. Реакция гибридизации нуклеиновых кислот - чувствительный метод выявления специфических
последовательностей нуклеотидов [43]
Если водный раствор ДНК нагреть до 100°С и сильно защелочить (рН 13), то комплементарные пары оснований, удерживающие две цепи
двойной спирали вместе, разрушатся и ДНК быстро диссоциирует на две

238
цепи. Этот процесс, называемый денатурацией ДНК, ранее считала необратимым. Однако в 1961 году было обнаружено, что если
комплементарные цепи ДНК выдержать при температуре 65 °С, они легко спариваются, восстанавливая структуру двойной спирали (процесс,
получивший название ренатурации или гибридизации). Подобные процессы гибридизации могут происходить между двумя любыми одинарными
цепями нуклеиновых кислот (ДНК—ДНК, РНК—РНК, ДНК—РНК; при условии, что они содержат комплементарные последовательности
нуклеотидов.
Скорость формирования двойной спирали лимитируется вероятностью столкновения двух комплементарных последовательностей
нуклеиновых кислот, что в свою очередь определяется их концентрацией в растворе. Скорость гибридизации может быть использована для
определения концентрации любых последовательностей РНК или ДНК в смеси, содержащей и другие последовательности нуклеиновых кислот.
Для этого теста необходимо иметь чистый одноцепочечный фрагмент ДНК, комплементарный к той последовательности, которую нужно
обнаружить. Этот фрагмент ДНК можно получить клонированием, а если последовательность короткая, ее можно синтезировать химическими
методами. В любом случае фрагмент ДНК интенсивно метят
32
Р (см. рис. 4-65) с тем, чтобы можно было следить за включением этой молекулы в
состав дуплексов в процессе реакции гибридизации, Одноцепочечная молекула ДНК, используемая здесь в качестве индикатора, называется ДНК-
зонд; она может содержать от 15 до 1000 нуклеотидов.
Реакция гибридизации с использованием ДНК-зондов настолько чувствительна и избирательна, что с ее помощью можно
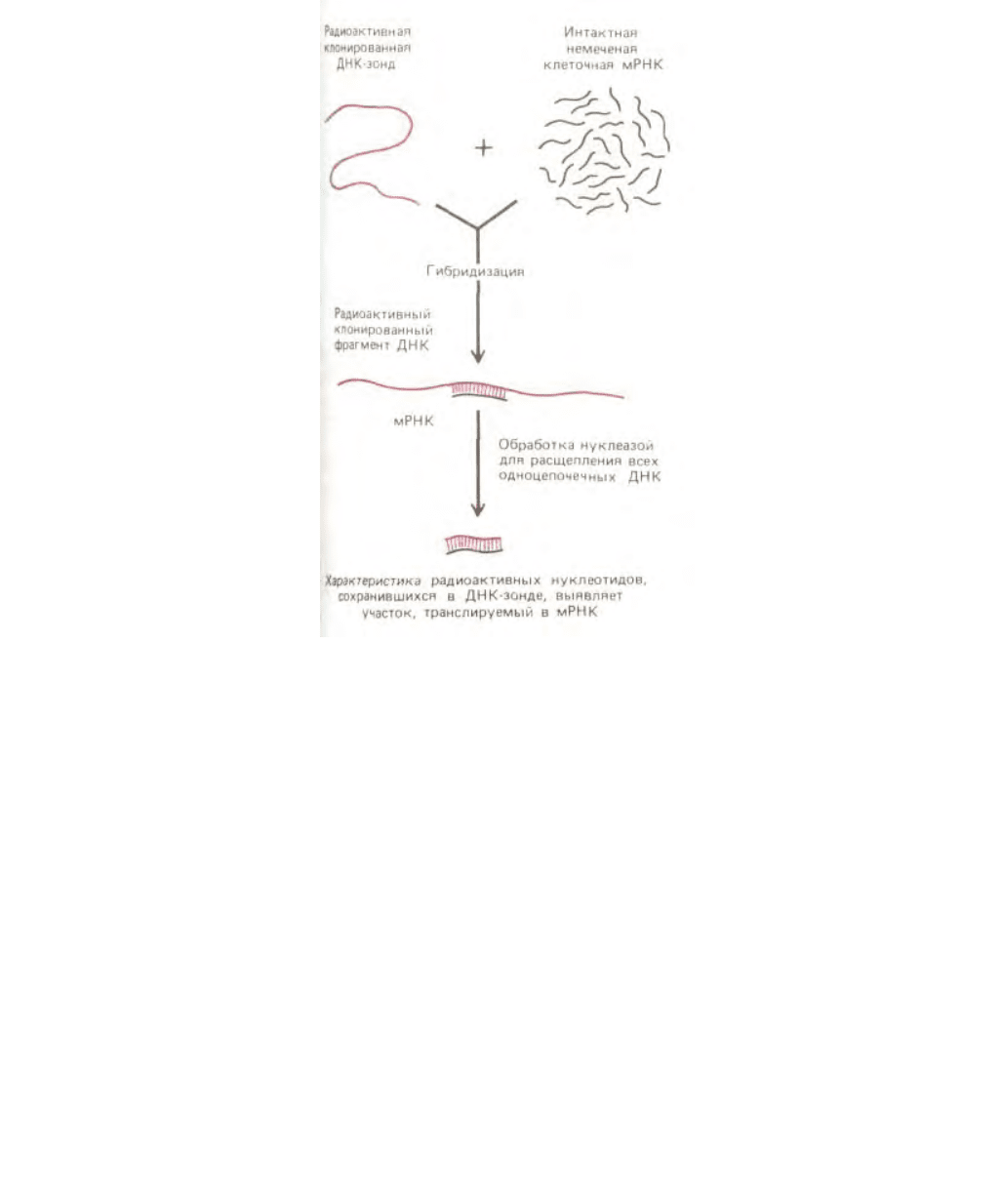
идентифицировать последовательности, присутствующие в концентрации 1 молекула на клетку (рис. 4-70). Это позволяет определить, какое
количество копий последовательности ДНК, комплементарной ДНК-зонду, присутствует в геноме клетки. Этот же метод весьма эффективен для
поиска неидентичных, но родственных генов; например, после клонирования интересующих исследователя генов мыши или курицы, их
последовательности могут быть использованы для поиска соответствующих генов в геноме человека.
ДНК-зонды применяют и в реакциях гибридизации с РНК до выявления экспрессии данного гена в клетках. В этом случае ДНК-зонд,
содержащий часть последовательности гена, пытаются гибридизовать с РНК, выделенной из анализируемой клетки. Если гибридизация
происходит, проводят количественное определение экспрессии. Более усовершенствованные методики предполагают обработку ДНК-зонда
специфическими нуклеазами для обнаружения участков, гибридизующих с клеточной РНК. Таким образом можно определить начальные и
концевые участки транскриптов РНК (рис. 4-71); этот же метод может быть полезен для выяснения точных границ участков, вырезаемых из
транскриптов РНК в процессе сплайсинга РНК.
В процессе развития эмбриона происходит включение и выключение больших групп генов и этот процесс скоординирован. Гибридизация
ДНК-зонда с клеточными РНК позволяет ответить на вопрос, работает или молчит определенный ген; более того, при изменении уровня экспрессии
гена можно узнать, зависит ли это изменение от контроля,
Рис. 4-70. Измерение количества копий определенного гена в образце ДНК с помощью гибридизации ДНК. Одноцепочечный радиоактивный
фрагмент ДНК, используемый в таких экспериментах, называют ДНК-зондом. Хромосомная ДНК в данном случае не содержит радиоактивных
атомов.
239
Рис. 4-71. Использование гибридизации нуклеиновых кислот для определения участка клонированного фрагмента ДНК, который транскрибируется
в мРНК. Данный метод предполагает обработку нуклеазой, расщепляющей цепи ДНК, не спаренные с комплементарной цепью РНК. Этот метод
позволяет точно выявлять начало и конец молекулы РНК. Аналогичные процедуры эффективны и для определения расположения нитронов
(некодирующих последовательностей эукариотических генов).
действующего на уровне транскрипции ДНК, сплайсинга РНК или же трансляции зрелых молекул мРНК в белок. Методы гибридизации в
современной клеточной биологии используются настолько широко, что даже трудно представить, как можно было бы без них изучать структуру
генов и их экспрессию.
4.6.8. Методы Нозерн- и Саузерн-блоттинга позволяют гибридизовать молекулы нуклеиновых кислот,
предварительно фракционированные с помощью электрофореза [44]
Для выявления молекул нуклеиновых кислот, последовательность которых комплементарна всему зонду или его участку, ДНК-зонды
часто используются в сочетании с гель-электрофорезом. Множество различных молекул РНК и ДНК, содержащихся в смеси, фракционируют
электрофорезом согласно размеру и после этого проводят реакцию гибридизации; если проба метит молекулы одного или нескольких размеров,
можно быть уверенным, что гибридизация достаточно специфична. В некоторых случаях очень ценной является информация даже о размере
гибридизуемых молекул ДНК. Это будет проиллюстрировано следующим примером.
Допустим, что перед исследователем стоит задача определить природу дефекта у мутантной мыши, синтезирующей аномально низкое
количество альбумина (белка, который в норме секретируется в кровь клетками печени в значительных количествах). Для этого прежде всего
необходимо взять образцы ткани печени у дефектных и нормальных мышей (последние служат в качестве контролей) и обработать клетки сильным
детергентом для инактивации клеточных нуклеаз, которые в противном случае могут разрушить нуклеиновые кислоты. Затем отделяют РНК и ДНК
от всех других компонентов клетки: присутствующие белки при этом полностью денатурируются, их удаляют последовательной экстракцией
фенолом - мощным органическим растворителем. Нуклеиновые кислоты остаются в водной фазе. Чтобы их отделить от низкомолекулярных
клеточных соединений, проводят осаждение спиртом. После этого ДНК отделяют от РНК, пользуясь их различной растворимостью в спиртах и
обрабатывают высокоспецифическими ферментами (соответственно РНКазой или ДНКазой), чтобы освободиться от нежелательных примесей
нуклеиновых кислот.
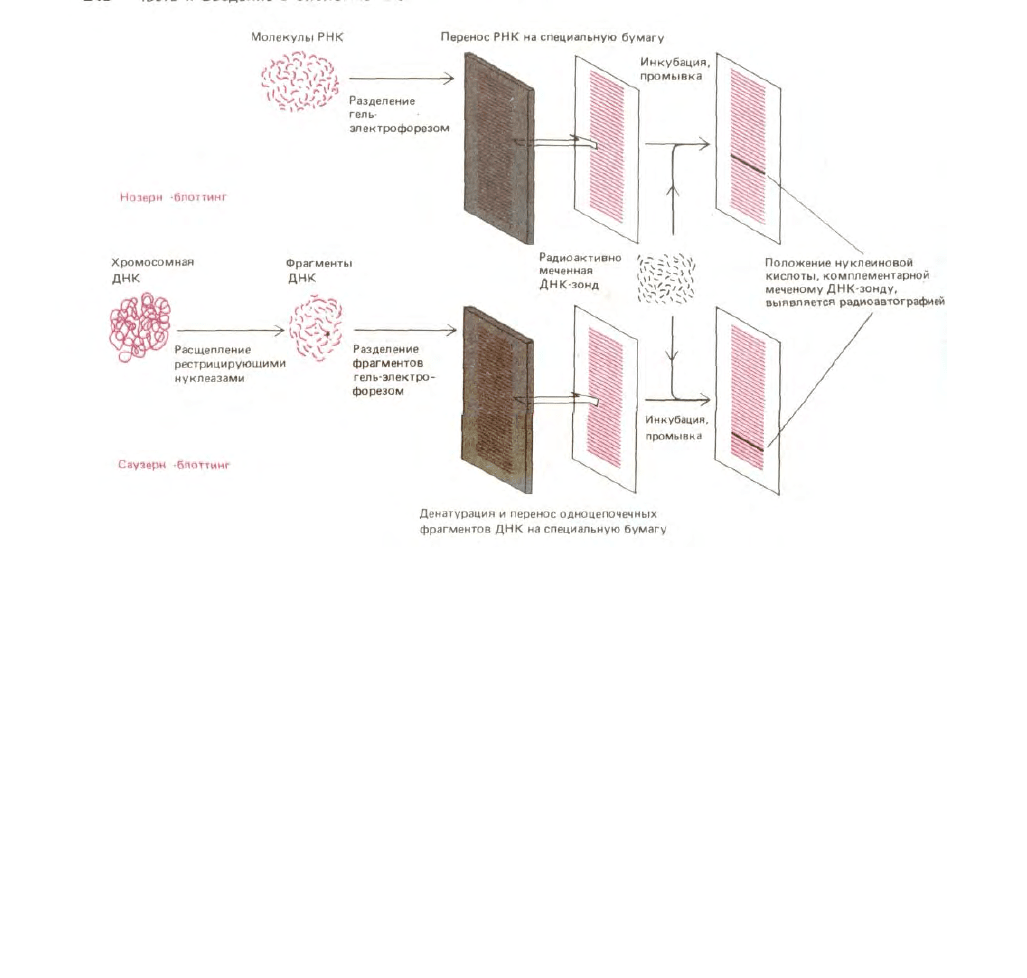
Для анализа РНК, кодирующих альбумин, с помощью ДНК-зонда используется метод Нозерн-блоттинга. На первом этапе с помощью
гель-электрофореза, фракционируют интактные молекулы РНК дефектных и контрольных клеток печени и получают набор полос. Для того чтобы
молекулы РНК, содержащиеся в геле, сделать более доступными ДНК-зонду, осуществляют перенос (блоттинг) фракционированных молекул РНК
из геля на лист нитроцеллюлозы. На следующем этапе лист нитроцеллюлозы инкубируют с раствором, содержащим меченый ДНК-зонд. Полосы
РНК, гибридизующиеся с зондом, выявляют методом радиоавтографии (рис. 4-72). Известно, что скорость движения молекул нуклеиновых кислот в
геле зависит от их размера: при электрофорезе малые молекулы перемещаются быстрее, чем большие. Сравнивая
240
Рис. 4-72. Методы «Нозерн»- и «Саузерн»-блоттинга. После электрофоретического фракционирования смеси молекул ДНК или РНК в агарозном
геле проводят перенос различных фрагментов нуклеиновых кислот на лист нитроцеллюлозы или найлона («блоттинг»). Этот лист затем
инкубируют с радиоактивным ДНК-зондом в течение длительного времени в условиях, способствующих гибридизации. Затем лист тщательно
промывают, так что радиоактивно меченными оказываются лишь те фрагменты, которые гибридизуются с ДНК-зондом. На радиоавтографе,
полученном с листа нитроцеллюлозы, эти фрагменты выявляются в виде полос.
cкорость миграции молекул интересующего нас образца и молекул РНК известного размера (стандарты РНК), можно определить размеры каждой
молекулы, связывающей зонд. При этом может оказаться, что клетки печени дефектных мышей синтезируют РНК альбумина в нормальных
количествах и размер этих молекул соответствует норме. Если бы это было не так, выявлялось бы уменьшенное количество молекул РНК
нормального альбумина. Возможен также вариант, когда молекулы РНК из дефектных клеток печени окажутся укороченными и вследствие этого
будут перемещаться в геле быстрее, чем в норме. В этом последнем случае блот, содержащий дефектные молекулы РНК, можно подвергнуть
повторной гибридизации с более чувствительными ДНК-зондами для выявления утраченных участков.
Для анализа структуры гена альбумина дефектных мышей был использован метод Саузерн-блоттинга. В данном случае вместо РНК
анализируется ДНК. Изолированную ДНК сначала обрабатывают рестрицирующими нуклеазами, затем полученные фрагменты разделяют по
размеру гель-электрофорезом и выявляют комплементарные ДНК-зонду альбумина с помощью переноса и гибридизации, как это описано для РНК
(см. рис. 4-72). Повторяя эту процедуру с различными рестрицирующими нуклеазами, можно получить детальную рестрикционную карту генома в
участке альбуминового гена (см. разд. 4.6.2). Анализируя эту карту, можно ответить на вопрос, несет ли альбуминовый ген у дефектных животных
перестройки, например, делеции или инсерции коротких фрагментов ДНК.
4.6.9. Искусственные ДНК-зонды позволяют проводить дородовую диагностику наследственных болезней [45]
Пока микробиологи разрабатывали методы клонирования ДНК, химики-органики усовершенствовали методы синтеза коротких
фрагментов
