Албертс Б., Брей Д. и др. Молекулярная биология клетки. Том 1
Подождите немного. Документ загружается.

261
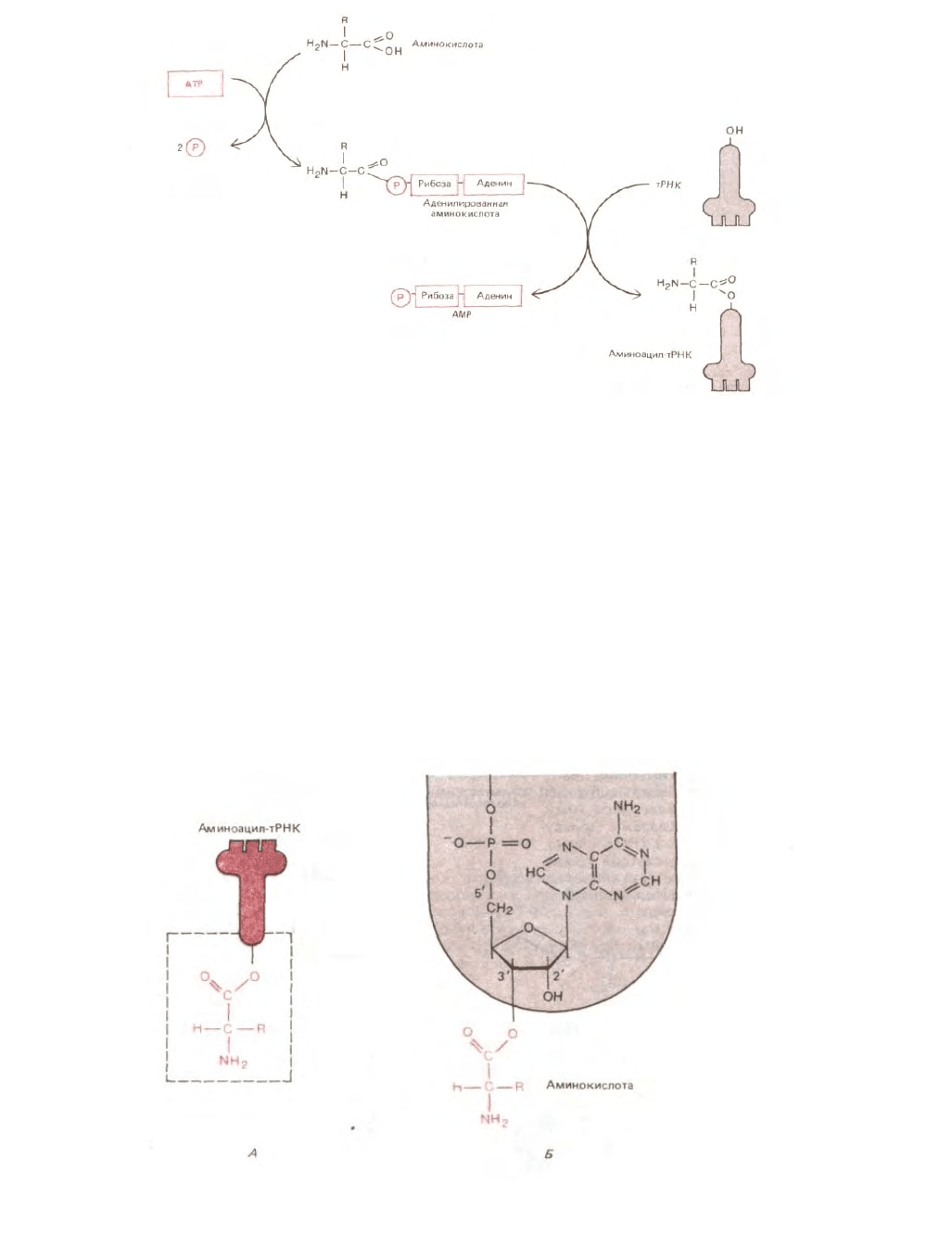
Рис. 5-10. Двухэтапный процесс, в котором аминокислота под действием аминоацил-тРНК-синтетазы переводится в
активированную форму, вовлекаемую в синтез белка. Для присоединения каждой аминокислоты к соответствующей молекуле
тРНК используется, как здесь показано, энергия гидролиза АТР, поскольку возникающая связь принадлежит к числу богатых
энергией. Сначала аминокислота активируется путем связывания ее карбоксильной группы непосредственно с AMP, т. е.
образуется аденилированная аминокислота; источником энергии для реакции аденилирования, в обычных условиях невыгодной в
термодинамическом смысле, служит гидролиз АТР (играющего роль донора AMP). Оставаясь связанной с аминоацил-тРНК-
синтетазой, аденилированная карбоксильная группа аминокислоты переносится затем на гидроксильную группу аминокислоты
остатка сахара, находящуюся на 3'-конце молекулы тРНК. В результате этого переноса образуется молекула аминоацил-тРНК, в
которой аминокислота присоединена к тРНК активированной сложноэфирной связью.
торных молекул каждая аминокислота может быть отождествлена с определенной последовательностью из трех нуклеотидов в молекуле мРНК,
иными словами, со своим кодовом (рис. 5-12).
5-6
5.1.5. Аминокислоты присоединяются к карбоксильному концу растущей полипептидной цепи
Основная реакция в синтезе белка - это реакция, приводящая к образованию пептидной связи между карбоксильной группой на конце
растущей полипептидной цепи и свободной аминогруппой аминокислоты. Белковая цепь синтезируется, следовательно, путем ее постепенного
наращивания от аминного конца к карбоксильному. На протяжении всего процесса растущий карбоксильный конец полипептидной цепи остается
Рис. 5-11. Связь между аминокислотой и тРНК. Карбоксильная группа аминокислоты присоединена сложноэфирной связью к рибозе. Поскольку
гидролитический разрыв этой сложноэфирной связи сопровождается термодинамически выгодным изменением свободной энергии, аминокислота,
удерживаемая подобной связью, активирована. А, Схематическое изображение. Б. Реальная структура области, выделенной в левой части рисунка в
рамку. R в аминокислотной части молекулы, как и на рис. 5-10, означает одну из 20 возможных боковых цепей.
262
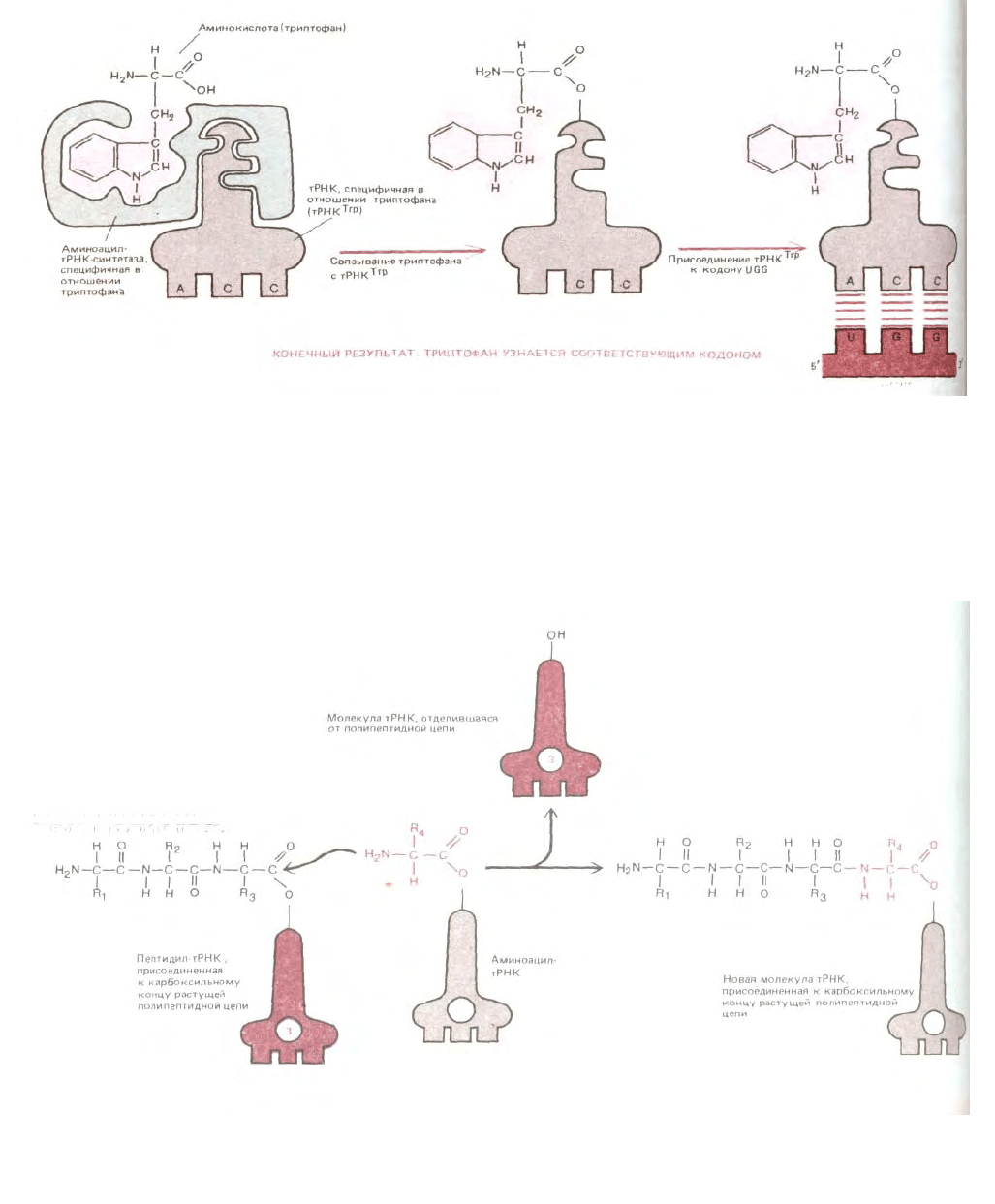
Рис. 5-12. Схема, показывающая, как осуществляется трансляция генетического кода при помощи двух совместно действующих «адапторов»:
одним из них является фермент аминоацил-тРНК-синтетаза, присоединяющий данную аминокислоту к соответствующей тРНК, а вторым -
молекула тРНК, которая связывается затем с надлежащей нуклеотидной последовательностью в мРНК.
в активированном состоянии, будучи связан ковалентной связью с тРНК (в молекуле пептидил-тРНК). В каждом цикле синтеза происходит разрыв
этой ковалентной связи, однако она тут же замещается точно такой же связью, образуемой следующей присоединенной к цепи аминокислотой (рис.
5-13). Таким образом, в процессе синтеза белка каждая добавляемая аминокислота несет с собой энергию активации, необходимую не для ее
собственного присоединения, а для присоединения следующей аминокислоты. Это один из примеров «роста с головы», описанного в гл. 2 (рис. 2-
34).
Рис. 5-13. Полипептидная цепь растет путем последовательного добавления новых аминокислот к ее карбоксильному концу. Образование каждой
пептидной связи в энергетическом смысле выгодно, так как растущий карбоксильный конец цепи активирован благодаря тому, что он ковалентно
связан с молекулой тРНК. Пептидил-тРНК-связь, поддерживающая растущий конец полипептидной цепи в активированном состоянии,
восстанавливается заново в каждом цикле.

263
5-3
5.1.6. Генетический код вырожден [5]
В процессе синтеза белка нуклеотидная последовательность мРНК считывается группами по три нуклеотида, по мере того как
считывающий «аппарат» перемещается вдоль молекулы мРНК в направлении 5' → 3'. Каждая аминокислота соответствует определенному триплету
нуклеотидов (кодону) в молекуле мРНК, который спаривается с последовательностью из трех комплементарных нуклеотидов в антикодоновой
петле определенной молекулы тРНК. Поскольку спариваться с данным кодовом способен только один из многих различных видов молекул
клеточной тРНК, выбор аминокислоты, присоединяемой в каждый данный момент к растущему концу полипептидной цепи, определяется кодовом
(рис. 5-14).
Число возможных сочетаний трех нуклеотидов четырех типов равно 64 (4 х 4 х 4). Большинство этих сочетаний действительно
встречается почти во всех молекулах мРНК. Три кодона из шестидесяти четырех не кодируют никаких аминокислот; эти кодоны определяют собой
прекращение (терминацию) синтеза полипептидной цепи, и потому их называют стоп-кодонами или терминирующими кодонами. Остается, таким
образом, 61 кодон, тогда как число различных встречающихся в белках аминокислот равно только 20. Отсюда следует, что большая часть
аминокислот представлена более чем одним кодоном. Поэтому генетический код называют вырожденным. Для двух аминокислот, метионина и
триптофана, имеется лишь по одному кодону; именно эти аминокислоты встречаются в белках реже всего.
Вырожденность генетического кода можно истолковывать двояко: 1) для каждой аминокислоты имеется более одной тРНК и 2) каждая
молекула тРНК может спариваться более чем с одним кодоном. В действительности справедливо и то и другое. Для некоторых аминокислот
существует более одной тРНК. Кроме того, некоторые тРНК таковы, что требуют точного спаривания только по первым двум положениям кодона;
в третьем же положении допускается и неверное спаривание (так называемое неоднозначное соответствие). Этим объясняется, почему многие
альтернативные кодоны аминокислот различаются лишь по своему третьему нуклеотиду (рис. 5-15). Спаривание при неоднозначном соответствии
позволяет «привязать» 20 аминокислот к 61 кодону при наличии всего 31 вида тРНК; в митохондриях животных неоднозначное соответствие
выражено еще более резко и здесь для синтеза белка оказывается достаточно 22 видов тРНК (см. разд. 7.5.5).
Рис. 5-14. Выбор каждой аминокислоты, добавляемой к растущему концу полипептидной цепи, определяется комплементарным спариванием
оснований между антикодоном присоединившей аминокислоту тРНК и очередным кодоном цепи мРНК.
Рис. 5-15. Генетический код. Под трехбуквенным обозначением каждой аминокислоты дано общепринятое однобуквенное обозначение. При таком
изображении кодонов 5'-концевой нуклеотид находится слева. Отметим, что почти все аминокислоты представлены более чем одним кодоном и что
изменения затрагивают в основном третий кодон (см. также рис. 3-15).
264
5.1.7. Реакции синтеза белка протекают на рибосомах [6]
Для осуществления реакций белкового синтеза, которые мы только что описали, требуется сложный каталитический аппарат. Растущий
конец полипептидной цепи должен, например, определенным образом подстраиваться к молекуле мРНК, для того чтобы каждый последующий
кодон мРНК мог точно соединиться с антикодоном тРНК, не проскочив ни на один нуклеотид, ибо это привело бы к сдвигу рамки считывания (см.
разд. 3.2.8). Эти и другие этапы белкового синтеза осуществляются рибосомами - крупными комплексами, состоящими из молекул белков и РНК.
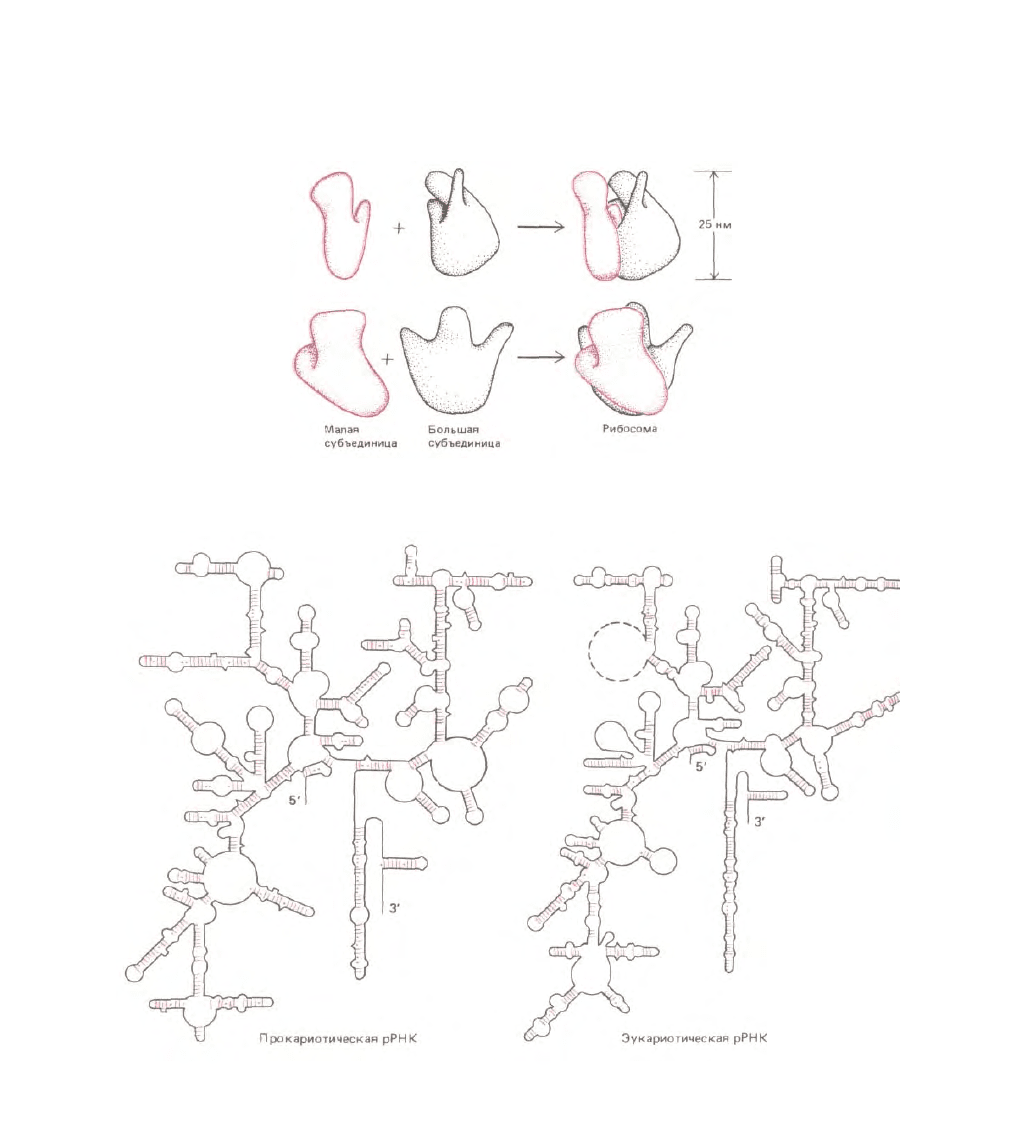
Рибосомы эукариот и прокариот очень сходны по своей структуре и функции. Каждая из них состоит из двух субъединиц - большой и малой,
образующих в совокупности комплекс с массой в
Рис. 5-16. Трехмерная модель бактериальной рибосомы (вид с двух разных сторон). Положение многих рибосомных белков в этой структуре
выявлено с помощью электронного микроскопа, позволяющего обнаружить места прикрепления специфических антител, а также по рассеянию
нейтронов от рибосом, содержащих один или несколько дейтерированных белков. (По J. A. Lake, Ann. Rev. Biochem., 54, 507-530, 1985.)
Рис. 5-17. Сложное расположение петель и спаренных прямых участков в трехмерной структуре 16S-pPHK E. coli ( А) и 18S-рРНК дрожжей (S.
cerevisiae) ( Б). В главных чертах такое строение характерно для всех видов рРНК, подобных 16S-pPHK, в том числе и для рРНК архебактерий.
Точки обозначают постулированные слабые взаимодействия между основаниями, например в парах G-U. (По R. R. Gutell, В. Weiser, С. R. Woese, Н.
F. Noller, Prog. Nucleic Acid Res. Моl. Biol., 32, 155-216, 1985.)
265
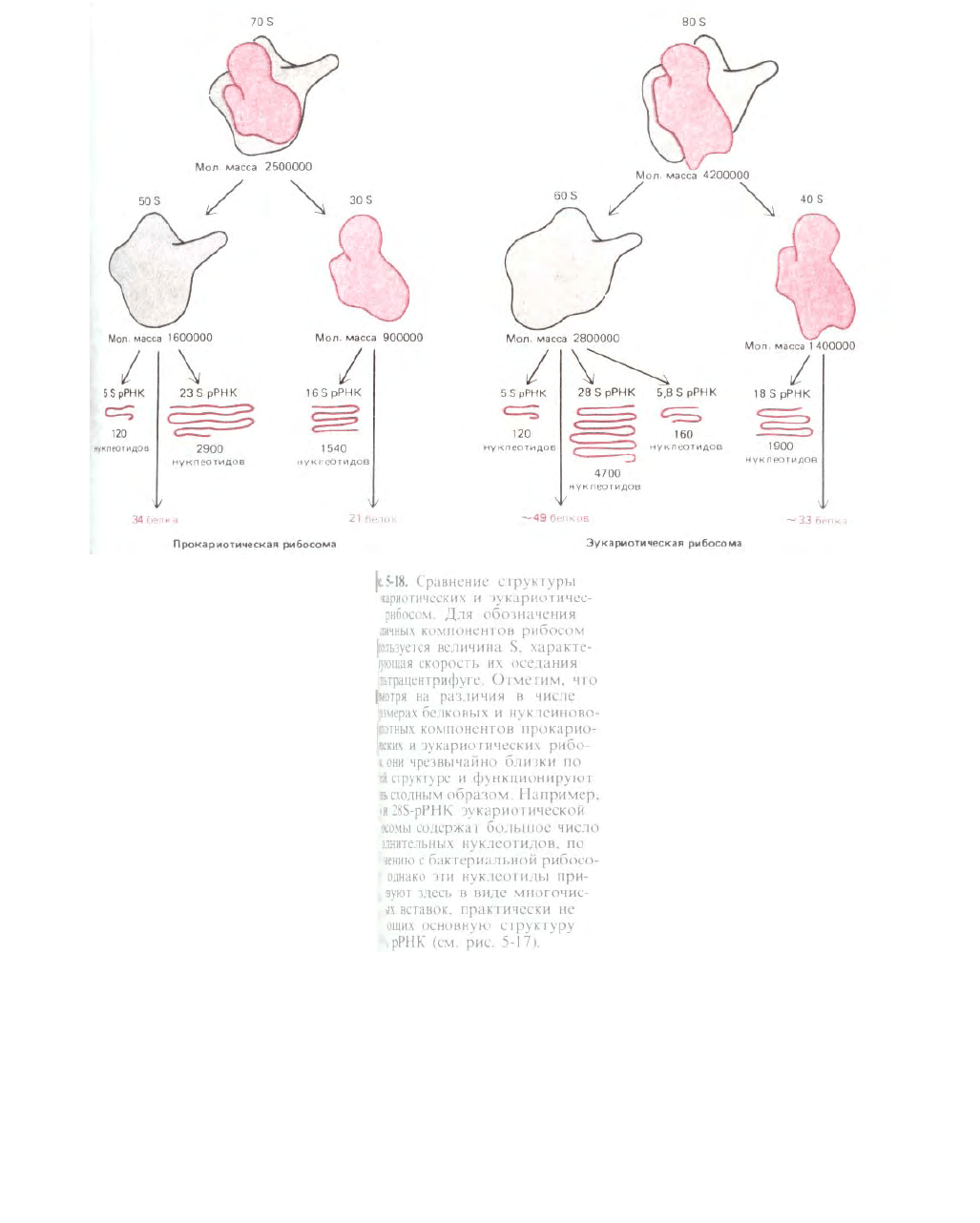
Рис. 5-18
несколько миллионов дальтон (рис. 5-16). Малая субъединица удерживает мРНК и тРНК, а большая катализирует образование пептидной связи.
Более половины массы рибосомы составляет РНК, и накапливается все больше данных, указывающих, что именно рибосомная РНК
(рРНК) играет ключевую роль в каталитической активности рибосомы. Размеры молекул рРНК в малой рибосомной субъединице у разных
организмов варьируют, но сложная ее структура остается весьма постоянной (рис. 5-17); между молекулами рРНК больших рибосомных
субъединиц также выявляется у разных организмов высокая степень гомологии. В состав рибосомы входит значительное число белков (рис. 5-18),
но их аминокислотные последовательности на протяжении эволюции довольно сильно менялись. Удивление вызывает тот факт, что многие из этих
белков для функционирования рибосом, по-видимому, не являются необходимыми. Можно предположить (ниже мы останавливаемся на этом
подробнее; см. разд. 5.1.16), что рибосомные белки нужны в основном для усиления функции рРНК и что не белковые молекулы, а молекулы РНК
катализируют многие из реакций, протекающих на рибосомах.
5.1.8. Рибосома продвигается шаг за шагом вдоль цепи мРНК [6, 7]
В рибосоме имеются три различных участка, с которыми связывается РНК, - один для мРНК и два для тРНК. Из двух последних один
участок удерживает молекулу тРНК, присоединенную к растущему концу полипептидной цепи (поэтому его называют пептидил-тРНК-
связывающим участком или Р-участком), а второй служит для удержания только
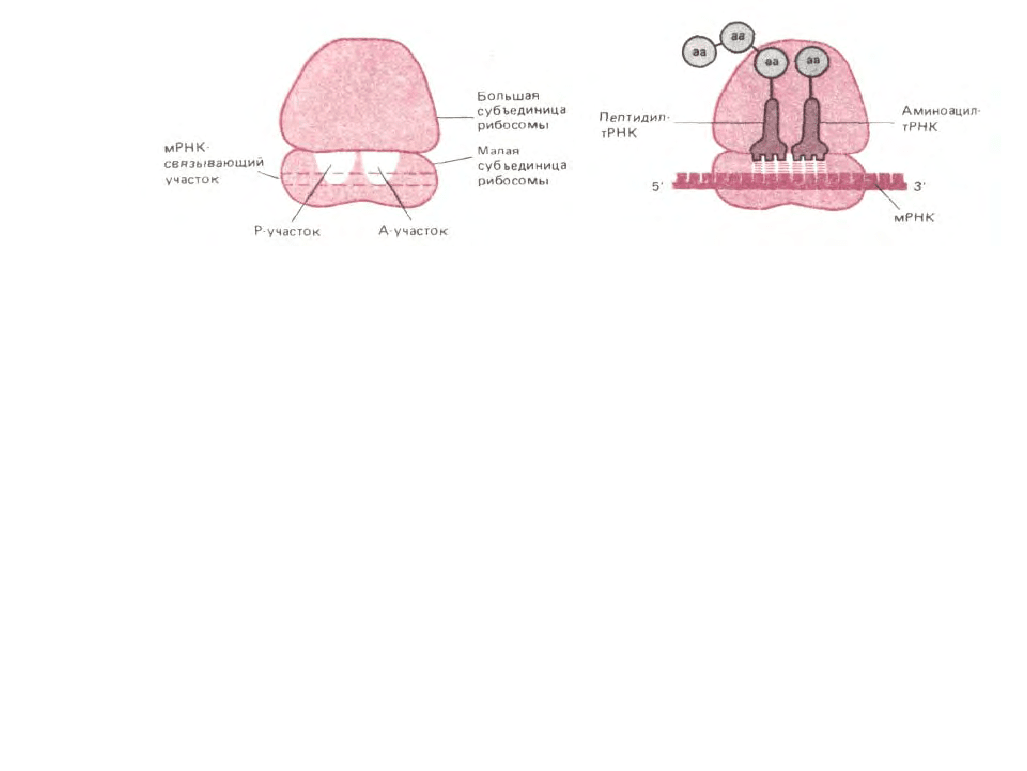
266
Рис. 5-19. Три главных участка связывания, в которых молекулы РНК присоединяются к рибосоме. Слева представлена ненагруженная рибосома,
справа - нагруженная. На этом рисунке так же, как и на трех следующих, рибосомы изображены схематично, более точное представление об их
форме дают рис. 5-16 к 5-23.
что прибывшей молекулы тРНК, нагруженной аминокислотой; называют аминоацил-тРНК-связывающим участком или А-участком. К обоим
участкам молекула тРНК прочно прикрепляется лишь в случае, если ее антикодон спаривается с комплементарным ему ко, мРНК. А- и Р-участки
располагаются очень близко друг к другу, так что две связанные с ними молекулы тРНК спариваются с двумя coceдними кодонами в молекуле
мРНК (рис. 5-19).
Процесс наращивания (элонгации) полипептидной цепи на рибосомах может рассматриваться как цикл, слагающийся из трех отдельных
этапов (рис. 5-20). На первом этапе молекула аминоацил-тРНК связывается со свободным участком рибосомы, примыкающим к занятому Р-
участку. Связывание осуществляется путем спаривания нуклеотидов антикодона с тремя нуклеотидами мРНК, находящимися в А-участке На
втором этапе карбоксильный конец полипептидной цепи отделяется в Р-участке от молекулы тРНК и образует пептидную связь с аминокислотой,
присоединенной к молекуле тРНК в А-участке. Эта реакция катализируется пептидилтрансферазой - ферментом, активность которой зависит от
целостности рибосомы, а также, как полагают, от участка некоторой специфической области в главной молекуле рРНК большой субъединицы
рибосомы. На третьем этапе новая пептидил-тРНК переносится в Р-участок рибосомы, в то время как рибосома продвигается вдоль молекулы
мРНК ровно на три нуклеотида. Этот этап требует затраты энергии; движущей силой служит для него ряд конформационных изменений,
индуцируемых в одном из компонентов рибосом гидролизом связанной с ним молекулы GTP (см. разд. 3.4.11).
Процесс транслокации, составляющий третий этап, включает в себя и возвращение свободной молекулы тРНК, отделившейся от
полипептидной цепи в Р-участке во время второго этапа, в цитоплазматический пул тРНК. Поэтому после завершения третьего этапа незаняты А-
участок может принять новую молекулу тРНК, нагруженную очередной аминокислотой, т. е. цикл может начаться снова. В бактериальной клетке
продолжительность одного цикла элонгации полипептидной составляет при оптимальных условиях около 1/20 с, так что синтез среднего по
размерам белка, состоящего из 400 аминокислот, занимает приблизительно 20 с. Рибосомы продвигаются вдоль молекулы мРНК в направлении 5'
→ 3', т. е. в том же направлении, в каком идет синтез РНК (см. рис. 5-2).
В большей части клеток синтез белка - самый энергоемкий из всех биосинтетических процессов. Образование каждой новой пептидной
связи сопровождается расщеплением по меньшей мере четырех высоко энергетических фосфатных связей. Две из них расходуются на то, чтобы
нагрузить аминокислотой молекулу тРНК (см. рис. 5-10), а две - на сам синтез в цикле реакций, протекающих на рибосоме: при связывании
аминоацил-тРНК на первом этапе цикла и при транслокации рибосомы на третьем этапе.

267
Рис. 5-20. Фаза элонгации в синтезе белка, протекающая на рибосоме. Представленный здесь трехэтапный цикл многократно повторяется во время
синтеза белковой цепи. На первом этапе молекула аминоацил-тРНК присоединяется к А-участку рибосомы, второй этап характеризуется
образованием новой пептидной связи, на третьем этапе рибосома продвигается вдоль цепи мРНК на расстояние, соответствующее трем
нуклеотидам, высвобождая предыдущую молекулу тРНК, т.е. устанавливается в таком положении, чтобы цикл мог повториться сначала.
5-5
5-8
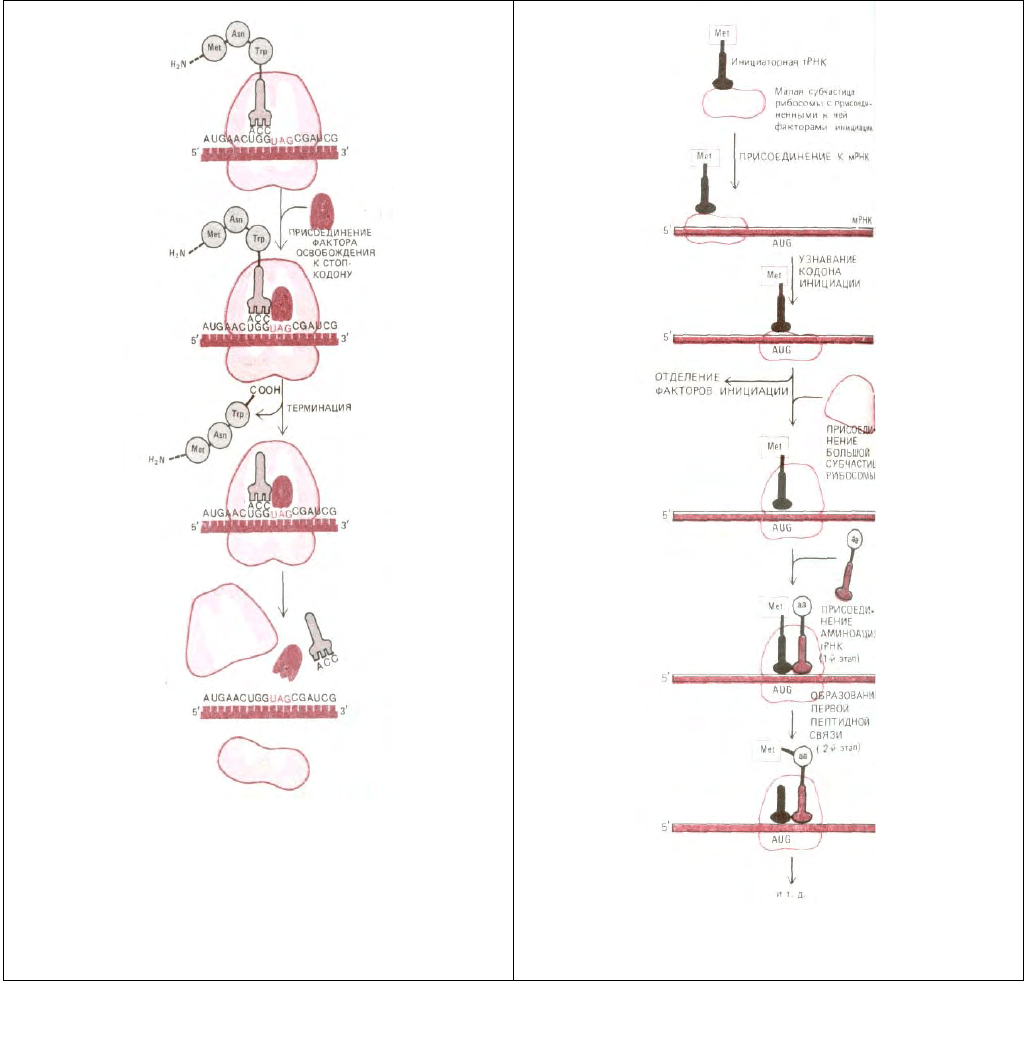
5.1.9. Белковая цепь отделяется от рибосомы, как только она достигает одного из трех терминирующих кодонов [6,
8]
Из 64 возможных кодонов мРНК три, а именно UAA, UAG и UGA, являются терминирующими или стоп-кодонами: они останавливают
трансляцию. Особые цитоплазматические белки, называемые факторами освобождения, непосредственно связываются с любым стоп-кодоном,
достигшим А-участка рибосомы. Это связывание изменяет активность пептидилтрансферазы. Фермент с измененной активностью присоединяет
теперь к пептидил-тРНК не аминокислоту, а молекулу воды. Вследствие этого карбоксильный конец растущей полипептидной цепи отделяется от
молекулы тРНК. А поскольку растущий полипептид удерживается на рибосоме только посредством его связи с молекулой тРНК, завершенная
белковая цепь оказывается свободной и, отделившись от рибосомы, немедленно поступает в цитоплазму (рис. 5-21). После этого рибосома
освобождает мРНК и распадается на две субъединицы; эти субъединицы могут затем объединиться на другой молекуле мРНК и начать новый цикл
белкового синтеза посредством процесса, который мы опишем ниже.
5-4
5.1.10. Рамка считывания матрицы устанавливается в момент инициации синтеза полипептидной цепи [6, 9]
Теоретически нуклеотидная последовательность РНК может быть декодирована с помощью любой из трех различных рамок считывания,
причем образующиеся полипептидные цепи будут в этих трех случаях совершенно разными (см. рис. 3-14). Как в действительности пойдет
считывание, определяется в тот момент, когда рибосома соединяется с молекулой мРНК. В фазе инициации белкового синтеза сборка рибосомы из
двух ее субчастиц на молекуле мРНК происходит в том самом месте, с которого должен начаться синтез полипептидной цепи.
Процесс инициации сложен. Он слагается из ряда этапов, катализируемых белками, которые носят название факторов инициации (IF);
многие из них сами состоят из нескольких полипептидных цепей. В силу этой сложности инициации многие ее детали до сих пор не вполне
выяснены. Известно, однако, что сборка каждой рибосомы на цепи мРНК проходит в два этапа: сначала нагруженная факторами инициации малая
субъединица рибосомы находит на мРНК старт-кодон, а затем к ней присоединяется большая субъединица.
Прежде чем рибосома может начать синтез новой полипептидной цепи, к ее Р-участку, обычно удерживающему пептидил-тРНК, должна
присоединиться молекула аминоацил-тРНК (рис. 5-22). Для этого требуется особая молекула тРНК, называемая инициаторной тРНК.
Инициаторная тРНК поставляет аминокислоту, с которой должен начаться синтез полипептидной цепи. Роль этой аминокислоты всегда играет
метионин или (у прокариот) его аминоформилированное произ-
268
Рис. 5.21. Последняя фаза синтеза белка. Присоединение фактора
освобождения к стоп-кодону прекращает трансляцию, завершенный
полипептид освобождается, а рибосома распадается на две отдельные
субъединицы.
Рис. 5-22. Фаза инициации в синтезе белка. Здесь представлена
последовательность событий, свойственная эукариотам, но очень
сходный процесс протекает и у бактерий. Этапы 1 и 2 относятся к фазе
элонгации (см. рис. 5-20).
водное. У эукариот малая субъединица рибосомы нагружается инициаторной тРНК, прежде чем присоединиться к мРНК. С инициаторш тРНК
прочно связывается важный фактор инициации, называемый эукариотическим фактором инициации 2 (eIF-2); он необходим для того, чтобы
инициаторная тРНК заняла правильное положение на малой

269
Рис. 5-23. Трехмерная модель функциональной рибосомы бактерий. Малая (красная) субъединица и большая (серая) образуют комплекс, сквозь
который протянута нить мРНК. Точно траектория движения мРНК и наращиваемой полипептидной цепи неизвестны, однако участок, где
происходит присоединение аминокислот, указан здесь правильно. (С изменениями по J. A. Lake, Annu. Rev. Biochem., Я 507-530, 1985.)
субъединице рибосомы. В некоторых клетках от этого фактора зависит общая скорость белкового синтеза (см. ниже).
В следующем разделе мы расскажем, как малая субъединица рибосомы помогает присоединенной к ней инициаторной тРНК отыскать на
молекуле мРНК среди всех встречающихся здесь кодонов AUG один особый кодон (старт-кодон). Как только это произойдет, несколько факторов
инициации, связавшихся ранее с малой субъединицей, отделяются от нее, освобождая место для присоединения к ней большой субъединицы
рибосомы. Поскольку молекула инициаторной тРНК связывается с Р-участком рибосомы, синтез полипептидной цепи может начаться прямо с
присоединения второй молекулы аминоацил-тРНК к А-участку (рис. 5-22). Тем самым завершается сборка функциональной рибосомы с
проходящей сквозь нее нитью мРНК (рис. 5-23). Далее следуют очередные этапы фазы элонгации белкового синтеза, описанные выше (см. второй
этап на рис. 5-20). Поскольку инициаторная тРНК всегда несет аминокислоту метионин или (у прокариот) его аминоформилированное производное,
у всех новосинтезированных белковых цепей на N-конце обнаруживается остаток метионина. Этот метионин часто вскоре после включения
удаляется специфичной аминопептидазой, что весьма существенно, потому что аминокислота, стоящая на аминном конце, может определять время
жизни клеточных белков, воздействуя на убиквитин - зависимый путь деградации (см. разд. 8.2.5).
Выбор правильной точки инициации синтеза на молекуле мРНК определяется, очевидно, малой субъединицей, действующей совместно с
факторами инициации (но в отсутствие большой субъединицы); вследствие этого, вероятно, все рибосомы и состоят из двух субъединиц. Теперь мы
познакомимся с тем, как осуществляется этот выбор.
5-45
5.1.11. У эукариот на каждой молекуле мРНК синтезируется только один вид полипептидных цепей [10]
В молекуле мРНК имеется обычно много триплетов AUG, и каждый из них кодирует метионин. Однако у эукариот лишь один из этих
триплетов AUG узнается инициаторной тРНК, т. е. выступает в качестве старт-кодона. Как рибосома узнает этот старт-кодон?
Механизм для выбора старт-кодона у эукариот и прокариот различен. Молекулы эукариотических мРНК (за вычетом тех, которые
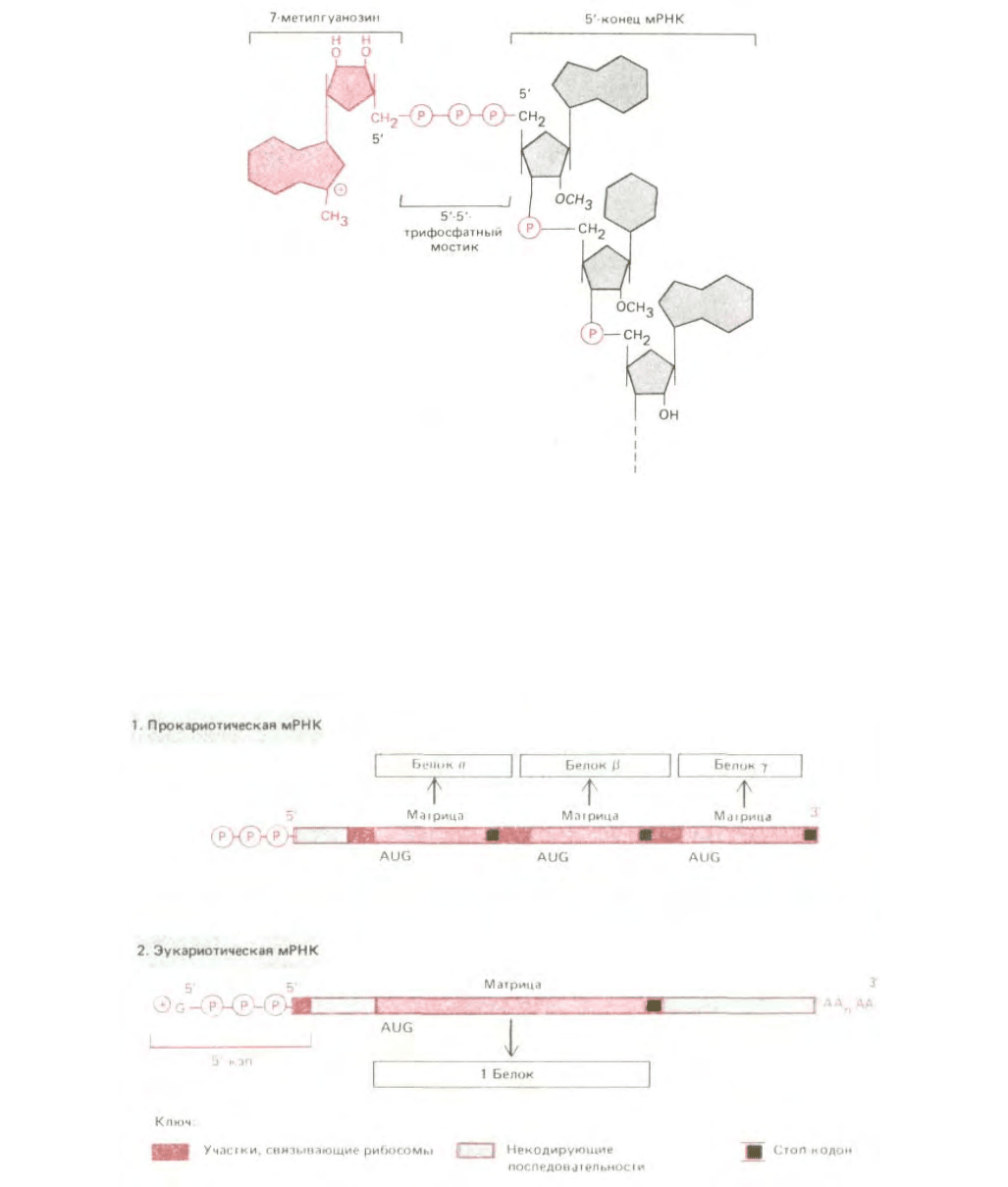
синтезируются в митохондриях и хлоропластах) сразу же по завершении транскрипции подвергаются в клеточном ядре весьма существенным
модификациям (см. разд. 9.4.8). Два главных изменения такого рода состоят в добавлении к 5'-концу особой структуры, так называемого кэпа,
состоящего из остатка 7-метилгуанозина, связанного с трифосфатом (рис. 5-24), а к 3'-концу - фрагмента, состоящего приблизительно из 200
остатков адениловой кислоты (polyA). Играет ли polyA какую-нибудь роль в процессе трансляции, мы пока не знаем. Что же касается кэпа на 5'-
конце, то он для эффективного белкового синтеза необходим. Опыты с экстрактами эукариотических клеток показали, что малая рибосомная
субъединица присоединяется к 5'-концу цепи мРНК, чему способствует узнавание ею 5'-кэпа (рис. 5.22). Затем эта малая субъединица, несущая
связанную с нею инициаторную тРНК, перемещается вдоль цепи мРНК в поисках старт-кодона AUG. Требования к старт-кодону не являются, по-
видимому, слишком жесткими: необходимо всего несколько дополнительных нуклеотидов помимо самого триплета AUG. У большинства видов
РНК используется первый подходящий кодон AUG поблизости от 5'-конца, при этом ни один из многих других триплетов AUG в цепи мРНК
служить точкой инициации полипептид-
270
Рис. 5-24. 5'-Кэп, имеющийся в молекулах мРНК у эукариот. Отметим необычную 5' → 5'-связь с положительно заряженным остатком 7-
метилгуанозина и метилирование 2'-гидроксила первого остатка рибозы в РНК. (Второй остаток рибозы метилирован не всегда.)
ной цепи уже не может. Поэтому на данной молекуле мРНК синтезируется, как правило, лишь один какой-нибудь вид полипептидной цепи. По
всем этим признакам прокариотические мРНК совершенно отличны от эукариотических (рис. 5-25). У бактериальных матриц 5'-кэп отсутствует.
Вместо этого они содержат специфические инициаторные последовательности примерно из шести нуклеотидов, встречающиеся на протяжении
одной и той же цепи мРНК неоднократно в разных ее участках. Такие последовательности располагаются обычно перед очередным триплетом
AUG, отделенные от него несколькими (от 4 до 7) нуклеотидами; они спариваются со специфическим участком рРНК рибосомы и это служит
сигналом для инициации синтеза белка у ближайшего старт-кодона. Более того, хотя бактериальные рибосомы и узнают терминирующие кодоны
как сигналы для окончания синтеза одной полипептидной цепи, они могут «проскользнуть» дальше по матрице. Поэтому бактериальные мРНК
обычно полицистронны, т.е. кодируют многие белки, синтезируемые на одной и той же молекуле
Рис. 5-25. Сравнение структуры прокариотической и эукариотической мРНК. В момент завершения синтеза обе эти мРНК имеют на 5'-конце
трифосфат, но эукариотическая мРНК немедленно вслед за тем приобретает 5'-кэп. У эукариот малая рибосомная субъединица узнает 5'-конец
мРНК именно благодаря 5'-кэпу. Поэтому синтез белка начинается со старт-кодона, ближайшего к 5'-концу (см. рис. 5-22). В отличие от этого у
прокариот 5'-конец не имеет особого значения и рибосомы могут присоединяться ко многим участкам нити мРНК, что всякий раз дает начало
синтезу иного белка.
