Зубилин И.Г. Научные основы охраны природы и рациональное природопользование
Подождите немного. Документ загружается.

101
б) осуществление мероприятий по предупреждению порчи, за-
грязнения, истощения природных ресурсов, отрицательного воздей-
ствия на состояние окружающей природной среды;
в) осуществление мероприятий по воспроизводству восстанав-
ливаемых природных ресурсов;
г) применение биологических, химических и иных методов
улучшения качества природных ресурсов, обеспечивающих охрану
окружающей природной среды;
д) сохранение территорий и объектов природно-заповедного
фонда, а также других территорий, подлежащих особой охране;
е) осуществление хозяйственной и иной деятельности без на-
рушения экологических прав других лиц.
Законом вводится плата за ухудшение качества природных ре-
сурсов и экологическое страхование (добровольное и обязательное)
на случай ущерба, причиненного вследствие загрязнения окружаю-
щей природной среды (ст. 45, 49).
В разделе XII определены природные территории и объекты,
подлежащие особой охране. К таким объектам причислены при-
родно-заповедный фонд Украины, курортные и лечебно-оздорови-
тельные зоны, рекреационные зоны (участки суши и водного про-
странства, предназначенные для организованного массового отдыха
населения и туризма).
В Законе также рассмотрены вопросы определения чрезвычай-
ных экологических ситуаций, пути предотвращения аварий и ликви-
дации их вредных экологических последствий, разрешение споров в
области охраны окружающей среды. Разделом XV определена ответ-
ственность за нарушения законодательства об охране окружающей
среды и международные отношения Украины в области охраны при-
роды.
В целом Закон охватывает практически все сферы охраны при-
роды, однако более детальное правовое регулирование природо-
охранной деятельности потребовало принятия законов «Об охране
атмосферного воздуха» и «О природно-заповедном фонде Украины».
2.2. Закон Украины «Об охране атмосферного
воздуха»
Этот Закон [12] принят 16 октября 1992 г. и введен в действие
Постановлением Верховного Совета Украины 16 октября 1992 г.
102
Атмосферный воздух является одним из основных жизненно
важных элементов окружающей природной среды. Данный закон на-
правлен на сохранение благоприятного состояния атмосферного воз-
духа, обеспечение экологической безопасности и предотвращение
вредного воздействия на природную среду. Он определяет правовые
и организационные основы и экологические требования в области ох-
раны и использования атмосферного воздуха.
Закон состоит из 10 разделов и 46 статей. Отдельными разде-
лами регулируются стандартизация и нормирование в области ох-
раны воздуха, мероприятия по его охране, отношения в области ис-
пользования атмосферного воздуха, экономические механизмы обес-
печения охраны воздуха, государственный мониторинг, ответствен-
ность за нарушение законодательства и др.
Вопросы охраны атмосферного воздуха актуальны на Украине,
так как значительная часть ее территории является зоной экологиче-
ского бедствия в отношении загрязнения атмосферного воздуха
(Донбасс, Запорожская, Днепропетровская области и др.). В связи с
этим данный Закон призван согласовать и упорядочить действия го-
сударственных и общественных органов по охране атмосферного
воздуха и предотвращению его дальнейшего загрязнения.
2.3. Закон «О природно-заповедном фонде
Украины»
Этот Закон [12] принят 16 июня 1992 г. и введен в действие
Постановлением Верховного Совета Украины 16 июня 1992 г. Дан-
ный закон состоит из 11 разделов и 67 статей.
Закон определяет правовые основы организации, охраны, эф-
фективного использования природно-заповедного фонда Украины,
воспроизводства его природных комплексов и объектов.
Природно-заповедный фонд составляют участки суши и вод-
ного пространства, природные комплексы и объекты которых имеют
особую природоохранную, научную, эстетическую, рекреационную и
иную ценность и выделены с целью сохранения природного разнооб-
разия ландшафтов, генофонда животного и растительного мира, под-
держания общего экологического баланса и обеспечения фонового
мониторинга окружающей природной среды.
103
В связи с этим законодательством Украины природно-заповед-
ный фонд охраняется как национальное достояние, в отношении ко-
торого устанавливается особый режим охраны, воспроизводства и
использования. Украина рассматривает этот фонд как составную
часть мировой системы природных территорий и объектов, находя-
щихся под особой охраной.
По состоянию на 1990 г. на Украине насчитывалось 13 запо-
ведников общей площадью 189 тыс. га, не считая лесопарковых зон,
водоохранных зон вдоль рек и водоемов, мест с реликтовой расти-
тельностью и других природоохранных объектов.
Закон определяет классификацию природоохранных объектов,
права и обязанности граждан в отношении этих объектов, способы и
методы управления в области организации, охраны и использования
природно-заповедного фонда. Вопросам экономического обеспече-
ния организации и функционирования природно-заповедного фонда
посвящен отдельный раздел Закона. Данным Законом также опреде-
ляется порядок создания и объявления заповедными территорий и
объектов природного фонда. Закон регулирует порядок отвода зе-
мельных участков природным заповедникам, биосферным заповед-
никам, национальным природным паркам, устанавливает меры от-
ветственности за нарушение законодательства о природно-заповед-
ном фонде.
Организация национальных парков, заповедных территорий
или управляемого заказного режима на охраняемых территориях
включает решение многих вопросов: сохранение уникальных при-
родно-территориальных комплексов, ценных в научно-природовед-
ческом, культурно-образовательном, социальном и народнохозяйст-
венном отношениях; охрану генетических ресурсов биосферы, в пер-
вую очередь – генофонда исчезающих, реликтовых или эндемичных
видов растений и животных; обеспечение экологических условий их
эволюции; охрану защитных рекреационных экосистем.
На современном этапе экологического воздействия на био-
сферу научно-природоведческое и народнохозяйственное значение
заповедных территорий значительно возросло, возникли новые эко-
логические требования к организации их сети. Организация заповед-
ных объектов различного назначения должна строиться на научных
принципах и поддерживаться развитой правовой базой.
104
III. МАСШТАБЫ ЗАГРЯЗНЕНИЯ
ОКРУЖАЮЩЕЙ СРЕДЫ И МЕРЫ ПО
ЕЕ ЗАЩИТЕ
В нашу эпоху антропогенное воздействие на окружающую
среду становится все более интенсивным и масштабным. Серьезную
озабоченность вызывает растущее загрязнение природных сред – ат-
мосферы, гидросферы и литосферы. В связи с этим наибольшее зна-
чение приобретает контроль качества и регулирования состояния
окружающей среды.
Мировое хозяйство ежегодно выпускает около 800 млн. т чер-
ных металлов, свыше 60 млн. т неизвестных природе синтетических
материалов, около 500 млн. т минеральных удобрений, до 8 млн. т
ядохимикатов, свыше 300 млн. т органических химических соедине-
ний.
За счет работы производственных мощностей в атмосферу вы-
брасывается ежегодно более 300 млн. т диоксида углерода, 50 млн. т
углеводородов, 120 млн. т золы, 150 млн. т диоксида серы, а в воды
Мирового океана попадает до 10 млн. т сырой нефти, твердые ос-
татки в стоках рек достигает 17 млн. т.
Кроме того, для ирригации, промышленного производства, бы-
тового потребления в мире используют более 13 % речного стока и
сбрасывают в водоемы ежегодно до 500 млрд. м
3
промышленных и
коммунальных стоков, а их нейтрализация требует пяти-двенадцати-
кратного разбавления чистой водой.
Загрязнение биосферы, исчерпание природных ресурсов, раз-
рушение экосистем, потеря природой способности к самовосстанов-
лению – опасные и сложные процессы, развитие которых вызвано и
стимулируется хозяйственной деятельностью человека. К настоя-
щему времени многие виды загрязняющих веществ, например, ме-
таллическая пыль, пестициды, радиоактивные вещества выходят на
региональный и глобальный уровни, превращая планету в единую
технобиологическую систему. Такие изменения не проходят бес-
следно для человека. В выбросах промышленных предприятий со-
держится до 150 веществ, наносящих вред здоровью людей. Уже се-
годня вызывает беспокойство тот факт, что многие современные бо-
лезни связаны с появлением в окружающей среде продуктов химиче-
ского производства и транспортных выбросов. Сформировавшиеся на
105
протяжении миллионов лет компоненты природы – лесные массивы,
чистая вода, чистый воздух, экологические системы разных уровней
оказались в местностях с наибольшей плотностью населения повре-
жденными, темпы исчезновения некоторых видов животных и расте-
ний приняли угрожающий характер.
В биосферу внесены вредные отходы промышленности, пести-
циды, избыток химических удобрений, перегретые воды электростан-
ций и другие отходы деятельности человека. По своему составу (мно-
гие синтетические материалы) и объему эти отходы не могут быть
переработаны естественным путем и войти в природные круговороты
веществ и элементов.
3.1. Экологический мониторинг. Проблемы
экотоксикологии
Для оценки состояния природной среды, исследования проис-
ходящих в ней процессов необходима детальная информация. В мире
создана система периодически повторяемых наблюдений показателей
окружающей природной среды в пространстве и во времени – сис-
тема мониторинга.
Система мониторинга охватывает как локальные районы или
отдельные страны (национальный мониторинг), так и земной шар в
целом (глобальный мониторинг). Задачи мониторинга: наблюдение
за состоянием биосферы, оценка и прогноз ее состояния; выявление
характера и степени антропогенных воздействий на биосферу и от-
дельные экологические системы.
Первая ступень мониторинга – санитарно-гигиенический мо-
ниторинг. Он предполагает систематический контроль содержания в
объектах окружающей среды важнейших токсичных антропогенных
загрязнителей.
Следующая ступень – природно-хозяйственный мониторинг.
Он представляет собой наблюдения над изменением экосистем и
преобразованием их в природно-технические системы (агросистемы,
городскую среду, среду индустриальных районов).
Наконец, высшая ступень – биосферный мониторинг, задачей
которого является наблюдение и прогноз изменений биосферы в гло-
бальном масштабе. В состав показателей биосферного мониторинга
включают характеристики солнечной радиации, озонового экрана в
атмосфере, запыленности атмосферы и ее газового состава, оценки
106
биологической продуктивности почв суши и вод Мирового океана,
фотосинтезирующей деятельности в биосфере. Отдельной задачей
биосферного мониторинга является изучение и контроль таких про-
цессов, как воздействие кислот, растворенных в дождевой воде, на
почву и растительность, перенос вирусов и микроорганизмов в грун-
товые воды, накопление токсичных химических веществ в организ-
мах.
Химическая экология тесно связана со смежными научными
дисциплинами, в частности, теми, которые имеют непосредственное
отношение к здоровью человека. Так, предметом экологической хи-
мии является исследование превращений химических веществ под
воздействием факторов окружающей среды, причем в центре внима-
ния стоит изучение веществ антропогенного происхождения.
Примеры негативного влияния загрязнителей на состояние ор-
ганизмов весьма многочисленны. Скажем, согласно недавним иссле-
дованиям [10], у табакокурильщиков обнаружено накопление в поч-
ках тионина кадмия. Заядлые курильщики рискуют испытать хрони-
ческое отравление кадмием с необратимым нарушением функций
почек. Цианиды, образующие с ионами металлов прочные ком-
плексы, легко реагирующие с альдегидами и кетонами, восстанавли-
вающие дисульфиды до сульфидов, тормозят ферментативные реак-
ции. Поскольку в живых организмах подавляющие большинство ре-
акций осуществляется при помощи ферментов, цианиды разруши-
тельным образом влияют на жизнедеятельность организмов. Токсич-
ные металлы, такие, как мышьяк, ртуть или медь, нарушают ход про-
цесса окислительного разрушения углеводов; ряд органических со-
единений, распространенных в антропогенной среде (пентахлорфе-
нол, триэтилсвинец, 2.4-динитрофенол) разрывают цепь химических
реакций процессов дыхания. Ряд химических соединений (например,
ароматические углеводороды, нитроароматические соединения, хло-
роформ, сахарин, фенобарбитал) вызывают онкологические заболе-
вания и приводят к мутациям.
Исследованием влияния химических веществ на организмы за-
нимается экотоксикология. Сумма результатов, полученных хими-
ками-экологами и токсикологами, является основой для выбора ве-
ществ, содержание которых подвергается санитарно-гигиеническому
мониторингу.
Воздействие химических веществ на организмы зависит от ок-
ружающих условий и биологического потенциала организма. Все ор-
ганизмы могут выводить довольно большие количества посторонних
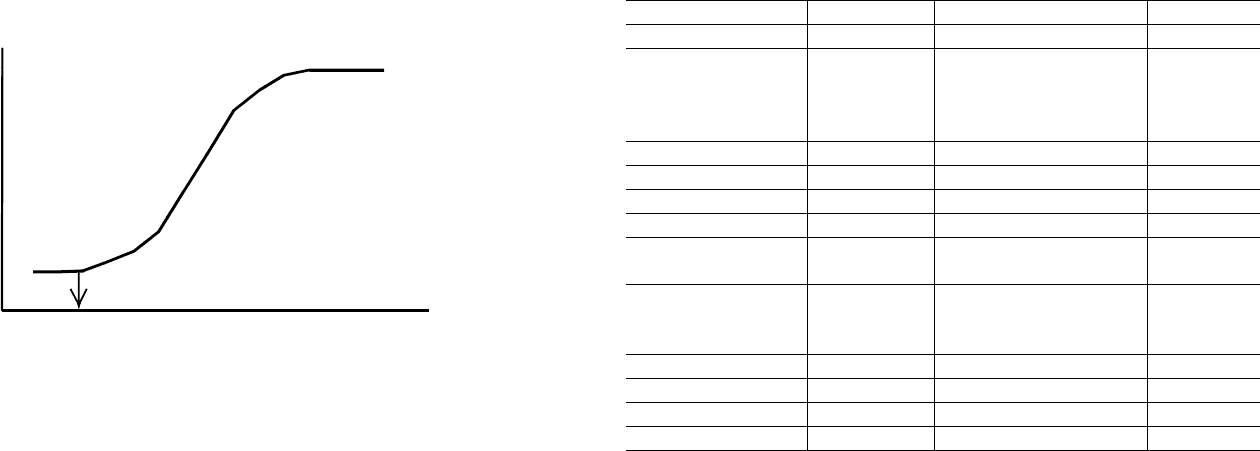
107
веществ или связывать их в своих тканях (например, галогенирован-
ные органические соединения накапливаются в жировых тканях).
Воздействие химического вещества на организм (W) представляют в
виде интеграла
∫
∞
=
0
dtВ)-П(W , (3.1)
где П – концентрация поглощенного вещества, В – концентрация вы-
веденного вещества, t – время. Характерный пример зависимости
«доза вещества (R) – воздействие (W)» приведен на рис. 3.1 Любая
зависимость W – R начинается с порога, ниже которого влияние ве-
щества не обнаруживается. На уровне этого порога выбирают вели-
чины предельно допустимых концентраций (ПДК) загрязнителей в
объектах окружающей среды, продуктах и т.д. Характер и степень
вредного воздействия химических препаратов во многих случаях
сложным образом зависят от времени действия. Наблюдаются как
быстрые биохимические изменения, нарушения поведения, субле-
тальные эффекты и быстрая гибель, так и вначале малозаметные на-
рушения, отчетливо проявляющиеся лишь по прошествии длитель-
ного времени.
по
р
ог
W
R
Рис. 3.1. Пример зависимости «доза – эффект».
108
По результатам оценки влияния химических загрязнителей на
организм человека были сформулированы основные критерии вред-
ности загрязнителей [6]:
1. Допустимым может быть признано только такое содержание того
или иного вещества, которое не оказывает на человека прямого
или косвенного вредного и неприятного действия, не снижает его
работоспособности, не влияет на самочувствие и настроение.
2. Привыкание к вредным веществам должно рассматриваться как
доказательство недопустимости изучаемого уровня содержания.
3. Недопустимо такое содержание вредных веществ, которое небла-
гоприятно влияет на растительность, климат местности, прозрач-
ность атмосферы и бытовые условия жизни населения.
Для важнейших загрязнителей уровни ПДК установлены зако-
нодательно, причем время от времени они пересматриваются в сто-
рону ужесточения. ПДК некоторых веществ приведены в табл. 3.1 и
3.2. Контроль содержания химических соединений является обяза-
тельным условием для разработки мероприятий, направленных на со-
хранение и возрождение природных экосистем и обеспечение безо-
пасных условий жизни человека.
Таблица 3.1. ПДК некоторых загрязнителей в атмосферном
воздухе, мг/м
3
Вещество ПДК Вещество ПДК
Азота диоксид 0.085 Оксид углерода 0.3
Азотная кислота:
по молекуле
по водородному
иону
0.4
0.006
Пыль нетоксичная 0.5
Аммиак 0.2 Сажа (копоть) 0.15
Анилин 0.05 Серная кислота 0.300
Ацетальдегид 0.01 Сероводород 0.008
Ацетон 0.35 Сероуглерод 0.03
Бензин (в пере-
счете на углерод)
5
Серы диоксид 0.5
Бензол 1.5 Соляная кислота:
по молекуле
по водородному иону
0.2
0.006
Метанол 1.000 Уксусная кислота 0.200
Нафталин 0.003 Фенол 0.01
Нитробензол 0.008 Хлор 0.01
Пиридин 0.080

109
Таблица 3.2. ПДК некоторых загрязнителей в водоемах, мг/л.
Элемент ПДК Вещество ПДК
Свинец 0.1 Анилин 0.1
Мышьяк 0.05 Фенол 0.1
Ртуть 0.005 Сероуглерод 1
Медь 0.10 Тиофос 0.003
Цинк 1
Кадмий 0.01
Железо 0.5
Загрязнение окружающей среды достигло таких масштабов,
что неотложной задачей стали разработка и внедрение технологиче-
ских методов, способных прекратить или, по крайней мере, затормо-
зить загрязнение биосферы. Мы рассмотрим, как решается эта про-
блема при очистке воздуха и вод.
3.2. Проблема чистого воздуха
3.2.1. Последствия загрязнения атмосферы
Во все времена загрязнения атмосферы доставляли немало не-
приятностей людям. Самое серьезное внимание привлекали катастро-
фические последствия скопления вредных веществ, сопровождавши-
еся смертями и тяжелыми заболеваниями.
Долина реки Маас (1930 г). Начиная с первой недели декабря
1930 г., Бельгия была покрыта густым туманом. В долине Мааса,
кроме того, наблюдалась инверсия температуры. На третий день со-
хранения этих неблагоприятных метеорологических условий у жите-
лей долины появились заболевания органов дыхания, шестьдесят че-
ловек умерли. Причиной катастрофы стала повышенная концентра-
ция в воздухе оксидов серы, действие которых усиливалось наличием
аэрозолей.
Лондон (1952, 1956, 1957 и 1962 г.г.). Для Великобритании ха-
рактерна туманная погода, сопровождающаяся инверсией темпера-
туры. В указанные годы в течение 12 часов после появления тумана
отмечалось резкое повышение смертности и заболеваемости жителей
Большого Лондона, вызванное накоплением в тумане вредных при-
месей. Образовался смог, что для многих людей, болевших хрониче-
110
ским бронхитом закончилось трагически. Количество смертных слу-
чаев резко возросло, превысив средний многолетний уровень на че-
тыре тысячи.
В Вальсуме, близ Дюссельдорфа (ФРГ) в ночь с 3 на 4 апреля
1952 г. на заводе по производству хлора произошла авария. Вследст-
вие разрыва резервуара в атмосферу попало 15 т хлора, который рас-
пространился по территории завода. В результате пять человек по-
гибли, более двухсот получили тяжелое отравление.
Оценивая масштабы загрязнения атмосферы, можно отметить,
что в атмосферу ежегодно выбрасывается 300 млн. т оксида угле-
рода, 50 млн. т оксидов азота, более 50 млн. т углеводородов, около
250 млн. т мелкодисперсных аэрозолей. Только за счет сжигания угля
в энергетических установках в окружающую среду поступают неко-
торые химические элементы в количествах, значительно превышаю-
щих их поступление из природных источников. Так, масса ртути ан-
тропогенного происхождения превышает массу ртути, поступающей
в биосферу естественным путем, в 8700 раз, мышьяка – в 125 раз,
урана – в 60 раз, бериллия – в 10 раз.
1234
0.1% 1% 12.9%
86%
Рис. 3.2. Схема распределения загрязнений в воздушной среде.
1 – над океанами; 2 – над сельской местностью; 3 – над городами; 4 –
над промышленными районами.
На рис. 3.2 представлена схема распределения загрязнений в
воздушной среде над промышленными районами, городами, сель-
скими местностями, океаном; основное загрязнение сосредоточено
над промышленными районами и городами, т.е. как раз в районах с
наибольшей плотностью населения.
111
Содержащиеся в воздухе загрязнения воздействуют на челове-
ческий организм при контакте с поверхностью кожи или со слизи-
стыми оболочками. Вредные газообразные вещества проникают в
кровь, почки, другие жизненно важные органы. Загрязненный воздух
негативно воздействует не только на живые организмы, но и на ин-
фраструктуру урбанистической цивилизации, прежде всего разру-
шает здания и сооружения. Разрушение материалов происходит в
результате действия абразивов (твердых частиц), грязей (твердых
частиц и жидкостей) и коррозии под действием окислителей, кислот,
солей и т.п. Наиболее заметным разрушающим действием загрязнен-
ного воздуха на здания является почернение их фасадов в результате
осаждения сажи и пыли. Строительные материалы, из которых сло-
жены здания, стареют под действием кислотных осадков в результате
образования сульфита и сульфата кальция. Сульфит, окисляясь,
также превращается в сульфат кальция. Эта соль довольно заметно
растворяется в воде и вымывается дождевыми потоками. Наличие в
атмосфере загрязнений в пять-десять раз ускоряет коррозию метал-
лических крыш зданий. Загрязнение воздуха наносит большой вред
сельскому и лесному хозяйству. В целом, экономический ущерб от
загрязнения атмосферы для развитых стран составляет от 10 до 100
долларов США в год на человека.
3.2.2. Аэрозольное загрязнение атмосферы. Смог
Аэрозоли – это твердые или жидкие частицы, находящиеся во
взвешенном состоянии в воздухе. Твердые компоненты аэрозолей в
ряде случаев особенно опасны для организмов, а у людей вызывают
специфические заболевания, В атмосфере аэрозольные загрязнения
воспринимаются в виде дыма, тумана мглы или дымки. Значительная
часть аэрозолей образуется в атмосфере при взаимодействии твердых
или жидких частиц между собой или с водяным паром. Средний раз-
мер аэрозольных частиц составляет 5–11 мкм. В атмосферу ежегодно
поступает около 11 куб. км пылевидных частиц искусственного про-
исхождения. Большое количество пылевых частиц образуется также
в ходе производственной деятельности людей.
Сведения о некоторых источниках техногенной пыли приведе-
ны ниже:
112
Производственный процесс Выброс пыли, млн. т в год
Сжигание каменного угля 93.6
Выплавка чугуна 20.2
Выплавка меди 6.2
Выплавка цинка 0.2
Выплавка олова 0.004
Выплавка свинца 0.1
Производство цемента 53.4
Основными источниками искусственных аэрозольных загряз-
нений воздуха являются (ТЭС), потребляющие уголь высокой золь-
ности, обогатительные фабрики, металлургические, цементные, маг-
незитовые и сажевые заводы. Аэрозольные частицы от этих источни-
ков отличаются большим разнообразием химического состава. Чаще
всего в их составе обнаруживаются соединения кремния, кальция и
углерода, реже – оксиды железа, магния, марганца, цинка, меди, ни-
келя, хрома, кобальта, свинца, сурьмы, висмута, селена, мышьяка,
бериллия, кадмия, молибдена и асбест. Еще большее разнообразие
свойственно органической пыли, содержащей алифатические и аро-
матические углеводороды, соли карбоновых кислот. Органическая
пыль образуется при сжигании остаточных нефтепродуктов, в про-
цессе пиролиза на нефтеперерабатывающих, нефтехимических и дру-
гих подобных предприятиях.
Постоянными источниками аэрозольного загрязнения явля-
ются промышленные отвалы – искусственные насыпи из переотло-
женного материала, преимущественно вскрышных пород, образуе-
мых при добыче полезных ископаемых, или из отходов предприятий
перерабатывающей промышленности, электростанций и др. Источ-
ником пыли и ядовитых газов служат массовые взрывные работы.
Так, в результате одного среднего по массе взрыва (250–300 т взрыв-
чатых веществ) в атмосферу выбрасывается около 150 т пыли. Про-
изводство цемента и других строительных материалов также явля-
ется источником загрязнения атмосферы пылью. Основные техноло-
гические процессы этих производств – измельчение и химическая
обработка шихт, полуфабрикатов и получаемых продуктов в потоках
горячих газов всегда сопровождается выбросами пыли и других
вредных веществ в атмосферу.
К атмосферным загрязнителям относятся насыщенные и нена-
сыщенные углеводороды, включающие 11–13 атомов углерода. Они
113
подвергаются различным превращениям, окислению, полимеризации,
взаимодействуя с другим атмосферными загрязнителями, причем
особенно интенсивно – в условиях высокой солнечной радиации. В
результате этих реакций образуются перекисные соединения, сво-
бодные радикалы, соединения углеводородов с оксидами азота и
серы, часто находящиеся в виде аэрозольных частиц. При некоторых
погодных условиях могут образовываться особо большие скопления
вредных газообразных и аэрозольных примесей в приповерхностном
слое воздуха. Обычно это происходит в тех случаях, когда в слое
воздуха непосредственно над источниками газопылевой эмиссии
слои холодного воздуха располагаются под слоями теплого (наблю-
дается инверсия), что ограничивает перемешивание воздушных масс
и перенос их вверх. В результате вредные выбросы накапливаются
под слоем инверсии, их содержание резко возрастает, что становится
одной из причин ранее неизвестного в природе явления – образова-
ния фотохимического тумана (смога). Последний представляет собой
многокомпонентную смесь газов и аэрозольных частиц. В состав ос-
новных компонентов смога входят озон, оксиды азота и серы, много-
численные органические соединения перекисной природы, называе-
мые в совокупности фотооксидантами. Фотохимический смог возни-
кает в результате фотохимических реакций в приземном слое воздуха
при определенных условиях: наличии в атмосфере высокой концен-
трации оксидов азота, углеводородов и других загрязнителей, интен-
сивной солнечной радиации, безветрии и повышенной инверсии. Та-
кие условия возникают чаще в июне – сентябре и реже зимой. При
продолжительной солнечной погоде поток солнечной радиации рас-
щепляет молекулы NO
2
с образованием NO и атомарного кислорода.
Последний, реагируя с молекулярным кислородом, образует озон О
3
.
На первый взгляд представляется, что озон, окисляя оксид азота,
должен снова воспроизводить кислород и диоксид азота. Но проис-
ходит другой процесс. Оксид азота вступает в реакции с непредель-
ными углеводородами, которые при этом расщепляются по двойной
связи и образуют осколки молекул и избыток озона. В результате
продолжающейся диссоциации новые массы диоксида азота расщеп-
ляются и дают дополнительные количества озона. Возникает цикли-
ческая реакция, в результате которой в атмосфере накапливается
озон. Этот процесс прекращается только в ночное время. В свою оче-
редь, озон реагирует с алкенами. В атмосфере концентрируются раз-
личные перекисные соединения, которые и образуют в сумме харак-
терные для фотохимического смога оксиданты. Последние являются
114
источником свободных радикалов, обладающих высокой реакцион-
ной способностью. Такие смоги – нередкое явление над Лондоном,
Лос-Анджелесом, Нью-Йорком и другими крупными городами Ев-
ропы и Америки. По своему физиологическому действию на орга-
низм человека они крайне опасны для дыхательной и кровеносной
системы и часто приводят к смертельным исходам.
3.2.3. Очистка газовых выбросов
Рассмотрим очистку воздуха от наиболее масштабных загряз-
нителей – диоксида серы и оксидов азота.
Для химика проблемы очистки газовой смеси от диоксида
серы не существует. В арсенале технолога простые химические реак-
ции, известные даже школьнику. Вопрос в том, как создать экономи-
чески выгодные способы концентрирования и поглощения SO
2
из
огромных по масштабам потоков отходящих газов различных произ-
водств и последующей утилизации SO
2
в виде необходимых для на-
родного хозяйства серы или серной кислоты. Трудность разработки
таких способов проистекает из разнохарактерности газовых выбро-
сов различных производств.
Эффективность очистки газов от SO
2
зависит от следующих
факторов:
1. парциальных давлений SO
2
и О
2
в очищаемой газовой смеси;
2. температуры отходящих газов;
3. наличия и характера твердых сопутствующих веществ;
4. объема очищаемых газов;
5. наличия в близлежащих районах доступного хемосорбента;
6. потребностью в продуктах утилизации SO
2
;
7. требуемой степенью очистки газа.
В настоящее время для промышленной очистки рекомендовано
несколько технологических схем.
Известняковый процесс, основанный на использовании сус-
пензии природного известняка, отличается простотой схемы, малыми
капитальными затратами, доступностью и дешевизной хемосорбента.
При поглощении SO
2
происходит реакция
SO
2
+ CaCO
3
+ 1/2 O
2
= CaSO
4
+ CO
2
. (3.2)
Существенным преимуществом метода является возможность очи-
стки газа без предварительного охлаждения и обеспыливания. Вместе
с тем, рассматриваемый процесс нециклический, и его применение
ограничено потребностью в гипсе, а также образованием большого
115
количества шлама. Поэтому известняковый процесс используют для
очистки небольших по объему газовых выбросов с низким содержа-
нием SO
2
.
Циклический магнезитовый метод обладает рядом несо-
мненных достоинств. К их числу относятся высокая реакционная
способность сорбента, позволяющая очищать газы с малыми содер-
жаниями SO
2
, и возможность очистки больших объемов газов с по-
лучением серной кислоты и серы, а также возможность очистки не-
охлажденных газов.
Разработаны варианты процессов, основанные на применении
растворов солей натрия, калия или аммония, позволяющие очищать
большие объемы газовых смесей без предварительного охлаждения и
практически при любых содержаниях SO
2
. Это существенно облег-
чает эксплуатацию газоочистных установок и повышает надежность
их работы.
Указанные методы являются примерами использования аб-
сорбционных процессов, наиболее перспективных для очистки газо-
вых выбросов кислых примесей отходящих газов химической про-
мышленности, черной и цветной металлургии.
Особняком стоит проблема очистки дымовых газов тепловых
электростанций. Упомянутые выше абсорбционные процессы приме-
нимы и в этом случае. Например, их применяют для очистки от SO
2
на Северодонецкой и Дорогобужской ГРЭС, однако в целом про-
блема далека от решения, поскольку высокой остаются стоимость
газоочистных установок и энергопотребление ими.
В ряде городов (например, в Москве) содержание SO
2
в дымо-
вых газах ТЭС регулируют путем замены одного вида топлива дру-
гим в зависимости от сложившейся экологической обстановки. За-
мена топлива может дать значительный эффект, поскольку ТЭС
мощностью 1 млн. кВт при работе на природном газе выбрасывает в
год 20 тыс. т SO
2
, а при работе на каменном угле – 11 тыс. т.
Другим вариантом решения проблемы является предваритель-
ная очистка топлива от серосодержащих примесей. В настоящее
время в промышленном масштабе создана технология очистки неф-
тепродуктов от таких примесей. Снижение содержания серы на 0.5 %
стоит в среднем 3 доллара США.
Разработка прогрессивных технологий (например, с использо-
ванием микробиологических методов очистки) значительно снижает
затраты на очистку жидкого и твердого топлива от серы. Внедрение
116
таких технологий способствовало бы решению одной из насущных
проблем охраны окружающей среды.
Очистка отходящих газов от оксидов азота на предпри-
ятиях химической промышленности производится на 80 %. Методы
очистки основаны на восстановлении оксидов до азота на различных
катализаторах. Установки каталитического восстановления работают
на всех предприятиях, оборудованных современными агрегатами
получения азотной кислоты.
Отходящие газы производств азотной кислоты после абсорб-
ционных колонн содержат 0.05 – 0.2 % оксидов азота по объему.
Восстановление природным газом, водородом, СО или NH
3
снижает
их содержание в очищенном газе до 0.001 – 0.005 %, что обеспечи-
вает соблюдение установленных санитарных норм.
На ряде существующих производств азотной кислоты под дав-
лением, а также для крупных агрегатов мощностью 400 – 440 тыс. т в
год используют метод восстановительной очистки на палладиевом
катализаторе, причем тепло реакции используется для получения
пара. Данный метод очистки органически связан с технологией про-
изводства, и затраты на него минимальны.
Интересным способом очистки является адсорбционно-десорб-
ционный. В качестве сорбента используют силикагель или кислото-
стойкие цеолиты. Остаточная концентрация оксидов азота в выбро-
сах составляет 0.001 %.
К сожалению, дымовые газы ТЭС служат источником загряз-
нения атмосферы не только диоксидом серы, оксидами азота, но и
другими вредными веществами (например, ртутью). Так, угли раз-
личных месторождений содержат в одной тонне от 50 до 500 мг
ртути. Современная ТЭС средней мощности (около 1 млн. кВт в год)
сжигает за сутки до 1000 т угля, выбрасывая при этом 1 кг ртути. До-
вольно велико загрязнение атмосферы от ТЭС радиоактивными ве-
ществами. Зола ТЭС, в том числе и летучая ее часть, содержит все
изотопы урано-радиевого и ториевого семейств. Так, например, ис-
следование воздуха в районе угольной ТЭС в Ундеус-Крик в США
показало присутствие в нем всех долгоживущих радиоактивных изо-
топов.
117
3.2.4. Сокращение выбросов в атмосферу в
коксохимическом производстве
3.2.4.1. Нормирование выбросов предприятий
Одним из крупных загрязнителей атмосферы является коксо-
химическое производство. В Украине ведутся интенсивные исследо-
вания, преследующие цель снизить его экологический вред, причем
наиболее заметные результаты достигнуты в научных и проектных
организациях г. Харькова. Рассмотрим основные современные кон-
цепции нормирования загрязнений окружающей среды предпри-
ятиями коксохимической промышленности и технические решения,
направленные на создание экологически безопасных условий произ-
водства [14].
Принятая в Украине и странах СНГ методика нормирования
выбросов базируется на концепции ПДК в атмосферном воздухе на-
селенных мест (табл. 3.1). Нормирование выбросов загрязняющих
веществ в атмосферу предприятием производят путем установления
предельно допустимых выбросов этих веществ (ПДВ). ПДВ устанав-
ливают для каждого источника загрязнения атмосферы из условия,
что выбросы данного источника и совокупности источников пред-
приятия, а также других источников не создадут в приземном слое
атмосферы концентраций, превышающих уровень ПДК.
Нормативы ПДВ для предприятий рассчитывают как сумму
значений ПДВ для отдельных источников загрязнения. Если в атмо-
сфере населенного пункта концентрации вредных веществ превы-
шают ПДК, а значения ПДВ по объективным причинам не могут
быть достигнуты, вводят поэтапное снижение выбросов до значений,
обеспечивающих соблюдение ПДВ. На каждом этапе до достижения
величин ПДВ устанавливаются временные согласованные выбросы
вредных веществ (ВСВ). Работы, связанные с установлением ВСВ
для действующего предприятия, осуществляют в следующем по-
рядке.
На первом этапе проводят путем замеров инвентаризацию
выбросов и получают сведения о распределении источников по тер-
ритории предприятия, количестве и составе выбросов загрязняющих
веществ в атмосферу и характеристиках газоочистных и пылеулавли-
вающих установок.
118
На втором этапе планируют природоохранные мероприятия
для достижения ПДВ.
На третьем этапе с помощью специальных компьютерных
программ рассчитывают концентрации загрязняющих веществ в ат-
мосфере жилых районов от выбросов данного предприятия и сопос-
тавляют их с соответствующими значениями ПДК. При этом учиты-
вают фоновое загрязнение, создаваемое источниками выброса дан-
ного населенного пункта. Если по результатам для всех загрязняю-
щих веществ значения приземных концентраций ниже уровня ПДК,
то данный объем выбросов утверждается министерством охраны ок-
ружающей природной среды в качестве норматива предприятия.
Имеющийся опыт расчетов свидетельствует, что достижение норма-
тивов ПДВ на коксохимических предприятиях обеспечивается при
показателе суммарных выбросов 2–2.5 кг/т кокса. Резкое ужесточе-
ние экологических требований в странах СНГ происходит в послед-
ние годы на фоне прогрессирующего физического износа коксовых
батарей. При этом показатель удельных выбросов вредных веществ
на тонну производимого кокса сохраняется в пределах от 4–5 кг/т
кокса для заводов, модернизированных в 80-х годах, до 8–10 кг/т для
устаревших заводов. С учетом этой ситуации, а также большого де-
фицита в Украине сырьевых ресурсов, приоритетными направле-
ниями в развитии коксохимической промышленности считают
а) максимальное извлечение компонентов и б) снижение вредных вы-
бросов в атмосферу [14].
3.2.4.2. Сокращение выбросов в атмосферу при производстве кокса
В коксохимическом производстве наиболее крупным источни-
ком загрязнения атмосферы является коксовый блок. Основная часть
загрязнений попадает в атмосферу из работающего коксового цеха в
периоды между технологическими циклами, когда коксовые печи
открываются для выдачи готового кокса и последующей загрузки
угольной шихтой. Чем больше объем и производительность коксо-
вых печей, тем меньше удельные выбросы из них в расчете на тонну
производимого кокса. Сокращение вредных выбросов в атмосферу на
коксовых заводах может быть достигнуто за счет
– уменьшения количества технологических циклов при по-
вышении единичной мощности коксовых батарей;
– сокращения выбросов дымовых труб путем глубокой очи-
стки отопительного коксового газа от сероводорода и циа-
119
нистого водорода, а также совершенствования системы
обогрева коксовых печей;
– совершенствования процессов тушения кокса.
В условиях значительного сокращения государственных инве-
стиций возможным решением является перекладка коксовых батарей
в существующих габаритных размерах. Однако, как показывает прак-
тика, с экологической точки зрения это решение не является лучшим,
так как достигаемое снижение вредных выбросов не превышает 30 %.
В данном случае экономический приоритет вступает в противоречие
с экологическим. Следует также учитывать, что с принятием нового
природоохранного законодательства и установления жестких финан-
совых санкций за превышение установленного норматива выбросов
экологические показатели начинают самым серьезным образом вли-
ять на экономическое положение предприятия. Некоторые коксохи-
мические заводы Украины уже достаточно остро столкнулись с этой
проблемой.
В связи с этим основой концепции повышения экологической
безопасности коксохимического производства должно стать укруп-
нение коксовых батарей с одновременным уменьшением их количе-
ства при сохранении объема производства кокса.
Практика ряда реконструируемых заводов подтверждает эф-
фективность этого направления. Например, строительство батарей
увеличенной мощности с объемом камер 41.6 м
3
на некоторых заво-
дах позволило вывести из эксплуатации по две устаревшие батареи,
наносившие большой экологический ущерб. Сохранив прежний
объем производства, эти предприятия сократили загрязнение атмо-
сферы на 50 %. В настоящее время ведется разработка коксовых ба-
тарей с еще большими объемами камер коксования, в частности с
объемом 63.4 м
3
.
На степень загрязнения атмосферы в жилых районах и непо-
средственно на территории завода влияют небольшие по объему, но
весьма токсичные неорганизованные выбросы коксовых батарей (со-
держат нафталин, аммиак, цианистый водород, сероводород, фенол).
Эти выбросы происходят, как правило, в приземном слое и медленно
рассеиваются. Чтобы уменьшить опасность неорганизованных вы-
бросов в атмосферу, в проектах новых коксовых батарей предусмат-
ривается использовать сбросные трубы газоочистки высотой 40 м.
Основной объем выбросов коксохимических заводов прихо-
дится на дымовые трубы коксовых батарей. Для заводов Украины,
использующих для обогрева печей коксовый газ, серьезную про-
120
блему представляют выбросы диоксида серы, т.к. содержание серо-
водорода в неочищенном коксовом газе доходит до 18 г/м/
3
из-за вы-
сокого содержания серы в углях. Поэтому практически все коксохи-
мические заводы Украины имеют цеха очистки коксового газа от
сероводорода. Используются две технологии улавливания сероводо-
рода – круговой сорбционно-десорбционный вакуум-карбонатный
метод и мышьяково-содовый метод, основанный на окислении серо-
водорода в элементарную серу. В последние годы разработаны тех-
нологии улавливания сероводорода в две ступени до остаточного
содержания 0.5 г/м
3
. При этом будет происходить глубокая очистка
коксового газа от цианистого водорода до содержания 0.15 г/м
3
, что
позволит существенно сократить выбросы оксидов азота при сжига-
нии газа в отопительной системе коксовых батарей.
На ряде предприятий предусматривается реализовать техноло-
гические схемы глубокой переработки коксового газа с получением
метанола и последующей переработкой его в экологически чистый
синтетический бензин.
3.2.4.3. Природоохранные мероприятия при тушении кокса
Одним из важнейших факторов повышения экологической
безопасности коксохимического производства является радикальное
сокращение выбросов при тушении кокса. Наиболее перспективным
направлением в решении этой проблемы является дальнейшее со-
вершенствование технологии сухого тушения кокса. В коксохимиче-
ской промышленности СНГ накоплен большой опыт эксплуатации
установок сухого тушения кокса (УСТК) конструкции института
ГИПРОКОКС (г. Харьков). Многолетние исследования показали, что
потенциально УСТК является экологически безопасным агрегатом
при условии соблюдения технологического режима и осуществления
комплекса технических решений по герметизации УСТК и очистке
выбросов. Практически единственной проблемой при использовании
УСТК остаются выбросы оксида углерода, источником которого яв-
ляются свечи избыточного циркуляционного газа и разгрузочные
устройства камер тушения. Обезвреживание выбросов избыточного
циркуляционного газа обеспечивается подключением свечи к газо-
проводу сырого коксового газа или сжиганием выбросов в специаль-
ной печи с последующей утилизацией тепла.
Технология безводного тушения кокса совершенствуется по
нескольким направлениям:
