Журнал - Проблемы криобиологии 2009 №1
Подождите немного. Документ загружается.

90
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1
Ðåçóëüòàòû è îáñóæäåíèå
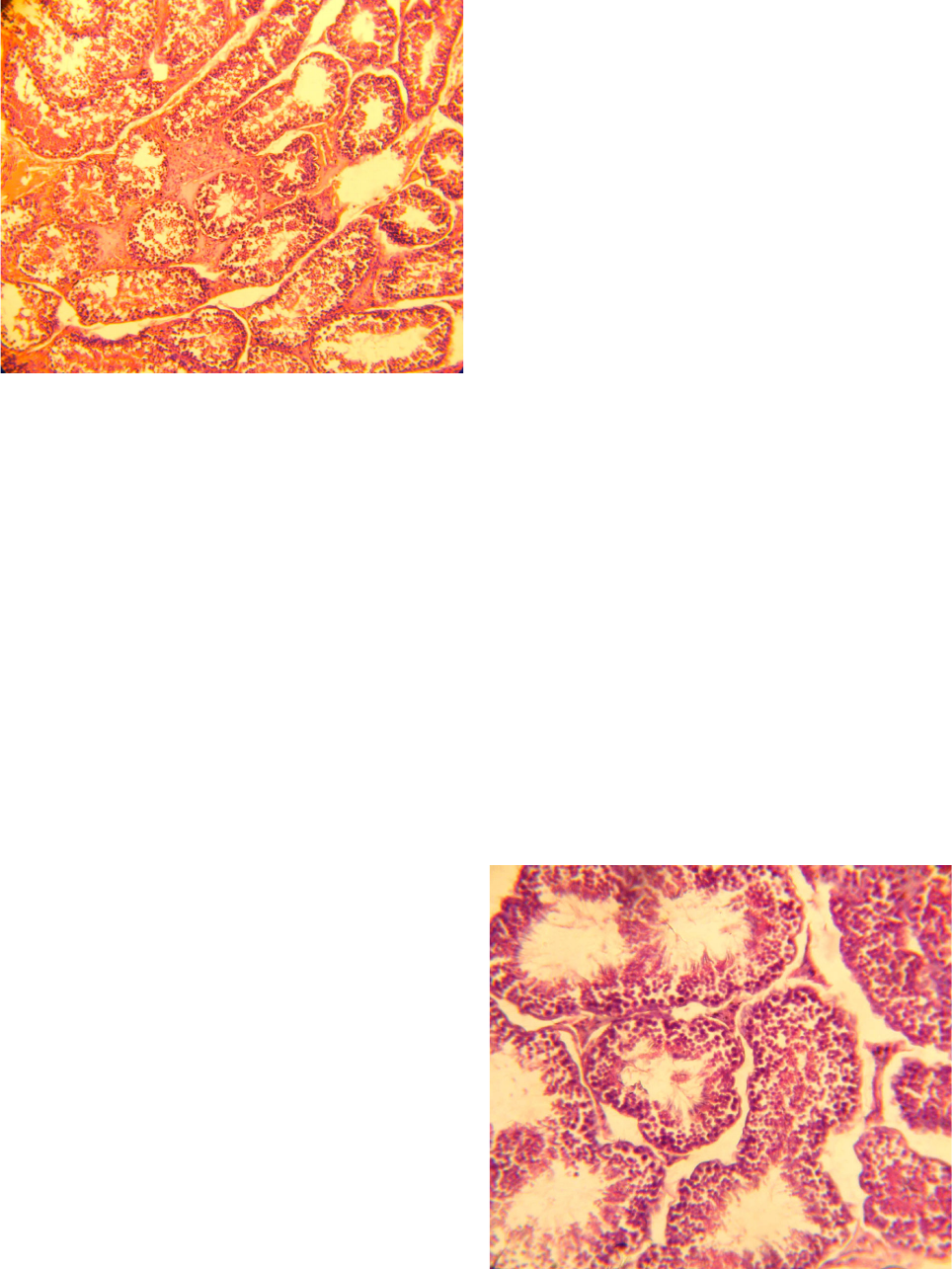
При морфологическом исследовании яичек
контрольных животных І группы – половозрелых
молодых кроликов – обнаруживается паренхима
органа, состоящая из извитых семенных каналь-
цев, между которыми находится небольшое коли-
чество соединительной ткани, содержащей круп-
ные интерстициальные клетки (клетки Лейдига).
Извитые семенные канальцы выстланы спермато-
генным эпителием, на базальной мембране кото-
рого находятся крупные клетки с гиперхромными
ядрами – предшественники гамет – спермато-
гонии. Между ними располагаются поддержива-
ющие клетки Сертоли (сустентоциты), имеющие
пирамидальную форму и вытянутые в просвет
семенного канальца. Клетки Сертоли выполняют
барьерную роль между половыми клетками и
внутренней средой организма [1]. Они делят спер-
матогенный эпителий на базальное и адлюминаль-
ное пространства. В базальном пространстве обна-
руживаются сперматогонии. Ближе к просвету
канальцев в достаточно свободном адлюминаль-
ном пространстве определяются сперматоциты
первого и второго порядков, а над ними, вблизи
просвета канальцев, – мелкие клетки-сперматиды
на различных этапах развития и зрелые спермато-
зоиды (рис. 1).
При морфологическом исследовании яичек
животных II группы наблюдали деструктивные
изменения сперматогенного эпителия, выража-
ющиеся в запустевании извитых семенных ка-
нальцев. Адлюминальное пространство содержит
набухшие сперматоциты первого и второго поряд-
ков. Поддерживающие клетки Сертоли плохо
Рис.1. Сперматогенный эпителий извитых семенных
канальцев яичка кролика. Контроль. окраска гемато-
ксилином и эозином, ×120.
Fig. 1. Spermatogenic epithelium of convoluted seminiferous
tubules of rabbit testes. Control. Staining with hematoxylin
and eosin, ×120.
Рис. 2. Запустевание извитых семенных канальцев кро-
ликов II группы. Окраска гематоксилином и эозином,
× 240.
Fig. 2. Barren convoluted seminiferous tubules of rabbits
of the 2
nd
group. Staining with hematoxylin and eosin, ×240.
Sertoli’s cells of pyramidal form and elongated into
seminiferous tubule lumen. The Sertoli’s cells realise
a barrier role between sexual cells and organism’s
internal medium [1]. They divide spermatogenic
epithelium in basal and adluminal spaces. Sperma-
togones are revealed in a basal space. Near the tubule
lumen in a quite free adlumnal space there are deter-
mined the spermatocytes of the first and second orders,
and over them close to the tubule lumen there are small
cells: spermatids in different developmental stages and
mature spermatozoa (Fig. 1).
During morphological study of testes of the 2
nd
group animals we observed destructive changes in
spermatogenic epithelium, manifesting in barren con-
voluted seminiferous tubules. An adluminal space
contains the swollen spermatocytes of the first and
second orders. The supporting Sertoli’s cells are poorly
determined. The oedema of testicular parenchyma is
seen. The single interstitial cells: glandulocytes with
pyknotic nuclei are found out between convoluted
seminiferous tubules (Fig. 2).
Morphological study of rabbit’s testes of the 3
rd
group demonstrated the renewal of regenerative func-
tion in convoluted seminiferous tubules (Fig. 3). Thus,
on a basal membrane of spermatogenic epithelium
there were revealed the maintaining Sertoli’s cells,
providing hematotesticular barrier, due to which in
adluminal space of spermatogenic epithelium a specific
hormonal medium with a high testosterone level was
created.
Selective permeability of hematotesticular barrier
is known to isolate the maturing sexual cells from toxic
substances and prevent the autoimmune response
development against surface antigens, being expressed
91
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1
on spermatozoa membrane during their maturation. In
addition, Sertoli’s cells, acting as a barrier function
between sexual cells and organism’s internal medium,
realise a trophic function, by providing the developing
gametes with nutritive substances [1]. In addition to
sustenocytes the spermatogones of A and B types are
located on a basal membrane. Near the lumen of con-
voluted seminiferous tubules there are spermato-cytes
of the first and second orders, over which there are
spermatides at different developmental stages, as well
as spermatozoa.
As a result of the performed researches we have
found out, that the destructive changes, occurring under
conditions, when testes release from mature sper-
matozoa is impossible, are similar to destructive pro-
cesses, progressing after vasoligation or vasotomy. As
we have demonstrated previously, during 2.5–3 months
of sexual abstinence the atrophy of testicular spermato-
genic epithelium occurs [6]. At the same time the most
differentiated layers of spermatogenic epithelium:
forming spermatozoa and spermatides, are first, who
undergo destructive changes. The latter, when swelling,
are getting confluent in typical roundish masses, so-
called spermatic spheres, swimming in tubular lumen.
However, since the inferior layers of spermatogenic
epithelium (spermatogones and first order spermato-
cytes) are preserved longer, sometimes it is sometimes
possible to recover spermatogenesis after removing
damaging agent or unfavourable factor.
Allotransplantation of cryopreserved testicular
tissue to male rabbits, keeping for 2 months without
females, resulting in recovery of morphofunctional state
of testes, proved the possibility of correcting testicular
hypofunction at sexual abstinence.
определяются. Наблюдается отек паренхимы яи-
чек. Между извитыми семенными канальцами
наблюдали единичные интерстициальные клетки
(гландулоциты) с пикнотичными ядрами (рис. 2).
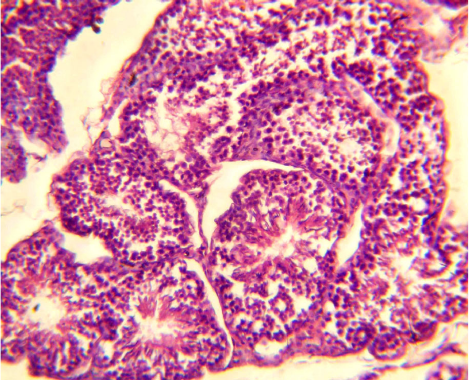
Морфологическое исследование яичек кроликов
ІІІ группы показало возобновление генеративной
функции в извитых семенных канальцах (рис. 3).
Так, на базальной мембране сперматогенного эпи-
телия обнаруживались поддерживающие клетки
Сертоли, обеспечивающие гематотестикулярный
барьер, благодаря которому в адлюминальном
пространстве сперматогенного эпителия создается
специфическая гормональная среда с высоким
уровнем тестостерона.
Известно, что избирательная проницаемость
гематотестикулярного барьера изолирует созрева-
ющие половые клетки от токсических веществ и
препятствует развитию аутоиммунного ответа
против поверхностных антигенов, экспрессиру-
ющихся на мембране сперматозоидов в процессе
их созревания. Кроме того, клетки Сертоли, выпол-
няя барьерную функцию между половыми клет-
ками и внутренней средой организма, осущест-
вляют трофическую функцию, обеспечивая раз-
вивающиеся гаметы питательными веществами
[1]. Помимо сустентоцитов на базальной мембране
располагаются сперматогонии типов А и В. Ближе
к просвету извитых семенных канальцев лежат
сперматоциты первого и второго порядков, над ко-
торыми находятся сперматиды на различных эта-
пах развития, а также сперматозоиды.
В результате проведенных исcледований обна-
ружено, что деструктивные изменения, возника-
ющие в условиях невозможности освобождения
яичек от зрелых сперматозоидов, аналогичны
деструктивным процессам, развивающимся после
перевязки или перерезки семявыводящих каналов.
Ранее нами было показано, что при 2,5–3 месяцах
половой абстиненции наступает атрофия сперма-
тогенного эпителия яичек [6]. При этом деструк-
тивным изменениям подвергаются в первую оче-
редь наиболее дифференцированные ярусы спер-
матогенного эпителия – формирующиеся сперма-
тозоиды и сперматиды. Последние, набухая, сли-
ваются в характерные округлые массы, так назы-
ваемые семенные шары, плавающие в просвете
канальца. Однако, поскольку нижние слои сперма-
тогенного эпителия (сперматогонии и сперма-
тоциты первого порядка) сохраняются более дли-
тельно, то восстановить сперматогенез после
прекращения действия повреждающего агента или
неблагоприятного фактора иногда возможно.
Аллотрансплантация криоконсервированной
тестикулярной ткани кроликам-самцам, содержа-
щимся в течение 2-х месяцев без самок, резуль-
татом которой явилось восстановление морфо-
Рис. 3. Возобновление сперматогенеза в паренхиме яичек
кроликов III группы. Окраска гематоксилином и эозином,
× 240.
Fig. 3. Spermatogenesis renewal in testicular parenchyma
of rabbits of the 3
rd
group. Staining with hematoxylin and
eosin, × 240.
92
Conclusions
Sexual abstinence in rabbits within 2 months was
shown as not to be irreversible; the method of allotrans-
plantation of cryopreserved testicular tissue enables
to recover morphofunctional state of testes via cor-
recting decrease in their function.
функционального состояния их яичек, доказала воз-
можность коррекции гипофункции яичек при
половой абстиненции.
Âûâîäû
Показано, что половая абстиненция кроликов в
течение 2-х месяцев не является необратимой; ме-
тод аллотрансплантации криоконсервированной
тестикулярной ткани позволяет восстанавливать
морфофункциональное состояние яичек путем кор-
рекции снижения их функции.
Литература
Гистология (введение в патологию) / Под ред. Э.Г.
Улумбекова, Ю.А. Челышева.– М.: ГЭОТАР, 1997.– 960 с.
Ендовицкая И.П., Зиновьева Н.А., Эрнст Л.К. Динамика
сперматогенеза у кролика oryctolagus cuniculus // Цито-
логия.– 2005.– Т. 47, №1.– С. 44–48.
Киселева А.Ф., Житников А.Я., Кейсевич Л.В. Морфо-
функциональные методы исследования в норме и пато-
логии. – Киев: Здоров’я, 1983.– 164 с.
Сперматогенез и его регуляция // Под ред. Л.В. Дани-
лова.– М.: Наука, 1983.– 232 с.
Чадаев В.Е., Добрунова И.В. Изучение влияния срока
половой абстиненции на поведенческие реакции у
кроликов. Первое сообщение // Клінічна та експеримен-
тальна патологія.– 2006.– Т. 5, №4.– С. 93-95.
Чадаев В.Е., Волина В.В. Изучение влияния срока поло-
вой абстиненции на морфофункциональное состояние
семенников кроликов. Второе сообщение // Клінічна та
експериментальна патологія.– 2007.– Т. 6, №2.– С. 76–
79.
Поступила 27.05.2008
Рецензент Т.М. Шарлай
References
Histology (introduction to pathology) / Ed. by E.G. Ulumbekov,
Yu.A. Chelyshev.– Moscow: GEOTAR, 1997.– 960 p.
Endovitskaya I.P., Zinovieva N.A., Ernst L.K. Sperma-
togenesis dynamics in rabbit Oryctolagus cuniculus //
Tsitologiya.– 2005.– Vol. 47, N1.– P. 44–48.
Kiseleva A.F., Zhitnikova A.Ya., Keysevich L.V. Morpho-
functional methods of research in the norm and pathology.–
Kiev: Zdorov’ya, 1983.– 164 p.
Spermatogenesis and its regulation // Ed. by L.V. Danilov.–
Moscow: Nauka, 1983.– 232 p.
Chadayev V.E., Dobrunova I.V. Study of the effect of sexual
abstinence term on behavioral reactions in rabbits. First
report // Klinichna ta eksperymental’na patologiya.– 2006.–
Vol. 5, N4.– P. 93–95.
Chadayev V.E., Volina V.V. Studying the effect of sexual
abstinence on morphofunctional state of rabbit’s testes.
Second report // Klinichna ta eksperymental’na patologiya.–
2007.– Vol. 6, N2.– P. 76–79.
Accepted in 27.05.2008
1.
2.
3.
4.
5.
6.
1.
2.
3.
4.
5.
6.
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1

93
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1
УДК 615.361:612.649;612.118.7:57.085.2
À.À. ÖÓÖÀÅÂÀ
1
,
Â.Â. ÂÎËÈÍÀ
1
*, Ë.Â.
ÑÎÊÎË
1
, Î.À. ÆÓËÈÊÎÂ
2
Âëèÿíèå ëåéêîêîíöåíòðàòà êîðäîâîé êðîâè ÷åëîâåêà
íà ðåãåíåðàòîðíóþ àêòèâíîñòü êîæè
â êóëüòóðå in vitro
UDC 615.361:612.649;612.118.7:57.085.2
A.A. TSUTSAYEVA
1
, V.V. VOLINA
1
, L.V. SOKOL
1
, O.A. ZHULIKOV
2
Effect of Human Cord Blood Leukoconcentrate
on Skin Regenerative Activity in Culture In Vitro
Изучали характер влияния лейкоконцентрата криоконсервированных клеток кордовой крови человека, взвешенных в
аутологичной плазме (препарат ЛККЧ), на морфологию кожи человека в разные сроки культивирования in vitro. Кожу
культивировали на агаризованной среде с добавлением 17% эмбриональной сыворотки (контроль) и 10% препарата ЛККЧ
(экспериментальная группа). В присутствии препарата ЛККЧ на 5–7 суток дольше поддерживалась жизнеспособность кожи
in vitro по сравнению с контрольной группой. Под влиянием ЛККЧ в культивируемых кожных лоскутах увеличивалось
количество фибробластов и волокнистых структур, что позволяет сделать предположение о стимуляции процессов как
пролиферации фибробластов, так и синтеза волокнистых структур в дерме.
Ключевые слова: кожные эксплантаты, лейкоконцентрат кордовой крови человека, культивирование in vitro, морфофунк-
циональная активность.
Вивчали характер впливу лейкоконцентрату кріоконсервованих клітин кордової крові людини, зважених в аутологічній
плазмі (препарат ЛККЛ), на морфологію шкіри людини в різні строки культивування in vitro. Шкіру культивували на
агаризованому середовищі з додаванням 17% ембріональної сироватки (контроль) та 10% препарату ЛККЛ (дослідна група).
У присутності препарату ЛККЛ на 5–7 діб довше підтримувалась тривалість життя шкіри in vitro у порівнянні з тривалістю
життя шкіри в контрольній групі. Під впливом ЛККЛ в шкірних шматках, які культивувалися, зростала кількість фібробластів
і волокнистих структур, що дозволяє зробити припущення щодо стимуляції процесів як проліферації фібробластів, так і
синтезу волокнистих структур у дермі.
Ключові слова: шкірні експлантати, лейкоконцентрат кордової крові людини, культивування in vitro, морфофункціональна
активність.
The effect of human cord blood cryopreserved cell leukoconcentrate, suspended in autologous plasm (LHCB preparation) on
in vitro cultured human skin morphology in different terms, has been studied. Skin was cultured on an agarised medium, supplemented
with 17% embryonic serum (control) and 10% LHCB preparation (experimental group). The skin viability in vitro was maintained for
5–7 days longer in the presence of LHCB preparation compared to the control group. Under LHCB effect in cultured skin flaps there
was an increase in fibroblast and fibrous structure amount, that enables concluding about the stimulation of both processes of fibroblast
proliferation and synthesis of fibrous structures in derma.
Keywords: skin explants, human cord blood leukoconcentrate, in vitro culturing, morphofunctional activity.
* Àâòîð, êîòîðîìó íåîáõîäèìî íàïðàâëÿòü êîððåñïîíäåíöèþ:
óë. Ïåðåÿñëàâñêàÿ, 23, ã. Õàðüêîâ, Óêðàèíà 61015; òåë.:+38
(057) 373-31-26, ôàêñ: +38 (057) 373-30-84, ýëåêòðîííàÿ ïî÷òà:
cryo@online.kharkov.ua
* To whom correspondence should be addressed: 23, Pereyaslavskaya
str., Kharkov, Ukraine 61015; tel.:+380 57 373 3126, fax: +380 57
373 3084, e-mail: cryo@online.kharkov.ua
1
Institute for Problems of Cryobiology and Cryomedicine of the Na-
tional Academy of Sciences of Ukraine, Kharkov, Ukraine
2
Kharkov Municipal Clinical Hospital N31, Kharkov, Ukraine
1
Èíñòèòóò ïðîáëåì êðèîáèîëîãèè è êðèîìåäèöèíû
ÍÀÍ Óêðàèíû, ã. Õàðüêîâ
2
Õàðüêîâñêàÿ ãîðîäñêàÿ êëèíè÷åñêàÿ áîëüíèöà ¹ 31
Разработка методов культивирования кожных
лоскутов остается актуальной в связи с тем, что
кожа как трансплантат используется при таких
повреждениях кожных покровов, как ожоги и об-
ширные травмы.
В последнее время применяются различные
способы стимуляции процессов репарации пов-
режденной и регенерации утратившей тургор и
эластичность кожи с помощью биологически ак-
тивных препаратов – плаценты и ее экстрактов, а
также клеточных суспензий [1, 3, 5].
Кордовая (пуповинная) кровь является источни-
ком биологически активных веществ [4, 5]. Однако
работы по оценке механизмов действия взвеси
Designing the methods for skin flap culturing has
remained an actual task due to skin usage as a trans-
plant at such skin integument damages as burns and
major traumas.
Recently there have been applied the different ways
for stimulating reparative processes in a damaged skin
and the one, lost the turgor and elasticity, using such
biologically active preparations as: placenta and its
extracts as well as cell suspensions [1, 3, 5].
Umbilical cord blood is the source of biologically
active substances [4, 5]. However the reports on eva-
luating the effect mechanisms of blood nucleated cell
suspensions are single and the obtained results are not
free of contradictions [6–8].
94
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1
ядерных клеток крови единичны, а полученные
исследователями результаты не лишены противо-
речий [6–8].
Цель работы – изучение характера влияния
криоконсервированных суспензий ядерных клеток
кордовой крови, взвешенных в аутологичной
плазме, на морфофункциональные процессы,
происходящие в образцах кожи, культивируемых
in vitro.
Ìàòåðèàëû è ìåòîäû
Исследовали фрагменты кожи человека, полу-
ченные из краев операционной раны в области жи-
вота во время полостной операции. Доноры давали
добровольное информированное согласие. Фраг-
менты кожи размером 0,3×0,3 см отделяли скаль-
пелем от подкожной жировой клетчатки, помеща-
ли на 0,7% бакто-агар (Difco), который готовили в
среде RPMI, содержащей 17% эмбриональной
сыворотки крупного рогатого скота либо 10% крио-
консервированного лейкоконцентрата кордовой
крови человека (ЛККЧ) от объема культуральной
среды и обогащенной L-глютамином, L-аспараги-
ном, аминокислотами и витаминами, pH среды 7,2.
После помещения на агар фрагменты кожи по-
крывали культуральной ростовой средой в объе-
ме 0,5 мл для исключения их подсыхания. Флаконы
с культивируемым материалом плотно закрывали
резиновыми пробками.
Фрагменты кожи были разделены на группы:
– группа I – нормальная кожа (исходный мате-
риал);
– группа II – образцы кожи на 7-, 14- и 21-е сутки
культивирования на агаровой среде (контроль);
– группа III – образцы кожи на 7-, 14- и 21-е
сутки культивирования на агаровой среде, вклю-
чающей препарат ЛККЧ (опыт).
Препарат ЛККЧ, который состоит из ядерных
клеток кордовой крови, взвешенных в аутологич-
ной плазме (“Гемокорд”, разрешен МОЗ Украины
к клиническому применению), криоконсервирова-
ли без традиционных криопротекторов и исполь-
зовали сразу после отогрева [5]. Концентрация кле-
точных элементов составляет 1,71 ± 0,07×10
–7
кл/мл
с сохранностью 86,2 ± 3,1%. Клеточный спектр
ядерных компонентов кордовой крови представ-
лен: лимфоцитами – 74,0 ± 2,0%, моноцитами –
9,0 ± 0,3%, нейтрофилами – 6,0 ± 0,2%, недиффе-
ренцированными клетками – 8,0 ± 0,7%, стволовы-
ми кроветворными и некроветворными клетками –
3,0 ± 0,1% [4, 5].
Культивирование кожи проводили in vitro при
температуре 37°С. Кожные эксплантаты извлекали
на 7-, 14-, 21-е сутки культивирования, фиксиро-
вали в 10%-м формалине, заливали в целлоидин и
The research was aimed to study the character of
effect of cryopreserved suspensions of cord blood nuc-
leated cells, suspended in an autologous plasm on mor-
phofunctional processes, occurring in cultured skin
samples in vitro.
Materials and methods
Human skin fragments, derived from operative
wound edges in abdominal area during major surgery,
were under study. Donors provided a voluntary infor-
med consent. The 0.3×0.3 cm’s skin fragments were
separated with scalpel from a subcutaneous fat, then
placed on 0.7% bacto-agar (Difco), prepared in the
RPMU medium, containing either 17% embryonic
cattle serum or 10% cryopreserved leukoconcentrate
of human cord blood (LHCB) of the cultural medium
volume and enriched with L-glutamine, L-asparagine,
aminoacids and vitamins, medium pH 7.2.
After placing on agar the skin fragments were cove-
red with a cultural growth medium in 0.5 ml volume
to exclude their drying. The flasks with cultured
material were tightly closed with rubber plugs.
Skin fragments were divided into the following
groups:
– the 1
st
group was normal skin (initial material);
– the 2
nd
one comprised the skin samples to the 7
th
,
14
th
and 21
st
culturing days with agar medium (cont-
rol);
– the 3
rd
one were the skin samples to the 7
th
, 14
th
and 21
st
culturing days with agar medium, comprising
the LHCB preparation (experiment).
The LHCB preparation, consisted of nucleated cord
blood cells, suspended in autologous plasm (“Hemo-
cord”, authorized to application by the Ministry of Health
Care of Ukraine) is cryopreserved with no standard
cryoprotectants and applied just after thawing [5]. Cell
element concentration makes 1.71 ± 0.07×10
-7
cells/ml
with 86.2 ± 3.1% integrity. Cell range of cord blood
nucleated components is represented by lymphocytes
(74.0 ± 2.0%), monocytes (9.0 ± 0.3%), neutrophils
(6.0 ± 0.2%), undifferentiated cells (8.0 ± 0.7%), stem
hemopoietic and non-hemopoietic cells (3.0 ± 0.1%)
[4, 5].
Skin was in vitro cultured at 37°C. Skin explants
were removed to the 7
th
, 14
th
and 21
st
culturing days,
fixed in 10% formalin, embedded into celloidin and
5-7 µm histological sections, stained with hematoxylin
and eosin, were prepared from them. In the obtained
histological preparations in 10 visual fields (lens 10,
ocular 40) the fibroblast number in derma was
calculated and the thickness of epidermis, papillary
and reticular derma layers was morphometrically
determined.
The obtained data were statistically processed with
the Student-Fisher method [2].
95
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1
готовили из них гистологические срезы толщиной
5–7 микрон, которые окрашивали гематоксилином
и эозином. На полученных гистологических препа-
ратах в 10 полях зрения (об. 10, ок. 40) подсчиты-
вали количество фибробластов в дерме и произво-
дили морфометрическое определение толщины
эпидермиса, сосочкового и сетчатого слоев дермы.
Статистическую обработку полученных дан-
ных проводили по методу Стьюдента-Фишера [2].
Ðåçóëüòàòû è îáñóæäåíèå
В опытах in vitro было установлено, что на 7-е
сутки культивирования эксплантатов кожи в конт-
рольной группе наблюдалось достоверно выражен-
ное (Р < 0,05) по сравнению с интактной кожей
(рис. 1) уменьшение толщины эпидермиса за счет
как кератинизации, так и миграции его клеток.
Отмечались сглаженность дермоэпидермальной
границы и расширение эпидермальных выростов,
местами – отслоение эпидермиса. В сосочковом
слое дермы наблюдалось достоверное (Р < 0,05)
увеличение количества фибробластов по сравне-
нию с нормальной кожей (таблица). В сетчатом
слое дермы обнаруживались молодые интенсивно
окрашивающиеся коллагеновые волокна, увеличи-
валось количество клеток в железистых структурах
и волосяных фолликулах (рис. 2).
В эксплантатах кожи группы III, выращенных
на агаризованной питательной среде, в которую
был добавлен препарат ЛККЧ, на этот срок струк-
тура эпидермиса была сравнима с нормальной
(рис. 3). Дермоэпидермальная граница хорошо
контурировалась, местами наблюдалось отслоение
эпидермиса от дермы. Коллагеновые волокна обра-
зовывали плотную сеть, количество фибробластов
достоверно увеличивалось (Р < 0,05) по сравнению
с группами I и II (таблица).
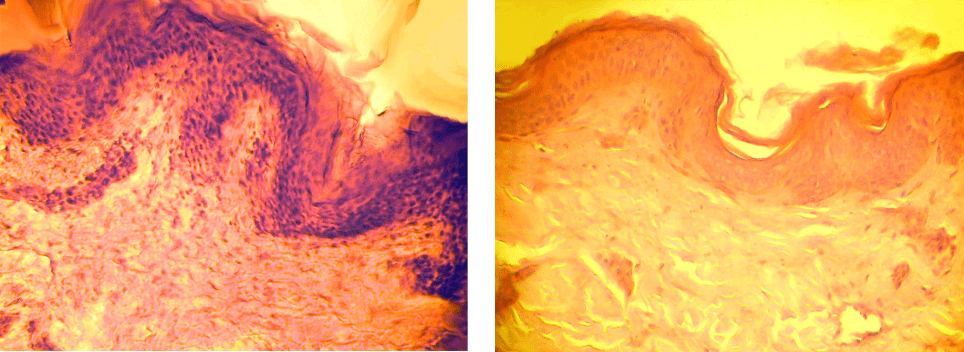
Рис. 1. Интактная кожа человека (группа I). Окраска
гематоксилином и эозином, ×240.
Fig. 1. Human intact skin (1
st
group). Staining with hemato-
xylin and eosin, ×240.
Рис. 2. Кожа группы II на 7-е сутки культивирования
(контроль). Окраска гематоксилином и эозином, ×240.
Fig. 2. The 2
nd
group’s skin to the 7
th
culturing day (con-
trol). Staining with hematoxylin and eosin, ×240.
Results and discussion
As in vitro experiments showed, to the 7
th
day of
skin explant culturing the control group demonstrated
a statistically significant decrease (P<0.05) in epider-
mis thickness due to both keratinisation and its cell
migration, compared to the intact skin (Fig. 1). The
dermoepidermal interface flattening and extension of
epidermal outgrowths and somewhere epidermis exfo-
liation were noted. In a papillary derma layer a statis-
tically significant (P < 0.05) increase in fibroblast num-
ber compared to the normal skin was observed (Table).
In a retinal derma layer the young intensively stained
collagen fibers were revealed, the cell number in glan-
dular structures and hair follicles increased (Fig. 2).
By this term in skin explants of the 3
rd
group, grown
up on an agarised nutritive medium, supplemented
with LHCB preparation, the epidermal structure was
compared to the normal one (Fig. 3). Dermoepidermal
interface was well contoured with here and there
observed epidermal exfoliation from a derma. Colla-
gen fibers formed a dense net, fibroblast number statis-
tically and significantly increased (P < 0.05) compared
to the 1
st
and 2
nd
groups (Table).
To the 14
th
day of skin graft culturing free of LHCB
preparation, a decrease in epidermis sizes compared
to the normal skin, was observed. Dermoepidermal
interface was slightly contoured. The structure of con-
nective fibers in derma corresponded to the normal
skin (Fig. 4). The fibroblast number statistically and
significantly increased (P < 0.05) compared to the nor-
mal skin (Table). In glands (sudoriferous and seba-
ceous) as well as in hair follicles the epithelial cell
proliferation was observed.
To the 14
th
day of skin culturing with LHCB prepa-
ration (Fig. 5) the epidermis sizes augmented compa-
red to the 2
nd
group within the same culturing term,
but its cell layer differentiation was complicated. In a
96
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1
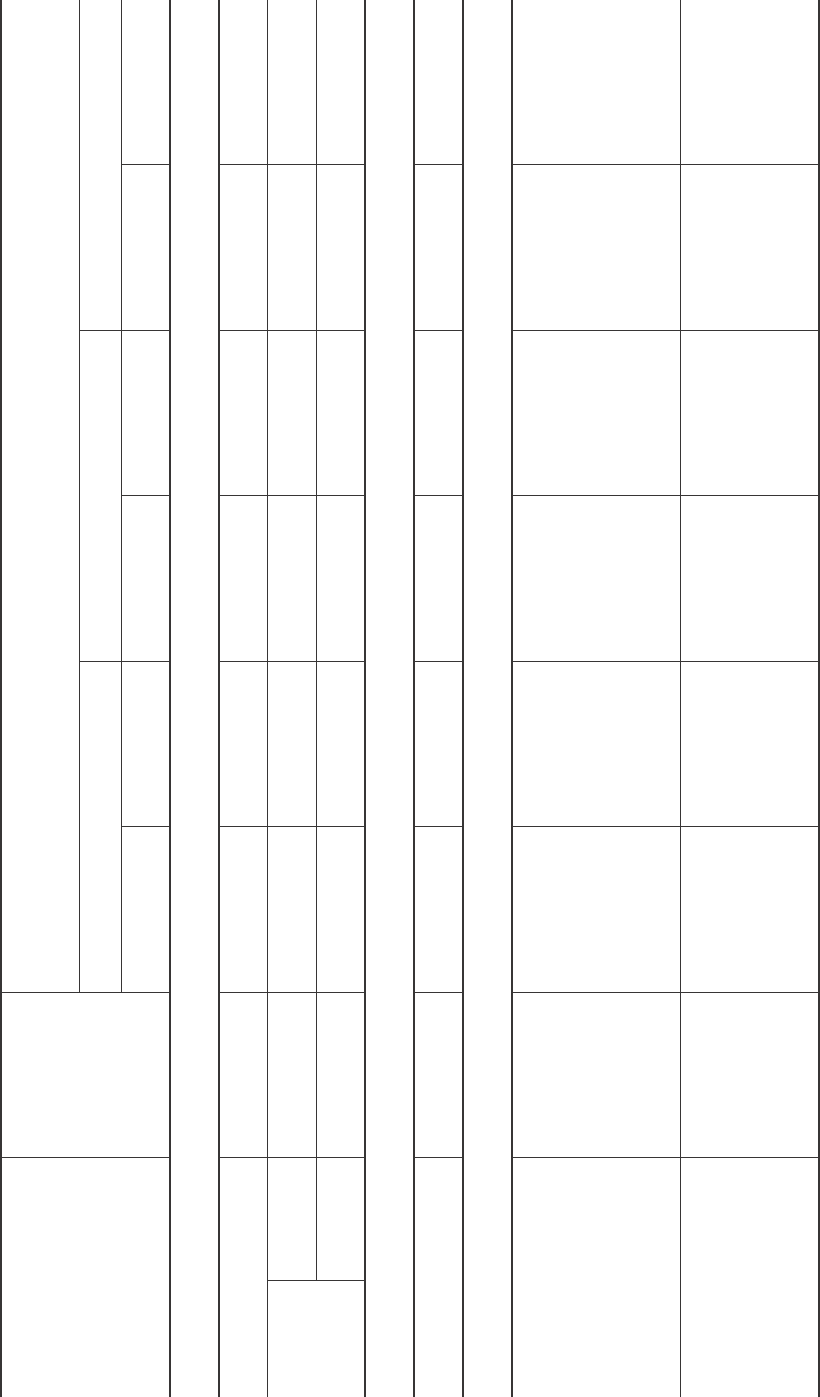
Гистология фрагментов кожи человека в зависимости от сроков культивирования in vitro с ЛККЧ
Histology of human skin fragments depending on in vitro culturing terms with LHCB
Примечание: группа II – фрагменты кожи, помещенные на поверхность культуральной среды (контроль); группа III – фрагменты кожи, помещенные на поверхность культуральной
среды, в которую добавляли 10% препарата ЛККЧ (опыт).
Notes: the 2
nd
group is the skin fragments, placed on a surface of cultural medium (control); 3
rd
group is the skin fragments, placed on a surface of cultural medium, supplemented with 10% LHCB
preparation (experiment).
èæîêûðóòêóðòÑ
serutcurtsnikS
îäàæîK
ÿèíàâîðèâèòüëóê
)Iàïïóðã(
gnirutlucerofebnikS
1(
ts
)puorg
àæîêÿàìåóðèâèòüëóK
èêòóñ,ÿèíàâîðèâèòüëóêèêîðÑ
niksderutluC
syad,smretgnirutluC
74112
IIàïïóðÃ
2
dn
puorg
IIIàïïóðÃ
3
dr
puorg
IIàïïóðÃ
2
dn
puorg
IIIàïïóðÃ
3
dr
puorg
IIàïïóðÃ
2
dn
puorg
IIIàïïóðÃ
3
dr
puorg
,ûðåìçàðåèíäåðÑ × 01
2
ìêì
,sezisegarevA × 01
2
µm
ñèìðåäèïÝ
simredipE
7,0±1,36,0±9,17,0±9,25,0±3,27,0±7,27,0±1,25,0±7,2
ûìðåäèîëÑ
sreyallamreD
éûâîê÷îñîñ
yrallipaP
4,1±4,014,1±4,311,2±3,011,2±8,99,2±0,113,1±3,61,1±3,6
éûòà÷òåñ
laniteR
9,3±2,749,6±4,363,3±8,470,9±8,158,6±6,578,3±0,338,8±0,56
)04.áî,01.êî(ÿèíåðçõÿëîï01ââîòñàëáîðáèôîâòñå÷èëîêååíäåðÑ
)04evitcejbo,01snel(sdleiflausiv01nistsalborbifforebmunegarevA
àìðåÄ
amreD
20,1±0,940,2±0,8155,2±3,735,1±6,172,01±3,26150,0±3,55,2±3,27
ðóòêóðòñåèíÿîòñîÑ
serutcurtsfoetatS
ûðóòêóðòñåûòñèíêîëîÂ
serutcurtssuorbiF
ÿàíüëåòèíèäåîÑ
îëõûðñüíàêò
èìûííåæîëîïñàð
èèìûâîíåãàëëîê
èìûâîíèòñàëý
èìàíêîëîâ
htiweussitevitcennoC
detacolylesool
dnasuonegalloc
srebifnitsale
çèüòåñÿàëõûÐ
èõûâîíåãàëëîê
íîêîëîâõûâîíèòñàëý
krowtenesooL
dnasuonegallocfo
srebifnitsale
çèüòåñÿàíòîëÏ
èõûâîíåãàëëîê
íîêîëîâõûâîíèòñàëý
krowtenesneD
dnasuonegallocfo
srebifnitsale
çèüòåÑ
èõûâîíåãàëëîê
íîêîëîâõûâîíèòñàëý
krowteN
suonegallocfo
srebifnitsaledna
çèüòåñÿàíòîëÏ
èõûâîíåãàëëîê
íîêîëîâõûâîíèòñàëý
krowtenesneD
suonegallocfo
srebifnitsaledna
èÿèöàçèíåãîìîÃ
äàïñàðéûòà÷áûëã
èõûâîíåãàëëîê
íîêîëîâõûâîíèòñàëý
adnanoitasinegomoH
dolc - foyacedekil
dnasuonegalloc
srebifnitsale
âåèíåîëññàÐ
õàêòñà÷óõûíüëåäòî
õûííå÷íîòñèâîê÷óï
èõûâîíåãàëëîê
íîêîëîâõûâîíèòñàëý
emosninoitailofxE
sehcnubfosetis
suonegallocdennihtfo
srebifnitsaledna
éèëåòèïýéûòñèçåëåÆ
ûëóêèëëîôåûíÿñîëîâè
muilehtiperaludnalG
selcillofriahdna
ûíàëòñûâûçåëåÆ
ìîäÿðìèíäî
õûíüëàèëåòèïý
êîòåëê
elgniserasdnalG - wor
lailehtipehtiwdeyalni
sllec
éûòñèçåëåÆ
íåíåìçèåíéèëåòèïý
raludnalgdegnahcnU
muilehtipe
îâòñå÷èëîK
õûíüëàèëåòèïý
õûòñèçåëåæâêîòåëê
õàðóòêóðòñ
îíå÷èëåâó
forebmundesaercnI
nislleclailehtipe
serutcurtsraludnalg
éûòñèçåëåÆ
íåíåìçèåíéèëåòèïý
raludnalgdegnahcnU
muilehtipe
éûòñèçåëåÆ
íåíåìçèåíéèëåòèïý
raludnalgdegnahcnU
muilehtipe
åûíâèòêóðòñåÄ
âÿèíåíåìçè
õûòñèçåëåæ
õàðóòêóðòñ
nisegnahcevitcurtseD
serutcurtsraludnalg
éûòñèçåëåÆ
íåíåìçèåíéèëåòèïý
raludnalgdegnahcnU
muilehtipe
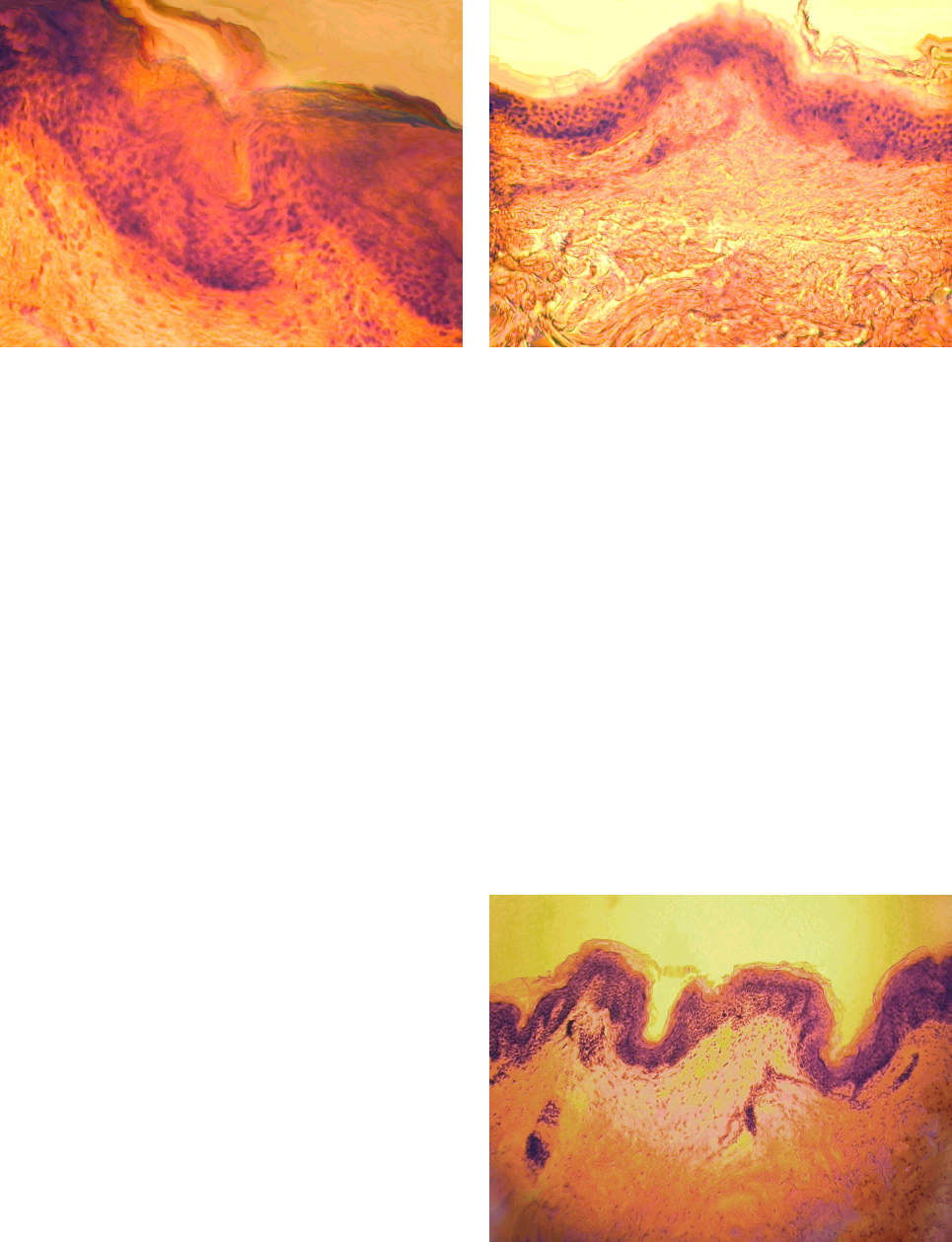
97
На 14-е сутки культивирования лоскутов кожи
без препарата ЛККЧ отмечалось уменьшение раз-
меров эпидермиса по сравнению с нормальной ко-
жей. Дермоэпидермальная граница контурирована
нечетко. В дерме структура соединительно-ткан-
ных волокон соответствовала нормальной коже
(рис. 4). Количество фибробластов достоверно
увеличивалось (Р < 0,05) по сравнению с нормаль-
ной кожей (таблица). В железах (потовых и саль-
ных), а также в волосяных фолликулах наблюда-
лась пролиферация эпителиальных клеток.
На 14-е сутки культивирования кожи с препара-
том ЛККЧ (рис. 5) размеры эпидермиса увеличива-
лись по сравнению с группой II в тот же срок куль-
тивирования, однако дифференциация его клеточ-
ных слоев была затруднена. В ростковом слое эпи-
дермиса обнаружены клетки в состоянии митоза.
Клетки базального слоя эпидермиса имели гипер-
хромные ядра и гиперацидофильную цитоплазму.
Дермоэпидермальная граница контурирована. В
дерме достоверно увеличивалось количество фиб-
робластов (Р < 0,05, таблица) по сравнению с их
содержанием в коже групп I и II, непосредственно
в сосочковом слое дермы. Фибробласты имели
гиперхромные ядра. Соединительная ткань была
представлена плотно расположенными пучками
коллагеновых и эластиновых волокон. Увеличива-
лось количество клеточных элементов, формирую-
щих волосяные и железистые структуры.
На 21-е сутки культивирования фрагментов
кожи группы II
без ЛККЧ в коже отмечены очаги
микронекроза. В эпидермисе увеличивались меж-
клеточные пространства, плохо дифференцирова-
лись слои, в клеточных элементах продолжались
Рис. 3. Кожа группы III на 7-е сутки культивирования в
присутствии препарата ЛККЧ (опыт). Окраска гемато-
ксилином и эозином, ×400.
Fig. 3. The 3
rd
group’s skin to the 7
th
culturing day at the
presence of LHCB preparation (experiment). Staining with
hematoxylin and eosin, ×400.
Рис. 4. Кожа группы II на 14-е сутки культивирования
(контроль). Окраска гематоксилином и эозином, ×240.
Fig. 4. The 2
nd
group’s skin to the 14
th
culturing day (con-
trol). Staining with hematoxylin and eosin, ×240.
growth epidermal layer the cells in mitotic stage were
revealed. Cells of basal epidermal layer had the hyper-
chromic nuclei and hyperacidophilic cytoplasm. Der-
moepidermal interface was contoured. Fibroblast num-
ber statistically and significantly increased (P < 0.05,
Table) compared to their content in skin of the 1
st
and
2
nd
groups, mostly in papillary derma layer. Fibroblasts
had hyperchromic nuclei. Connective tissue was repre-
sented with the tightly located bunches of collagenous
and elastin fibers. There was the augmentation of the
amount of cell elements, forming hair and glandular
structures.
To the 21
st
day of skin fragment culturing of the
2
nd
group free of LHCB, the micronecrotic foci were
Рис. 5. Кожа группы III на 14-е сутки культивирования
в присутствии препарата ЛККЧ (опыт). Окраска гемато-
ксилином и эозином, ×120.
Fig. 5. The 3
rd
group’s skin to the 14
th
culturing day at the
presence of LHCB preparation (experiment). Staining with
hematoxylin and eosin, ×120.
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1

98
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1
дистрофические и некротические процессы
(рис. 6). Ядра эпителиальных клеток в большин-
стве наблюдений были пикнотичны, цитоплазма
их вакуолизирована. Отмечалась нечеткость
границы между эпидермисом и дермой, наблюда-
лись единичные очаги клеточного детрита. В дерме
происходила дезорганизация соединительной
ткани в виде гомогенизации и глыбчатого распада
коллагеновых и эластиновых волокон, количество
фибробластов среди них достоверно (Р < 0,05)
уменьшалось по сравнению с их содержанием в
нормальной коже и в образцах кожи контрольной
группы в предыдущие сроки культивирования
(таблица). Наблюдались отечность и деструкция
железистых структур и волосяных фолликулов.
При культивировании фрагментов кожи группы
III с добавлением ЛККЧ на 21-е сутки только в
отдельных участках отмечались отслоение эпидер-
миса и микроочаги клеточного детрита (рис. 7).
Толщина эпидермиса кожных эксплантатов досто-
верно не изменялась по сравнению с 14 сутками
культивирования, клетки базального слоя остава-
лись активными. Граница между эпидермисом и
дермой была четко выражена. В дерме сохранялось
достоверно высокое (Р < 0,05) количество фибро-
бластов по сравнению с их количеством в коже
групп I и II в предыдущие сроки наблюдения (таб-
лица). В сетчатом слое дермы четко контурирова-
лись коллагеновые и эластиновые волокна, однако
в отдельных участках их плотность уменьшалась
по сравнению с 14 сутками культивирования, тогда
как в других участках фрагментов кожи сохраня-
лась плотная волокнистая структура соединитель-
ной ткани. Морфология дериватов дермы не изме-
нялась.
Рис. 7. Кожа группы III на 21-е сутки культивирования
в присутствии препарата ЛККЧ (опыт). Окраска гемато-
ксилином и эозином, ×240.
Fig. 7. The 3
rd
group’s skin to the 21
st
culturing day at the
presence of LHCB preparation (control). Staining with
hematoxylin and eosin, ×240.
Рис. 6. Кожа группы II на 21-е сутки культивирования
(контроль). Окраска гематоксилином и эозином, ×120.
Fig. 6. The 2
nd
group’s skin to the 21
st
culturing day (con-
trol). Staining with hematoxylin and eosin, ×120.
noted in a skin. The intercellular spaces were increased
in epidermis, the layers were poorly differentiated, the
dystrophic and necrotic processes were in progress in
cell elements (Fig. 6). Epithelial cell nuclei in the
majority of observations were picnotic with vacuolated
cytoplasm. A vague interface between epidermis and
derma was observed, the single foci of cell detritus
were noted. The disorganisation of connective tissue
in the form of homogenisation and clod-like decay of
collagenous and elastin fibers occurred, the fibroblast
amount between them statistically and significantly
(P < 0.05) reduced if compared to their content in nor-
mal skin and the control group’s skin samples in pre-
vious culturing terms (Table). The swelling and dest-
ruction in glandular structures and hair follicles were
observed.
When culturing the 3
rd
group’s skin fragments with
LHCB addition, the exfoliation and cell detritus
microfoci were noted only in some sites to the 21
st
day (Fig. 7). Epidermis thickness of skin explants was
statistically and significantly unchanged compared to
the 14
th
culturing day, cells of basal layer remained
active. The interface between epidermis and derma
was distinctly manifested. Statistically and significant-
ly high (P < 0.05) fibroblast number was preserved in
derma if compared to their amount in the skin of the
1
st
and 2
nd
groups within previous observation terms
(Table). In a retinal dermal layer the collagenous and
elastin fibers were distinctly contoured, but in some
sites their density reduced compared to the 14
observation days, meanwhile in other sites of skin
fragments a dense fibrous structure of connective
tissue was preserved. The morphology of dermal deri-
vates was unchanged.
99
PROBLEMS
OF CRYOBIOLOGY
Vol. 19, 2009, ¹1
ÏÐÎÁËÅÌÛ
ÊÐÈÎÁÈÎËÎÃÈÈ
Ò. 19, 2009, ¹1
Âûâîäû
Описанный вариант культивирования позволяет
поддерживать in vitro фрагменты кожи в течение
14 суток практически без изменения их гистологи-
ческого строения и может использоваться как
модель для изучения влияния различных препара-
тов на свойства эксплантатов кожи.
При культивировании фрагментов кожи in vitro
препарат ЛККЧ, внесенный в среду культивиро-
вания, обеспечивает возможность поддерживать
фрагменты кожи в жизнеспособном состоянии в
течение 21 суток.
В присутствии ЛККЧ увеличивается количество
фибробластов и волокнистых структур в дерме, что
позволяет предполагать эффект стимуляции про-
цессов пролиферации и биосинтетической функ-
ции фибробластов.
Под влиянием ЛККЧ увеличиваются количест-
во пролиферирующих клеток в кожных экспланта-
тах, культивируемых in vitro, а также количество
волосяных фолликулов.
Литература
Волков А.В. Краткий обзор коммерчески доступных кле-
точных продуктов для восстановления кожных покровов //
Клеточная трансплантология и тканевая инженерия.–
2007.– №4 (6).– С. 62–65.
Лакин Г.Ф. Биометрия.– М.: Высш. школа, 1980.– 295 с.
Морозова Р.П., Козулина Е.П., Николенко И.А. Плацента –
источник биологически активных веществ // Укр. биохим.
журнал.– 1999.– Т. 71, №4.– С. 21–29.
Цуцаева А.А., Кудокоцева О.В., Щеглов А.В. и др. Кордовая
кровь как компонент поддерживающей терапии // Пробл.
криобиологии.– 2001.– №3.– С. 93–99.
Цуцаєва А.О., Глушко Т.О., Лобасенко Н.П. та інш. Гемо-
корд – препарат комплексної терапії // Трансплантологія.–
2003.– Т. 4, №1.– С. 46–48.
Badiavas E.V., Abedi M., Butmarc J. et al. Participation of
bone marrow derived cells in cutaneous wound healing // J.
Cell. Physiol.– 2003.– Vol. 196, N2.– P. 245–250.
Hematti P., Sloand E.M., Carvallo C.A. et al. Absence of donor-
derived keratinocyte stem cells in skin tissues cultured from
patients after mobilized peripheral blood hematopoetic stem
cell transplantation // Exp. Hematol.– 2002.– Vol. 30, N8.–
P. 943–949.
Krause D.S., Theise N.D., Collector M.I. et al. Multi-organ,
multi-lineage engraftment by a single bone marrow-derived
stem cell // Cell.– 2001.– Vol. 105, N3.– P. 369–378.
Поступила 04.06.2008
Рецензент Т.М. Шарлай
1.
2.
3.
4.
5.
6.
7.
8.
References
Volkov A.V. Brief review of commercially available cell
products to recover skin integuments // Cell transplantology
and tissue engineering.– 2007.– N4 (6).– P. 62–65.
Lakin G.F. Biometry.– Moscow: Vysshaya shkola, 1980.– 295p.
Morozova R.P., Kozulina E.P., Nikolenko I.A. Placenta is the
source of biologically active substances // Ukr. Biokhim. Zh.–
1999.– Vol. 71, N4.– P. 21–29.
Tsutsayeva A.A., Kudokotseva O.V., Scheglov A.V. et al. Cord
blood as a component of supporting therapy // Problems of
Cryobiology.– 2001.– N3.– P. 93–99.
Tsutsayeva A.O., Glushko T.O., Lobasenko N.P. et al.
Hemocord is the preparation of a combined therapy //
Transplantologiya.– 2003.– Vol. 4, N1.– P. 46–48.
Badiavas E.V., Abedi M., Butmarc J. et al. Participation of
bone marrow derived cells in cutaneous wound healing // J.
Cell. Physiol.– 2003.– Vol. 196, N2.– P. 245–250.
Hematti P., Sloand E.M., Carvallo C.A. et al. Absence of donor-
derived keratinocyte stem cells in skin tissues cultured from
patients after mobilized peripheral blood hematopoetic stem
cell transplantation // Exp. Hematol.– 2002.– Vol. 30, N8.–
P. 943–949.
Krause D.S., Theise N.D., Collector M.I. et al. Multi-organ,
multi-lineage engraftment by a single bone marrow-derived
stem cell // Cell.– 2001.– Vol. 105, N3.– P. 369–378.
Accepted in 04.06.2008
1.
2.
3.
4.
5.
6.
7.
8.
Conclusions
The described version of culturing enables the in
vitro maintaining of skin fragments within 14 days
with their practically unchanged histological structure
and may be used as the model to study the effect of
different preparations on skin explant peculiarities.
During skin fragment in vitro culturing the LHCB
preparation, added into culturing medium, provides
the possibility to maintain the skin fragments in a
viable state for 21 days.
At the LHCB presence the number of fibroblasts
and fibrous structures in derma augments, that enables
to assume the stimulation effect of proliferation
processes and fibroblasts’ biosynthetic function.
Under LHCB effect there is an increase in the
number of proliferating cells in skin explants, in vitro
cultured, as well as the augmentation of hair follicle
number.
