Журнал Биотехнологии. Теория и практика. 1, 2010 г
Подождите немного. Документ загружается.


71Биотехнология. Теория и практика. №1 2010
Материалы и методы
Поиск возможных белков для ис-
пользования в диагностической имму-
ноферментной тест-системе для диагнос-
тики ящура проводили с использо ванием
баз данных PubMed NCBI (http://www.
ncbi.n1m.nih.gov/pubmed) и GenBank NCBI
(http://www.ncbi.nlm.nih.gov/genbank).
Анализ первичных структур проводился
с использованием пакета программ
Vector NTI 9.0 (Informax, США). Синтез
производили фосфоамидитным способом
на автоматическом синтезаторе ASM-700
(BIOSSET, Россия).
В работе использовали штаммы
Е. coli DH5a и B834(DE3) (Novagen,
USA), плазмидные векторы pGEM-
TEasy (Promega, USA), pET15b и pET32a
(Novagen, США). Выделение плазмидной
ДНК, а также препаративное разделение
фрагментов ДНК проводили методами,
описанными Маниатисом с соавт. [2].
Для лигирования фрагментов ДНК
использовали ДНК-лигазу фага Т4
производства «Promega» (США). Первич-
ную структуру ДНК определяли по методу
Sanger [3] с использованием наборов BigDye
на автоматических анализаторах ДНК ABI
Prism 3100 (Applied Biosystems, США).
Наработка и очистка рекомбинантного
белка. Полученными плазмидами транс-
формировали компетентные клетки E.
coli штамма B834(DE3), трансформантов
высевали на селективную среду с ампи-
циллином (100 мкг/мл). Выросшими коло-
ниями инокулировали 100 мл среды 2xYT
(ампициллин 100 мкг/мл), культивировали
до OD
600
~ 0.8 при 37
o
C. Затем индуцировали
экспрессию гена добавлением IPTG до
концентрации 0,1 мМ. После добавления
индуктора температуру культивирования
снижали до 30
о
С и культивировали
индуцированную культуру 4-5 часов.
После этого клетки собирали центри-
фугированием (3000g 15’), промывали
небольшим объемом охлажденного буфера
(25 мМ натрий-фосфатный буфер рН 7.4,
400 мМ NaCl) и разрушали ультразвуком,
следуя рекомендациям производителя
прибора. Полученный лизат осветляли
центрифугированием (40 000g 45’). Реком-
бинантный белок очищали на колонке
HisTrap (Amersham) c использованием
хроматографической системы AktaFPLC
(Amersham).
Денатурирующий диск-электрофорез
белков проводили в вертикальной камере
(«Хеликон», Россия) в стеклах 10x8 см.
Нижний, разделяющий, гель имел размеры
5х8 см. При проведении электрофорезы
использовались гели и буферы следую-
щих составов. Разделяющий: 12% поли-
акриламид (акриламид: метилен бис-
акри ламид в соотношении 29:1); буфер
разде ляющего геля: 0,375М Трис-HCl
pH8,8; 0,1% SDS.
Концентрирующий гель: 5% поли ак-
риламид (акриламид: метиленбисак ри ламид
в соотношении 29:1); буфер разде ляющего
геля: 0,125М Трис-HCl pH6,8; 0,1% SDS.
Электродный буфер: 25 мМ Трис-
ОН; 250 мМ глицин; 0,1% SDS. Условия
проведения электрофореза: 25 мА на один
гель, разделение проводилось до выхода
красителя (бромфенолового синего) из геля.
результаты и обсуждение
Большинство из описанных в лите-
ратуре тест-систем для диагностики
ящура используют в качестве антигенов
неструктурные белки вируса ящура 3А,
3В, 3С. При этом, наиболее эффективным
является использование белка 3А, пос-
кольку он наиболее консервативен среди
неструктурных белков вируса [4, 5, 6, 7]. Более
того, обнаружение антител к неструктурным
белкам Lb, 2C, 3A или 3D, является сви-
детельством предыдущей инфекции FMD
вируса, с четким исключением некото рых
старых, многократно привитых живот ных
[8]. На основании изложенных данных,
мы предприняли сравнительный анализ
первичных структур известных последо-
вательностей гена неструктурного белка 3А
штаммов О и А.

72 Биотехнология. Теория и практика. №1 2010
Сравнительный анализ показал, что
основные различия в аминокислотных
последовательностях сосредоточены в
С-концевой части полипептидной цепи.
Например, по аминокислотам в области
119–122 идентичные последовательности
наблюдались только у вирусов типа А,
Азия 1 и О. Тогда как аминокислотная
последовательность в области 1–100
была почти полностью идентична у всех
типов вирусов, кроме некоторых областей
аминокислотных остатков, таких как 65-74.
Степень идентичности белков при этом
составляет приблизительно 68%, а степень
родства последовательностей – 96,7%.
Далее нами был проведен анализ
распределения возможных эпитопов в
первичных последовательностях выбран-
ных белков. Анализ проводился с исполь-
зованием программного пакета Vector
NTI 9.0 по алгоритму [9]. В качестве ана-
лизируемой последовательности была
использована первичная структура кон-
сенсусного полипептида, полученного в
результате выравнивания первичных струк-
тур неструктурных белков 3А различных
штаммов вируса ящура. Результаты про-
веденного исследования представлены на
рисунке 1.
Рис. 1. антигенность участков полипептидной
цепи консенсусного неструктурного белка вируса
ящура 3а.
В результате проведенного анализа
выявлено, что С-концевая, вариабельная
часть полипептида обладает невысокой
антигенностью. Исходя из этого, в даль-
нейшей работе было решено исполь зовать
участок полипептидной цепи неструк-
турного белка 3А без его С-концевой части.
С учетом полученных данных проведен
дизайн и синтез 3 олигонуклеотидов: 2
праймера, комплементарных 5'-концевой
последовательности гена и один праймер,
комплементарный 3'-концевой области
гена. Первичные структуры подобранных
олигонуклеотидов представлены в таблице 1.
Таблица 1
Первичные структуры подобранных олигонуклеотидов для ПЦр амплификации
Наиме нование Последовательность 3' - 5' Длина
3AFbam GGAТССТСAAGGAGGAGCTCCGGCC
BamHl
25 нт
3AFnde САТАTGTCAAGGAGGAGCTCCGGCC
Ndel
25 нт
3Arev CTCGAGCAG AGGGTTCTTTTCCGCC
Xhol
25 нт
В 5'-концевые области подобранных
олигонуклеотидов дополнительно вво-
дились сайты узнавания эндонуклеаз
рестрикции BamHl, Ndel и Xhol. Данные
сайты рестрикции необходимы для
последующего клонирования полученных
амплифицированных генов в составе
экспрессирующих плазмидных векторов.
Получение 3AFbam и 3AFnde праймеров
с сайтом рестрикции в 5’-концевой части
праймеров было связано необходимостью
последующего клонирования в составе
разных векторных систем.
В результате, участок гена 3А, ко-
дирующий полипептид из аминокис лот ных
остатков с 1-го по 113-й, был амплифи-
цирован с помощью полимеразной цепной
реакции с использованием праймеров
73Биотехнология. Теория и практика. №1 2010
3AFbam, 3AFnde и 3Arev, имеющих в своем
составе сайты узнавания для рестриктаз
BamHl, Ndel и Xhol соответственно.
Продукт амплификации был клонирован
в составе промежуточного плазмидного
вектора pGEM-TEasy.
После отбора клонов, содержащих
участок исследуемого гена, было про-
ведено определение нуклеотидной после-
довательности клонированных участков.
В результате сиквенирования было пока-
зано, что клонированный участок по
нуклеотидной последовательности соот-
ветствует последовательности гена участка
неструктурного белка ЗА вируса ящура
штамма А.
Для получения штамма – продуцента
3А неструктурного белка вируса ящура
нами было проведено конструирование
экспрессионного плазмидного вектора.
Для этого плазмиды, полученные в ходе
выполнения первого этапа работы, были
обработаны парами эндонуклеаз рестрикции
NdeI-XhoI или BamHI-XhoI. После гид-
ролиза отщепленные фрагменты ДНК,
соответствующие генам выбранных белков,
препаративно очищали электрофорезом в
агарозном геле и клонировали в составе
плазмидных векторов pET15b и pET32a,
обработанных теми же эндонуклеазами
соответственно.
В результате этого, после селективного
отбора выросших трансформантов и их
PCR-анализа, нами были получены два
экспрессионных плазмидных вектора.
Один из них, сконструированный на
основе плазмиды pET15b, содержал в
своем составе ген белка 3А, к N-концевой
части которого был присоединен
гистидиновый гексапептид, необходимый
для последующей эффективной очистки
методом аффинной металл-хелатирующей
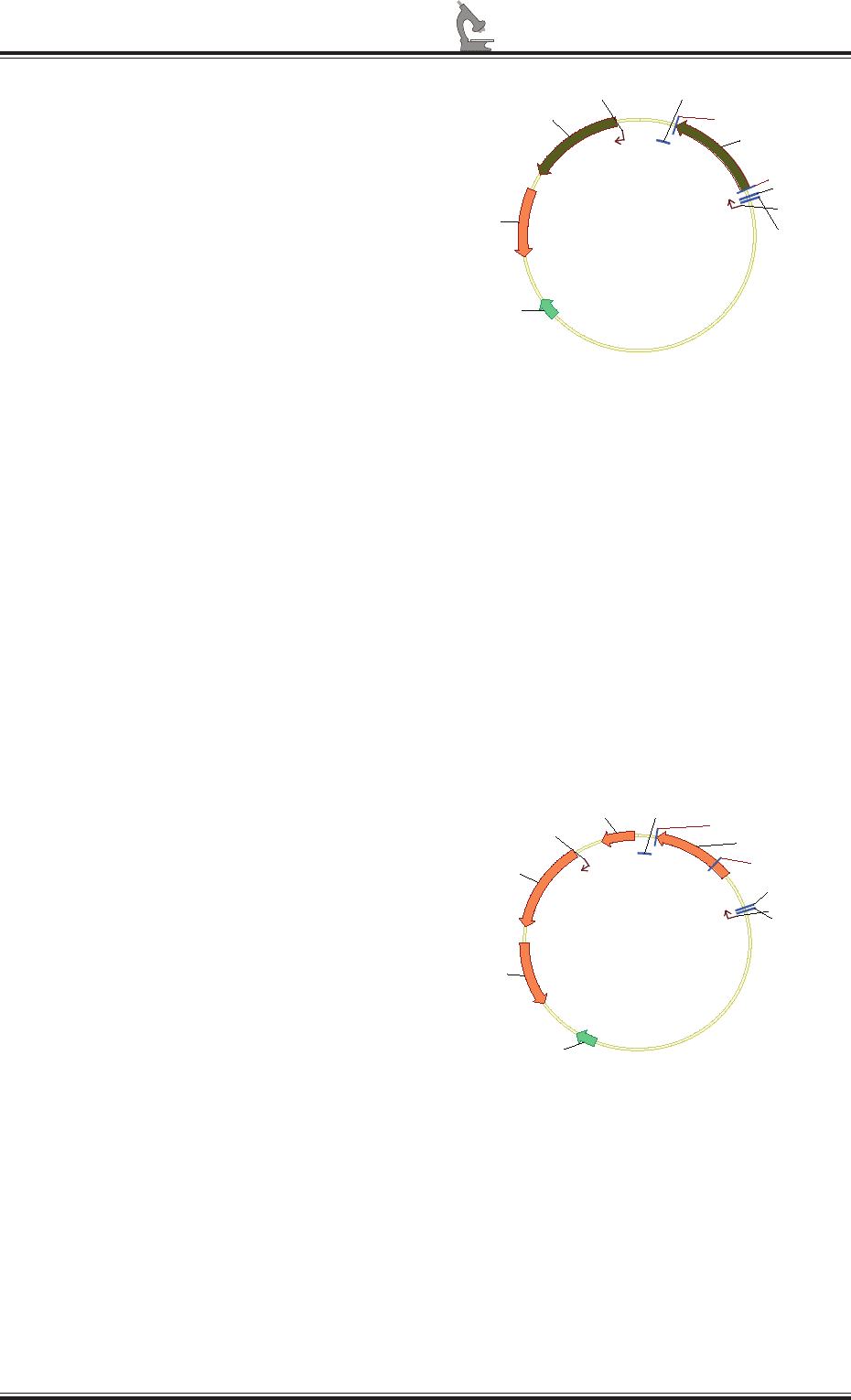
хроматографии (рис. 3). Этот вектор полу-
чил название p15/3А.
p15/3A
6585 bp
Ampicillin
6xHis-3A
T7 transl en RBS
lacO
ROP
T7 promoter
AmpR promoter
pBR322 origin
T7 terminator
Nde I (1209)
Xho I (325)
Рис. 3. Схема экспрессионного вектора p15/3A,
полученного на основе плазмиды pET15b.
Ген неструктурного белка 3А (6xHis-3A) был
клонирован по сайтам рестрикции NdeI и XhoI
Другой экспрессионный вектор, полу-
ченный на основе плазмиды pET32a, нес
ген того же белка, слитого с тиоредоксином
А E. coli, что необходимо для потен ци-
ального увеличения растворимости реком-
бинантного полипептида. Эта плаз мида
получила название p32/3А. У такого слитого
рекомбинантного белка гистидиновый
гексапептид распола гался в линкерном
участке между последо вательностями тио-
редоксина А и антигена (рис. 4).
p32/3A
6459 bp
Ampicillin
TrxA-3A
T7 transl en RBS
lacO
ROP
T7 promoter
AmpR promoter
pBR322 origin
f1 origin
T7 terminator
BamHI (758)
Xho I (159)
Рис. 4. Схема экспрессионного вектора p32/3A,
полученного на основе плазмиды pET32a.
Ген неструктурного белка 3А (TrxA-3A)
был клонирован по сайтам рестрикции BamHI
и XhoI. Предполагаемым белковым продуктом
экспрессии клонированного гена является слитой
полипептид, содержащий в N-концевой части
последовательность тиоредоксина А E. coli.
Для оценки эффективности полу чен -
ных экспрессионных векторов, каждой

74 Биотехнология. Теория и практика. №1 2010
полученной плазмидой были трансфор-
мированы компетентные клетки E. coli
штамма В834(DE3). В результате было
выявлено, что все клоны, содержащие
полученные рекомбинантные конструкции,
демонстрировали примерно одинаковый
уровень продукции потенциальных анти-
генов. Таким образом, было проде мон-
стрировано отсутствие клоновой зависи-
мости в экспрессии клонированных генов
исследуемого белка. Исходя из этого, в
дальнейшей работе использовали произ-
вольно выбранные клоны штаммов-проду-
центов.
Для определения оптимальных пара-
метров культивирования штаммов-проду-
центов неструктурного белка 3А вируса
ящура, исследовали лока лиза цию реком-
бинантных белков в двух штаммах-
продуцентах E. coli B834(DE3), транс-
формированных p15/3А и p32/3А. Для
этого штаммы-продуценты, трансфор ми-
рованные соответствующими векторами,
культивировали в среде 2хYT до дости-
жения оптической плотности OD
600
= 0.8,
добавляли индуктор (изопропил-b,D-
тиогалактопиранозид) до концентрации
0.1 мМ и продолжали культивирование
в течение 2-х часов. После этого клетки
собирали центрифугированием, осадок
клеток ресуспендировали в 1/10 объема
буфера (25 мМ натрий-фосфатный буфер рН
7.4, 400 мМ NaCl), разрушали ультразвуком.
Растворимую и нерастворимую фракции
разделяли центрифугированием (40000g,
30 мин) и анализировали фракции с
помощью денатурирующего электрофореза
в полиакриламидном геле. Полученные
результаты приведены в таблице 2.
Таблица 2
Локализация рекомбинантных белков
при их продукции в клетках E. coli
Штамм-
продуцент
E. coli
Локализация рекомбинантного
белка
растворимая
фракция
нерастворимая
фракция
B834/p15/3А - +
B834/p32/3А +/- +
На основании полученных результатов
было принято решение оптимизировать
условия экспрессии клонированных генов
только штамма, трансформированного
плазмидой, полученной на основе вектора
pET32a (p32/3А), поскольку уровень
накопления рекомбинантного белка в таких
клетках был выше, чем при использовании
вектора p15/3A.
Оптимизация параметров гетероло-
гичной экспрессии клонированных генов
подразумевает, в первую очередь, выбор
условий культивирования штаммов-про-
дуцентов для максимизации продукции
рекомбинантных белков. Основными пара-
метрами культивирования с целью продук-
ции неструктурного белка вируса ящура
3А являются концентрация индуктора
экспрессии изопропил-b,D-тиогалак топи ра-
нозда (IPTG) и температура среды при инку-
бации после внесения в среду индуктора.
В ходе оптимизации продукции реком-
бинантного белка для штамма-продуцента
были протестированы сле дующие пара-
метры культивирования: концен трации ин-
дуктора 0,1 мМ, 0,25 мМ, 0,5 мМ, 1 мМ;
температуры питательной среды 30
о
С и
37
о
С. При этом оценивалось относи тельное
содержание рекомбинантного белка массой
29 кДа в нерастворимой фракции лизатов
штамма-продуцента. Полученные данные
представлены в таблице 3.
Таблица 3
Относительные количества рекомбинантного белка 3а (29 кДа) в нерастворимых
фракциях лизатов штаммов-продуцентов при различных условиях индукции
экспрессии. н/д – не детектируется
0,1 mM IPTG 0,25 mM IPTG 0,5 mM IPTG 1 mM IPTG
30°С
18% 15% 10% н/д
37°С
8% н/д н/д н/д
75Биотехнология. Теория и практика. №1 2010
Как следует из приведенных данных,
для всех выбранных для даль нейшей
работы штаммов-продуцентов макси маль-
ная продукция рекомбинантного белка
в нерастворимой фракции отмечена при
следующих условиях культи виро вания:
концентрация индуктора 0,1 мм, темпера-
тура культивирования после индук ции
экспрессии 30
о
С.
Далее нами был разработан протокол
очистки рекомбинантного неструктурного
белка 3А вируса ящура. Клетки E. coli,
содержавшие наработанный химерный
рекомбинантный белок, осаждали центри-
фугироваием при 3000g в течение 20 минут,
осадок промывали 1/3 объема физраствора,
центрифугировали при 3000g 20 минут
и ресуспендировали в 10-30 мл буфера
(А) для металл-аффинной хроматографии
(25 мМ натрий-фосфатный буфер рН 7.4,
400 мМ NaCl, 20 mM имидазол). Клетки
разрушали ультразвуком (22kHz, 4 раза
по 20 секунд), нерастворимую фракцию
отделяли центрифугированием при 50000g
в течение 45 минут. Нерастворимую фрак-
цию (осадок) ресуспендировали в 10 мл
25 мМ буфера (А) для металл-аффин ной
хроматографии с 8М мочевиной, инку-
бировали 1 час на магнитной мешалке,
затем центрифугировали при 50000g в
течение 45 минут. Полученный таким
образом осветленный лизат фильтровали
через нейлоновый фильтр (диаметр пор
0,45 мкм) и подвергали металл-аффинной
хроматографии. Рекомбинантный белок
очищали на колонке HisTrap (Amersham,
США) c использованием хромато гра-
фической системы AktaFPLC (Amersham,
США). Элюцию проводили буфером (Б)
(25 мМ натрий-фосфатный буфер рН
7.4, 400мМ NaCl, 300 mM имидазол, 8М
мочевина).
Ренатурацию рекомбинантного белка
проводили с помощью диализа против
300-кратного объема 25 мМ натрий-
фосфатного буфера рН 7.25 с 300 мМ
NaCl. Исходный лизат, растворимую и
нерастворимую фракции, а также элюат и
ренатурированный белок анализировали
денатурирующим электрофорезом в 12%
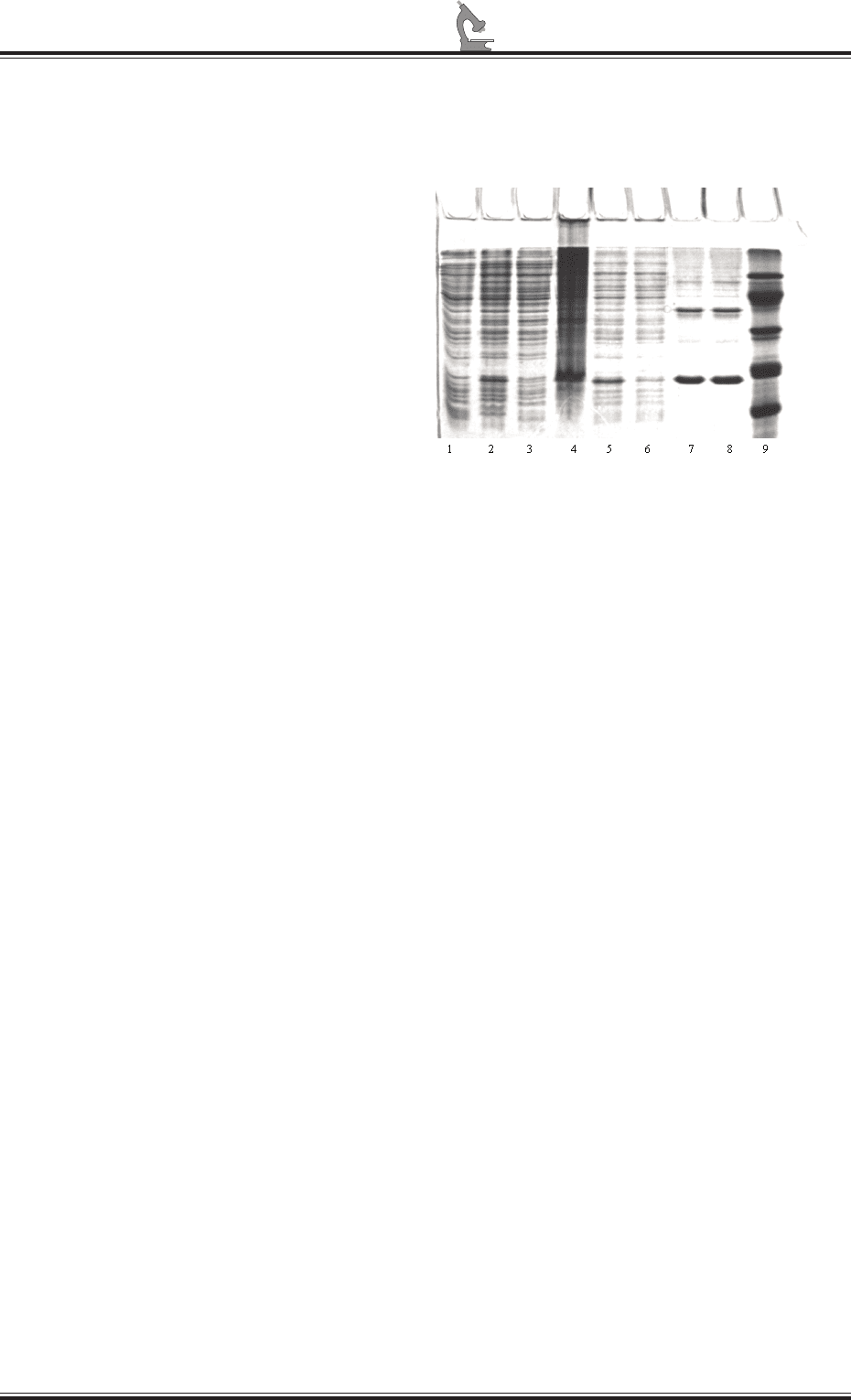
ПААГ (рис. 5).
97 кДа
60 кДа
45 кДа
30 кДа
20 кДа
мм
Рис. 5. Электроферез лизатов трансфор миро-
ванных клеток E.coli и очищенных рекомби-
нантных неструктурных белков вируса ящура
1 – лизат клеток E.coli (В-834) до индукции IPTG
2 – лизат E.coli (В-834) после индукции IPTG
3 – супернатант после разрушения клеток E.coli
(В-834) ультразвуком в 1
х
PBS
4 – осадок после разрушения клеток E.coli (В-834)
ультразвуком в 1
х
PBS
5 – супернатант после растворения телец вклю-
чения в 1
х
PBS с 8М мочевиной
6 – хроматография на Ni-агарозе, проскок
7 – хроматография на Ni-агарозе, элюат
8 – элюат после диализа
9 – маркер молекулярной массы белка (20 кДа,
30 кДа, 45 кДа, 66 кДа, 97 кДа)
Как видно из представленных дан-
ных, в ходе проделанной работы нам
удалось получить препарат очищенного
рекомбинантного белка 3А вируса ящура.
Присутствие дополнительных полос на
электрофореграмме в образцах элюата
и ренатурированного белка (треки 7 и 8)
объясняется наличием некоторого коли-
чества контаминантных белков штамма-
продуцента E. coli. Однако, с нашей точки
зрения, такая степень очистки реком-
бинантного белка достаточна для его
исполь зования в качестве антигена в
иммуно ферментной тест-системе для
диагностики наличия антител к вирусу –
возбу дителю ящура в сыворотки крови
животных.

76 Биотехнология. Теория и практика. №1 2010
Выводы
На основе плазмидных векторов pЕТ15
и pЕТ32 были созданы генетические
конструкции pЕТ15/3А и pЕТ32/3А, не-
сущие ген неструктурного белка 3А вируса
ящура.
Получен штамм-продуцент E. coli (В-
834) рекомбинантного неструктурного белка
3А вируса ящура и отработаны параметры
культивирования, позволяющие усилить
продуктивность полученных штамм -
продуцентов.
Предложен и реализован протокол
выделения, очистки и ренатурации ре-
комбинантного неструктурного белка 3А
вируса ящура с помощью металл-аффинной
хроматографии и последующего диализа.
Литература
1. Berger H.G., Straub O.C., Ahl R., Tesar M., Marquardt O. Identication of foot-and-mouth disease
virus replication in vaccinated cattle by antibodies to non-structural virus proteins // Vaccine. - 1990.
- Vol. 8. - P. 213-216.
2. Маниатис Т., Фрич Э., Сэмбрук Дж. Молекулярное клонирование. - М.: Мир, 1982.
3. Sanger F., Nicklen S., Coulson A. DNA sequencing with chain-terminating inhibitors. // Proc. Natl.
Acad. Sci. USA, 1977, v. 74, pp. 5463-5467.
4. De Diego M, Brocchi E, Mackay D, De Simone F. The non-structural polyprotein 3ABC of foot-and-
mouth disease virus as a diagnostic antigen in ELISA to differentiate infected from vaccinated cattle
// Arch Virol. 1997;142(10):2021-33.
5. Clavijo A., Wright P., Kitching P. Developments in diagnostic techniques for differentiating infection
from vaccination in foot-and-mouth disease // Vet J. 2004 Jan;167(l):9-22.
6. Kitching R.P. Identication of foot and mouth disease virus carrier and subclinically infected animals
and differentiation from vaccinated animals // Rev Sci Tech. 2002 Dec;21(3):531-8.
7. Paton D.J., de Clercq K., Greiner M., Dekker A., Brocchi E., Bergmann I., Sammin D..J, Gubbins
S., Parida S. Application of non-structural protein antibody tests in substantiating freedom from
foot-and-mouth disease virus infection after emergency vaccination of cattle // Vaccine. 2006 Oct
30;24(42-43):6503-12. Epub 2006 Jul 5.
8. D.K.J. Mackay, M.A. Forsyth, P.R. Davies, A. Berlinzanij, G.J. Belsham”, M. Flint and M.D. Ryan.
Differentiating infection from vaccination in foot-and-mouth disease using a panel of recombinant,
non-structural proteins in ELISA// Vaccine. 1998, Vol. 16, No. 5, pp. 446-459.
9. Welling G.W., Weijer W.J., van der Zee R., Welling-Wester S. Prediction of sequential antigenic
regions in proteins. FEBS Lett. 1985 Sep 2; 188(2):215-8.
Түйін
Жүргізілген жұмыс нәтижесінде E. coli 3А аусыл вирусының рекомбинантты құрылымсыз
белогына штамм-продуцент алынды және рекомбинантты белокты бөлудің хаттамасы әзірленді,
штамды өсірудің параметрлері оңтайландырылды.
Summary
A strain producer of a non-structural protein of a foot-and-mouth virus was produced from E.coli;
strain cultivation characteristics were optimized and a purication protocol of a recombinant protein was
developed.

77Биотехнология. Теория и практика. №1 2010
ӘОж 576.3:599.323.4:591.44
еГеУқұйрықтың тері аСты ШаНДырЛарыНаН БөЛіНіП аЛыНғаН
LYVE-1+МаКрОФаГтарДың ФУНКЦиОНаЛДық БеЛСеНДіЛіГі
В.Т. Кумашева
1
, Ғ.А. Даңлыбаева
2
, В.Б. Огай
1, 2
ogay76@gmail.com
1
Л.Н. Гумилев атындағы Еуразия ұлттық университеті, Астана қ.
2
«Қазақстан Республикасы Ұлттық биотехнология орталығы» РМК, Астана қ
Бұл жұмыста тері асты шандырларынан бөлініп алынған LYVE-1+ макрофагтарының функционалдық
белсенділігін анықтау үшін иммунофлуоресцентті талдау және ІНФ-α (ФНО-α) анықтау үшін цитотоксикалық
тест пайдаланылды. LYVE-1+макрофагтардың гиалуронан қышқылын байланыстыру және оны сіңіру
қасиетіне ие екені байқалды. Сонымен қатар LYVE-1+ макрофагтарының ІНФ-α өндіруші белсенділігі
перитонеалдық қуыс макрофагтарына қарағанда жоғары. Әдебиеттер және біздің мәліметтер бойынша
LYVE-1+ макрофагтар лимфалық тамырлары жоқ егеуқұйрық тері асты шандырларының гиалурон қышқылы
метаболизміне, гомеостазына қатысады.
Кіріспе
LYVE-1 лимфалық тамыр эндоте-
лиі нің жақында табылған арнайы гиалу-
ронат рецепторы болып табылады. Бұл
лейкоциттер және мезенхималды жасу ша-
ларда кеңінен экспрессияланатын гиалу-
ронат рецепторы CD44-пен жалпы құры-
лымдық және функционалдық ұқ састық тары
бойынша анықталды [1-3]. Лимфа және қан
тамыры дифференциа циясында маңызды
рөл атқаратын LYVE-1 рецепторы 1999ж.
Д. Джексон арқылы табылған. LYVE-1
рецепторы мембранды интег ралды гли-
копротеин болып табылады [1].
Бастапқы зерттеулерде LYVE-1 тек
қана лимфалық тамыр эндотелиінде
және бауыр мен көкбауыр синусоидты
эндотелиінде экспрессияланғаны баян-
далған [1, 2, 4-6]. Бірақ кей мәліметтер
лимфалық тамыр эндотелиінен басқа LYVE-
1 рецепторының макромолекулалардың
қал дықтарын жоюға қатысатын басқа
рецепторлармен қатар қатерлі емес ісік,
жазылып жатқан жара ұлпаларында,
қабынған көздің қасаң қабығында, бел-
сендірілген макрофагтардың белгілі суб-
по пуляциясында экспрессияланған дығын
көрсеткен [2]. Соңғы зерттеу жұмыс тарында
LYVE-1 рецепторы қалыпты физио ло-
гиялық жағдайда тышқандар көзінің
қасаң қабығында, адам хороидында және
лимфалық тамырлары мен капил лярлары
жоқ адам қағанағын хорионды вилласының
макрофагы үстінде экспрес сияланды [7-12].
Біздің зерттеу жұмысымызда егеу-
құйрықтың тері асты шандырлары макро-
фагтарындағы LYVE-1 гиалурондық рецеп-
торының типтік (кәдімгі) емес экспрессиясы
анықталынды [13].
Макрофагтар мононуклеарлы фаго-
циттер болып табылады, олар бүкіл денеде
орналасқан. Бұл жасушалар ағзаның дамуы
мен гомеостазына, сонымен қатар туа пайда
болған және жүре қалыптасқан иммундық
жауаптарға қатысады.
Макрофагтардың физиологиясы олар
тіршілік ететін қоршаған ортасының
әсеріне тікелей байланысты. Олар ғажайып
секреторлы жасушалар және иммундық
жауапты күшейтіп немесе реттеуге және
нәтижесінде аутоиммунопатологияға қа-
тыса алады.
Макрофагтар фагоцитарлық қасиетке
ие және бұл қасиетіне байланысты имму-
нитеттің негізгі эффекторлық жасушалары
болып табылады. Олар гомеостазды сақ-
тап тұру және ұлпалардың құрылуы,
жараның жазылуы мен ағзаны қорғауда
маңызды рөл атқарады. Макрофагтар
лимфалық эндотелиалдық жасушаларға
трансдифференцациялануы мүмкін. LYVE-

78 Биотехнология. Теория и практика. №1 2010
1+макрофагтар лимфалық түйіндер өсу
факторының көзі ретінде қызмет етеді.
LYVE-1+макрофагтар гиа лурон қышқылы
метаболизміне қатысады [8].
Бұл жұмыстың мақсаты егеуқұй рықтың
тері асты шандырларынан бөлініп алынған
LYVE-1+макрофагтардыың функ ционалдық
белсенділігін зерттеу болып табылады.
Әдістер мен материалдар
қолданылған жануарлар
Тәжірибеде 8-10 апталық Wistar егеу-
құйрық линиясы пайдаланылды. Жануарлар
23ºС температурада, 60% ылғалдылықта, 12
сағат бойы ұсталды. Оларға тамақтану үшін
ad-libitum шектеу қойылмаған.
Жануарларды ұстау және барлық
процедуралар халықаралық заңға және
ережелерге сай жасалды (Guide for the Care
and Use of Laboratory Animals, National
Academy Press, 1996). Егеуқұйрықтар эфир-
мен ұйықтатылып, арқа терілері алынды.
Макрофагтарды бөліп алу
Цервикалды дислокация әдісімен жан-
уарлар өлтірілді. Этанолдың 70% ері-
тіндісімен залалсыздандырып, құрсақ
қабыр ғасын тесіп алмай, терісі алып
таста лынды. Құрсақ қуысына кішкене ауа
үрленіп, 2,5-3 мл мөлшерде қоректік орта
(5% феталды қан сарысуы бар DMEM)
енгізілді.
Суспензия ретінде макрофагтарды
бөліп алу үшін 1 минут құрсақ қабырғасын
хирургиялық пинцет көмегімен уқаланды.
Шприцті пайдаланып, құрсақ қуысының
жанынан сұйықтық сорылып, 15 мл
стерильді пробиркаларға ауыстырылды.
Басқа жанама жасушаларды жою үшін
перитонеалды макрофагтар адгезиялық
қасиеттеріне байланысты бөлінді. Ол үшін
2х10
6
жасуша/мл концентрациясында пери-
тонеалдық жасушаларын 10мM HEPES
және 10% феталды қан сарысуы қосыл-
ған RPMI-1640 қоректік ортасында сус-
пензиялап, полистирильді 24 шұңқырлы
планшеттің әр шұңқырына 1 мл қосып, 1
сағат 37°С және 5% CO
2
қойылды. Содан
кейін макрофагтардың моноқабаты бір
рет DMEM қоректік ортасымен шайылып,
жабыспаған жасушалар алынып тасталды.
Жасушалардың өмір сүру қабілеттілігі
0,1% трипан көгі көмегімен анықталды.
Макрофагтардың активациясын күшейту
үшін 10 нг липополисахарид (ЛПС) қосыл-
ды және 1 мл RPMI-1640 қоректік орта-
сында 24 сағат бойы 37ºC және 5% CO
2
инкубацияланды. Инкубацияланған соң
жасушаларды 3 реттік қатыру-еріту әдісі
арқылы лизиске ұшыратылды және алынған
лизаттар -20ºС сақталынды.
Егеуқұйрықтың арқа терісінен, тері
асты шандыры бөлініп алынды. Ол кішкене
бөлшектерге бөлінді. Тері асты шандыры
трипсин ерітіндісінде 1 сағат бойы 37°С
инкубацияланды. Содан соң 2 рет RPMI-
1640 қоректік ортасымен шайып, 5 минут
1000 айн/мин центрифугаланды. Бөлініп
алынған макрофагтар Петри табақшасына
отырғызылып, 1 сағат 37°С және 5% CO
2
инкубацияланды. 1 сағаттық инкубациядан
кейін 2 рет RPMI-1640 қоректік ортасымен
шайылды және 10% феталды қан сарысуы
қосылған RPMI-1640 қоректік ортасында 24
сағат 37°С және 5% CO
2
инкубацияланды.
іНФ- α концентрациясын анықтау
ІНФ-α өнімі жасушалық лизаттар дың
L929 линиясы жасушаларына цитоток-
сикалық әсері бойынша анықталды [14]. Әр
шұңқырға 3×10
4
L929 жасушаларын 10%
феталды қан сарысуы, 1% L-глютамин,
100мкг/мл стрептомицині бар RPMI-
1640 қоректік ортасында түбі тегіс 96
шұңқыршықты планшеттерде 24 сағат
бойы 37ºC және 5% CO
2
өсірілді. 24
сағаттан кейін L929 жасушаларынан
түзілген моноқабат өсуін тоқтату үшін
әр шұңқырға 1 мкг/мл актиномицин D
(Sigma, США) және 100 мл жасушалық
лизаттар қосылды. Бақылау шұңқырларына
тек қана 10% феталды қан сарысуы бар
RPMI-1640 қоректік ортасы қостылды.
Планшеттерді үлгілерімен 24 сағат 37ºC
және 5% CO
2
инкубацияланды. 24 сағаттық

79Биотехнология. Теория и практика. №1 2010
инкубациялаудан кейін супернатант алып
тасталынды, жасушалардың моноқабаты
0,9% NaCl ерітіндісімен шайылды.
Жасушалардың өмір сүру қабілеттілігі 100
мкл 0,05% кристаллвиолет(Sigma, США)
ерітіндісімен бояу арқылы анықталды.
Бояғыш дистилденген сумен бірнеше
рет шайылған соң тірі қалған L929
жасушаларынан бояғыштың кристалдарын
еріту мақсатында әр шұңқырға 100 мкл
1% додецилсульфат натрий ерітіндісі
қосылды. Оптикалық тығыздығы 546 нм
толқын ұзындығында спектрофотометр
арқылы («Titertek Multiscan» MCC/340,
Flow Laboratories, Finland) өлшенді.
Жасушалардың цитотоксикалық индексі
(ЦИ) мына формула бойынша есептеледі:
ЦИ=1-(эксперименталдық шұңқыр да-
ғы оптикалық тығыздық)/(бақылау шұ ң-
қырдағы оптикалық тығыздық) х 100
In vitro жағдайында макрофаг тардың
гиалурон қышқылын бай ланыстыру
қабілетін анықтау
Егеуқұйрықтың тері асты шан дыр-
ларынан бөлініп алынған LYVE-1+
макрофагтар кішкентай Петри табақ-
шасында моноқабат түзу үшін 45 минут
37ºC және 5% CO
2
инкубацияланды. 2 реттік
ФСБ-мен шайылған соң, жасушаларға 1мл
10% феталды қан сарысуы бар RPMI-1640
қоректік ортасы және ФИТЦ –конъюгат
гиалурон қышқылы (Sigma, США) қосыл-
ды. 30 минуттық инкубациядан кейін
мак ро фагтар 3 рет ФСБ-мен шайыл-
ды және 4% параформальдегид ерітін ді-
сімен 20 минуттай фиксацияланды. Фик са-
циядан кейін LYVE-1-ге (10 мкг/мл) қарсы
поликлоналды қоянның анти денелерімен,
содан соң Alexa 555 (1:500) конъю га-
цияланған екіншілікті анти де нелермен ин-
кубацияланды. Ядро ларды бақылау үшін
жасушалар DAPI бар ерітіндісімен боялды.
Иммуно флуорес ценцияның микроско пия-
лық құ жаттан дырылуы флуоресцентті ин-
вертті микрос коп (Olympus IX-71, Japan)
арқылы өңделді. Суреттерді өңдеуді Image
J pro Plus 5.0 арнайы бағдарламасы арқылы
өңделді.
Нәтижелер және оларды талдау
Бұл жұмыста біз қалыпты егеу-
құйрықтың тері асты шандырынан бөлініп
алынған LYVE-1+макрофагтардың функ-
ционалдық белсенділігін анықтадық.
(1-сурет) [13]. LYVE-1+макрофагтардың
моно циттер және макрофагтардың типтік
маркері болып табылатын CD45, CD11b
және F4/80 экспрессиялайтыны фенотиптік
талдау көрсетті (2-сурет).
Функционалдық белсенділігін зерттеу
үшін 2 әдіс пайдаланылды:
1) LYVE-1+ макрофагтарының гиа лурон
қышқылын байланыстыру қабілетін анықтау
үшін иммунофлуоресценттік талдау;
2) макрофагтарда ІНФ-α секреторлық
өнімін анықтауға арналған тест.
1-сурет. Егеуқұйрықтың әртүрлі тері
қабаттарындағы lYVE-1 экспрессиясы. А) LYVE-
1 антиденелерімен анықталған егеуқұйрықтың
гистологиялық тері кесінділері. 1 – тері; 2 – тері
асты бұлшықет қабаты; 3 – тері асты шандыры.
Лимфалық тамырлардың (cызықша) гиподермисте
және көптеген тері асты шандырының LYVE-1+
жасушаларда бар екені көрсетілген; Б) 1-суретіндегі

80 Биотехнология. Теория и практика. №1 2010
(А) тіктөртбұрышпен көрсетілген аймақ LYVE-1 жасушаларда (сызықша) типтік емес экспрессиясын
анық көрсетеді.
2-сурет. LYVE-1+жасушаларға иммунофлуоресценттік талдау. СD45 қарсы антиденелер қолданылды
– жалпы лейкоцитарлық антиген; СD11b и F4/80 – моноциттер мен макрофагтардың типтік
маркерлері. жасуша ядролары (көк) ДНқ-спецификалық бояу DAPI- мен боялған. 200 х үлкейтілген.
ІНФ-ның биологиялық тиімділігі оның
концентрациясына байланысты. Төмен
концентрацияда ол жарақаттану және
инфекцияға қарсы пара- және аутокринді
регулятор ретінде иммуноқабыну реак-
цияларына қатысады. Ол нейтрофилдер
мен эндотелиалдық жасушаларға және
олардың адгезиясы және лейкоциттердің
миграциясына, жараның жазылуы ке-
зінде эндотелий мен фибробластардың
пролиферациясында негізгі стимулятор
болып табылады.
Біздің жүргізген зерттеуіміздің нә-
тижесін салыстыру арқылы кезінде егеу-
құйрықтың тері асты шандырларының
белсендірілген LYVE-1 +макрофагтардың
ІНФ продуцирлейтін қасиеті сол жану-
ардан бөлініп алынған перитонеалдық мак-
рофагтарға қарағанда жоғары болғанына
көз жеткіздік.
