Тіманюк В.О., Животова О.М. Біофізика
Подождите немного. Документ загружается.

11
Тоді критерієм здатності системи зробити те або інше термодинамічне
перетворення є знак зміни енергії Гіббса або Гельмгольца, у залежності
від умов процесу. При dG < 0 (або dF < 0), процес відбувається мимовільно
з виділенням енергії, так як при цьому енергія кінцевого стану менша
енергії початкового. Зміни в системі будуть відбуватися доти, поки термо-
динамічний потенціал Гіббса (або вільна енергія Гельмгольца) не прийме
мінімальне значення. Хімічні реакції, що протікають із зменшенням цих
потенціалів, називаються екзергонічними. Якщо ж учинення якогось
термодинамічного процесу вимагає збільшення енергії (dG > 0, або dF > 0),
то такий процес мимовільно здійснюватися не може і вимагає притоку
енергії з навколишнього середовища. Хімічні реакції, що підкоряються
цій умові, називаються ендергонічними.
Зміна вільної енергії залежить від умов протікання процесу (темпера-
тури, тиску, рН, концентрацій речовин, що реагують). Тому в хімії вико-
ристовується поняття зміни стандартної вільної енергії хімічної реакції
∆
G
0
, тобто зміни вільної енергії хімічної системи, кожний із реагентів
якої, що вступає у хімічну реакцію, знаходиться в концентрації 1 моль/л
у стандартних умовах (р = 1 атм, рН = 7,0, Т = 25 °С).
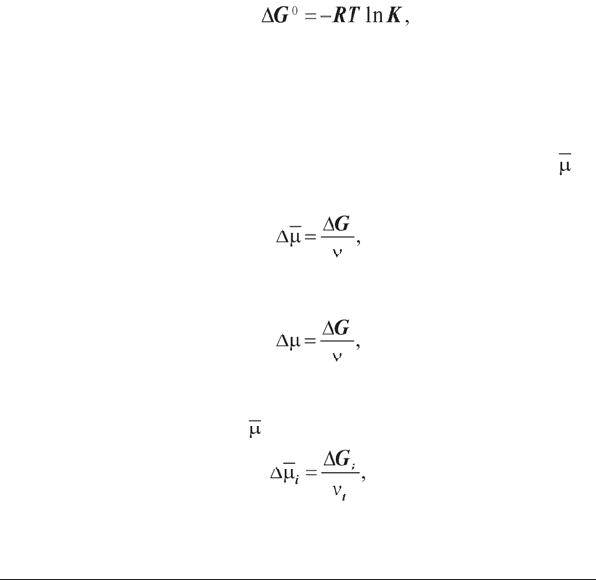
Зміна стандартної вільної енергії в ході хімічної реакції пов’язана з
константою хімічної рівноваги K цієї реакції в такий спосіб
(1.6)
де R — універсальна газова стала; T — температура.
Залежність (1.6) дозволяє при відомому значенні константи рівноваги
хімічної реакції визначити зміну вільної енергії в ній.
Термодинамічний потенціал Гіббса одного моля речовини нази-
вається хімічним потенціалом
µ
(у випадку незаряджених часток) або
електрохімічним потенціалом (у випадку заряджених часток)
. Зміна
електрохімічного потенціалу дорівнює
(1.7)
де ν — кількість молей заряджених часток. Зміна хімічного потен ціалу
аналогічна (1.7)
де ν — кількість молей незаряджених часток.
Якщо система складається з кількох компонентів, то електрохімічний
потенціал iFго компонента
i
визначається як
де ν
i
— кількість молей iFго компонента; ∆G
i
— вільна енергія iFго ком-
понента.

12
Для розведених розчинів незаряджених часток хімічний потенціал
дорівнює
µ
i
= µ
0i
+ RT lnс
i
,
де µ
0i
— стандартний хімічний потенціал iFго компонента, чисельно
рівний хімічному потенціалу цього компонента при його концентрації
в розчині 1 моль/л; с — молярна концентрація.
Електрохімічний потенціал розведених розчинів дорівнює
i
= µ
i
+ zFϕ = µ
0i
+ RТ lnс
i
+ zF ϕ,
де z — заряд іона; F = eN
A
= 9,65·10
4
Кл/моль — число Фарадея (заряд
одного моля одновалентних іонів); ϕ — електричний потенціал на межі
поділу фаза — навколишнє середовище.
Запишемо зміну електрохімічного потенціалу ∆ для часток одного
сорту:
∆ = ∆µ
0
+ RТ ln(c
2
/c
1
) + zF (ϕ
2
– ϕ
1
).
Зміна електрохімічного потенціалу має фізичний зміст роботи, що
необхідно зробити, щоб:
1) викликати хімічне перетворення одного моля сполуки при переході
зі стану 1 у стан 2 (перший доданок, що визначає хімічну роботу);
2) змінити молярну концентрацію від с
1
до с
2
(другий доданок, що
визначає осмотичну роботу);
3) перебороти сили електричного відштовхування, що виникають при
переносі речовини з області з електричним потенціалом ϕ
1
в область із
потенціалом ϕ
2
(третій доданок, що визначає електричну роботу).
§ 4. Швидкість зростання ентропії та дисипативна функція
На відміну від класичної рівноважної термодинаміки термодинаміка
необоротних процесів розглядає зміну термодинамічних параметрів у
часі. Особливе значення тут має швидкість зростання ентропії. Інфор-
мація про цю величину дозволяє оцінити швидкість дисипації різних
видів енергії, що можуть бути витрачені на вчинення роботи, у теплову
енергію, за рахунок якої при постійній температурі робота не може бути
зроблена.
Зміна ентропії у відкритій системі складає:
dS = d
e
S + d
i
S,
причому d
e
S = dQ/T , а dQ = dU + pdV .
Звідси

13
(1.8)
З (1.5) випливає, що
TdS – dU – pdV = – dG . (1.9)
З урахуванням (1.9) і (1.2) вираз (1.8) для необоротних процесів
прийме вигляд
Звідси швидкість зміни ентропії складе:
(1.10)
Таким чином, швидкість зростання ентропії в мимовільних не оборотних
процесах при постійних температурі і тиску прямо пропорційна швидкості
зменшення термодинамічного потенціалу Гіббса.
Можна показати, що для хімічних реакцій швидкість зростання
ентропії складає
(1.11)
де v — швидкість хімічної реакції; А — хімічна спорідненість, або
рушійна сила хімічної реакції, причому
де µ
i
, ν
i
— відповідно хімічний потенціал і стехіометричний коефіцієнт
iFго реагенту або продукту. Хімічна спорідненість має фізичний зміст
різниці електрохімічних потенціалів початкового і кінцевого станів (А
= µ
нач
– µ
кін
) при ν
i
= 1. Якщо в системі протікають кілька необоротних
реакцій, то швидкість зміни ентропії в цій системі складе:
(1.12)
де A
k
і v
k
— відповідно швидкість і хімічна спорідненість kFї хімічної
реакції.
У термодинаміці необоротних процесів уводиться поняття дисипа-
тивної функції
1
β:
З (1.11) випливає, що
β > 0. (1.13)
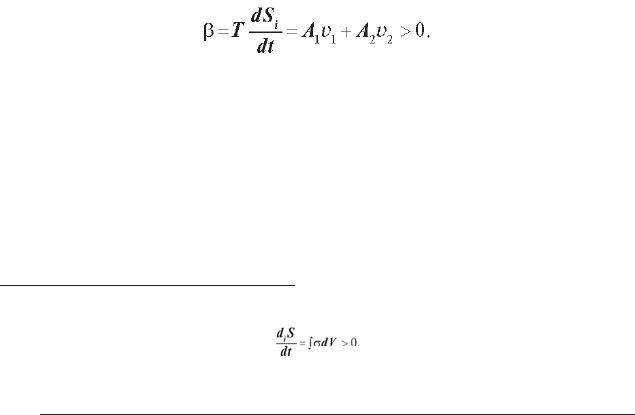
14
Для ідеальних оборотних процесів β = 0.
Таким чином, дисипативна функція, що визначає швидкість зрос-
тання ентропії в системі, у якій протікають необоротні процеси, є мірою
розсіювання енергії системи в тепло. Чим більша величина дисипативної
функції, тим швидше енергія усіх видів перетворюється в теплову. Диси-
пативна функція також визначає можливість мимовільного протікання
того або іншого процесу: при β > 0 процес можливий, при β < 0 — ні.
§ 5. Спряжені процеси
У процесі функціонування біологічних систем відбуваються як
екзергонічні процеси, у ході яких визволяється енергія (при цьому
∆G < 0), так і ендергонічні, при яких енергія затрачується (при цьому
∆G > 0). Останні процеси термодинамічно невигідні і не можуть здій-
снюватися без додаткового притоку енергії, джерелом якої в живому
організмі служать екзергонічні процеси. Якщо енергія, що виділяється
в ході якогось екзергонічного процесу перевищує енергію, необхідну
для вчинення ендергонічного процесу, то перший процес може енерге-
тично забезпечити другий. При цьому сумарна зміна потенціалу Гіббса
залишається негативною.
Явище, при якому один процес енергетично забезпечує протікання
другого, називається спряженням. Процес, що є джерелом енергії,
називається спрягаючим, а процес, на який затрачується енергія,
— спряженим. Розглянемо це явище докладніше на прикладі спряжених
хімічних реакцій.
Нехай у системі одночасно протікають дві необоротні реакції. З
(1.12) випливає:
(1.14)
Ця умова може виконуватися в двох випадках:
1) A
1
v
1
> 0 , A
2
v
2
> 0;
2) A
1
v
1
> 0 , A
2
v
2
< 0, якщо |A
1
v
1
| > |A
2
v
2
|.
У першому випадку обидві реакції є термодинамічно вигідними, тому
що в ході кожної з них відбувається збільшення ентропії (1.12) і тоді, як
випливає з (1.10) — зменшення термодинамічного потенціалу Гіббса. Ці
реакції можуть здійснюватися незалежно одна від одної.
В другому випадку реакція 1 є вигідною, а реакція 2 — ні (d
i
S/dt < 0,
dG/dt > 0). Друга реакція може здійснитися тільки у тому випадку, якщо
1
Часто дисипативною функцією називають локальну швидкість продукції ентропії σ в еле-
ментарному об’ємі dV, що зв’язана зі швидкістю продукції ентропії в такий спосіб:

15
буде спряжена з першою. У ході спряження цих двох реакцій сумарна
ентропія системи збільшиться, відповідно до (1.12), а сумарний потен-
ціал Гіббса — зменшиться (1.10).
Таким чином, критерієм можливості спряження двох або кількох
процесів є позитивне значення дисипативної функції для сумарного
процесу.
З умови (1.14) можна знайти максимальну швидкість спряженої
реакції:
Розглянемо явище спряження на наступному прикладі. Початкова
реакція гліколізу — фосфорилювання глюкози є ендергонічною реак-
цією і протікає за схемою:
Глюкоза + Ф = ГлюкозаF6Fфосфат + Н
2
О,
∆
G
1
0
= 13,4 кДж/моль,
де Ф — фосфорна кислота.
Підвищення вільної енергії в цьому випадку компенсується спряжен-
ням із реакцією гідролізу АТФ, що є найбільш поширеною спрягаючою
хімічною реакцією у живих системах:
АТФ + Н
2
О = АДФ + Ф, ∆G
2
0
= –30,5 кДж/моль.
Таким чином, загальна зміна вільної енергії в ході цих двох реакцій
складає
∆G = ∆
G
1
0
+ ∆
G
2
0
= 13,4 кДж/моль + (–30,5 кДж/моль) = –17,1 кДж/моль.
Явище хімічного спряження забезпечує перетворення енергії одних
хімічних зв’язків в енергію інших, знижуючи таким чином втрати енергії
у вигляді тепла. У відсутність спряження величина дисипативної фун-
кції вища, ніж у випадку наявності спряження. Чим менше значення
дисипативної функції, тим економічніше працює система.
§ 6. Положення лінійної нерівноважної термодинаміки.
Рівняння Онзагера
Лінійна нерівноважна термодинаміка вивчає процеси, що протіка-
ють поблизу положення термодинамічної рівноваги. Можна показати,
що в цих умовах між узагальненим потоком J (швидкістю процесу) і
узагальненою силою Х (причиною процесу), що його ви кликає, існує
лінійна залежність:
J = LX,
де L — коефіцієнт пропорційності.
Прикладом лінійного процесу є закон Ома I = U/R, де в ролі потоку
виступає електричний струм I, рушійної сили — напруга U, а коефіцієнта

16
пропорційності — величина 1/R, зворотна електричному опорові (про-
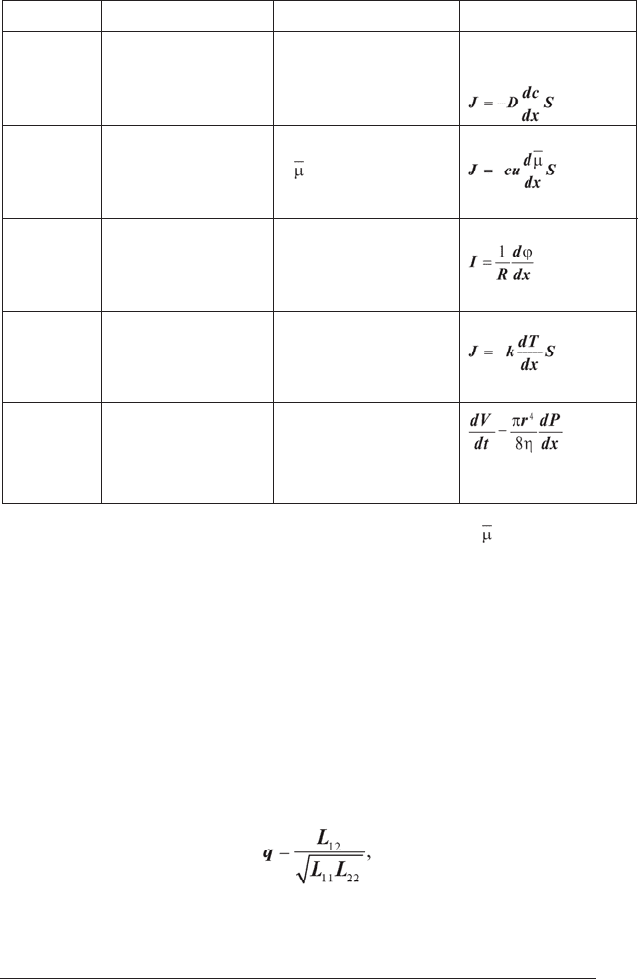
відність). Деякі приклади лінійних процесів приведені в таблиці 1.2.
Припустимо, що в системі відбуваються два процеси, спряжені
один з одним. У такому випадку потік першого процесу J
1
буде залежати
як від власної рушійної сили Х
1
і зв’язаний із нею коефі цієнтом про-
порційності L
11
, так і від рушійної сили другого процесу Х
2
(коефіцієнт
пропорційності L
12
). Аналогічні міркування застосовуємо і для другого
потоку J
2
, що зв’язаний із ру шійною силою першого процесу коефіцієн-
том L
21
. Вирази для потоків у випадку спряжених процесів називаються
рівняннями Онзагера.
J
1
= L
11
X
1
+ L
12
X
2
; (1.15)
J
2
= L
21
X
1
+ L
22
X
2
. (1.16)
Коефіцієнти L
12
і L
21
називаються коефіцієнтами взаємності Онзагера
і відбивають явище спряження процесів: потік першого процесу зале-
жить від рушійної сили другого і навпаки. Коефіцієнти L
12
і L
21
зв’язані
один з одним співвідношенням взаємності Онзагера:
L
12
= L
21
, (1.17)
тобто вплив одного процесу на другий викликає таку ж відповідну ре-
акцію з боку другого процесу на перший.
У виразі (1.11) спорідненість реакції А відіграє роль рушійної сили
реакції, а швидкість v — роль потоку. За аналогією з (1.11) можна по-
казати, що в загальному випадку
Для системи, в котрій одночасно протікають n спряжених лінійних
процесів, виконується співвідношення
(1.18)
Рівняння (1.15) і (1.16) виконуються для будьFяких взаємозв’язаних
процесів, наприклад, спряжених хімічних реакцій, дифузії якоїсь
речовини і зв’язаного з цим перенесення теплоти, перенесення
через мембрану води і спряженого перенесення розчиненої в ній
речовини. У живих організмах одним із найпоширеніших спряже-
них процесів є активний транспорт, тобто перенесення речовини
з області з меншою його концентрацією в область із більшою кон-
центрацією. Такий процес мимовільно відбутися не може, тому що
супроводжується збільшенням упорядкованості системи і, отже,
— зниженням ентропії. Активний транспорт вимагає витрати енергії
і може відбуватися тільки у випадку спряження з іншим процесом
— джерелом енергії. Як спрягаючий процес може виступати, наприклад,
17
реакція гідролізу АТФ, наявність різниці потенціалів на межі по ділу двох
областей (у випадку перенесення заряджених часток), різниця концен-
трацій якихFнебудь речовин. Докладніше явище активного транспорту
буде розглянуто в розділі 5.
У загальному ж випадку будьFякі два спряжені процеси можуть бути
описані рівняннями (1.15) і (1.16). Якщо потік і рушійна сила спряже-
ного процесу рівні відповідно J
1
і X
1
, а спрягаючого — J
2
і X
2
, то J
1
X
1
< 0,
J
2
X
2
> 0.
Кількісно ступінь спряження відбиває величина
що змінюється в межах
–1 ≤ q ≤ 1.
де D – коефіцієнт дифузії; c – молярна концентрація речовини; – електрохімічний
потенціал; u – рухливість іонів; R – електричний опір; S – площа поперечного перети-
ну, через який здійснюється потік; k – коефіцієнт теплопровідності; V – об’єм рідини; r
Процес Потік J Узагальнена сила X Закон
Дифузія
Електроди-
фузія
Електрич-
ний струм
Теплопровід-
ність
Плин рідини
Потік незаряджених
частинок J
Потік іонів J
Потік електронів I
Потік тепла J
Об’ємний потік
рідини через трубку
dV/dt
Закон Фіка
Рівняння Теорелла
Закон Ома
Закон Фур’є
Формула Пуазейля
Градієнт концентрації
(dc/dx)
Градієнт електрохіміч-
ного потенціалу
(d
/dx)
Градієнт електричного
потенціалу (dϕ/dx)
Градієнт температури
dТ/dx
Градієнт гідростатично-
го тиску (dР/dx)
Табл. 1.2
Спряжені потоки і сили

18
При q = 0, L
12
= L
21
= 0. Тоді рівняння (1.15) і (1.16) зводяться до
вигляду
J
1
= L
11
X
1
;
J
2
= L
22
X
2
,
тобто процеси цілком не залежать один від одного і кожний із потоків
визначається тільки «власною» рушійною силою.
При q = ±1 потоки цілком спряжені. Якщо q < 0 (тобто L
12
< 0), тоді,
як випливає з (1.15) і (1.16), збільшення рушійної сили одного процесу
буде супроводжуватися зменшенням потоку спряженого з ним другого
процесу.
У процесі спряження не вся енергія, що виділяється в ході спряга-
ючого процесу передається спряженому: частина енергії переходить
у тепло. Для визначення КПД перетворення енергії вводять поняття
ефективності спряження:
де J
1
, X
1
і J
2
, X
2
— відповідно потоки і рушійні сили спряженого та спря-
гаючого процесів. Для біологічних процесів ефективність спряження
досить висока і може досягати 80–90%.
§ 7. Критерії досягнення й усталеності стаціонарних станів
У класичній термодинаміці збільшення ентропії до деякого макси-
мального значення є критерієм встановлення в системі рівноважного
стану, зміна ентропії, таким чином, визначає напрямок ходу процесу.
Нерівноважна термодинаміка розглядає стаціонарні стани. Аналогіч-
ною проблемою буде питання про завбачення встановлення в системі
стаціонарного стану за характером зміни ентропії за рахунок внутрішніх
процесів.
Розглянемо систему, у якій одночасно відбуваються два спряжених
процеси, наприклад, потік тепла J
1
, викликаний градієнтом температур
(рушійною силою X
1
), і потік речовини J
2
, викликаний різницею кон-
центрацій (рушійною силою X
2
). Поблизу становища термодинамічної
рівноваги для них справедливі рівняння Онзагера:
J
1
= L
11
X
1
+ L
12
X
2
;
J
2
= L
21
X
1
+ L
22
X
2
.
Відповідно до (1.18), дисипативна функція в цьому випадку буде
записана у вигляді
β = J
1
X
1
+ J
2
X
2
> 0 .
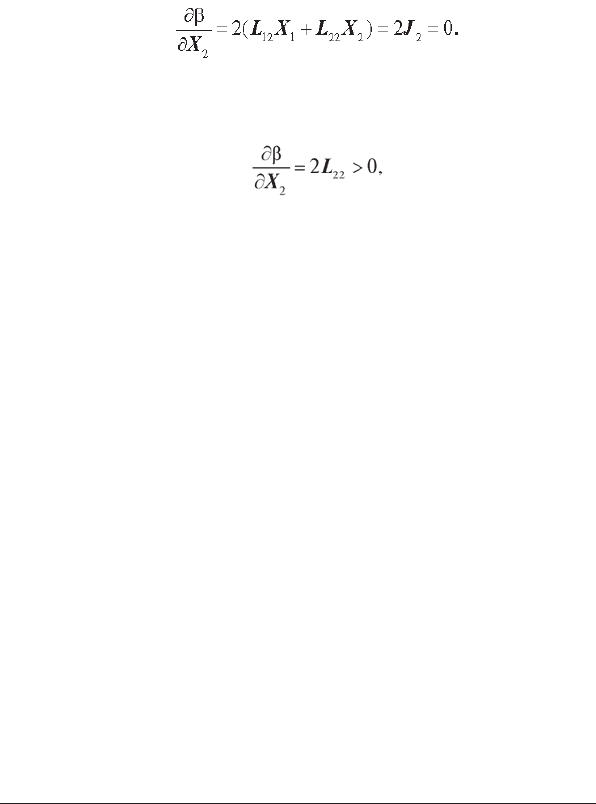
19
З урахуванням рівнянь Онзагера і співвідношення (1.17) одержи-
мо:
β = J
1
X
1
+ J
2
X
2
= (L
11
X
1
+ L
12
X
2
)X
1
+ (L
21
X
1
+ L
22
X
2
)X
2
=
= L
11
X
1
2
+ (L
12
+ L
21
)X
1
X
2
+ L
22
X
2
2
= (1.19)
=L
11
X
1
2
+ 2L
12
X
1
X
2
+ L
22
X
2
2
> 0 .
Припустимо, що в системі встановився стаціонарний стан, у якому
кількість речовини, що входить у систему, дорівнює кількості речовини,
що залишає систему, тобто J
2
= 0, а потік теплоти відбувається з постій-
ною швидкістю.
Продиференціюємо (1.19) по X
2
при X
1
= const:
(1.20)
Дане рівняння визначає екстремум функції, що описується рівнян-
ням (1.19).
Так як друга похідна
позитивна (при L
22
> 0), то дана екстремальна точка відповідає мінімуму
дисипативної функції.
Аналогічно можна довести, що при J
1
= 0
∂β / ∂X
1
= 0. (1.21)
Сказане можна узагальнити і на будьFяке число спряжених про-
цесів в системі поблизу положення рівноваги. Вирази (1.20) або (1.21)
дозволяють сформулювати один з основних принципів нерівноважної
термодинаміки лінійних процесів (теорему Пригожина): при постійних
зовнішніх умовах у системі, що знаходиться поблизу положення термоди-
намічної рівноваги в стаціонарному стані, швидкість зростання ентропії за
рахунок внутрішніх необоротних процесів обумовлена величиною дисипа-
тивної функції β, приймає постійне мінімальне відмінне від нуля позитивне
значення.
Таким чином, за зміною в часі швидкості зростання ентропії за
рахунок внутрішніх процесів можна судити про те, чи приведуть дані
процеси систему в стаціонарний стан або ні. Якщо швидкість зростання
ентропії зменшується, тобто
dβ/dt < 0, (1.22)
то система прагне до стану з мінімальною швидкістю продукції ентропії,
тобто до стаціонарного стану. Вираз (1.22) визначає критерій еволюції
відкритої системи до стаціонарного стану поблизу положення рівно-
ваги.
Як видно з графіка на рисунку 1.1, дисипативна функція β монотонно
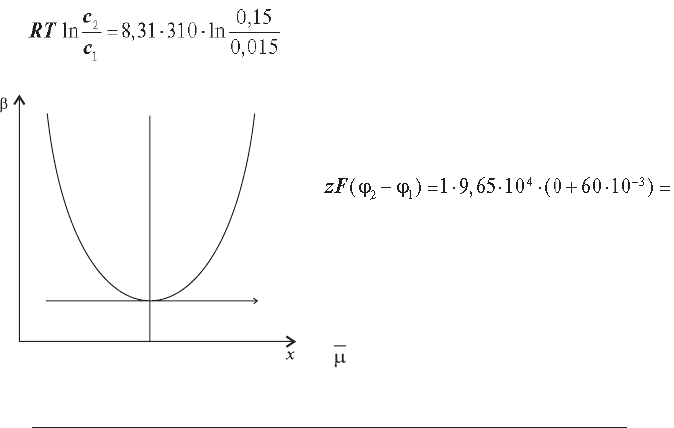
20
зменшується до мінімального значення, тобто система прагне до стаціо-
нарного стану. Така система не може самостійно вийти зі стаціонарного
стану, тому що збільшення β приводить до зростання швидкості про-
дукції ентропії. Якщо система в силу якихFнебудь флуктуацій все ж таки
вийшла зі стаціонарного стану, то в ній виникають сили, що прагнуть
звести швидкість зростання ентропії до мінімуму. Такий стаціонарний
стан є стійким (відхилення від нього приводить до збільшення диси-
пативної функції). Таким чином, критерієм усталеності стаціонарного
стану є умова:
dβ > 0 .
При значних змінах зовніш ніх умов система виходить з одного ста-
ціонарного стану і переходить в інший. Це спостерігається, наприклад,
при проведенні нервового імпульсу або при м’язовому скороченні. Зміна
одного стаціонарного стану на інший при зміні зовнішніх умов означає
пристосування (адаптацію) до них організму. Нездатність адаптуватися
приводить до загибелі.
Приклади розв’язання задач
Задача 1.1. Концентрація Na
+
усередині клітини складає
0,015 моль/л, а зовні — 0,15 моль/л. Температура клітини дорівнює 37
°С, її внутрішня сторона має потенціал –60 мВ. Розрахувати осмотичну
та електричну роботу, а також зміну електрохімічного потенціалу при
переносі іонів натрію через мембрану нервової клітини назовні.
Розв’язання. Осмотична робота при переносі іонів в область із кон-
центрацією с
2
з області з концентрацією с
1
дорівнює
= 5932 (Дж/моль)≈5,9 (кДж/моль).
Якщо електричний потенціал
із зовнішнього боку клітини прий-
няти за нуль, то електрична робота
складе
5790 (Дж/моль)
≈
5,8 (кДж/моль).
Так як з Na+ не відбувається
ніяких хімічних змін, то ∆µ
0
= 0.
Тоді зміна електрохімічного по-
тенціалу
∆ = ∆µ
0
+ RТ ln(c
2
/c
1
) + zF(ϕ
2
–
ϕ
1
) = 0 + 5,9 + 5,8 = 11,7 кДж/
Рис. 1.1 (пояснення в тексті).
