Соболев В.В., Шиман Л.Н. Высокоэнергетическая обработка материалов. Сборник научных трудов
Подождите немного. Документ загружается.


Высокоэнергетическая обработка материалов
91
УДК 661.52: 662.2
ТЕРМИЧЕСКОЕ ПОВЕДЕНИЕ АММИАЧНОЙ СЕЛИТРЫ
КАК ОСНОВЫ СОВРЕМЕННЫХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ
А.В. Куприн, И.Л. Коваленко, Л.В. Довбань, А.Г. Теплицкая
ГВУЗ "Украинский государственный химико-технологический университет",
пр. Гагарина, 8, г. Днепропетровск, 49000, Украина
е-mail: arragorn@rambler.ru
, ooo-ekkom@mail.ru
В работе приведены результаты систематического исследования термического разложе-
ния аммиачной селитры, определены термодинамические и кинетические параметры про-
цессов термодеструкции. Показано каталитическое влияние нитратов натрия и кальция, а
также ферросилиция и неорганических хлоридов на термическое разложение аммиачной
селитры исследованной системы.
Materials of regular research of ammoniac saltpeter thermal decomposition, thermodynamic
and kinetic parameters of thermal decomposition processes are given in work. Influence of sodium
and calcium nitrates, and also ferrosilicon and inorganic chlorides on exothermal reaction of am-
moniac saltpeter decomposition of system is offered.
Введение
Аммиачная селитра как основа современных взрывчатых веществ (ВВ),
в том числе эмульсионных, обладает целым рядом преимуществ, например,
невысокой стоимостью, хорошей растворимостью, удовлетворительным зна-
чением кислородного баланса и полным превращением при термической де-
струкции в газообразные продукты.
Условием реализации механизма теплового взрыва эмульсионных и
простейших смесевых ВВ на основе аммиачной селитры является
не столько
величина теплового эффекта реакции, как скорость тепловыделения, опреде-
ляемая энергией активации процесса. Поэтому для создания чувствительных
взрывчатых веществ на основе аммиачной селитры необходимо не только ис-
пользовать компоненты, увеличивающие общий тепловой эффект реакции
взрывчатого превращения, но и вводить в состав сенсибилизаторы, повы-
шающие чувствительность системы за счет снижения
энергии активации тер-
мического разложения нитрата аммония.
Результаты многочисленных исследований терморазложения нитрата
аммония (аммиачной селитры), обобщенные в [1-3], позволили сформировать
общее представление о механизме процесса.

Высокоэнергетическая обработка материалов
92
Согласно Манелису и Рубцову [1] при нагревании аммиачной селитры
(АС) происходит перенос протона с образованием растворенных в конденсиро-
ванной фазе аммиака и азотной кислоты и последующим термическим разло-
жением HNO
3
. Кроме того, в этой системе вероятно окисление иона аммония
азотной кислотой с образованием нитрамида и его быстрым распадом до N
2
O:
NH
4
+
+ HNO
3
= NH
3
NO
2
+
+ H
2
O = H
2
O +H
3
O
+
+ N
2
O, (1)
В совокупности с передачей протона с H
3
O
+
на NO
3
-
это приводит к реа-
лизации основного пути разложения АС по уравнению (2):
NH
4
NO
3
= N
2
O + 2H
2
O. (2)
Кроме основной, в качестве побочных идут реакции (3-4):
NH
4
NO
3
= 0,8N
2
+ 1,8H
2
O +0,4 HNO
3
, (3)
NH
4
NO
3
= N
2
+ 0,5O
2
+ 2H
2
O. (4)
Испарение нитрата аммония происходит с образованием аммиака и азот-
ной кислоты [1]:
NH
4
NO
3
= NH
3
+ HNO
3
, (5)
Однако рассмотренные ранее закономерности установлены для термо-
лиза нитрата аммония в замкнутых системах, где накопление в объеме аммиа-
ка приводит к затуханию процесса разложения.
Цель работы: определение кинетических закономерностей термическо-
го поведения аммиачной селитры в открытых системах и каталитического
влияния различных добавок на процесс ее термодеструкции.
Методика проведения экспериментов. Термический анализ образцов
аммиачной селитры по ГОСТ 2-85, влажностью не более 0,2 % масс., осущест-
вляли с помощью Q-дериватографа "Паулик и Эрдей", а также установки для
дифференциально-термического анализа "Термоскан-2" при атмосферном
давлении. Кинетические исследования выполнены методом изотермических
серий в интервале температур от 200 до 270
0
С по изменению массы навески в
открытом сосуде.
Высокоэнергетическая обработка материалов
93
Термодинамические расчеты возможности протекания химических ре-
акций выполнены по методу Темкина-Шварцмана [4]. Определялись измене-
ния стандартной свободной энергии Гиббса (ΔG
0
) при заданной температуре,
термодинамические константы равновесия (К
Т
0
) и доля превращения 1 моля
исходного вещества в продукты реакции (α, %):
000
TTT
STHG Δ−Δ=Δ
, (6)
где ΔH
T
0
– изменение энтальпии, а ΔS
T
0
–изменение энтропии реакции.
Термодинамическую константу равновесия рассчитывали по уравнению
RT
G
K
T
T
0
0
exp
Δ
−=
, (7)
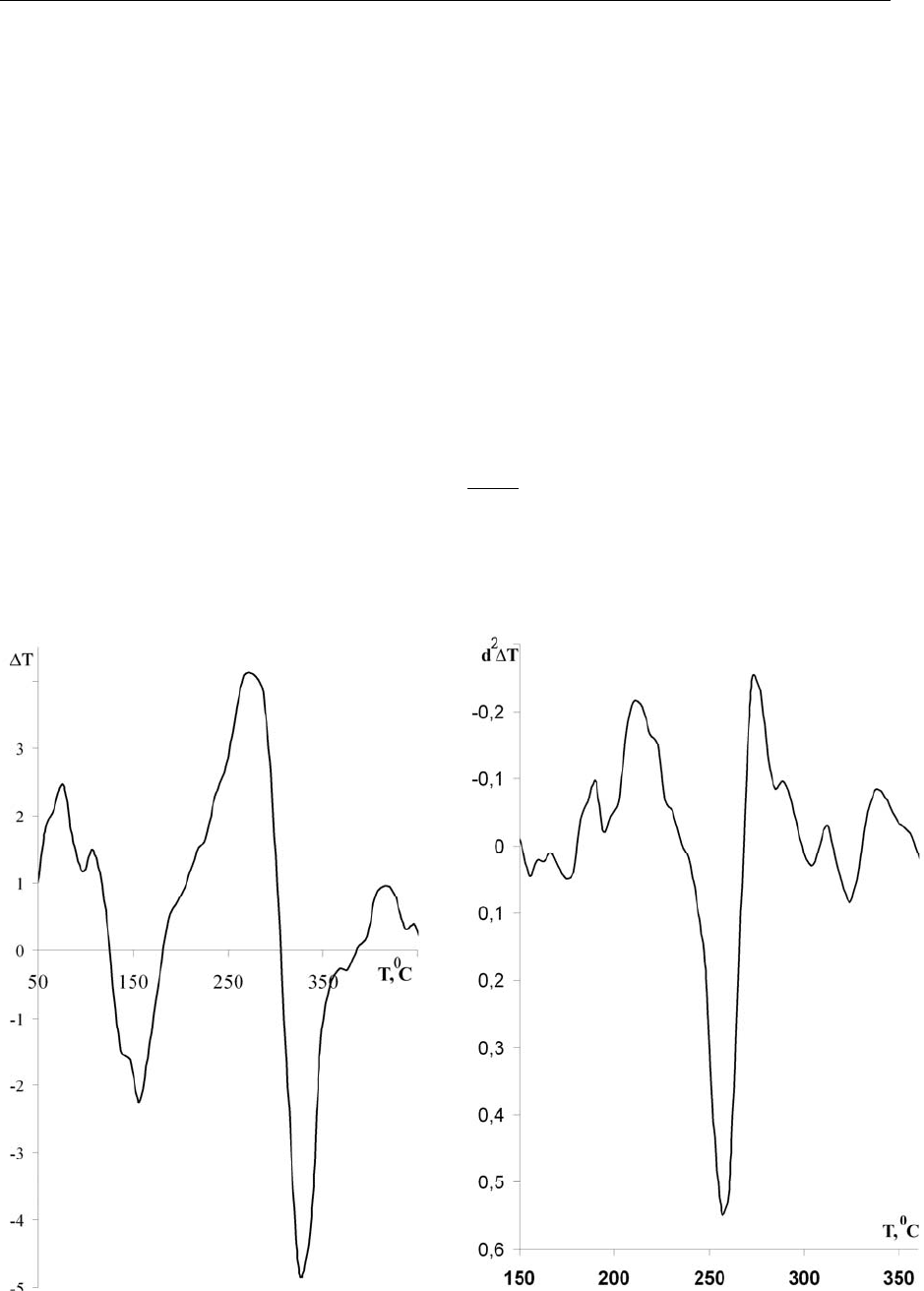
На рис. 1-а приведена ДТА кривая дифференциального термического
анализа (ДТА) аммиачной селитры.
а) б)
Рис. 1: а) дифференциальная термическая кривая разложения аммиач-
ной селитры; б) вторая производная ДТА кривой разложения селитры
(7-точечный фильтр)

Высокоэнергетическая обработка материалов
94
Термическое поведение нитрата аммония в открытой системе
Эндотермические эффекты, наблюдаемые на ДТА кривой разложения в
интервале температур 50-150
0
С, скорее всего, обусловлены фазовыми перехо-
дами селитры из одной кристаллической модификации в другую [5]. Кроме
того, в указанном температурном интервале происходит удаление физической
влаги селитры и ее плавление.
Начиная с температуры 200
0
С, в системе регистрируется выделение те-
пла, обусловленное деструкцией нитрата аммония. Характерно, что на восхо-
дящем участке кривой (200-280
0
С) имеется несколько перегибов, что может
свидетельствовать об изменении механизма процесса.
Численным дифференцированием данных термического анализа были
установлены характеристические температуры, при которых происходит из-
менение хода процесса термолиза. Двукратное дифференцирование ДТА кри-
вой позволяет не только устранить линейный дрейф базовой линии, но и раз-
делить сильно пересекающиеся пики [6], т.к. численное
дифференцирование
позволяет сохранить место положение пика (с изменением направления), но
делает его значительно уже (рис. 1б).
Согласно [2,3] термический распад нитрата аммония в интервале темпе-
ратур 200-280
0
С происходит не только по реакциям (2-5), но и с образованием
оксида азота(II):
NH
4
NO
3
= NO + 0,5N
2
+ 2H
2
O, (8)
Отрицательные значения изменения стандартной свободной энергии
Гиббса (ΔG
0
298
) (табл. 1) для реакций (2-4) и (8) говорят о том, что эти процес-
сы могут протекать самопроизвольно практически со 100% выходом и значи-
тельным тепловыделении (ΔH
298
0
) даже при стандартных условиях. Однако из-
за кинетических затруднений они идут весьма медленно [6-7]. Так, при тем-
пературах ниже точки плавления АС энергия активации ее термораспада со-
ставляла свыше 300 кДж/моль [6], а для жидкого нитрата аммония соответст-
венно 134 кДж/моль [2].
Что же касается разложения АС с образованием аммиака и азотной ки-
слоты, то реакция (5) должна протекать с заметным выходом только при тем-
пературах выше 250
0
С (табл. 2).

Высокоэнергетическая обработка материалов
95
Таблица 1
Стандартные термодинамические параметры разложения аммиачной
селитры по уравнению (2-5), (8)
Уравнение реакции
ΔH
298
0
,
кДж/моль
ΔG
298
0
,
кДж/моль
К
298
0
NH
4
NO
3
= N
2
O + 2H
2
O, (2) -361,80 -169,156 4,5·10
29
NH
4
NO
3
= 0,8N
2
+ 1,8H
2
O +0,4 HNO
3
, (3) -218,37 -275,193 1,6·10
48
NH
4
NO
3
= N
2
+ 0,5O
2
+ 2H
2
O, (4) -206,17 -341,879 8,6·10
59
NH
4
NO
3
= NH
3
+ HNO
3
(5) 146,48 87,542 4,2·10
-16
NH
4
NO
3
= NO + 0,5N
2
+ 2H
2
O, (8) -269,30 -185,701 3,6·10
32
Таблица 2
Результаты термодинамического расчета возможности разложения
аммиачной селитры по уравнению (5)
Т, К
ΔH
Т
0
, кДж/моль ΔG
Т
0
, кДж/моль
К
Т
0
α (расчетн.), %
300 146,558 87,145 6,70·10
–16
0
350 148,542 77,102 3,10·10
–12
0
400 189,659 61,634 8,90·10
–9
3,94·10
–2
450 191,737 45,549 5,20·10
–6
2,28·10
–1
500 193,869 29,239 8,80·10
–4
3,01
550 196,058 12,719 6,19·10
–2
27,14
600 198,306 –3,997 2,23·10
0
89,94
Исследования кинетики разложения аммиачной селитры показали, что
процессы в интервале температур 200-250
0
С и 260-270
0
С должны описывать-
ся различными кинетическими уравнениями.
Действительно, как показали расчеты, при температурах 200-250
0
С
процесс проходит в соответствии с уравнением первого порядка, при этом
энергия активации реакции, определенная по углу наклона графика зависимо-
сти lnK от 1/Т, составляет около 110 кДж/моль.
С повышением температуры до 260
0
С зависимость степени превраще-
ния от времени приобретает практически линейный характер, что указывает на
нулевой порядок реакции. Это может свидетельствовать о каталитическом ха-
рактере процесса.
По мнению ряда авторов [1] роль катализатора термического разложе-
ния выполняет азотная кислота, образующаяся по реакции (5). Однако катали-

Высокоэнергетическая обработка материалов
96
затором термолиза нитрата аммония является диоксид азота, образующийся
при термическом разложении НNO
3
в области высоких температур:
2HNO
3
=2NO
2
+ 0,5O
2
+ H
2
O
(г)
, (9)
Термодинамические расчеты по реакции (9) показывают, что при тем-
пературах 260-270
0
С степень превращения азотной кислоты превышает 99%.
Образовавшийся диоксид азота реагирует в дальнейшем с аммиаком и при
соответствующей концентрации реагентов процесс приобретает взрывной
характер [2].
Влияние добавок на характер термической деструкции аммиачной
селитры
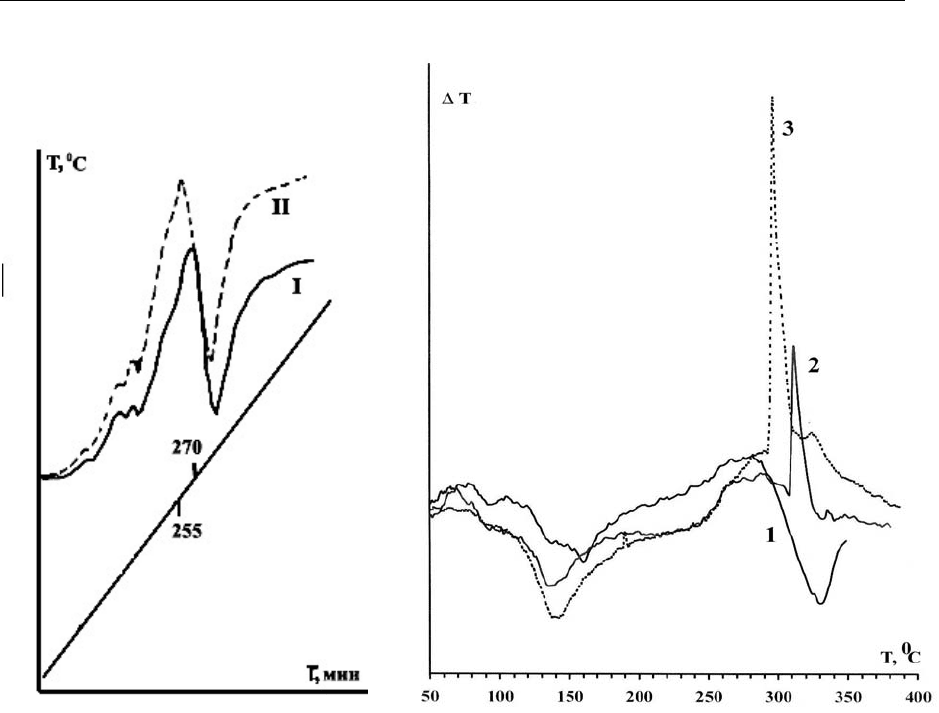
Как показали исследования [7], введение в систему порошков кремния и
ферросилиция (ФС-65) различного фракционного состава оказывает положи-
тельное влияние на динамику разложения аммиачной селитры, рис. 2, смещая
характеристическую температуру экзотермического пика в область более низ-
ких температур. Так как в исследуемом интервале температур кремний и фер-
росилиций не претерпевают каких-либо физико-химических
преобразований,
и не вступают в прямую химическую реакцию с аммиачной селитрой, можно
говорить о положительном каталитическом влиянии кремния и кремнийсо-
держащих материалов на динамику разложения нитрата аммония.
В современных эмульсионных взрывчатых веществах в качестве окис-
лителя используют смесь аммиачной селитры с нитратами щелочных и ще-
лочно-земельных металлов. Представляло интерес
выяснить влияние этих со-
единений на термолиз нитрата аммония.
Как видно из рис. 3, термограмма разложения аммиачной селитры в
присутствии нитратов кальция и натрия приобретает совершенно иной харак-
тер. Площадь экзотермических пиков заметно возрастает, особенно в присут-
ствии NaNO
3
, а сам процесс приобретает взрывной характер.
При этом присутствие в системе нитратов кальция и натрия снижает рас-
четную энергию активации реакции экзотермического разложения нитрата ам-
мония на 35-50% [8]. Именно этим эффектом можно объяснить обнаруженное
авторами [9] повышение работоспособности Сибирита-1000, содержащего
16% масс. NaNO
3
, по сравнению с Сибиритом-1200 на основе монораствора АС.
Высокоэнергетическая обработка материалов
97
Рис. 2. Термограмма раз-
ложения: I – аммиачной селитры
(марка А); II – аммиачной селит-
ры в присутствии ферросилиция
фракции 215–350мкм
Рис. 3. Термограмма разложения ам-
миачной селитры (1) и с добавками (10%.):
кальциевой селитры (2), натриевой селит-
ры (3)
Примечательно, что NaNO
3
и Ca(NO
3
)
2
имеют близкий кислородный ба-
ланс (47,4 % и 48,8 %, соответственно), характеризующий окислительную
способность вещества, однако натриевая соль действует значительно эффек-
тивнее. На роль натрия в катализе горения и термолиза впервые обратила вни-
мание Глазкова [2]. По ее мнению, ответственным за каталитическое действие
является именно металл, и замена солей щелочных металлов на соли аммония
может
привести даже к ингибированию процесса.
На рис. 4 приведены термограммы разложения аммиачной селитры
(рис. 4-a) и смеси аммиачной селитры с углеводородной фазой (рис. 4-б) в
присутствии различных хлоридов.

Высокоэнергетическая обработка материалов
98
а) б)
Рис. 4. Термограммы разложения систем: а) аммиачная селитра-хлориды
(1%); б) аммиачная селитра–углеводород–хлориды (1%): 1 – АС; 2 – АС/НСl;
3 – AC/NaCl; 4 – AC/NH
4
Cl
Степень воздействия исследованных соединений на термолиз аммиач-
ной селитры легко оценить по высоте экзотермического пика и его относи-
тельной площади, которая свидетельствует о степени влияния хлоридов на ве-
личину теплового эффекта разложения селитры.
Как видно из рис. 3, по каталитическому эффекту воздействия на амми-
ачную селитру хлориды можно расположить в следующий
ряд:
NaCl > NH
4
Cl > HCl > CaCl
2
> KCl > MgCl
2
При этом площадь экзотермического пика разложения аммиачной се-
литры при введении хлоридов возрастает в 2,8-2,9 раза. А при введении NaCl в
смесь аммиачной селитры с углеводородной фазой – в 1,5-1,6 раза.
При этом, как показали расчеты по методу Озавы-Логвиненко [10] по
результатам серии термических исследований, проведенных в интервале ско-
ростей нагрева 1-20 град/мин, условная
энергия активации экзотермической

Высокоэнергетическая обработка материалов
99
реакции разложения аммиачной селитры в присутствии 1% NaCl снижается до
46-47 кДж/ моль.
Наблюдаемое каталитическое действие NaCl на первый взгляд кажется
неожиданным. Общеизвестно, что большинство цепных реакций окисления
органических соединений ускоряются диоксидом азота, в то время как галоге-
ниды щелочных металлов выступают в качестве ингибиторов реакций цепного
окисления и воспламенения. При этом считается, что
на поверхности таких га-
логенидов происходит рекомбинация активных промежуточных продуктов.
Можно предположить [11], что на поверхности NaCl происходит поло-
жительная каталитическая реакция превращения активных промежуточных
продуктов в конечные, что приводит к значительному увеличению скорости и
полноты окисления органических веществ.
Положительное каталитическое влияние хлорида натрия было подтвер-
ждено экспериментами по определению критического диаметра
детонации от-
крытого заряда аммиачной селитры повышенной пористости с углеводород-
ной фазой в соотношении 94:6. Критический диаметр определялся по методи-
ке, разработанной В.В. Лавровым и К.К. Шведовым [12] (Черноголовка), по-
зволяющей получить наиболее достоверные результаты.
Установлено, что критического диаметра детонации стехиометрической
смеси аммиачной селитры повышенной пористости с углеводородной фазой
составляет 120 мм
. При введении в состав 1% NaCl критический диаметр сни-
зился до 105 мм, а в случае добавки 1% NH
4
Cl увеличился до 135 мм.
Заключение
Термическое поведение аммиачной селитры в различных системах, при
различных скоростях нагрева или инициирования является неоднозначным
процессом, представляющим собой комплекс параллельно-последовательных
реакций. Детальное изучение механизмов деструкции компонентов взрывча-
тых систем, и в частности нитрата аммония, позволяет выявить каталитиче-
ское или стабилизирующее действие различных добавок, и, как следствие, по-
лучать сложные гетерогенные
системы с управляемыми свойствами.
Результаты проведенных исследований показывают возможность повы-
шения чувствительности простейших взрывчатых веществ на основе аммиач-
ной селитры путем введения неорганических катализаторов реакции взрывча-
того превращения нитрата аммония.

Высокоэнергетическая обработка материалов
100
Литература
1. Термическое разложение и горение взрывчатых веществ и порохов /
Г.Б. Манелис, Г.М Назин, Ю.И. Рубцов, В.А. Струнин. – М.: Наука, 1996. – 223 с.
2. Глазкова А.П. Катализ горения взрывчатых веществ. – М.: Наука,
1976. – 264 с.
3. Розман Б.Ю. О термической стойкости аммиачной селитры. – Л.:
ЛИИТВ, 1957. – 131 с.
4. Еремин Е.Н.
Основы химической термодинамики. – М.: Высшая шко-
ла, 1974. – 341 с.
5. Технология аммиачной селитры / Под ред. В.М. Олевского. – M.: Хи-
мия, 1978. – 383 с.
6. Аналитическая химия. Проблемы и подходы: в 2 т / М.: МИР, АСТ,
2004. – Т.2. – 728 с.
7. Kovalenko I., Kuprin V., Kuprin A. Nonaerations sensibilization of emul-
sive explosives // 7-th sem. New trends in research of energetic materials. – Par-
dubice, 2004. – P. 512–516.
8. Влияние нитратов кальция и натрия на физико-химические свойства
аммиачной селитры и ее растворов / И.
Л. Коваленко, А.В. Куприн, Л.В. Дов-
бань, А.Г. Теплицкая // Вопросы химии и химической технологии. – 2008. –
№2. – С. 245–251.
9. Детонационная способность современных промышленных взрывча-
тых веществ / Е.Н. Кукиб, В.Б. Иоффе, В.Б. Жученко и др.// Материалы IV
междунар. научн. конф. Физические проблемы разрушения горных пород. –
2004. – С. 293–296.
10. Логвиненко В.
А. Термический анализ координационных соединений
и клатратов. – Новосибирск: Наука, 1982. – 273 с.
11. Глазкова А.П. // Кинетика и катализ. – Т. 12. – 1971. – №5. – С. 27–39.
12. Лавров В.В. Исследование затухающих взрывных процессов в гете-
рогенных пористых ВВ. Разработка стандартных методов оценки взрывоопас-
ности: Автореф. дисс. кандидата физ-мат. наук: 01.04.17 / ИПХФ РАН. – Чер-
ноголовка, 2008. – 30 с.
