Штриплинг Л.О., Туренко Ф.П. Основы очистки сточных вод и переработки твердых отходов
Подождите немного. Документ загружается.


71
Ме
+
+ Na[K] ↔ Me[K] + Na
+
,
где Ме
+
– катион, находящийся в сточной воде; [К] – сложный комплекс катионита.
Величина рН сточной воды, при которой происходит обмен ионами, зависит от
константы диссоциации ионообменных групп. Сильнокислотные катиониты поз-
воляют осуществлять процесс ионного обмена при любых значениях рН, а слабо-
кислотные – в щелочных и нейтральных, при рН > 7. Так катиониты с карбоксиль-
ными группами обмениваются ионами при рН > 7, а с фенольными – при рН > 8.
Иониты в контакте с водой не растворяются, но поглощают некоторое коли-
чество воды, являясь гелями с ограниченной набухаемостью. При соприкоснове-
нии с водой, вследствие осмотических явлений, происходит их набухание; размер
пор увеличивается от 0,5-1,0 нм до 4,0 нм. Объем ионитов обычно увеличивается
в 1, 2-3 раза. Степень набухания зависит от строения ионита, природы проти-
воионов, от состава раствора. Набухание влияет на скорость и полноту обмена
ионов, а также на селективность ионита. Оно прекращается после того, как раз-
ность осмотических давлений до и после обмена уравновесится упругими силами
растяжения и сжатия ионита. Сильно набухающие смолы, называемые гелеобраз-
ными, имеют удельную обменную поверхность 0,1-0,2 м
2
/г. Макропористые
иониты обладают развитой обменной поверхностью, равной 60-80 м
2
/г. Синтети-
ческие иониты набухают больше и имеют большую обменную емкость, чем при-
родные.
На кинетику ионного обмена влияют также температура, концентрация ионов и др.
Иониты должны обладать термической и химической стойкостью. При нагревании
ионитов в воде и на воздухе возможно разрушение их зерен, отщепление активных
групп, что приводит к снижению емкости. Для каждого ионита имеется темпера-
турный предел, выше которого его нельзя использовать. В общем случае термиче-
ская устойчивость анионитов ниже, чем катионитов. Химическая стойкость оцени-
вается по изменению полной обменной емкости и изменению массы ионита.
Характерной особенностью ионного обмена является его обратимость, т.е.
возможность проведения реакции в обратном направлении, что и лежит в основе
регенерации ионитов.
Регенерация отработанных катионитов осуществляется 2-8 % растворами
кислот (при Н-катионите) или раствором хлористого натрия (при Na-катионите).
Регенерационные растворы – элюаты – содержат катионы. После взрыхления и
промывки катиониты заряжаются
2 4 2 4
2
Ме[К] + Н SО 2H[K] + Me SO ,
Me[K] + NaCl Na[K] + MeCl
Поскольку в сточных водах, как правило, содержится несколько катионов,
большое значение имеет селективность их поглощения, которая зависит от степени
набухания в порах и размера пор ионита. При малом размере пор большие ионы не
могут достичь внутренних активных групп. В целях повышения селективности
ионитов к определенным металлам в его состав вводят вещества, способные обра-
зовывать с ионами этих металлов внутрикомплексные соединения – хилаты.
Для каждого вида катионита установлены ряды катионов по энергии их вы-
теснения. Например, для сильнокислого сульфокатионита КУ-2: Н
+
< Na
+
< NH
4
+

72
< Mg
2+
< Zn
2+
< Co
2+
< Cu
2+
< Cd
2+
< Ni
2+
< Ca
2+
< S
r
2+
< Pb
2+
< Ba
2+
, для слабокис-
лого катионита КБ-4: Mg
2+
< Са
2+
< Ni
2+
< Со
2+
< Cu
2+
.
Слабоосновные аниониты поглощают анионы сильных кислот
2 4 2 4 2
2[
А]ОН + H SO [A] SO + 2H O
,
где [А] – сложный органический комплекс анионита.
Для большинства анионов справедлив следующий ряд по поглощающей
способности SO
4
2-
> NO
3
-
> Сl
-
.
Регенерация отработанных слабоосновных анионитов достигается фильтро-
ванием через слой анионита 2-6 % водных растворов щелочей (например NaOH
Na
2
CO
3
или NH
4
OH). Аниониты при этом переходят в ОН-форму
2 4 2 4
[
А] SO + 2NaOH 2[A]OH+N SO
.
Элюаты содержат в сконцентрированном виде все извлеченные из сточных вод
анионы. При необходимости регенерируемый анионит можно перевести в С1 –
форму, пропуская раствор NaCl. В отработанном заряжающем растворе накаплива-
ется едкий натрий.
Элюаты представляющие собой отработанные растворы кислот и щелочей,
нейтрализуют или обрабатывают с целью рекуперации ценных продуктов.
Нейтрализацию проводят смешением кислых и щелочных элюатов, а также до-
полнительным введением кислоты или щелочи. Степень регенерации в процентах
определяют по формуле
100
в п
и и
(1.17)
где и
в
– восстановленная обменная емкость; и
п
– полная обменная емкость.
На степень регенерации влияют: тип ионита, состав насыщенного слоя, при-
рода концентрация и расход регенерирующего вещества, температура, время кон-
такта и расход реагентов. Процесс регенерации ионитов состоит из трех стадий:
взрыхления ионита, регенерации, отмывки ионита от продуктов регенерации и
избытка регенерирующего вещества. Объем промывных вод обычно составляет
75-100 % объема регенерационных растворов.
Процессы ионообменной очистки сточных вод осуществляются в установках,
периодического или непрерывного действия. Установка периодического действия
состоит из фильтра (или колонны) периодического действия, насоса, емкостей и
контрольно-измерительных приборов. Фильтр периодического действия пред-
ставляет собой закрытый цилиндрический резервуар с расположенным у днища
щелевым дренажным устройством, обеспечивающим равномерное отведение во-
ды по всему сечению фильтра, высота слоя загрузки ионита 1,5-2,5 м.
Фильтр может работать по параллельно-точной схеме (при подаче сточной во-
ды и регенерирующего раствора сверху) и по противоточной схеме (сточная вода
подается снизу, а регенерирующий раствор – сверху). На продолжительность
фильтроцикла большое влияние оказывает содержание взвешенных веществ по-
этому перед подачей воды в ионообменную установку следует обеспечить макси-
мальное их удаление. При фильтровании сточной воды через неподвижный слой
ионита со скоростью до 10 м/ч расчет фильтра производится на основании матери-
ального баланса. При очистке сточных вод, загрязненных взвешенными вещества-
ми, применяют ионообменные колонны с псевдоожиженным слоем ионита.
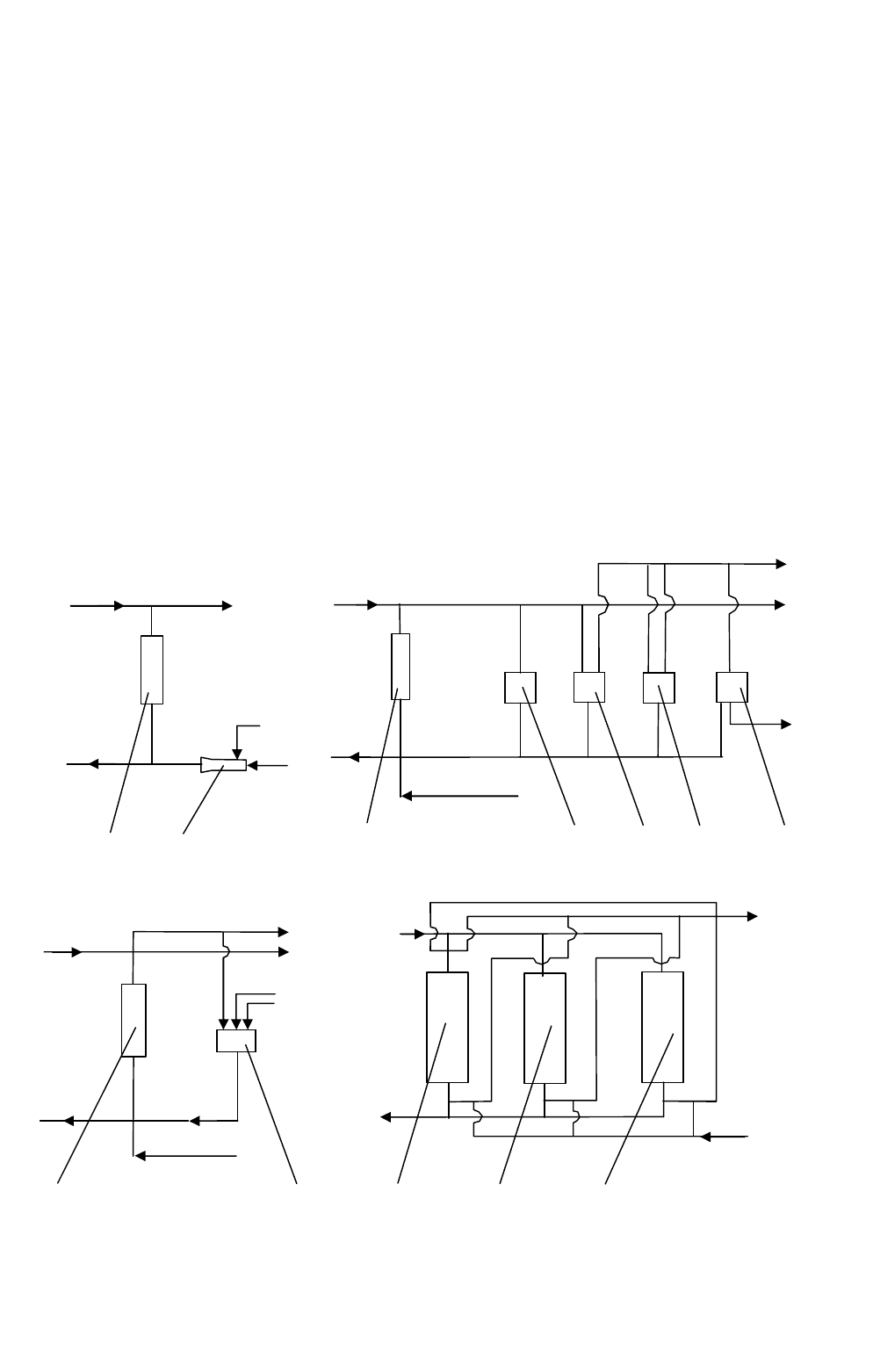
73
На рис. 1.39, а – в приведены схемы установок периодического действия с
одним ионообменным аппаратом. Все приведенные схемы отличаются способом
регенерации ионита. На схеме с проточной регенерацией (см. рис. 1.39, а) регене-
рирующий раствор готовят непрерывно при подаче в эжектор воды и концентри-
рованного раствора кислоты или щелочи. Подачу кислоты прекращают после
пропускания через ионит заданного объема регенерационного раствора. А подачу
воды продолжают для отмывки ионита от регенерационного раствора. Элюат и
промывные воды после нейтрализации можно сбрасывать в канализацию.
По схеме с оборотом части реагента (см. рис. 1.39, б) регенерирующий рас-
твор готовится в специальной емкости 3. Этим достигается сокращение расхода
регенерирующего реагента и объема регенератора, т.к.к регенерирующий раствор
готовят путем добавления к первой порции промывочной воды концентрирован-
ного реагента. В результате часть реагента находится в обороте.
По схеме с фракционированием реагента (см. рис. 1.39, в) достигается
наименьший расход реагентов. Регенерат разделяют на отдельные фракции и со-
бирают в емкости. Первую фракцию, более концентрированную, направляют на
переработку. Промывную воду также собирают в две емкости. При следующей
регенерации в качестве первой фракции используют вторую фракцию от преды-
дущей регенерации, доведенную до заданной концентрации реагентом.
I
II
III
IV
V
VI
1
2
а
I
II
III
IV
V
VI
1
3
б
I
II
III
IV
V
VI
1
в
4
4
3
3
I
II, V
III, VI
IV
1
г
1
1
Рис. 1.39. Схемы ионообменных установок периодического действия:
а – с проточной регенерацией; б – с оборотом части реагента;
в – с фракционированием регенерата; г – с «плавающим» фильтром;
I – подача сточной воды; II – подача воды на регенерацию; III – промывная во
да;
IV – очищенная вода; V – кислота, щелочь; VI – регенерат

74
Схема с плавающим фильтром (см. рис.1.39, г) дает возможность получить
более концентрированные регенераты. Очищаемую воду последовательно про-
пускают через два фильтра. В начале проскока во втором фильтре подключают
отрегенерированный третий фильтр, а первый по ходу воды выводится на регене-
рацию. Регенерация отработанного фильтра может производиться по описанным
выше схемам с одним аппаратом.
Недостатки установок периодического действия: большие объемы аппаратов;
значительный расход реагента; большая единовременная загрузка ионита; сложность
автоматизации процесса – ограничивают возможность их применения на практике.
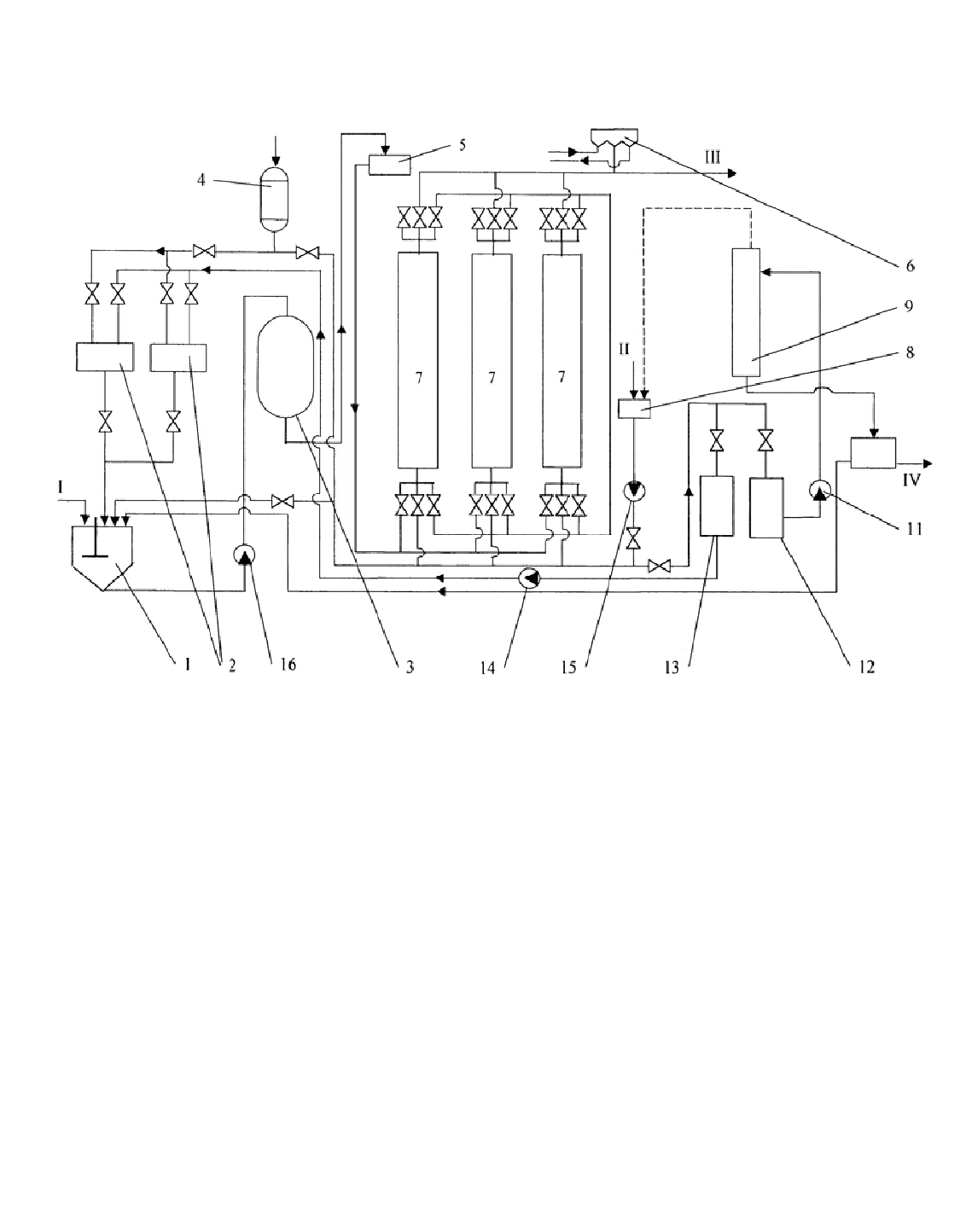
В качестве примера приведена технологическая схема ионообменной очист-
ки сточных вод производства хлоранилина от смесей анилина с хлоранилином
(рис. 1.40). Необработанная сточная вода по линии I поступает в резервуар 1, куда
дозируется из мерников 2 соляная кислота для снижения рН < 4-4,5. Подкисленная
сточная вода насосом 16 подается на фильтр 3, где отделяется от выпавших при
подкислении взвешенных веществ. Фильтрат поступает в блок последовательно
расположенных ионообменных колонн 7 с общей высотой слоя катионита КУ-2 не
менее 3 м; скорость фильтрования около 2 м
3
/ч на 1 м
2
площади поперечного сече-
ния ионообменной колонны.
Обычно две колонны работают в режиме ионного обмена, а одна регенери-
руется. Регенерационный аммиачно-метанольный раствор насосом 15 из мерни-
ка 8 подается в регенерируемую колонну снизу вверх. Подогретая до 35-40
0
С
вода для промывки отрегенерированной колонны поступает в нее через тот же
мерник 8. Из колонны отработанный регенерационный раствор выпускается в
приемник 12, откуда центробежным насосом 11 подается в ректификационную
колонну 9 для отгонки метанола и аммиака.
Кубовый осадок из этой колонны направляется в отстойник, где происходит
разделение фаз: водный слой направляется в сборник, а слой сырых аминов на
разгонку и утилизацию. Разделение фаз происходит простым отстаиванием, и эта
операция требует много времени.
После регенерации водно-метанольным раствором аммиака катионит для пе-
ревода в водородную форму промывают 8-10 % раствором соляной кислоты, по-
ступающем из емкости 4. Кислота, вытекающая из колонны, собирается в емкость
13 и насосом 14 подается в мерники 2 для регенерирования рН сточной воды. Туда
направляются промывные воды. Обработанная сточная вода имеет слабокислую
реакцию и должна перед сбором нейтрализоваться известковым раствором.
Процесс ионного обмена может быть представлен в виде нескольких стадий:
- перенос ионов А из ядра потока жидкости к внешней поверхности пограничной
жидкой пленки, окружающей зерно ионита; диффузия ионов через пограничный слой;
- переход ионов через границу раздела фаз в зерно ионита;
- диффузия ионов А внутри зерна ионита к ионообменным функциональным
группам;
- собственно химическая реакция двойного обмена ионов А и В;
- диффузия ионов В внутри зерна ионита к границе раздела фаз;
- переход ионов В через границу раздела фаз на внутреннюю поверхность
пленки жидкости;
75
- диффузия ионов В через пленку;
- диффузия ионов В в ядро потока жидкости.
Рис. 1.40 Схема ионообменной установки по очистке сточных вод хлорани-
лина:
I – подача сточной воды; II – подача свежей воды; III –выпуск обработанной
сточной воды;
IV – выпуск продукта
Пробел
Химическая реакция ионного обмена происходит быстро и не определяет
суммарную скорость процесса. А диффузия в пленке жидкости и диффузия в
зерне ионита протекают медленно. Они и определяют скорость ионного обмена.
Для того чтобы оценить зависимость скорости реакции от концентрации веще-
ства, введем понятие числа био:
B
i
= β·r
0
/ (K
r
·D), (1.18)
где β – коэффициент массоотдачи; r
0
– радиус зерна иона; К
r
– константа Генри;
D – коэффициент массопроводности.
При B
i
< 1 (концентрация вещества в сточных водах менее 0,003 моль/л) –
скорость обмена определяется диффузией ионов через пленку жидкости – пле-

76
ночная кинетика). При B
i
< l (концентрация вещества не менее 0,1моль/л) – ско-
рость процесса определяется диффузией ионов внутри зерна – гелевая кинетика.
Если концентрация раствора находится в пределах 0,003-0,1моль/л – скорость
ионного обмена определяют оба вида диффузии. Коэффициенты диффузии раз-
личных ионов в смоле имеют порядок 10
–6
-10
–9
см
2
/с, а в воде 10
–4
-10
–5
см
2
/с. Ко-
эффициент диффузии снижается при увеличении размера гидратированных
ионов в растворе и росте заряда обменивающихся противоионов. Для внешне-
диффузионной области при значениях числа Рейнольдса Rе
э
=2-30 для расчета ко-
эффициента массоотдачи может быть использована следующая формула:
Nu
э
= 0,725
.
Re
э
0,47·
·Pr
D
1/3
, (1.19)
где Re
э
= u·d
э
/ ν – число Рейнольдса; Nu
э
= β d
э
/ D – число Нуссельта; Pr
D
= ν/D –
число Прандтля.
Для определения основных параметров установки подсчитывает суммарную
оптимальную площадь сечения ионообменных колонн, по расходу сточных вод и
скорости фильтрования через псевдоожиженный слой ионита:
общ опт
S Q / u ,
где
опт
u – скорость фильтрования на 1 м
:
поперечного сечения колонны, м
3
/ч;
Q –расход сточной воды, м
3
/ч.
Общее количество ионов, которое должно быть задержано в ионообменной
колонне за 1 ч, зависит от их начальной С
н
и конечной С
к
концентраций и состав-
ляет Q·(C
н
– С
к
). Для поглощения этого количества ионов необходимо подать
определенное количество воздушно-сухого ионита с динамической емкостью Е
д
М
ч
= Q·(C
н
– С
к
) / Е
д
, (1.20)
где, М
ч
– требуемая масса воздушно-сухого ионита, т/ч.
Если продолжительность рабочего цикла ионообменных колонн между двумя
регенерациями равно t ч, то общая их загрузка
М
о6щ
=М
ч
·t. (1.21)
Объем загрузки ионообменных колонн до образования псевдоожиженного слоя
W
1
= M
oбщ
/ d
н
, (1.22)
где d
н
– насыпная плотность ионита, т/м
3
.
Поскольку суммарная площадь ионообменных колонн определяется опти-
мальной скоростью фильтрования, то высота набухшего слоя ионита до псевдо-
ожижения составит:
H
1
= W
1
/ S
oбщ
. (1.23)
Т.к.к оптимальное отношение высоты псевдоожиженного слоя к высоте q не-
подвижного слоя Н
2
/ Н
1
= 1,5, то
Н
2
= 1,5 W
1
/ S
oбщ
(1.24)
Если задаться диаметром ионообменной колонны D
к
, то число колонн

77
2
общ к
n 4S /( D ).
Далее подсчитывают объем регенерационных растворов и емкостей для них.
Непрерывный ионообмен дает возможность снизить затраты ионита, реагентов
для регенерации, промывочной воды, а также применять более компактное обо-
рудование по сравнению с периодическими ионообменниками. Колонны непре-
рывного действия могут работать как с движущимся слоем ионита (в качестве ко-
торого и обычно используются синтетические ионообменные смолы), так и ки-
пящим. Установки непрерывного действия обычно содержат несколько ионооб-
менных аппаратов с катионитом и анионитом.
В аппаратах непрерывного действия
(рис. 1.41) ионит движется по замкнутому
контуру, последовательно проходя стадии
сорбции, регенерации и промывки.
Аппарат состоит из ионообменной
емкости, выполненной в виде усеченно-
го конуса 9. Внутри этого конуса нахо-
дится второй усеченный конус 7, где
происходят процессы регенерации и от-
мывки. Сточная вода подается по линии
I в колонну через трубку с коническими
насадками. Пройдя через псевдоожи-
женный слой ионита, обработанная вода
выходит из верхней части колонны (ли-
ния IV). Обработанный ионит осаждает-
ся в нижней части колонны. Во внут-
реннем полом усеченном конусе 7 ско-
рость движения потока воды уменьшает
с помощью регулятора 5, что способ-
ствует вовлечению отработанного иони-
та в этот конус и последующему оса-
ждению его в нижней части ионообмен-
ной колоны. Регенерационный раствор
подается в нижнюю часть внутреннего
усеченного конуса по линии III, а отво-
дится в верхней части (линия V). Реге-
нерированный ионит, продолжая опускаться навстречу восходящему потоку во-
ды, промывается и переходит в рабочую зону колонны. Аппарат прост в кон-
структивном исполнении и эффективен в работе.
Ионообменный аппарат должен удовлетворять следующим требованиям:
- иметь необходимый рабочий объем;
- обеспечивать гидродинамический режим движения взаимодействующих фаз;
- обеспечивать требуемый уровень насыщения ионита;
- обеспечивать небольшое гидравлическое сопротивление;
- минимизировать капитальные и эксплуатационные затраты
I
II
III
IV
V
1
2
3
4
5
6
Рис. 1.41. Ионообменный аппарат
непрерывного действия: I – подача
сточной воды; II – подача воды;
III – подача регенерационного
раствора; IV – выпуск обработанной
сточной воды; V – отвод после
регенерационного раствора

78
Таким образом, систематизируя сказанное выше, аппараты ионного обмена
можно классифицировать по различным признакам.
1. По организации процесса – аппараты непрерывного действия, периодиче-
ского и полунепрерывного.
2. По гидродинамическому режиму – аппараты вытеснения, аппараты смеше-
ния и аппараты промежуточного типа.
3. По состоянию слоя ионита – с неподвижным слоем, с движущимся слоем,
пульсирующим, перемешиваемым и циркулирующим.
4. По организации контакта взаимодействующих фаз – с непрерывным кон-
тактом и со ступенчатым контактом.
5. По организации взаимного направления движения фаз – прямоточные, про-
тивоточные и со смешанным током.
6. По конструкции – на колонные и емкостные.
7. По способу подвода энергии – без подвода энергии извне (с гравитацион-
ным движением твердой фазы) и с подводом энергии извне (принудительное
движение твердой фазы).
5.6. Мембранные процессы
Частицы растворенного вещества и растворителя находятся в беспорядочном
тепловом движении и равномерно распределяются по всему объему раствора. Ес-
ли поместить в емкость концентрированный раствор какого-либо вещества, а по-
верх него осторожно налить слой более разбавленного (менее концентрированно-
го) раствора, то через некоторое время молекулы растворителя и растворенного
вещества равномерно распределятся по всему объему жидкости. Самопроизволь-
ный процесс перемещения молекул вещества, приводящий к выравниванию кон-
центраций в растворе, называется диффузией. Диффузия, при которой процесс
проникновения молекул в результате беспорядочного теплового движения осу-
ществляется в обоих направлениях: из раствора с высокой концентрацией в рас-
твор со слабой концентрацией, и наоборот, из раствора со слабой концентрацией
в раствор с высокой концентрацией – называется встречной или двусторонней.
Осмосом называется односторонняя диффузия через полупроницаемую пере-
городку – мембрану. Осмотическое давление раствора – количественная характе-
ристика осмоса – равно гидростатическому давлению, при котором достигается
(наступает) равновесие при односторонней диффузии через полупроницаемую
мембрану. Полупроницаемая мембрана – это такая мембрана, через которую рас-
творитель может проходить, а растворенное вещество нет. Такие перегородки
существуют в природе, а также могут быть получены искусственно.
При измерениях осмотического давления различных растворов было установ-
лено, что величина осмотического давления зависит от концентрации раствора и
от его температуры, но не зависит ни от природы растворенного вещества и ни от
природы растворителя.
Закон Вант-Гофа показывает для растворов электролитов невысоких концен-
траций зависимость осмотического давления от концентрации и температуры
раствора

79
P = C·R·T, (1.25)
где Р – осмотическое давление раствора, кПа; С – объемная мольная концентра-
ция раствора (молярность), моль/л; R = 8,314 Дж/моль – универсальная газовая
постоянная; Т – абсолютная температура раствора, К.
Молярность раствора представляет собой отношение количества растворен-
ного вещества к объему V в литрах
C = n / V.
или C = m / (M – V). (1.26)
Подставляя выражение (1.26) в (1.25), получим:
P
.
V = m·R·T / M. (1.27)
Это уравнение позволяет по величине осмотического давления раствора
определять мольную массу, а значит, и молекулярную массу растворенного ве-
щества, следовательно, и объем выделяемого из раствора вещества.
Если к раствору, отделенному от растворителя полупропорциональной мембра-
ной, приложить внешнее давление (рис. 1.41), равное осмотическому давлению рас-
твора, то осмос прекратится, следовательно, установится осмотическое равновесие.
Если же приложенное внешнее давление превысит осмотическое, то диффузия
растворителя будет преимущественно происходить из раствора в фазу растворите-
ля, т.е. в направлении, противоположном направлению переноса растворителя при
осмосе. Такое явление получило название обратного осмоса. Таким образом, это
непрерывный процесс молекулярного разделения растворов путем их фильтрова-
ния под давлением через полупроницаемые мембраны, задерживающие полностью
или частично молекулы, или ионы растворенного вещества.
Осмос широко применяется как один из наиболее экономичных способов
опреснения воды. Солевой раствор (например, морская вода) отделяют полупро-
ницаемой мембраной от пресной воды и подвергают давлению, более высокому,
чем осмотическое давление раствора. В результате часть содержащейся в раство-
ре воды "вытесняется" в пресную воду, а концентрация соли в оставшемся рас-
2
1
3
а
р
Н
2
1
3
б
р = Н
Н
в
р Н
Н
1
3
2
Рис. 1.42. Схемы осмоса: а – прямой осмос; б – осмотическое равновесие;
в – обратный осмос; Н – осмотическое давление; р – рабочее давление;
1 – растворитель; 2 – полупроницаемая мембрана; 3 – раствор

80
творе повышается. Концентрированный солевой раствор периодически заменяет-
ся свежими порциями морской воды, подлежащей опреснению. Обратный осмос
также используется для обессоливания воды в системах водоподготовки ТЭЦ и
предприятий различных отраслей промышленности (полупроводников, кинеско-
пов, медикаментов и др.); в последние годы начинает применяться для очистки
некоторых промышленных и городских сточных вод. В процессе ультрафильтра-
ции получают концентрат, содержащий органические вещества, а в процессе об-
ратного осмоса – концентрат неорганических веществ и чистую воду.
Обратным осмосом и ультрафильтрацией называются процессы фильтрова-
ния растворов через полупроницаемые мембраны под давлением, превышаю-
щим осмотическое давление.
Мембраны пропускают молекулы растворителя, задерживая растворенные
вещества. При обратном осмосе отделяются частицы (молекулы, гидратирован-
ные ионы), размеры которых не превышают размеров растворителя. При ультро-
фильтровании размер отдельных частиц d
ч
на порядок больше. Условные грани-
цы применения этих процессов приведены в табл. 1.4.
Таблица 1.4
Процесс d
ч
, MKM
Обратный осмос 0,0001 0,001
Ультрафильтрация 0,001-0,02
Макрофильтрация (гиперфильтрация) 0,02-10
Таким образом, от обычной фильтрации такие процессы отличаются отделе-
нием частиц меньших размеров. Давление, необходимое для проведения процесса
обратного осмоса (6-10 МПа), значительно больше, чем для процесса ультра-
фильтрации (0,1-0,5 МПа).
Достоинства метода:
1. Отсутствие фазовых переходов при отделении примесей, что позволяет ве-
сти процесс при небольшом расходе энергии.
2. Возможность поведения процессов при комнатных температурах без при-
менения или с небольшими добавками химических реагентов.
3. Простота конструкции аппаратуры.
Недостатки:
1. Возникновение явления концентрационной поляризации, которое заключа-
ется в росте концентрации растворенного вещества у поверхности мембраны. Это
приводит к уменьшению производительности установки, степени разделения
компонентов и срока службы мембран.
2. Проведение процесса при повышенных давлениях, что вызывает необходи-
мость применения специальных уплотнений для аппаратуры.
Эффективность процесса зависит от свойств применяемых мембран. Они
должны обладать следующими достоинствами:
1) высокой разделяющей способностью (селективностью);
2) большой удельной производительностью (проницаемостью);
3) устойчивостью к действию среды;
