Сборник докладов Энергетика, надежность, безопасность
Подождите немного. Документ загружается.


Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
Такое взаимодействие характерно для цельных, жестких частиц и его следствием является
рикошетирование частиц и абразивный износ поверхностей.
Агломераты состоят из множества частиц, поэтому имеют массу, большую по сравнением
с массой частиц. В зависимости от соотношений радиальной и тангенциальной скорости
агломерата подлет его к поверхности осуществляется под разными углами (рис.1). Угол
падения
определяет характер его взаимодействия с поверхностью. Агломерат имеет плотность в несколько
раз меньшую по сравнению плотностью вещества частиц, из которых он состоит. Поэтому
рикошетирование едва ли возможно. В зависимости от угла взаимодействия и скорости
взаимодействия агломерат будет либо размываться, диспергироваться и снова укрупняться, либо
наоборот, будет уплотняться и образовывать отложения
. Если отложения прочны, они не
разрушаются потоком. На рис. 1 показаны траектории движения агломерата в канале и схема
преобразования агломерата А (пунктир) в
уплотненный сгусток Б.
Рис. 1. Траектории движения агломерата в
канале и схема преобразования агломерата А
(пунктир) в уплотненный сгусток Б.
Агломерат, состоящий из мелких
частиц, под воздействием
центробежной силы движется относительно газа к периферии и при
взаимодействии со стенкой проходит стадии уплотнения, деформирования, последействия.
Изменение количества движения равно импульсу силы, возникающей в сформировавшейся
поверхности контакта. Время взаимодействия и деформирования определяется скоростью подлета
агломерата к стенке и размером области «сплющивания». Кроме того, может быть использовано
уравнение скорости изменения энергии
, связывающее кинетическую энергию и скорости
изменения энергии периферийных сил, приложенных к деформируемой поверхности. Все эти
данные позволяют прогнозировать состояние и параметры агломерата, если известны параметры
слоя частиц в отложении.
Скорость частицы относительно газа в криволинейном потоке в радиальном направлении
может быть найдена из безразмерного уравнения [5]
()
δ,w
δ
δ
Stk
Ψ
r
W
Re24
Re
Re
2
2
⋅
=
ϕ
, (1)
ν
δW
δ,w
0
Re =
,
c
δ
R
W
ρ
ρ
ν
δ
Stk
0
2
18
=
,
2
32
0
18
Re
ν
δ
R
W
ρ
ρ
Stk
c
δ
δ,w
=⋅
,
ν
δ
δ
U
∆
=Re
, где ρ, ρ
δ
−плотности
газа и частиц δ− диаметр частицы, ν− кинематический коэффициент вязкости газа, ∆U− скорость
частицы относительно газа в радиальном направлении, W
0
−скорость газа на входе в аппарат,
0
W
W
W
ϕ
ϕ
=
−безразмерная окружная скорость частицы, R
c
− базовое значение радиуса циклона. В [5]
было показано, что в диапазоне
1001Re
−
=
δ
уравнение (1) можно аппроксимировать
зависимостью
750
2
ReRe
,
δ,wδ
R
W
Stk
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
(*),
а в диапазоне
уравнение (1) аппроксимируем зависимостью
100000500Re −=
δ
50
2
Re71Re
,
δ
δ,wδ
R
δ
ρ
ρ
,
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
=
(**) .
Агломераты вблизи стенки проходят участок с уменьшающей скоростью потока, причем
на самой стенке скорость потока равна нулю. Окружная скорость газа на расстоянии от стенки
)ln32.15.9()(
η
ρ
τ
ϕ
+=
w
yW
,
ρ
τ
ν
η
W
y
=
[6], ,
2/5.0
2
∆
= WC
fW
ρτ
006.0
≈
f
C
, – значении
окружной скорости на границе пристенной зоны;
∆
W
0
95.0 WW
=
∆
. Положим, что на половине
151

Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
пристенной зоны интенсивного падения скорости
0.03
R
∆
≈
на агломерат не воздействует
увлекающая сила потока, и эту зону агломерат проходит по инерции. Проведем оценку значения
конечной скорости подлета агломерата к стенке. Обозначим х=R
−
y, скорость подлета к
пристенной зоне ∆U
∆
, скорость падения на стенку в нормальном направлении ∆U
ст
Уравнение замедленного движения агломерата в радиальном направлении имеет вид
dx
Ud
dt
Ud
dt
dx
Um
U
dt
Ud
m
a
aa
2
; ;
6
;
24
2322
∆
=
∆
=∆=
∆
=
∆
ρ
πδ
ρ
πδ
ξ
. После интегрирования,
получим следующее выражение
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
∆
−=
∆
∆
∆ aa
U
U
δρ
ρ
ξ
22
3
exp
ст
(2)
Рис. 2. Схема взаимодействия
цилиндрического агломерата с поверхностью
под прямым углом
Рассмотрим наиболее простой процесс уплотнения агломерата
при его нормальном контактном взаимодействии с преградой. Задачи
процесса деформирования и разрушения жесткопластического тела
(бойка) при ударе о жесткую преграду приведены в [7]. Отличие
процесса при взаимодействии дисперсного тела с преградой от процесса
взаимодействия
жесткопластического тела заключается в непостоянстве
его плотности. Опыты показывают, что при скоростях удара выше некоторого значения агломерат
разрушается с образованием осколков и налипших фрагментов, при меньших скоростях агломерат
уменьшает свою длину, уплотняется и прилипает к поверхности. Агломерат в форме цилиндра
производит удар плоским торцом о поверхность неподвижной абсолютно твердой преграды.
Скорость удара V
0
направлена по оси цилиндра перпендикулярно плоскости преграды. Процесс
удара сопровождается сжатием дисперсной среды с малым изменением площади сечения. Это
может происходить в случае взаимодействия частиц внутри цилиндра, при котором каждый
контакт является неупругим, и частицы притягиваются друг к другу аутогезионными силами. Это
характерно для частиц размером менее 10 мкм. Первоначальная длина цилиндра
L
1
, длина в
сжатом состоянии L
2
(рис. 2).
При ударе дисперсная среда из объема с длиной L
1
−L
2
переходит в объем с длиной L
2
.
Положим, что до удара и после удара плотность среды в объемах распределена равномерно.
Условие сохранения массы дисперсной среды в положении цилиндров 1 и 2 дает следующее
соотношение
ρ
1
L
1
= ρ
2
L
2
(***)
Уравнение импульсов при взаимодействии агломерата со стенкой имеет вид
0
11
;
V
dl
dt
dt
dV
L
s
=−=
σρ
,
где t− переменное время, l− переменная длина, V− переменная скорость, σ
s
− напряжение контакта
на стенке. Последнее уравнение можно записать в разностном виде
s
l
V
L
σρ
−=
∆
∆
2
0
11
,
Разделяя множители и учитывая, что ∆l = L
1
−L
2
, используя равенство (***), получим
соотношение между плотностью, скоростью и напряжением.
2
1
1
2
0
1
ρ
ρ
ρ
σ
−
= V
s
(3)
Плотность агломерата определяет его прочностные показатели, которые, в свою очередь,
определяются аутогезионными внутренними силами. Поэтому допущение постоянства плотности
дисперсной среды в агломерате приводит и к допущению постоянства напряжения,
определяющего прочность в период взаимодействия. Из уравнения (3) следует, что напряжение
контакта, которое при вышеприведенных допущениях являются и напряжением в агломерате в
конце
периода контактного взаимодействия, определяется плотностью и скоростью агломерата до
152
Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
удара и плотностью после удара. Однако ясно, что напряжение внутри агломерата должно
уменьшаться к свободному концу, поэтому осредненное по длине напряжение должно быть
меньше, чем напряжение на торце.
Представим распределение напряжений по длине в объеме с длиной L
2
в виде
k
s
L
l
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
−=
2
1
σσ
, (4)
причем
1
1
1
2
0
22
+
=
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
−=
∫
k
dl
L
l
L
s
k
L
s
σ
σσ
, откуда
.1
1
2
1
2
2
1
2
1
−
⎟
⎟
⎠
⎞
⎜
⎜
⎝
⎛
−
=−=
ρ
ρ
ρ
ρ
σ
σ
s
k
После прекращения воздействия всех нагрузок (период последействия) агломерат в новом
состоянии оказывается в равновесии. На агломерат действуют увлекающие аэродинамические
силы со стороны потока, силы тяжести, с другой притягивающая за счет адгезии и аутогезии
частиц сила стенки. В новом состоянии на свободном торце отсутствует сила давления, тогда как
на контактном
торце действуют адгезионные силы, которые зависят от силы «прижима» во время
взаимодействия, на боковой поверхности действуют стягивающие поверхностные силы, которые
обуславливаются аутогезионными силами.
Формула (2) и формулы (3, 4) позволяют провести расчет контактного напряжения и
оценить распределение напряжений в агломерате в период взаимодействия его со стенкой. Расчет
проводится для двух значений отношений плотностей
ρ
2
/ρ
1
=0.7 и ρ
2
/ρ
1
=0.4 [8]. ρ
1
=300 кг/м
3
. В
формуле (3) ∆U
ст
≡V
0
.
Таблица 3.
Результаты расчета скорости агломератов в радиальном направлении
δ (мкм) 50 100 200 400 800
Re
δ
8.2 39.2 186 607 1690
∆U
∆
м/с 2.4 5.8 13.9 23 32
∆
∆
∆
U
U
ст
0.31
0.48
0.69
0.83
0.91
ρ
2
/ρ
1
=0.7
σ
s
кПа 0.553 7.75 92. 364. 847.
ρ
2
/ρ
1
=0.4
σ
s
кПа 0.276 3.87 46. 182. 423.
Расчет напряжений в самом агломерате (формула 4) показывает быстрое уменьшение
напряжения к свободному концу.
Таким образом, информация о плотности отложений может явиться и информацией о
скорости подлета агломерата к поверхности и о его массе. Оценки показывают, что напряжения во
взаимодействиях агломерата с поверхностью могут достигать значений, сопоставимых с
атмосферным давлением, что
является причиной образования прочных отложений, которые, в
свою очередь, определяются аутогезионными связями частиц, образующими агломерат.
Работа выполнена при поддержке РФФИ (грант 06-08-00054а)
Список литературы:
1. Зимон А.Д. Адгезия пыли и порошков. – М.: Химия, 1976. – 432 с.
2.
Левич В.Г. Физико-химическая гидродинамика.− М.: Физматгиз.− 1959.− 699 с.
3.
Медников Е.П. Турбулентный перенос и осаждение аэрозолей. −М.: Наука, 1981. − 176 с.
4.
Морозов Е.М., Зернин М.В. Контактные задачи механики разрушения.− М.:
Машиностроение.− 1999.− 544 с.
5.
Василевский М.В., Зыков Е.Г. Расчет эффективности очистки газа в инерционных аппаратах:
Учебное пособие. − Томск: Изд-во ТПУ, 2005.−88 с.
6.
Штым А.Н. Аэродинамика циклонно-вихревых камер. – Владивосток: Дальневосточный ун-т,
1985. −200с.
153

Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
7. Сагомонян А.Я. Динамика пробивания преград.− Изд- во МГУ, 1988.−221 с.
8.
Некрасова К.В., Разва А.С., Зыков Е.Г., Василевский М.В. Определение связности сыпучих
материалов. //Материалы тринадцатой Всеросс. науч.-техн. конференции "Энергетика:
экология, надежность, безопасность."−Томск: Изд-во ТПУ,−2007. − С. 234−238.
УДК 543.13
Экологические проблемы технологий производства литийсодержащих соединений и их
определение в объектах окружающей среды
С.В. Ковалева
, Н.А. Гормакова, К. Вильдероттер
Томский государственный педагогический университет, г. Томск
Fachhohcshule Rosenheim
laksmin@mail.ru
Соединения щелочных металлов (литий, натрий, калий) находят применение в
современных технологиях и в разнообразных областях техники народного хозяйства и военно–
промышленного комплекса. Производство соединений этих металлов основано на использовании
электрохимических процессов, осуществляемых как в водной среде, так и в солевых расплавах.
Основным источником производства
щелочных металлов и их соединений являются
природные галиды и алюмосиликаты, которые перерабатываются с применением щелочных
растворов на основе гидроксидов и карбонатов. Важнейшим направлением в этих технологиях
является применение электрохимических процессов на жидкометаллических электродах: ртутном
и амальгамных. Наиболее многотоннажными процессами из числа названных являются
технологии получения гидроксидов натрия и калия [1], которые
обеспечивают сырьем
аккумуляторную промышленность и производство щелочных аккумуляторов на основе
полупроводниковых приборов.
Одним из направлений ртутных технологий является разделение изотопов лития [2].
Продуктами этих технологий являются соединения лития, применяемые в термоядерном оружии,
производстве литиевых аккумуляторов, твердого ракетного топлива и других направлений. В
значительных количествах металлический литий первыми получили в 1855 г.
Природный литий
состоит из двух изотопов с массовыми числами 6 и 7. По способности
захватывать тепловые нейтроны (поперечное сечение захвата) ядра этих изотопов отличаются
очень сильно. Тяжелый изотоп 7Li имеет сечение захвата 0,033 барна, он практически прозрачен
для нейтронов. Зато литнй-6 активно поглощает тепловые нейтроны, его сечение захвата – около
тысячи (точнее, 912) барн. Несмотря на то, что
в природе легкого лития в 12 раз меньше, чем
тяжелого, сечение захвата природного лития довольно велико – 71 барн. Понятно, что «виновник»
этого – изотоп 6Li. Интересная деталь: стоимость изотопов лития совсем не пропорциональна их
распространенности. В начале этого десятилетия в США относительно чистый литий-7 стоил
почти в 10 раз дороже лития-6 очень высокой чистоты. Искусственным путем
получены еще два
изотопа лития. Время их жизни крайне невелико: у лития-8 период полураспада равен 0,841
секунды, а у лития-9 0,168 секунды.
В значительных количествах металлический литий первыми получили в 1855 г.
(независимо друг от друга) немецкий химик Р. Бунзен и англичанин О. Матиссен. Как и Дэви, они
получали литий электролизом, только
электролитом в их опытах служил расплав не гидроокиси, а
хлорида лития. Этот способ до сих пор остается главным промышленным способом получения
элемента №3. Правда, теперь в электролитическую ванну помещают смесь LiCl и KCl и
подбирают такие характеристики тока, чтобы на катоде осаждался только литий. Выделяющийся
на аноде хлор – ценный побочный продукт. Есть и
другие способы получения металлического
лития, но всерьез конкурировать с электролитическим они пока не могут.
В связи с реализацией названных процессов возникают проблемы экологической
безопасности, обусловленные как попаданием самих щелочных металлов (литий, натрий, калий),
так и загрязнение объектов окружающей среды ртутью, используемой в качестве рабочего тела, и
побочными продуктами этих производств
(водород, хлор), которые попадают как в водоемы, так и
в атмосферу. Особую опасность в реализации этих технологий представляют органические
соединения ртути[3–6, 11].
Ртуть – атмофильный элемент, являющийся аналогом благородных газов, присутствует во
всех геосферах. Ртуть, ее неорганические соединения, органические и металлоорганические
154
Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
соединения являются практически вездесущими веществами, присутствующими во всех объектах
неживой и живой природы.
Глобальное выделение ртути из земной коры и океанов превышает количество ртути,
производимой из руд примерно в 5 раз, однако техногенные источники, связанные с ее
извлечением из руд и применением более локальны, а газовые потоки содержат ртуть в
значительно больших
концентрациях по сравнению с природными. Мощными техногенными
источниками загрязнения окружающей среды ртутью являются карьеры по добыче сульфидных и
других руд гидротермального происхождения и угля, тепловые электростанции, ртутные заводы и
химические предприятия, потребляющие металлическую ртуть (производство хлора, каустика и
каучука).
Способность паров ртути адсорбироваться почвами, горными породами, частицами
аэрозолей, растениями и
поверхностью строительных материалов и зависимость адсорбции от
климатических условий (температура, давление, влажность воздуха) обусловливают сезонные и
суточные колебания (ритмы) концентрации ртути в атмосфере [7].
Распространение ртути в экосистемах приводит к нарушению функционирования
природных объектов, выводу из сферы использования природных угодий (земель, пастбищ,
водоемов), загрязнению пищевых продуктов растительного и животного происхождения и порою
к острым отравлениям населения в регионах, прилегающих к промышленным объектам [3].
В предыдущих наших работах была термодинамически обоснована и экспериментально
показана возможность образования водородсодержащих амальгам при электролизе с ртутным
катодом водных электролитов на основе соединений s – металлов. Установлено, что при анодном
окислении водородсодержащих амальгам s – металлов присутствуют четыре потенциал
определяющих компонента. Наиболее отрицательным
потенциалопределяющим компонентом
является атомарный водород, гидратированный ртутью Н(Hg)
n
, затем по мере уменьшения
потенциала следует s – металл в виде гидратов М(Hg)
n
, третьим компонентом является собственно
амальгама гидрата s – металла МН
m
(Hg)
n
и четвертый компонент – молекулярный водород,
образующийся при анодном окислении амальгамы гидрида s – металла в объеме ртути.
В условиях ИВА, так же как и в условиях ЦВА, наблюдаются пики тока, связанные с
протеканием следующих реакций:
H(Hg)-e → H
+
+ nHg
М(Hg)
n
– me → M
m+
+ nHg
МН
m
(Hg)
n
-me → M
m+
+ mН(Hg)
n
H
2
(Hg)
n
– 2e → 2H
+
+ nHg
Оценены стационарные концентрации различных форм водорода в амальгамах.
Удаление ртути из технологических растворов и отходящих газов производств целесообразно
осуществлять с использованием реакций, приводящих к образованию малодиссоциирующих и
нелетучих соединений, обеспечивающих глубокую степень очистки[10]. Наиболее целесообразно
использовать для этой цели окислительно – восстановительные реакции на поверхности активных
сорбентов или в водных растворах,
приводящие к образованию соединений ртути, которые могут
быть переработаны известными методами. Такими реакциями являются процессы взаимодействия
паров ртути с твердыми элементными халькогенами, халькогенидами, оксидами марганца, серебра
и растворами галогенидов щелочных металлов и ртути, растворами окислителей или простыми
нейтральными сорбентами с нанесением на их поверхность названных выше соединений. Большое
число работ выполнено
в области применения ртутного электрода для отделения весьма важного
для ядерной технологии изотопа литий-6 от изотопа литий-7, например при обмене ионами в
системе амальгама – раствор. При контактировании амальгамы лития со спиртовым раствором его
хлорида в результате обменной реакции:
Li7(Hg) + Li6ClLi6(Hg) +Li7(Hg) + Li7Cl
Происходит некоторое увеличение содержания изотопа литий – 6 в ртутной фазе.
Разделение изотопов
лития в данном случае обусловлено разницей в величинах коэффициентов
диффузии атомов различных изотопов в ртутной и водной фазе.
Метод ИВА с ртутным пленочным электродом может быть использован для определения
концентрации щелочных металлов в технологических средах и объектах биосферы и водорода в
амальгамах Li, Na, K, применяемых в современных технологиях. Исследования показали, что
эффекты
разряда – ионизации водорода на ртути следует учитывать при определении щелочных
металлов методом ИВА, для технологии получения соединений щелочных металлов и
мониторинге природных вод.
155

Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
Может возникнуть вопрос, почему, обнаруженные в работах, процессы образования
различных по природе водородсодержащих амальгам при электролизе с ртутным макрокатодом и
микроэлектродами не были обнаружены ранее. Это вполне естественно, так как традиционные,
порой консервативные, воззрения не способствовали развитию новых подходов к физикохимии
амальгам, кроме того, исследования процессов выделения водорода выполняли компенсационным
методом в узкой области потенциалов связанных с разрядом ионов гидроксония.
Обнаруженные эффекты, связанные с образованием амальгам водорода, указывают на
необходимость четкого выбора потенциалов предэлектролиза при концентрировании s-металлов
на ртутном пленочном электроде. Результаты наших исследований позволили найти условия
определения щелочных и щелочноземельных металлов в солях (10
-3
– 10
-4
%), а также в
природных и бытовых сточных водах (10
-4
– 10
-6
моль/л).
Указанным методом были проанализированы водопроводные, природные и питьевые
лекарственные воды известных марок.
Список литературы:
1. Kovaleva S.V., Gladyshev V.P., Nazarov B.F., Gormakova N.A.. About a capability of determination
alkaline and alkaline earth metals by a method of stripping voltammetry. 8th Korea - Russia
International Symposium on Science and Technology. Korus 2004. Tomsk, Russia v. 2, p. 49 – 51.
2.
Ягольницер М.А.,. Соколов В.М, Рябцев А.Д. и др.// Химия в интересах устойчивого развития,
май 1995, Т3, N 1 –2, с. 23.
3.
Гладышев В. П. // Сб. Контроль и реабилитация окружающей среды. Материалы II
международного симпозиума. Томск 2000, с. 34 – 39.
4.
Гладышев В.П., Ковалева С.В. // Экология и жизнь. Международный сб. статей. Новгород,
1997, вып. 2, с. 59 – 67.
5. Илющенко М..А. // Современные проблемы экологии Центрального Казахстана. Караганда
1996.
6.
Ртуть: экологические аспекты применения. Женева, 1992. С. 127.
7.
Гладышев. В. П. // Ж. Общей химии.1994. Т. 64. N 4, с. 545.
8.
Гладышев В.П., Ковалева С.В. // Журн. общ. химии. 1995. Т. 65. Вып. 11. С. 1761 – 1765.
9.
Ковалева С.В. // Вестник ТГПУ. 1998. Вып. 2. С 70 – 81.
10.
Гладышев В. П., Ковалева С.В. // Сб. Контроль и реабилитация окружающей среды.
Материалы III международного симпозиума. Томск 2002, с. 170 – 172.
11.
Ковалева С.В., Гладышев В.П., Гормакова Н.А., Гатин А.И.. Экологические проблемы
технологий производства соединений щелочных металлов и их определение в
технологических средах и объектах окружающей среды // Мат-лы II международной научно -
технической конференции “Развитие оборонно–промышленного комплекса на современном
этапе ” Омск. 2003.ч. 1. стр. 39 – 41.
УДК 579.5:539.752+577(T2-575):582.16
Перенос радионуклидов из почвы в грибы и кустарники в 30-км зоне ГХК
Д.В. Дементьев, А.Я. Болсуновский
Институт биофизики СО РАН
dementyev@gmail.com
На исследованной территории Красноярского края можно выделить два первичных
источника поступления техногенных радионуклидов в окружающую среду: глобальные выпадения
радионуклидов и поступление радионуклидов в результате деятельности Горно-химического
комбината (ГХК) г. Железногорск. Поступление радионуклидов в результате деятельности ГХК
происходит по двум путям: аэрозольное загрязнение территорий и загрязнение
поймы р. Енисей, в
том числе через вынос загрязнённых радионуклидами донных отложений во время паводков [1].
Значительную часть территорий, находящихся в зоне воздействия ГХК занимают лесные массивы.
Имеющиеся сведения о накоплении радионуклидов в лесных экосистемах этих районов носят
отрывочный характер и относятся главным образом к изучению загрязнения древесных растений,
как основного
объекта лесопользования, между тем, другие компоненты лесных экосистем, в
частности грибы и ягодные кустарники, могут более интенсивно накапливать радионуклиды [2, 3].
Целью работы является оценка интенсивности накопления техногенных радионуклидов
грибами и кустарниками в лесных экосистемах Красноярского края в зоне влияния ГХК.
156
Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
Материалы и методы. Объектами исследований в лесных экосистемах центральной
части Красноярского края стали почва, 12 видов грибов и 5 видов ягодных кустарников, на
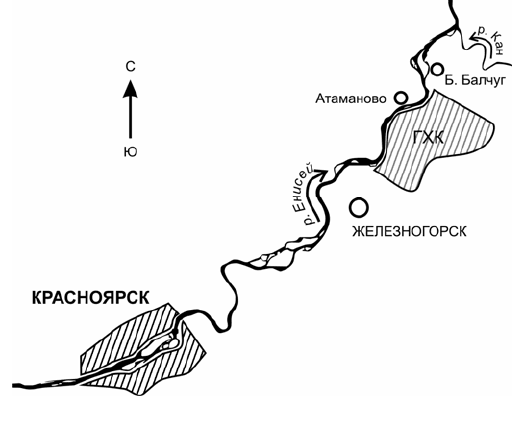
участках вблизи населённых пунктов (рис. 1): Красноярск (фоновый), загрязнённый только в
результате глобальных аэрозольных выпадений; Железногорск (66 км ниже Красноярска по
течению р. Енисей), Атаманово (88 км), Балчуг (98 км), загрязнённые в результате глобальных
выпадений и
аэрозольных выбросов ГХК; пойменные участки р. Енисей ниже сброса ГХК –
остров около с. Атаманово и берег в районе с. Балчуг с водным поступлением техногенных
радионуклидов. Исследования
проводились с 2002 по 2007 гг.
Во всех пробах определяли
содержание гамма-излучающих
радионуклидов на -спектрометре
со сверхчистым германиевым
детектором (Canberra, США).
Полученные спектры обрабатывали
с помощью ПО
CANBERRA
GENIE 2000 (США).
На пойменном участке
“Атаманово (остров)” в пробах
Ribes nigrum и почвы определяли
содержание
90
Sr по дочернему
90
Y.
Выделенный радиохимически
препарат
90
Y измеряли на
низкофоновом α-β газопроточном
пропорциональном счётчике и на
ЖСС Tri-Carb 2800TR (США). Все
удельные активности радионуклидов рассчитаны для воздушно сухой массы образцов.
Рис. 1. Карта-схема района отбора проб (Красноярский край)
Для определения формы нахождения радионуклидов в свежих пробах почвы и грибов
использовали метод последовательного химического фракционирования. Фракционирование
почвы проводили по схеме описанной Клемтом [4]. Для фракционирования грибов
модифицировали схему
фракционирования растений [5].
Радионуклиды в почве. По результатам лабораторных измерений на участках
“Железногорск”, “Атаманово (село)”, “Балчуг”, в верхнем 10 см слое почв из техногенных
радионуклидов зарегистрирован только
137
Cs, удельная активность которого в почвах в зоне ГХК в
2-3 раза превышает фоновое значение участка «Красноярск» и достигает 100 Бк/кг.
В пойменных почвах участка “Атаманово (остров)” -спектрометрический анализ
показал наличие:
60
Co – до 160 Бк/кг,
137
Cs – до 1800 Бк/кг,
152
Eu – до 400 Бк/кг,
154
Eu – до 60 Бк/кг,
155
Eu – до 12 Бк/кг и
241
Am – до 25 Бк/кг. Также в этих почвах было определено содержание
90
Sr –
до 26 Бк/кг. Такое разнообразие радионуклидов в пойменных почвах р. Енисей возникло в
результате выноса донных отложений, загрязнённых радионуклидами, во время сильных
паводков. Проведённые исследования показали крайне неоднородное распределение
радионуклидов в почвах – средняя удельная активность
137
Cs в центре острова в 2,5 раза ниже, по
сравнению с его береговой частью. Неоднородность распределения
137
Cs, наблюдается и на других
участках.
Из всего запаса радионуклидов в почвах, грибами и растениями может усваиваться только
та часть, которая находится в почвенном растворе или может перейти в этот раствор. С помощью
последовательного химического фракционирования была определена доля подвижных
радионуклидов в почвах, которая потенциально может усваиваться организмами. По результатам
фракционирования
получено, что более 90%
137
Cs в почве находится в фиксированном состоянии.
Для
60
Co и
152
Eu доли подвижной и фиксированной части одинаковы.
Радионуклиды в грибах. В исследованных 12 видах грибов из техногенных гамма-
излучающих радионуклидов, присутствующих в почвах, накапливается только
137
Cs, для которого
наблюдается ярко выраженная видовая зависимость и видовые различия в уровнях накопления
достигают двух порядков величины. Так для грибов, собранных в районах с аэрозольным
поступлением радионуклидов (“Железногорск”, “Атаманово (село)”, “Балчуг”), удельная
активность
137
Cs изменяется от единиц до сотен Бк/кг [3]. На участке “Атаманово (остров)”
удельная активность
137
Cs в грибах разных видов изменяется от 100 до 10000 Бк/кг. Из изученных
157
Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
видов грибов, биоидикативные свойства проявляют Suillus granulatus и S. luteus, между которыми
не выявлено достоверного различия в накоплении
137
Cs.
Средняя удельная активность
137
Cs в S. granulatus из районов, подверженных только
аэрозольным радиоактивным выбросам ГХК, в 2-4 раза выше содержания
137
Cs в грибах
контрольного района “Красноярск”. На пойменных участках удельная активность
137
Cs в S.
granulatus и S. luteus достигала 10200 Бк/кг, что превышает установленный российскими
нормативами предел и сопоставимо с уровнями накопления наблюдаемые на отдельных участках
30-км зоны Чернобыльской АЭС [6].
При определении степени связывания
137
Cs с биомассой S. granulatus и S. luteus
установлено, что
137
Cs в них распределяется аналогично
40
К. Наибольшая доля
137
Cs и
40
K
находится в обменно-адсорбционной фракции (от 56 до 71% общего содержания радионуклида). В
органической фракции содержание
137
Cs и
40
K варьирует от 23 до 37%. В минеральном остатке
остаётся менее 6% радионуклидов накопленных грибами и, следовательно, при отмирании
плодового тела большая часть
137
Cs быстро станет доступной для усвоения другими организмами.
В исследованных районах с аэрозольными выпадениями
137
Cs абсолютное содержание
этого радионуклида в S. granulatus и S. luteus увеличивается линейно с увеличением содержания
137
Cs в почвах, при этом средние значения коэффициентов накопления для
137
Cs и
40
K совпадают и
составляют 3,0±0,3 (табл. 1). Для проб маслят из районов с водным источником поступления
137
Cs
в почву отмеченная выше линейность в накоплении
137
Cs нарушается. Здесь значения
коэффициента накопления
137
Cs возрастают более чем в 5 раз.
Таблица 1
Коэффициенты накопления (КН)
40
K и
137
Cs в грибах
Поступление РН в почву Место отбора КН
40
K КН
137
Cs
“Атаманово (село)” 2,7 3,0
“Балчуг (село)” 3,3 2,9
“Железногорск” 3,2 3,4
Аэрозольное
“Красноярск” 2,9 2,7
“Балчуг (берег)” 2,1 4,7
Водное
“Атаманово (остров)” 2,0 10–16
Проведённые исследования накопления радионуклидов грибами подтверждают, что S.
granulatus и S. luteus являются аккумуляторами радиоцезия. Величина изменения рассчитанных
значений КН
137
Cs совпадает с полученными ранее данными других исследователей [7].
Радионуклиды в ягодных кустарниках. Накопление радионуклидов в кустарниковом
ярусе изучали в компонентах надземной фитомассы Ribes hispidulum, Ribes nigrum, Rosa majalis,
Rubus idaeus, Viburnum opulus. На всех исследованных участках в растениях зарегистрированы
40
K
и
137
Cs. В пробах с пойменных почв в надземной фитомассе зафиксированы также
60
Co и
90
Sr,
накопление других техногенных радионуклидов не было выявлено. Уровни накопления
137
Cs
растениями на 2-3 порядка ниже, по сравнению с грибами. Также для выбранных видов ягодных
кустарников отмечено, что накопление
137
Cs отличается не более чем в 2 раза, в то время как для
грибов межвидовые различия накопления радиоцезия на тех же участках достигают 2 порядков.
Из выбранных видов Rubus idaeus и Ribes nigrum характеризуются повышенным
накоплением радионуклидов, особенно в ягодах, поэтому они были выбраны для более детального
изучения. Исследование проб надземной фитомассы этих кустарников показало
наличие
техногенных
60
Co (до 2,8 Бк/кг),
90
Sr (до 45 Бк/кг) и
137
Cs (до 29 Бк/кг), накопление других
техногенных радионуклидов не зафиксировано.
137
Cs и
90
Sr накапливается во всех органах
кустарников,
60
Co – только в листьях и ветвях. Для всех видов прослеживается 2-3 кратное
различие между листьями и ветками в накоплении радионуклидов, что можно объяснить
проводящей функцией ветвей в период активной вегетации.
Показателем интенсивности переноса радионуклидов из почвы в растения является
коэффициент накопления, который рассчитывается аналогично КН для грибов. Характер
накопления калия в разных
условиях произрастания одинаков. КН
40
K для веток малины и чёрной
смородины равен 0,4-0,5, для листьев и ягод – 1-1,4.
Содержание
137
Cs в ягодных кустарниках увеличивается пропорционально с увеличением
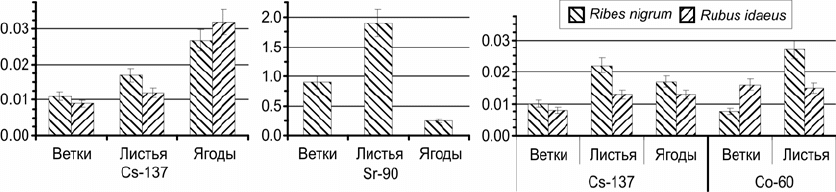
концентрации радионуклида в почве. Рассчитанные КН
137
Cs (рис. 2) лежат в диапазоне в 0,01-
0,03, что на 1-2 порядка ниже значения КН
40
K, то есть в этом случае аналоговая модель не может
объяснить накопление цезия.
158
Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
а) б) в)
Рис. 2. Коэффициенты накопления техногенных радионуклидов для различных органов
кустарников: для участков с аэрозольным (а) и водным (б, в) поступлением радионуклидов
Наиболее интенсивно из техногенных радионуклидов в кустарниках накапливается
90
Sr –
в Ribes nigrum КН
90
Sr на 2 порядка выше, чем для
137
Cs. Как видно из рис. 2в, КН
60
Co близки с
таковыми для
137
Cs, что выше значений полученных для чернобыльской зоны [8]. По
рассчитанным КН получено, что накопление
137
Cs и
60
Co компонентами кустарников возрастает в
ряду «ветки < листья ~ ягода», а для
90
Sr – в ряду «ягода < ветки < листья».
Полученные данные по накоплению техногенных радионуклидов ягодными кустарниками
согласуются с результатами исследований других авторов. Коэффициенты накопления
137
Cs в
зелёной фитомассе Rubus idaeus в 30-км зоне ЧАЭС составляет 0,02–0,4 [8]. Полевые
исследования по накоплению
137
Cs ягодами Rubus idaeus дали схожие результаты – 0,015–0,028.
Для ягод Ribes nigrum средний КН
137
Cs по данным исследований в районе Sellafield равен 0,015
[9], что также совпадает с полученными нами значениями. Некоторые отличия наблюдались
только в накоплении
60
Co, для которого КН в зелёной фитомассе малины в 30-км зоне ЧАЭС
составляет 0,006–0,007 [8], что ниже полученных нами значений.
Список литературы:
1. Bolsunovsky A. and Bondareva L. // J. Alloy. Compd. 2007. №444-445. Pp. 495-499.
2.
Носов А.В., Мартынова А.М. // Атомная энергия. 1996. Том 81. №3. С. 226-232.
3.
Болсуновский А.Я., Дементьев Д.В., Бондарева Л.Г. // Радиационная биология. Радиоэкология.
2006. Том 46. №1. С. 67-74.
4. Klemt E., Spasova Y., Zibold G., et al in Environmental Radioactivity in the Arctic and Antarctic,
edited by P. Strand and S. Ase. – Norway, 2002.
5.
Bolsunovsky A., Zotina T., Bondareva L. // J. Environ. Radioactivity. 2005. №81. Pp. 33-46.
6.
Зарубина Н.Е. Многолетняя динамика накопления радионуклидов грибами-макромицетами
после аварии на Чернобыльской АЭС / Под ред. Таскаев А.И. и др. / Радиоэкологические
исследования в зоне отчуждения Чернобыльской АЭС (к 20-летию аварии на Чернобыльской
АЭС). Тр. Коми НЦ УрО РАН; № 180. – Сыктывкар, 2006. – С. 152-167.
7.
Gillett A.G., Crout N.M.J. // J. Environ. Radioactivity. 2000. №48. Pp. 95-121.
8.
Lux D., Kammerer L., Ruhm W., Wirth E. // Sci. Total Environ. 1995. №173/174. Pp. 375-384.
9.
Carini F. // J. Environ. Radioactivity. 2001. №52. Pp. 237-279.
УДК 622.648.24
Технология теплоэнергосбережения предприятий угольной отрасли
с использованием их отходов
А.В. Неведров, А.В. Папин, Е.В. Жбырь
Кузбасский государственный технический университет, г. Кемерово
В будущем прогнозируется повышение роли угля в энергетике, что обусловлено его
крупными запасами и истощением месторождений нефти и газа. В тоже время экологические
проблемы, возникающие при переработке угля требуют разработки и внедрения новых
технологий, которые обеспечат эффект максимального использования минеральной и
органической части угля,
в результате чего повысится экономическая эффективность предприятий
угольной отрасли. Особенно остры эти проблемы для угольных регионов России, таких как
Кузбасс, испытывающих недостаток в экологически чистых природных энергоносителях.
Поскольку с ростом добычи, а также вследствие ухудшения горно-геологических условий и
широкой механизации производства ухудшается качественная характеристика углей по зольности,
159

Секция 4
ЭНЕРГЕТИКА: ЭКОЛОГИЯ, НАДЕЖНОСТЬ, БЕЗОПАСНОСТЬ
гранулометрическому составу, влажности и сернистости, то практически весь добываемый уголь
требуется подвергать обогащению [1,2]. В Кузбассе на углеобогатительных фабриках
применяются преимущественно мокрый способ обогащения углей.
На обогатительных фабриках Кузбасса флотацией обогащается в год порядка 6 млн.т
угольного шлама, из которого образуется 1-1,2 млн.т флотохвостов с зольностью 30 – 75 % и
теплотой сгорания 1050 – 2600 млн.т ккал
/кг. Из-за плохой флотируемости крупнозернистых
шламов более 0,5 мм, которые содержатся в питании флотомашин, часть их теряется, попадая в
флотохвосты. Потери угля в флотохвостах с условной зольностью 30 % на предприятиях Кузбасса
составляют порядка 300 – 350 тыс.т в год. Помимо этого, себестоимость процесса флотации в 7-10
раз выше стоимости обогащения более крупных классов угля
отсадкой и другими методами.
Шламонакопители, наружные отстойники, гидроотвалы предприятий угольной отрасли в
Кузбассе оказывают отрицательное воздействие на недра, воздушный и водный бассейны, земли и
почвы, флору и фауну. Существенным негативным фактором ведения горных работ является
значительный ущерб, наносимый водному бассейну, в связи с этим все острее встает проблема
охраны водных ресурсов
Кемеровской области. Это обусловлено сбросами в поверхностные
водоемы и водотоки больших объемов шламовых вод, содержащих, как правило, взвешенные и
растворенные примеси.
Проблема утилизации отходов угледобычи, накапливающихся в больших количествах в
гидроотвалах и отстойниках, достаточно остро стоит практически перед всеми предприятиями
угольной отрасли. Актуальность этой проблемы имеет два аспекта: во-первых,
решение проблемы
переработки отходов важно для улучшения экологической обстановки в регионе и, во-вторых,
использование уже добытого угля позволяет уменьшить потери топлива и соответственно
повысить эффективность работы угледобывающих и углеперерабатывающих предприятий.
Основными проблемами на пути переработки отходов угольной отрасли являются:
высокая зольность исходного сырья; отсутствие научно обоснованных рекомендаций и процессов
физико
-химического воздействия на исходный уголь с учетом его свойств.
Современные технологии переработки обогащенных угольных шламов, ориентированы
под конкретные производственные агрегаты, при этом, обязательным условием экономической и
экологической эффективности, предъявляемым к исходному сырью, является глубокая
деминерализация угля.
Минимально возможная зольность исходного угля применяемого в энергетических целях
обеспечит, прежде всего, повышение теплотворной
способности топлива, снижение вредных
выбросов в атмосферу, сокращение объемов золо- и шлакоудаления, уменьшается износ и
вследствие этого увеличивается срок службы котлоэнергоагрегатов.
Для решения проблемы утилизации шламовых вод и угольных шламов была разработана
нетрадиционная технология их комплексной переработки с получением ряда товарной продукции
и обеспечением углеобогатительных фабрик тепловой энергией [3].
Особенность данной технологии
заключаются: в обогащении угольных шламов методом
масляной агломерации с применением в качестве оптимального связующего реагента
отработанное машинное масло, что позволяет селективно отделять минеральные частицы от
органической части угля при его обогащении с получением концентрата приемлемого для
энергетики и коксования; в очистке шламовой воды от механических и органических примесей и
антинакипной
обработке ее электрическим полем с последующим использованием обработанной
воды в системах теплоснабжения.
Исследования по обогащению угольных шламов проводились на сырье, характеристики
которого представлены в табл. 1.
Таблица 1.
Технический анализ исходных угольных шламов
Вид анализа Наименование показателя
Шлам угля
марки К
Шлам угля
марки Г
Технический
анализ
Влага аналитическая, W
а
, %
Зольность, А
d
, %
Высшая теплота сгорания, Q
б
t
, кДж/кг
Выход летучих веществ, V
t
daf
, %
1,44
34,5
35500
27,85
1,35
38,0
34250
40,85
В качестве реагента-собирателя использовалось отработанное машинное масло с
эксгаустеров машинного зала коксохимического производства.
160
